块根块茎类作物内生固氮菌分离鉴定、系统发育与促生特性
李艳星,郭平毅,孙建光
块根块茎类作物内生固氮菌分离鉴定、系统发育与促生特性
李艳星1,2,郭平毅1,孙建光2
(1山西农业大学农学院,山西太谷030801;2中国农业科学院农业资源与农业区划研究所/农业部农业微生物资源收集与保藏重点实验室,北京100081)
【目的】分离鉴定块根块茎类作物内生固氮菌,研究块根块茎类作物内生固氮菌的系统发育,分析测定块根块茎类作物内生固氮菌的促生特性,探讨块根块茎类作物内生固氮菌的种群特点及其随寄主植物的分布特征。【方法】表面消毒块根块茎样品后采用低氮培养法分离内生细菌;通过对菌株的PCR扩增、测序确认分离细菌是固氮菌;通过16S rRNA基因测序、比对初步鉴定菌株,分析菌株的系统发育;通过测定菌株产生ACC脱氨酶、植物激素IAA,拮抗病原真菌研究菌株的促生特性。【结果】从胡萝卜、白萝卜、马铃薯、紫甘蓝、山药、莲藕、芋头、红薯、生姜、甜菜等14个块根块茎类作物的块根、块茎中共分离到内生固氮菌219株。基于16S rRNA序列,这些菌株在系统发育上分别属于、、、、、、、、、、、、、、、、、、、、、、、,共计24属79种,显示了块根块茎内生固氮菌丰富的种群多样性。鉴定结果显示,219株新分离菌株中有77株系统发育地位属于属的23个种,29株属于属的10个种,二者合计为33种106株,分别占系统发育种数和新分离菌株数的41.77%和48.40%,说明和属是新分离块根块茎类作物内生固氮菌的优势种群。从219株新分离菌株中选取了79株代表菌株进行促生特性研究,结果显示8.86%菌株检测到了ACC脱氨酶活性(0.026—13.76 µmol-丁酮酸·mg-1蛋白·h-1),64.56%菌株检测到了产IAA(0.34—28.99 µg·mL-1),6.33%—13.92%菌株具有拮抗病原真菌能力(抑菌率41%—63%)。【结论】在正常生长的块根块茎类作物的块根块茎内栖息着大量内生固氮菌;块根块茎类作物内生固氮菌在科学分类地位上分布广泛,达到24属79种,显示出巨大的生物多样性;和是块根块茎类作物内生固氮菌优势种群;大约10%—60%的块根块茎类作物内生固氮菌显示出产生ACC脱氨酶、产生植物激素IAA、拮抗病原真菌等促进植物生长特性,这可能是内生固氮菌有益于植物生长的内在原因。
块根块茎;内生固氮菌;系统发育;促生特性
0 引言
【研究意义】胡萝卜、白萝卜、紫甘蓝、马铃薯、山药、莲藕、芋头、红薯、生姜、甜菜等都是常见食才(甜菜是生产蔗糖原料),作为蔬菜、杂粮或调味品,在人们的日常生活中起着不可或缺的重要作用。从植物学的角度,它们有一个共同特征,都是块根块茎类作物(紫甘蓝为球茎),而且块根块茎正是人们取食的部分。研究块根块茎类作物内生固氮菌对于加强人们对该类作物的了解,获得固氮菌资源,提高栽培技术,生产安全优质产品具有重要意义。【前人研究进展】植物内生菌(endophytic bactcria)指从经过表面消毒的植物组织器官或植物体内分离出来的对植物本身有益无害的细菌[1]。现在这个概念有了一些扩大,认为植物内生菌泛指生活史或某个生命阶段生活在健康植物体内,不引起宿主植物外在病症的细菌、真菌或放线菌[2],但不包括在植物体内定殖,引起寄生植物病害的致病菌,也不包括菌根真菌[3]。植物内生固氮菌(endophytic diazotrophs)是植物内生菌中的一个主要类群,它们不仅具有固氮作用,还有促进植物生长,提高植物抗病、抗逆等多种功能[4]。目前,人们在水稻[5]、玉米[6]、小麦[7]、甘蔗[8]等作物上都发现了内生固氮菌,对于马铃薯内生固氮菌的研究也有报道[9-10],但对于其他块根块茎类作物的内生固氮菌了解尚少。【本研究切入点】通过农田采集和市场采购两种方式收集块根块茎类作物的块根块茎样品,批量分离、鉴定内生固氮菌,研究块根块茎类作物内生固氮菌的系统发育、促生特性,并探讨块根块茎类作物内生固氮菌的种群特点及其随寄主植物的分布特征。【拟解决的关键问题】明确块根块茎类作物内生固氮菌的系统发育、种群特点、分布特征、促生特性。
1 材料与方法
试验于2014—2015年在中国农业科学院完成。
1.1 样品、试剂、培养基
试验共用到块根块茎类作物样品14份,包括胡萝卜、白萝卜、马铃薯、紫甘蓝、山药、莲藕、芋头、红薯、生姜、甜菜等。其中5份样品采自农田,9份样品购自北京蔬菜市场。样品主要为处于成熟期的作物块根块茎。样品信息详见表1。
病原真菌靶标菌株拟枝镰孢()ACCC37402和尖镰孢()ACCC37438由中国农业科学院农业资源与农业区划研究所邓晖提供,尖镰孢MLS1由笔者实验室提供。试剂主要购自北京化学试剂公司和Sigma公司。
多碳源低氮培养基(CCM)[11]:溶液Ⅰ:KH2PO40.2 g,NaCl 0.1 g,K2HPO40.8 g,Na2Fe EDTA 28 mg,钼酸钠25 mg,酵母浸膏100 mg,甘露醇5 g,蔗糖5 g,乳酸钠0.5 mL,蒸馏水900 mL。溶液Ⅱ:MgSO4·7H2O 0.2 g,CaCl2·2H2O 0.06 g,蒸馏水100 mL。将溶液Ⅰ、Ⅱ分别灭菌,冷却至50℃左右混合,加入生物素(5 µg·L-1)和维生素(10 µg·L-1)各0.5 mL。无氮培养基[12]:蔗糖10 g,NaCl 0.12 g,K2HPO4·3H2O 0.5 g,CaCO31 g,MgSO4·7H2O 0.2 g,蒸馏水1 L,pH 7.2。LB培养基:酵母膏5 g,蛋白胨10.0 g,NaCl 10.0 g,蒸馏水1 L,pH 7.0。
1.2 内生固氮菌分离
采用上述多碳源低氮培养基和无氮培养基,将植物块根块茎样品表面消毒后,切取内部组织块进行分离培养内生细菌,方法参考文献[13]。
1.3 菌株16S rRNA序列测定与初步鉴定
细菌分离物16S rRNA基因扩增方法同文献[14],序列测定委托北京博迈德生物技术公司完成,基于16S rRNA基因序列的初步鉴定采用EzTaxon和NCBI数据库在线比对完成。
1.4 菌株基因检测与序列测定
菌株固氮酶基因扩增方法同文献[15],序列测定委托生工生物工程(上海)股份有限公司完成。
1.5 内生固氮菌系统发育分析
在上述16S rRNA基因序列测定和基因检测的基础上,采用Mega软件分析块根块茎类作物内生固氮菌的系统发育[16]。
1.6 菌株促生特性
测定菌株产生ACC脱氨酶(1-aminocyclopropane- 1-carboxylic acid (ACC) deaminase)、产生植物激素IAA(indole acetic acid)以及拮抗病原真菌的能力。
ACC脱氨酶、IAA以及拮抗病原真菌测定方法同前述[7,15,17]。拮抗病原真菌定义抑制率(%)=(对照半径r0-对峙培养病原真菌菌落半径r1)/对照半径r0×100。
2 结果
2.1 块根块茎类作物内生固氮菌分离、基因检测及基于16S rRNA基因序列鉴定
从14个块根块茎类作物样品的块根、块茎中共分离到内生细菌219株,全部菌株检测到了固氮酶基因,从而确认这些细菌是固氮菌。经过16S rRNA基因序列分析比对初步确定了菌株的分类地位。新分离菌株的编号、来源及其最大相似性模式种如表1所示。
2.2 块根块茎类作物内生固氮菌的系统发育分析
16S rRNA基因序列比对结果显示,分离到的219株块根块茎类作物内生固氮菌与已知模式种的最大相似性均在98%以上(42号菌株为97.70%),说明新分离内生固氮菌的科学分类地位比较明确。按照16S rRNA基因序列相似性,219株块根块茎类作物内生固氮菌在系统发育地位上属于24属79种。这24属分别为、、、、、、、、、、、、、、、、、、、、、、、。
以79株最大相似性模式种作为代表菌株进行的系统发育分析结果如图1所示。总的来看,新分离的219株块根块茎类作物内生固氮菌在系统发育关系上可以分为5群:第1群包括7个属,分别是(其中包含23个种代表77菌株)、(其中包含1个种代表17菌株)、(其中包含4个种代表17菌株)、(其中包含5个种代表6菌株)、(其中包含3个种代表5菌株)、(其中包含1个种代表1菌株)、(其中包含1个种代表1菌株),共计38个种,代表124菌株,分别占分类地位种数和新分离菌株总数的48.10%和56.62%。第2群包括3个属,(其中包含2个种代表2菌株)、(其中包含5个种代表11菌株)、(其中包含1个种代表1菌株),共计8个种,代表14菌株,分别占分类地位种数和新分离菌株总数的10.13%和6.39%。第3群只有1个属,包括3个种,代表5菌株,分别占分类地位种数和新分离菌株总数的3.80%和2.28%。第4群包括10个属,(其中包含10个种代表29菌株)、(其中包含1个种代表4菌株)、(其中包含1个种代表1菌株)、(其中包含1个种代表1菌株)、(其中包含1个种代表3菌株)、(其中包含1个种代表4菌株)、(其中包含1个种代表2菌株)、(其中包含4个种代表10菌株)、(其中包含1个种代表1菌株)、(其中包含4个种代表11菌株),共计25个种,代表66菌株,分别占分类地位种数和新分离菌株总数的31.65%和30.14%。第5群包括3个属,(其中包含2个种代表3菌株)、(其中包含1个种代表1菌株)、(其中包含2个种代表6菌株),共计5个种,代表10菌株,分别占分类地位种数和新分离菌株总数的6.33%和4.57%。
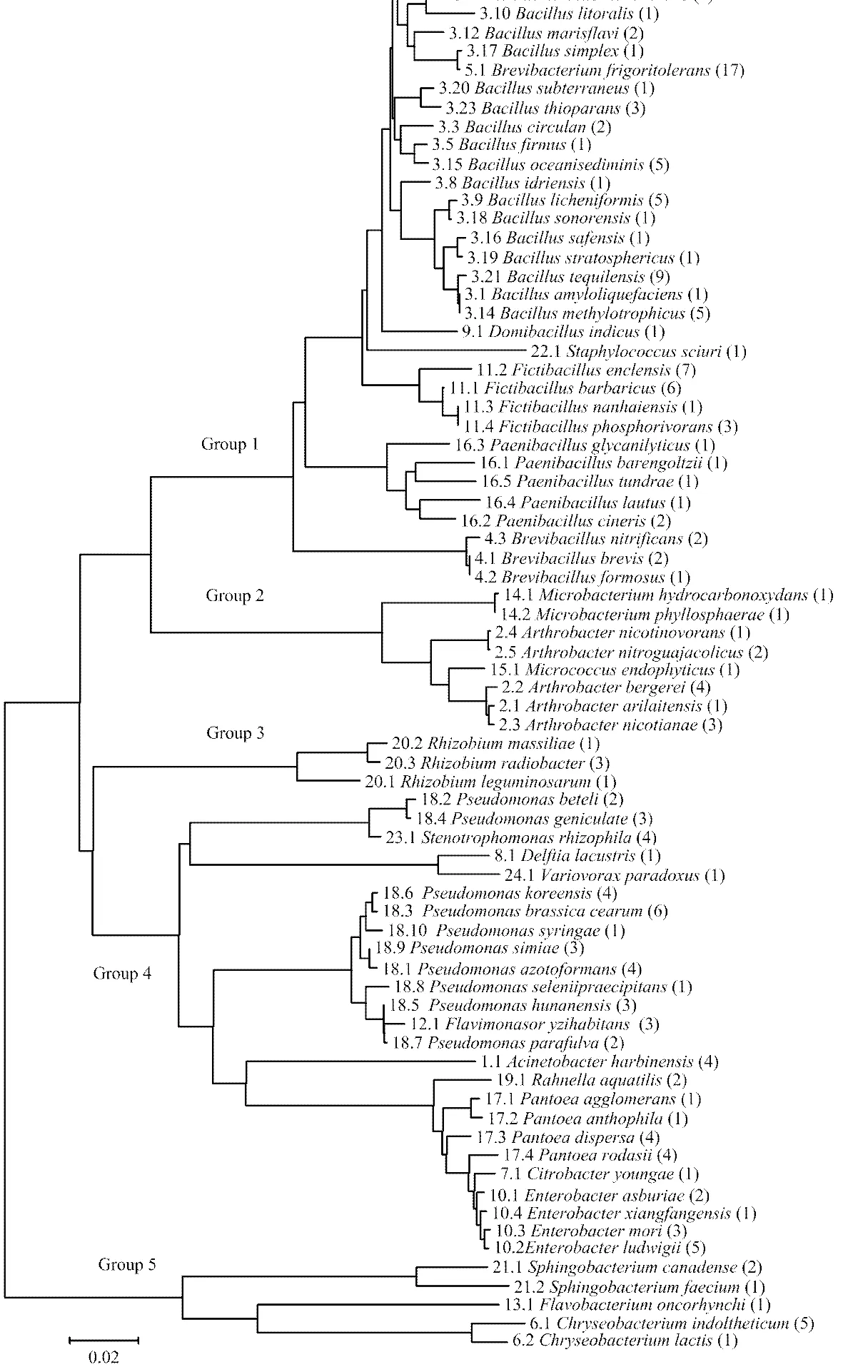
图中种名后括号中的数字表示新分离菌株在分类地位上属于该种的菌株数
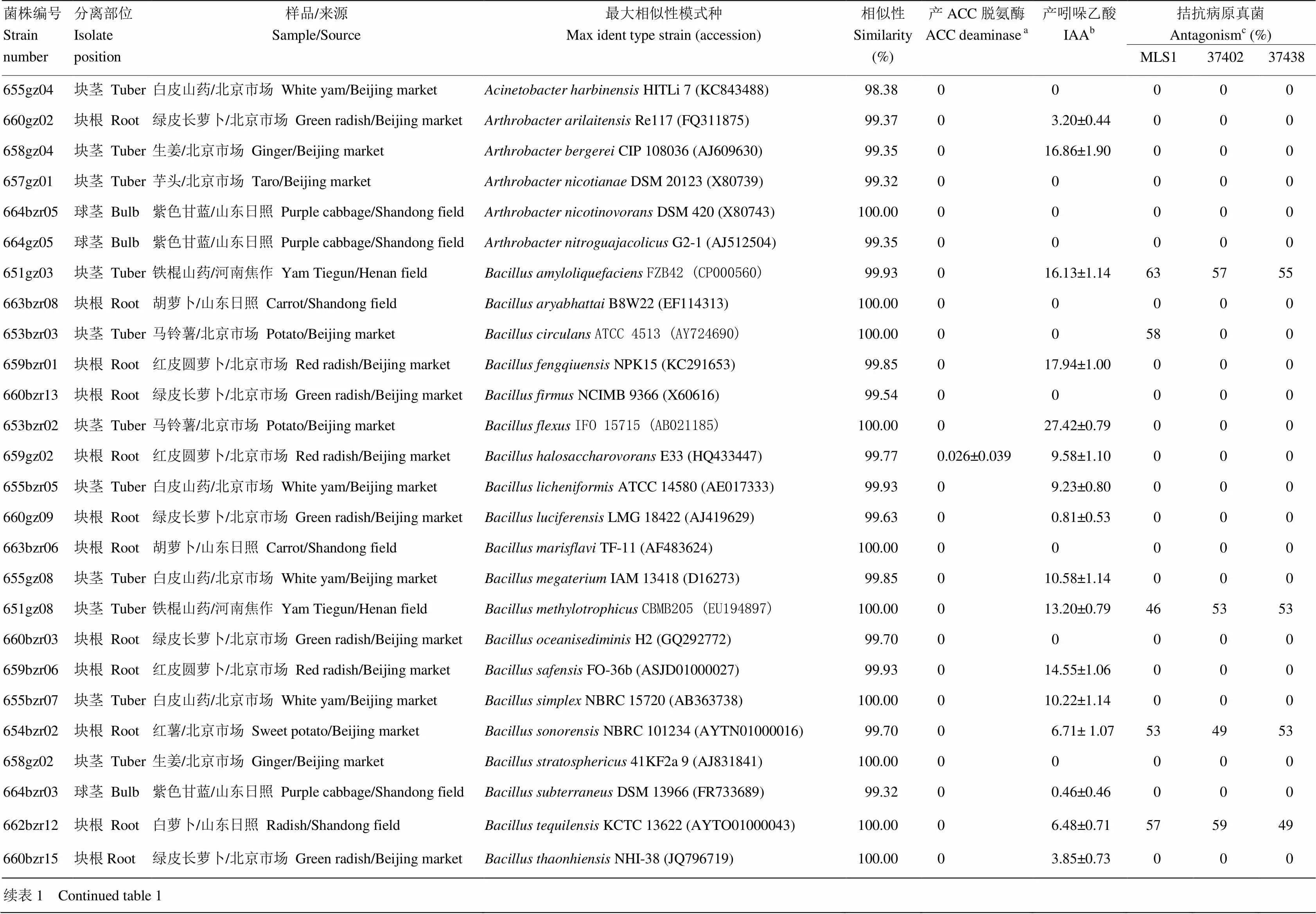
表1 新分离内生固氮菌及其促生特性
aACC脱氨酶ACC: 1-aminocyclopropane-1-carboxylic acid deaminase activity (µmol-ketobutyrate·mg-1protein·h-1);b吲哚乙酸 IAA: indole acetic acid production (µg·mL-1);c拮抗病原真菌Antagonism: MLS1=MLS1; 37402=ACCC 37402; 37438=ACCC 37438
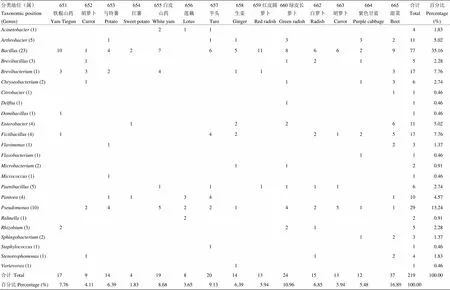
表2 新分离内生固氮菌随寄主植物分布特点
属名后括号中的数字表示该属的种数The number in the parentheses behind the genus name meant the number of species including in this genus
2.3 块根块茎类作物内生固氮菌的分类地位及其随寄主植物分布特点
列表分析了新分离的219株块根块茎类作物内生固氮菌的分类地位及其随寄主植物的分布(表2),发现如下特点:(1)从菌株分类地位来看,属菌株最多,有77株,占分离菌株总数的35.16%;属居第2位,有29株,占分离菌株总数的13.24%;二者合计有106株,占新分离菌株总数的48.40%;(2)包含新分离菌株较多的属和,也是包含细菌种数较多的属,如芽孢杆菌属()包括23个种,分别是、、、、、、、、、、、、、、、、、、、、、、;假单胞菌属()包括10个种,分别是、;这在一定程度上证明了新分离菌株在分类地位上的广泛性和对寄主植物的代表性;(3)新分离块根块茎类作物内生固氮菌在寄主植物的分布上具有广泛性,如分类地位属于的77菌株分布在除莲藕之外的其他13个样品中,分类地位属于的29菌株分布在除铁棍山药、红薯、红皮圆萝卜之外的其他11个样品中,分布相对均匀;(4)从寄主植物来看,分离到菌株最多的是665号样品甜菜,分离到37菌株,占新分离菌株总数的16.89%,在分类地位是分属于12属21种,分布广泛;分离到菌株最少的样品是红薯,只有4株菌。
2.4 菌株的促生特性
由于分离到的块根块茎类作物内生固氮菌共计219株,全部测定工作量较大,因此选取了79株代表菌株进行了促生特性研究(表1)。结果显示,其中有7株菌检测到了ACC脱氨酶活性,占被测菌株的8.86%,ACC脱氨酶活性为0.026—13.76 µmol-丁酮酸·mg-1蛋白·h-1。51株菌检测到了产IAA,占被测菌株的64.56%,检测到的IAA浓度为0.34—28.99 µg·mL-1。
拮抗试验显示有11株菌拮抗病原真菌MLS1,抑菌率为41%—63%;6株菌拮抗病原真菌ACCC37402,抑菌率为48%—59%;5株菌拮抗病原真菌ACCC37438,抑菌率为49%—55%。合计有5—11株菌对靶标真菌具有抑制作用,占被测菌株的6.33%—13.92%。菌株651gz03、651gz08、654bzr02、662bzr12和660bzr10 同时对3株靶标真菌具有抑制作用,有较好的应用前景。
2.5 新分离块根块茎类作物内生固氮菌与文献报道其他植物内生固氮菌的比较
笔者尝试对照前人的工作,在种水平上分析菌株的系统发育地位与寄主植物的关系。将219株新分离块根块茎内生固氮菌所属的79种列表,统计每种所含菌株数,就会发现除了、、、4个种所含菌株数相对较多,合计53株,占新分离菌株总数24.20%之外,其他75种代表了166株新分离菌株,平均每种代表2.2株。这些结果显示了块根块茎类作物内生固氮菌极其丰富的种群多样性(表3)[18-20]。
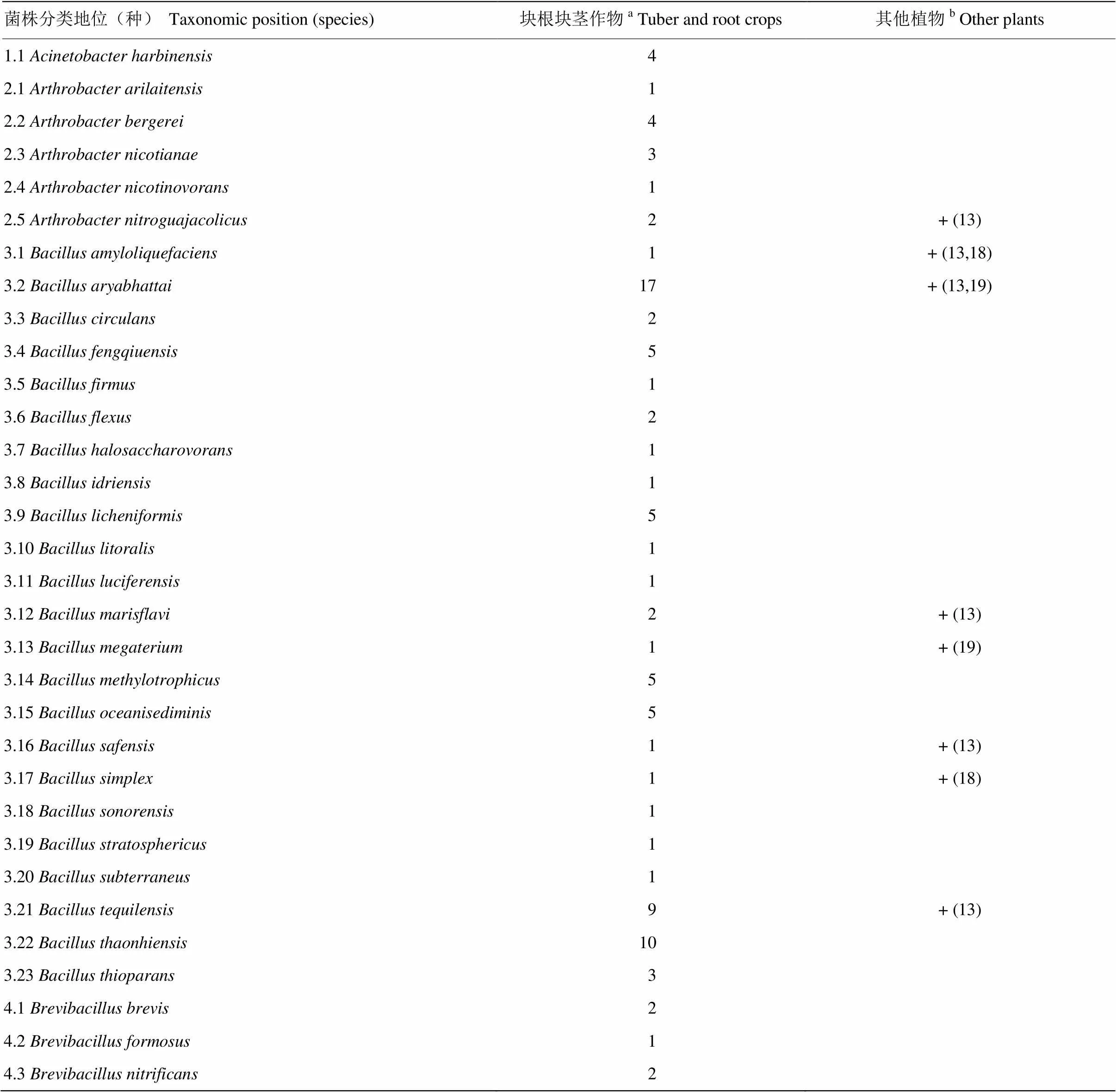
表3 新分离块根块茎类作物内生固氮菌与文献报道其他植物内生固氮菌的比较
a本文工作,表中数字表示新分离到的分类地位属于该种的菌株数This work. The number in table meant the number of newly isolated strains which belonged to this species;b文献数据。表中“+”号表示该种有过内生固氮菌报道,括号中数字为参考文献编号Data from references. “+” meant this species had been reported as endophytic diazotroph. The number in parenthese meant corresponding reference
3 讨论
尽管地球上几乎所有的植物都有内生细菌栖息其中[21],但当试验结果展示出丰富多样的微生物种群时,我们仍然为块根块茎类作物具有的内生固氮菌多样性感到惊奇。
本研究从14个块根块茎样品分离到的219株内生固氮菌在系统发育地位上属于24个属79个种,从目前检索到的文献资料来看,如此丰富的种群多样性在以往报道过的植物内生固氮菌中未曾有过。以上述79种为参照菌群,查阅文献结果显示,虽然关于植物内生固氮菌的研究报道很多,但只有很少文献能够与此对应,只找到18种与之相同的种群有过作为植物内生固氮菌的记载。此外,一些研究较多的植物内生固氮菌,如[22]、[23]、[24-25]、[26]、[27]、[28]、[29]、[30]都没有出现在表3中。原因可能有下列几个方面:一是作为作物内生固氮菌资源研究,这些工作已经处于研究领域的前沿,研究报道相对较少;二是块根块茎类作物内生固氮菌存在自身的种群特异性,在其他植物内生固氮菌中没有出现;三是研究方法的差异导致结果不同,如基于微生物培养技术的研究方法得到的信息只能是样品中真实微生物组成的一小部分。但是,即使考虑到所有这些因素,试验结果仍然显示了块根块茎类作物内生固氮菌具有独有的种群特异性。
本文共用到块根块茎样品14个,涉及胡萝卜、白萝卜、马铃薯、紫甘蓝、山药、莲藕、芋头、红薯、生姜、甜菜10种作物。其中5份样品采自农田,9份样品采自蔬菜市场。但无论来自农田的新鲜样品,还是来自蔬菜市场的贮存样品,每个样品都分离到了内生固氮菌,从4株到37株不等(表2)。分离菌株最少的是红薯,得到4株菌,分类地位分别为、、、。这些结果说明,正常生长的作物块根块茎中普遍存在大量固氮细菌。另一方面,由于上述作物块根块茎是人们食用多年的常见食材,这从侧面印证了内生固氮菌对于人畜的安全性。
另一个值得讨论的结果是内生固氮菌的促生特性。广义的微生物对植物的促生特性定义不严格,包含内容较多,比如提供营养(固氮、溶磷、解钾、矿化有机质等),促进生长(分泌植物激素IAA[31]等),抑制病害(拮抗病原真菌,营造微生态环境等),提高抗逆(产生ACC脱氨酶[32],缓解胁迫[33],抗寒抗旱抗涝等)等。本研究新分离菌株中8.86%菌株检测到了ACC脱氨酶活性,64.56%菌株检测到产植物激素IAA,6.33%—13.92%菌株拮抗病原真菌,这些结果表明作物内生固氮菌中具有促生特性的菌株比例远高于其他环境。特别是菌株651gz03、651gz08、654bzr02、662bzr12和660bzr10同时抑制3株靶标真菌,值得进一步开发研究。
4 结论
在正常生长的块根块茎类作物的块根块茎内栖息着大量内生固氮菌;块根块茎类作物内生固氮菌在科学分类地位上分布广泛,达到24属79种,显示出巨大的生物多样性;和是块根块茎类作物内生固氮菌优势种群;大约10%—60%的块根块茎类作物内生固氮菌显示出产生ACC脱氨酶、产生植物激素IAA、拮抗病原真菌等促进植物生长特性,这可能是内生固氮菌有益于植物生长的内在原因。
References
[1] Saharan B S, Nehra V. Plant growth promoting rhizobacteria: a critical review., 2011, 2011: LSMR-21.
[2] Stone J K, Bacon C W, White J F. An overview of endophytic microbes: endophytism defined//. New York: Marcel Dekker, 2000, Chapter3: 29-33.
[3] Kloeppe J W, Rodriguez-Kabana R, Zehnder A W, Murphy J F, Sikora E, Fernández C. Plant rootbacterial interactions in biological control of soilborne diseases and potential extension to systemic and foliar diseases., 1999, 28(1): 21-26.
[4] Carvalho T L G, Ballesteros H G F, Thiebaut F, Ferreira P C G, Hemerly A S. Nice to meet you: genetic, epigenetic and metabolic controls of plant perception of beneficial associative and endophytic diazotrophic bacteria in non-leguminous plants., 2016, 90(6): 561-574.
[5] Barraquio W, Revilla L, Ladha J. Isolation of endophytic diazotrophic bacteria from wetland rice., 1997, 194(1/2): 15-24.
[6] Estrada P, Mavingui P, Cournoyer B, Fontaine F, Balandreau J, Caballero-Mellado J. A N2-fixing endophyticsp. associated with maize plants cultivated in Mexico.2002, 48(4): 285-294.
[7] 秦宝军, 罗琼, 高淼, 胡海燕, 徐晶, 周义清, 孙建光. 小麦内生固氮菌分离及其ACC脱氨酶测定. 中国农业科学, 2012, 45(6): 1066-1073.
Qin B J, Luo Q, Gao M, Hu H Y, Xu J, Zhou Y Q, Sun J G. Isolation of wheat endophytic diazotrophs and determination of 1-aminocyclopropane-1-carboxylate deaminase., 2012, 45(6): 1066-1073. (in Chinese)
[8] Junior F, Reis V M, Urquiaga S, Döbereiner J. Influence of nitrogen fertilisation on the population of diazotrophic bacteriaspp. andin sugar cane (spp.)., 2000, 219(1): 153-159.
[9] Romero F M, Marina M, Pieckenstain F L. The communities of tomato (L.) leaf endophytic bacteria, analyzed by 16S-ribosomal RNA gene pyrosequencing.,2014, 351(2): 187-194.
[10] Kempe J, Sequeria L. Biological control of bacterial wilt potatoes: attempts to induce resistance by treating tubers with bacteria.,1983, 67(5): 499-503.
[11] 李倍金, 罗明, 周俊, 孔德江, 张铁明. 几种禾草内生固氮菌的分离及固氮活性测定. 草业学报, 2008, 17(5): 37-42.
Li B J, Luo M, Zhou J, Kong D J, Zhang T M. Isolation of endophytic diazotrophic bacteria from several gramineae grasses and determination of their nitrogenase activity., 2008, 17(5): 37-42. (in Chinese)
三星期以后,这个人躺在捕鲸船“白德福号”的一个铺位上,眼泪顺着他的削瘦的面颊往下淌,他说出他是谁和他经过的一切。同时,他又含含糊糊地、不连贯地谈到了他的母亲,谈到了阳光灿烂的南加利福尼亚,以及桔树和花丛中的他的家园。
[12] 孙建光, 张燕春, 徐晶, 胡海燕. 高效固氮芽孢杆菌筛选及其生物学特性. 中国农业科学, 2009, 42(6): 2043-2051.
Sun J G, zhang Y C, Xu J, Hu H Y. Isolation and biological characteristic investigation on efficient nitrogen-fixing bacilli.,2009, 42(6): 2043-2051. (in Chinese)
[13] 孙建光, 罗琼, 高淼, 胡海燕, 徐晶, 周义清. 小麦、水稻、玉米、白菜、芹菜内生固氮菌及其系统发育. 中国农业科学, 2012, 45(7): 1303-1317.
Sun J G, Luo Q, Gao M, Hu H Y, Xu J, Zhou y Q. Isolation and phylogeny of nitrogen-fixing endophytic bacteria in wheat, rice, maize, Chinese cabbage and celery., 2012, 45(7): 1303-1317. (in Chinese)
[14] 孙建光, 徐晶, 胡海燕, 张燕春, 刘君, 王文博, 孙燕华. 中国十三省市土壤中非共生固氮微生物菌种资源研究. 植物营养与肥料学报, 2009, 15(6): 1450-1465.
Sun J G, Xu J, Hu H Y, Zhang Y C, Liu J, Wang W B, Sun Y H. Collection and investigation on asymbiotic nitrogen-fixing microbial resources from 13 provinces over China., 2009, 15(6): 1450-1465. (in Chinese)
[15] Gao M, Zhou J, Wang E, Chen Q, Xu J, Sun J. Multiphasic characterization of a plant growth promoting bacterial strain,sp. 7016 and its effect on tomato growth in the field.,2015, 14(9): 1855-1863.
[16] 孙建光, 胡海燕, 刘君, 陈倩, 高淼, 徐晶, 周义清. 农田环境中固氮菌的促生潜能与分布特点. 中国农业科学, 2012, 45(8): 1532-1544.
SUN J G, HU H Y, LIU J, CHEN Q, GAO M, XU J, ZHOU Y Q. Growth promotion potential and distribution features of nitrogen- fixing bacteria in field environments.,2012, 45(8): 1532-1544. (in Chinese)
[17] 陈倩, 高淼, 胡海燕, 徐晶, 周义清, 孙建光. 一株拮抗病原真菌的固氮菌sp. GD812. 中国农业科学, 2011, 44(16): 3343-3350.
Chen Q, Gao M, Hu H Y, Xu J, Zhou Y Q, Sun J G. A nitrogen-fixing bacteriumsp. GD812 antagonistic against plant pathogenic fungi., 2011, 44(16): 3343-3350. (in Chinese)
[18] Banik A, Mukhopadhaya S K, Dangar T K. Characterization of N2-fixing plant growth promoting endophytic and epiphytic bacterial community of Indian cultivated and wild rice (spp.) genotypes., 2016, 243(3): 799-812.
[19] Ji S H, Gururani S A, Chuna S C. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars., 2014, 169(1): 83-98.
[20] Verma S C, Ladha J K, Tripathi A K. Evaluation of plant growth promoting and colonization ability of endophytic diazotrophs from deep water rice., 2001, 91(2/3): 127-141.
[21] Santoyoa G, Moreno-Hagelsieb G, Orozco-Mosquedac M, Glickc B R. Plant growth-promoting bacterial endophytes., 2016, 183: 92-99.
[22] Rodrigues E, Rodrigues L, Oliveira A, Baldani V, Teixeira S, Urquiaga S, Reis V.inoculation: effects on growth, yield and N2fixation of rice (L.)., 2008, 302(1): 249-261.
[23] Baldani V D, Baldani J I, Döbereiner J. Inoculation of rice plants with the endophytic diazotrophsandspp., 2000, 30: 485-491.
[24] Santos P, Bustillos-Cristales R, Caballero-Mellado J., a genus rich in plant-associated nitrogen fixers with wide environmental and geographic distribution.,2001, 67(6): 2790-2798.
[25] Govindarajan M, Balandreau J, Kwon S W, Weon H Y, Lakshminarasimhan C. Effects of the inoculation ofand related endophytic diazotrophic bacteria on grain yield of rice., 2008, 55(1): 21-37.
[26] Govindarajan M, Kwon S W, Weon H Y. Isolation, molecular characterization and growth-promoting activities of endophytic sugarcane diazotrophsp. GR9., 2007, 23(7): 997-1006.
[27] Junior F, Reis V M, Urquiaga S, Döbereiner J. Influence of nitrogen fertilisation on the population of diazotrophic bacteriaspp. andin sugar cane (spp.)., 2000, 219(1): 153-159.
[28] Muthukumarasamy, R, Cleenwerck I, Revathi G, Vadivelu M, Janssens D, Hoste B, Gum K, Park K, Son C Y, Sa T, Caballero-Melladoe J. Natural association ofand diazotrophicwith wetland rice., 2005, 28(3): 277-286.
[29] Sandhiya G S, Sugitha T C, Balachandar D, Kumar K. Endophytic colonization andnitrogen fixation by a diazotrophicsp. in rice.2005, 43(9): 802-807.
[30] Böhm M, Hurek M, Reinhold-Hurek B. Twitching motility is essential for endophytic rice colonization by the N2-fixing endophytesp. strain BH72., 2007, 20(5): 526-533.
[31] Etesami H, Alikhani H A, Hosseini H M. Indole-3-acetic acid (IAA) production trait, a useful screening to select endophytic and rhizosphere competent bacteria for rice growth promoting agents., 2015, 2: 72-78.
[32] Etesami H, Hosseini H M, Alikhani H A. Bacterial biosynthesis of 1-aminocyclopropane-1-caboxylate (ACC) deaminase, a useful trait to elongation and endophytic colonization of the roots of rice under constant flooded conditions., 2014, 20(4): 425-434.
[33] Ma Y, Rajkumar M, Zhang C, Freitas H. Beneficial role of bacterial endophytes in heavy metal phytoremediation., 2016, 174: 14-25.
(责任编辑 岳梅)
Isolation, identification, phylogeny and Growth Promoting Characteristics of endophytic diazotrophs from tuber and root crops
LI YanXing1,2, GUO PingYi1, SUN JianGuang2
(1College of Agriculture, Shanxi Agricultural University, Taigu 030801, Shanxi;2Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Microbial Resources, Ministry of Agriculture, Beijing 100081)
【Objective】The objectives of this study are to isolate, identify and analyze phylogenetics of endophytic diazotrophs from tuber and root crops, test plant growth promoting (PGP) characteristics of the isolates, and to explore population property and host distributions of endophytic diazotrophs from tuber and root crops. 【Method】Surface sterilization and low nitrogen medium were used to isolate endophytic diazotrophs.detection based on PCR amplification to confirm isolates as nitrogen-fixing bacteria. 16S rRNA was amplified with PCR, blasted in EzTaxon after sequencing, and analyzed with Clustalx-MEGA to make phylogenetic tree. PGP characteristics were evaluated by testing 1-aminocyclopropane-1-carboxylic acid (ACC) deaminase activity, indole acetic acid (IAA) production and antagonism tospp. 【Result】Total 219 endophytic bacterial isolates were obtained from 14 tuber and root samples including radish, carrot, potato, ginger, beet, lotus, yam, taro, cabbage, and sweet potato. All isolates were verified as nitrogen-fixing bacteria afterinspection and identified as 79 species of 24 genera based on 16S rRNA. The 79 species are,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,,This result showed the biodiversity of endophytic diazotrophs from tuber and root crops. Of the 219 endophytic diazotrophs, 77 strains are identified as 23 species of, and 29 strains are identified as 10 species of. This makes up 106 strains of 33 species, in percentages of 48.40% and 41.77% of the 219 endophytic diazotrophs and 79 identified species. Indicating thatandare dominant populations of endophytic diazotrophs from tuber and root crops. Conducted with 79 representatives of the 219 strains, PGP test showed that 8.86% strains showed ACC deaminase activity ranging from 0.026 to 13.76 µmol-ketobutyrate·mg-1protein·h-1, 64.56% strains showed IAA production ranging from 0.34 to 28.99 µg·mL-1, and 6.33%-13.92% strains showed antagonistic against phytopathogenACCC37402,MLS1 andACCC37438 with antifungal indexes of 41% to 63%. 【Conclusion】Large number of endophytic diazotrophs habitat in the tuber and root of normally growing tuber and root crops. Endophytic diazotrophs from tuber and root crops phylogenetically belong 79 species of 24 genera showing wide distribution and huge biodiversity.andare dominant populations of endophytic diazotrophs from tuber and root crops. About 10%-60% endophytic diazotrophs have PGP property of producing ACC deaminase or IAA or antagonism. This might be the underlying reasons that endophytic diazotrophs are benefit to host plants.
tuber and root crops; endophytic diazotrophs; phylogeny; growth promoting characteristics
2016-05-28;接受日期:2016-08-08
国家公益性行业(农业)科研专项(201203045)
李艳星,E-mail:LiYX@163.com。通信作者孙建光,Tel:010-82108701;E-mail:jgsun@caas.ac.cn

