纳米铁酸钴活化过氧单硫酸盐系统去除水中磺胺类药物的研究
谈超群 董雨婕 傅大放
(东南大学土木工程学院, 南京 210096)
纳米铁酸钴活化过氧单硫酸盐系统去除水中磺胺类药物的研究
谈超群 董雨婕 傅大放
(东南大学土木工程学院, 南京 210096)
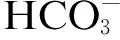
纳米铁酸钴;磺胺类药物;过氧单硫酸氢钾;影响因素;淬灭实验
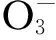
Keywords: nano-scaled CoFe2O4; sulfonamides; peroxymonosulfate; influencing factors; scavenging tests
磺胺类药物具有广谱抗菌性、疗效明显、使用方便等优点,已被广泛用于由细菌及真菌引起的感染性疾病的治疗.人工合成的磺胺类药物(SAs)具有对氨基苯磺酰胺基结构,其在人和动物体内均不能被完全代谢,未完全代谢部分最终通过排泄物的形式进入水环境中,因此在各类水体循环中均能检测到磺胺类药物的存在,如饮用水水源、污水厂尾水等[1-2].水循环中富集的磺胺类药物会引发水中微生物产生抗药性,同时也会对人体健康造成危害.
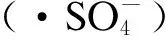
1 实验材料与方法
1.1 实验材料
实验中所用药品均为分析纯.甲醇(色谱纯,纯度大于99.9%)、乙酸(色谱纯,纯度大于99.9%)、乙腈(色谱纯,纯度大于99.9%)均购自美国西格玛药剂公司;磺胺甲基嘧啶(纯度大于99.5%)、磺胺吡啶(纯度大于99.5%)均购自上海国药集团;磁性纳米铁酸钴(CoFe2O4,纯度大于99.5%)购自南京埃普瑞纳米材料有限公司;过硫酸氢钾复合盐(KHSO5·0.5KHSO4·0.5K2SO4,KHSO5质量分数ω=47.0%)、乙醇(EtOH,纯度大于99.7%)、叔丁醇(TBA,纯度大于99.7%)、磷酸氢二钠(Na2HPO4,纯度大于99.0%)、磷酸二氢钠(NaH2PO4,纯度大于99.0%)、碳酸氢钠(NaHCO3,纯度大于99.0%)、氯化钠(NaCl,纯度大于99.0%)均购自国药集团化学试剂有限公司,超纯水产自Milli-Q学术水净化系统.
实验仪器有配有Symmetry C18色谱柱的高效液相色谱仪(HPLC,Waters 2695)、SHZ-B恒温水浴振荡器、梅特勒-托利多pH计和电子天平(FA2202)等.
1.2 实验方法
取200 mL预制的含目标磺胺药物的标准溶液放入250 mL聚四氟乙烯瓶盖的棕色玻璃瓶中,加入磁性纳米催化剂CoFe2O4.而后将玻璃瓶均匀放置于恒温水浴振荡器中,开启控温系统调至反应所需温度,调节振荡器振荡速度,以保证玻璃瓶中物质混合均匀且吸附饱和.30 min后,向各反应瓶中加入一定量的氧化剂PMS,反应开始计时.利用5 mL注射器在指定的反应时间内取样2 mL,经孔径为0.22 μm的针头滤器过滤后,取0.8 mL滤液加入有0.2 mL乙醇淬灭剂的液相进样瓶中,进行分析.
1.3 分析方法
实验采用HPLC(C18色谱柱)测定SM1浓度,测定中流动相配比中甲醇与乙酸质量浓度比为45∶55,检测波长为270 nm,流速为0.7 mL/min,柱温为35 ℃;采用HPLC(C18色谱柱)测定SPY浓度,流动相甲醇、乙腈、乙酸质量浓度比为20∶20∶60,检测波长为285 nm,流速为0.8 mL/min,柱温为35 ℃.
2 结果与分析
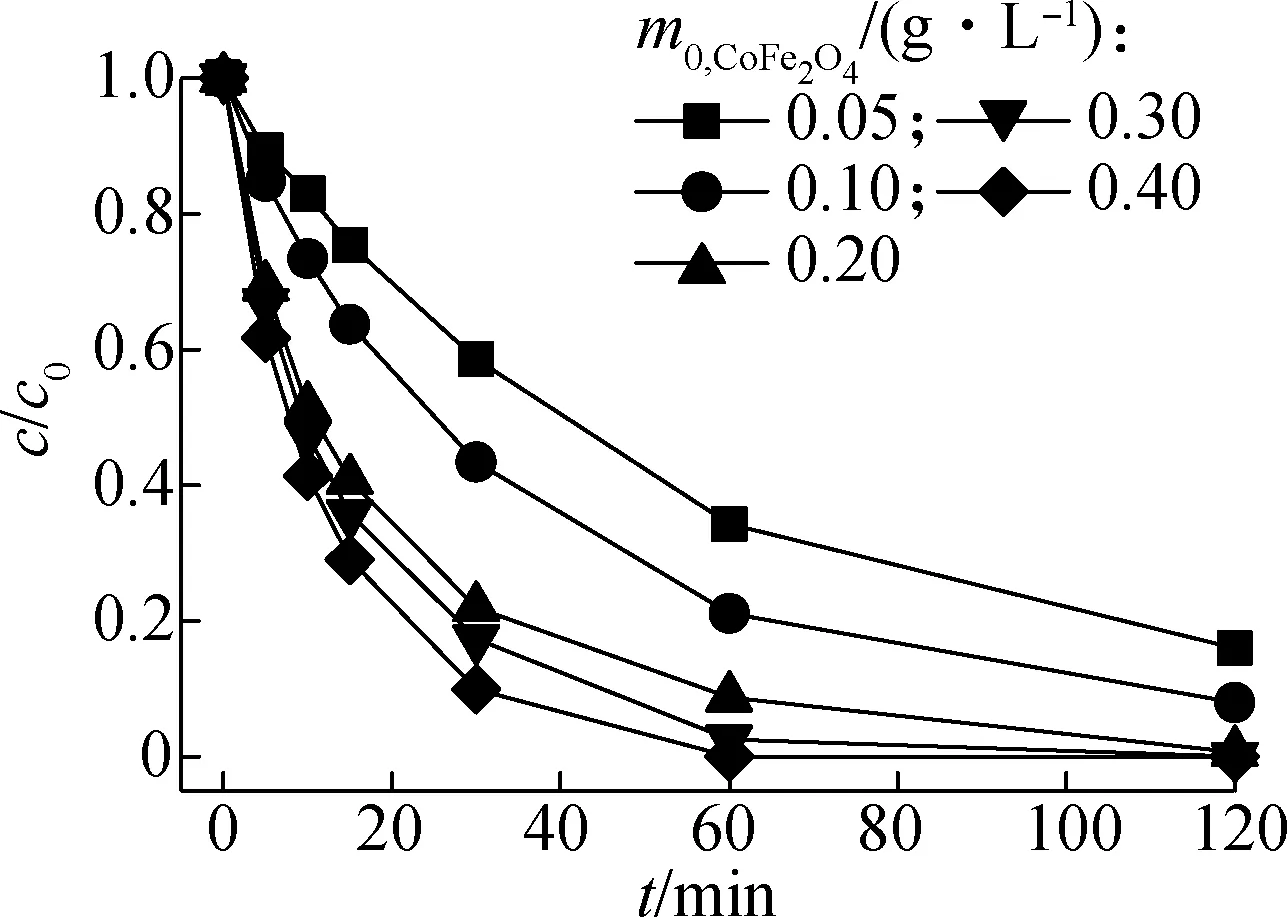
2.1 催化剂投量的影响
SM1与SPY初始浓度为10 mg/L,氧化剂投量为0.2 mmol/L,在反应历时120 min情况下,考察不同催化剂投加量对SM1,SPY降解效果的影响,实验结果如图1所示,图中c/c0为药物t时刻物质的量浓度与药物初始物质的量浓度的比值.由图可知,催化剂CoFe2O4的初始投加质量浓度m0,CoFe2O4
(a) SM1浓度变化情况

(b) SPY浓度变化情况

(c) SM1降解速率

(d) SPY降解速率
的增加显著提高了SM1及SPY的去除率,当催化剂投量提高至0.30 g/L时,系统中的SM1及SPY已被完全去除.根据拟一级动力学模型对药物降解规律进行拟合,拟合结果(见图1)表明,2种药物的拟一级动力学反应降解速率常数kobs值均随催化剂投量的增加而线性增加.在催化剂投量0.05~0.40 g/L范围内,SM1降解的kobs值由1.595×10-2min-1递增至7.937×10-2min-1,符合kobs=0.192 67m0,CoFe2O4+0.003 25的规律;SPY的kobs值由0.702×10-2min-1递增至5.172×10-2min-1,符合kobs=0.130 99m0,CoFe2O4+0.001 02的规律.这是由于催化剂CoFe2O4中的Co2+与氢氧根形成了配合物,该配合物为PMS中的O—O断裂提供了有效催化点位,从而产生更多的强氧化性自由基,反应式如下[9]:
Co2++H2O→CoOH++H+
(1)
Fe3++H2O→FeOH2++H+
(2)
Co2++FeOH2+→CoOH++H+
(3)
(4)
Su等[10]利用CoxFe3-xO4催化剂Oxone降解水中罗丹明B时也发现类似规律,CoxFe3-xO4投加量越大,污染物罗丹明B的降解kobs值也越大.相同的CoFe2O4投量对于SM1系统降解的速率要高于SPY系统,这可能是由于2种磺胺类药物特征官能团的化学稳定性差异所致[11].
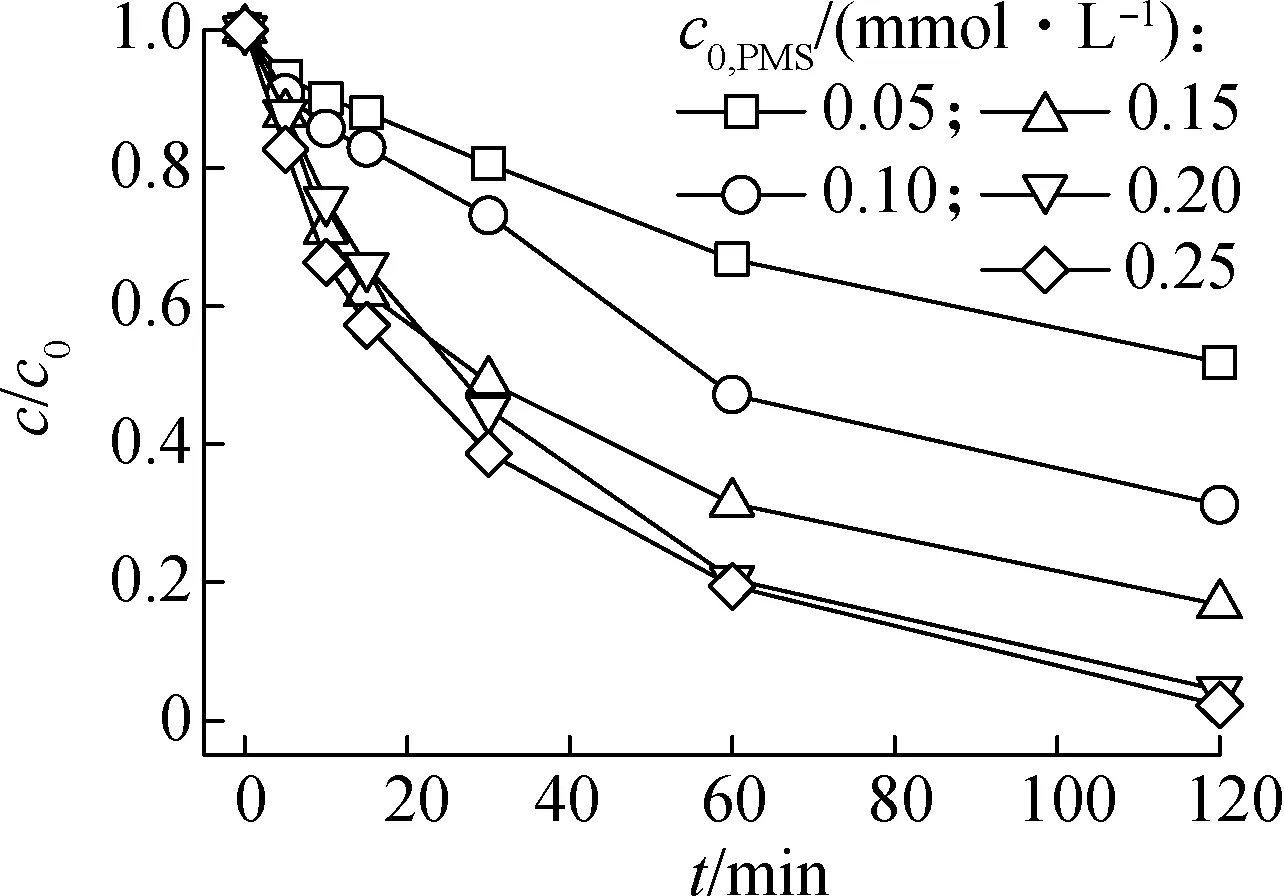
2.2 氧化剂投量的影响

(5)
(6)

(a) SM1浓度变化情况
(b) SPY浓度变化情况

(c) SM1降解速率

(d) SPY降解速率
在利用Fe3O4磁性纳米颗粒催化PMS降解扑热息痛的研究中发现,氧化剂投量超过0.4 mmol/L时,扑热息痛的降解效率显著下降[12].Fang等[13]研究V2O3催化过二硫酸盐(PS)去除水中2,4,4′-三氯联苯(PCB28)时发现,PMS投量过高会抑制污染物的去除效果.
2.3 底物浓度的影响
在CoFe2O4投量为0.2 g/L,PMS投量为0.2 mmol/L,反应历时为120 min的实验条件下,系统中SM1,SPY初始浓度变化对药物去除效果的影响如图3所示.由图可知,当SM1的初始投加质量浓度m0,SM1分别为2.5,5.0,7.5 mg/L时,完全去除污染物所需时间分别为15,30,60 min,对应的kobs值分别为0.265,0.143,0.078 min-1.而当SPY的初始投加质量浓度m0,SPY为2.5,5.0,7.5 mg/L时,完全去除污染物所需的时间分别为30,60,120 min,对应的kobs值分别为0.149,0.067,0.044 min-1.当目标污染物初始浓度为10.0 mg/L时,120 min内SM1的去除率为99.3%,对应的kobs值0.042 min-1;SPY的去除率为95.6%,对应的kobs值0.026 min-1.可见SM1,SPY的降解速率与相应的药物初始浓度呈负相关.原因是当系统中氧化剂和催化剂投量一定时,活化反应产生的自由基数量也一定,反应系统中目标药物浓度越大,达到相同药物去除率所需的反应历时就越长,降解反应速率也越慢.Muhammad等[14]利用载钌活性炭活化PMS降解苯酚时,也得到了类似的结论.

(a) SM1浓度变化情况

(b) SPY浓度变化情况

(c) SM1降解速率

(d) SPY降解速率
2.4 pH的影响
SM1,SPY的降解速率常数随系统pH的变化如表1所示.由表1可知: 当系统酸碱度在酸性至偏碱性范围内(pH=3~9)变化时,2种磺胺类药物的kobs值均随着pH的上升而增大,同时在pH=3~5时,CoFe2O4/PMS系统的降解速率较小且随pH的增加kobs值的增速较慢,当pH=5~7时,随pH上升,系统降解速率剧烈增加;当pH值由7提升至9时,系统对2种药物降解速率的增长均趋缓,在pH=9时,SM1和SPY均出现最大kobs值,其中SM1的降解速率常数kobs值为7.547×10-2min-1,SPY的降解速率常数kobs值为6.389×10-2min-1,此时系统中SM1,SPY均被完全去除;当反应液酸碱度由偏碱性变化至碱性时(pH=9~11),SM1及SPY的降解速率均呈现快速下降,并在pH=11时出现最小kobs值,SM1的降解速率常数kobs值为0.937×10-2min-1,SPY的降解速率常数kobs值为0.761×10-2min-1,此时2种药物的去除率也最小,SM1的去除率为64.4%,SPY的去除率为59.4%.


表1 不同pH对2种药物降解的影响
(9)
(10)
(11)

2.5 阴离子的影响

(12)
(13)

表2 不同阴离子浓度对药物降解速率的影响
(14)
(15)
(16)
(17)
2.6 催化材料回收次数的影响
为考察CoFe2O4催化性能的稳定性,在氧化剂投量为0.2 mmol/L、初始CoFe2O4投量为0.2 g/L、底物初始浓度为10.0 mg/L的条件下进行实验,在每次实验后利用磁铁回收催化材料,并将材料洗净及真空烘干后用于下次实验.依次对催化材料进行1~4次回收实验,实验结果如图4所示.CoFe2O4使用1~4次时,SM1在120 min内的去除率分别为99.3%,91.5%,71.9%,47.1%,对应的降解速率常数kobs值分别为2.616×10-2,1.337×10-2,0.847×10-2,0.780×10-2min-1;而SPY的去除率为95.6%,79.3%,63.6%,62.4%,对应的降解速率常数kobs值分别为4.241×10-2,2.176×10-2,1.072×10-2,0.529×10-2min-1.
随着催化材料使用次数的增加,SM1和SPY的去除率和降解速率均逐渐下降,可见CoFe2O4的催化性能与其回收次数之间呈负相关.这是因为随着使用次数的增加,催化材料间的团聚作用增强,导致催化剂比表面积下降,降低了催化能力.此外,催化剂CoFe2O4回收使用后,材料表面的有效官能团Co2+及CoOH+的数量也相应减少[23],也会一定程度导致其催化效率的降低.
2.7 矿化效果
在目标污染物初始浓度为10.0 mg/L、催化剂投量为0.2 g/L、反应历时为120 min的条件下分别考察系统对磺胺类药物的矿化效果.由图5可知,当c0,PMS=0.2 mmol/L时,CoFe2O4/PMS/SM1系统中的总有机碳量TOC去除率为14.0%,对应的SM1去除率高达99.3%;CoFe2O4/PMS/SPY系统中的TOC去除率为11.1%,对应的SPY去除率为95.6%,可见大部分SM1及SPY只是被降解为中间产物,并未得到完全矿化,在Yao等[24]的研究中也有类似结论.
通过配平,求得如下SM1和SPY完全矿化的反应方程式:
(18)
(19)

(a) SM1一次回收

(d) SM1四次回收

(g) SPY三次回收

图5 不同PMS投加量下磺胺类药物的矿化效果
由反应式 (18)和(19)可知,完全降解1 mol SM1需要44 mol PMS氧化剂,完全降解1 mol SPY则需要47 mol PMS氧化剂,因此理论上,要达到相同的矿化效果,同等数量的SM1比SPY需要更多的氧化剂.提高PMS投加量至1及2 mmol/L时,SM1的TOC去除率可分别提高至20.7%,33.8%,而SPY的TOC去除率可提高至17.2%,28.5%,这说明提高PMS的投量可以有效减少CoFe2O4/PMS系统中有机副产物的产生,但仍不能将所有中间产物全部矿化.在相同氧化剂投量下,SM1的矿化效果优于SPY.Ding等[25]也提出将PMS浓度由0.2 mmol/L提高至1.5 mmol/L,可将四溴双酚A的TOC去除率由10%大幅提升至56%.
2.8 自由基鉴定


图6 叔丁醇和乙醇对2种药物降解反应的影响
3 结论
1) CoFe2O4/PMS系统对磺胺类药物的去除率随着催化剂投加量增加、氧化剂投加量增加、目标药物初始浓度降低而增加,且其kobs值与CoFe2O4投加量、PMS投加量、SM1及SPY初始浓度呈线性关系.
2) CoFe2O4/PMS系统在中性和弱碱性环境下对污染物的降解效率最高,且催化剂在中性条件下循环3次后对SM1,SPY的去除率仍高达47.1%,62.4%.

References)
[1] Baran W, Adamek E, Ziemiańska J, et al. Effects of the presence of sulfonamides in the environment and their influence on human health[J].JournalofHazardousMaterials, 2011,196: 1-15. DOI: 10.1016/j.jhazmat.2011.08.082.
[2] Quinn B, Gagné F, Blaise C. Evaluation of the acute, chronic and teratogenic effects of a mixture of eleven pharmaceuticals on the cnidarian, hydra attenuata[J].ScienceoftheTotalEnvironment, 2009,407(3): 1072-1079. DOI: 10.1016/j.scitotenv.2008.10.022.
[3] Cui C, Jin L, jiang L, et al. Removal of trace level amounts of twelve sulfonamides from drinking water by UV-activated peroxymonosulfate[J].ScienceoftheTotalEnvironment, 2016,572: 244-251. DOI: 10.1016/j.scitotenv.2016.07.183.
[4] Anipsitakis G P, Dionysiou D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J].EnvironmentalScience&Technology, 2003,37(20): 4790-4797. DOI: 10.1021/es0263792.
[5] Qi F, Chu W, Xu B. Modeling the heterogeneous peroxymonosulfate/Co-MCM41 process for the degradation of caffeine and the study of influence of cobalt sources[J].ChemicalEngineeringJournal, 2014,235: 10-18. DOI: 10.1016/j.cej.2013.08.113.
[6] Ji Y, Dong C, Kong D, et al. New insights into atrazine degradation by cobalt catalyzed peroxymonosulfate oxidation: kinetics, reaction products and transformation mechanisms[J].JournalofHazardousMaterials, 2015,285: 491-500. DOI: 10.1016/j.jhazmat.2014.12.026.
[7] Burke V, Richter D, Greskowiak J, et al. Occurrence of antibiotics in surface and groundwater of a drinking water catchment area in Germany[J].WaterEnvironmentResearch, 2016,88(7): 652-659. DOI: 10.2175/106143016X14609975746604.
[8] Tong L, Huang S, Wang Y, et al. Occurrence of antibiotics in the aquatic environment of Jianghan Plain, central China[J].ScienceoftheTotalEnvironment, 2014,497-498: 180-187. DOI: 10.1016/j.scitotenv.2014.07.068.
[9] 鲁映青,俞月萍.药理学[M].2版.上海:复旦大学出版社,2009:282-284.
[10] Su S, Guo W, Leng Y, et al. Heterogeneous activation of Oxone by Co(x)Fe(3-x)O4nanocatalysts for degradation of rhodamine B[J].JournalofHazardousMaterials, 2013,244-245: 736-742. DOI: 10.1016/j.jhazmat.2012.11.005.
[11] 符荷花,陈猛,熊小京.Fenton氧化法对磺胺类抗生素的降解动力学[J].环境工程学报,2014,8(3):972-976. Fu Hehua, Chen Meng, Xiong Xiaojing. Kinetics of degradation of sulfonamides by Fenton process[J].ChineseJournalofEnvironmentalEngineering, 2014,8(3): 972-976. (in Chinese)
[12] Tan C, Gao N, Deng Y, et al. Radical induced degradation of acetaminophen with Fe3O4magnetic nanoparticles as heterogeneous activator of peroxymonosulfate[J].JournalofHazardousMaterials, 2014,276: 452-460. DOI: 10.1016/j.jhazmat.2014.05.068.
[13] Fang G, Wu W, Liu C, et al. Activation of persulfate with vanadium species for PCBs degradation: A mechanistic study[J].AppliedCatalysisB:Environmental, 2017,202: 1-11. DOI: 10.1016/j.apcatb.2016.09.006.
[14] Muhammad S, Shukla P R, Tadé M O, et al. Heterogeneous activation of peroxymonosulphate by supported ruthenium catalysts for phenol degradation in water[J].JournalofHazardousMaterials, 2012,215-216: 183-190. Doi:10.1016/j.jhazmat.2012.02.045.
[15] Liang C, Wang Z S, Bruell C J. Influence of pH on persulfate oxidation of TCE at ambient temperatures[J].Chemosphere, 2007,66(1): 106-113. DOI: 10.1016/j.chemosphere.2006.05.026.
[16] Feng Y, Wu D, Deng Y, et al. Sulfate radical-mediated degradation of sulfadiazine by CuFeO2rhombohedral crystal-catalyzed peroxymonosulfate: Synergistic effects and mechanisms[J].EnvironSciTechnol, 2016,50(6): 3119-3127. DOI: 10.1021/acs.est.5b05974.

[18] Bennett D A, Yao H, Richardson D E. Mechanism of sulfide oxidations by peroxymonocarbonate[J].InorganicChemistry, 2001,40(13): 2996-3001. DOI: 10.1021/ic000910h.
[19] 何勇,陈瑛,卢丽娟,等.基于UV/H2O2和UV/PS系统降解水体中磺胺吡啶研究[J].应用化工,2016,45(5):815-819. DOI: 10.16581/j.cnki.issn1671-3206.20160201.008. He Yong, Chen Ying, Lu Lijuan, et al. Degradation of sulfapyridine in aqueous solution by UV/H2O2and UV/PS technology[J].AppliedChemicalIndustry, 2016,45(5): 815-819. DOI: 10.16581/j.cnki.issn1671-3206.20160201.008. (in Chinese)
[20] Anipsitakis G P, Dionysiou D D, Gonzalez M A. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. Implications of chloride ions[J].EnvironSciTechnol, 2006,40(3): 1000-1007. DOI: 10.1021/es050634b.
[21] Yuan R, Ramjaun S N, Wang Z, et al. Effects of chloride ion on degradation of Acid Orange 7 by sulfate radical-based advanced oxidation process: Implications for formation of chlorinated aromatic compounds[J].JournalofHazardousMaterials, 2011,196: 173-179. DOI: 10.1016/j.jhazmat.2011.09.007.
[22] Bennedsen L R, Muff J, Søgaard E G. Influence of chloride and carbonates on the reactivity of activated persulfate[J].Chemosphere, 2012,86(11): 1092-1097. DOI: 10.1016/j.chemosphere.2011.12.011.
[23] Xu L, Wang J. Magnetic nanoscaled Fe3O4/CeO2composite as an efficient fenton-like heterogeneous catalyst for degradation of 4-chlorophenol[J].EnvironSciTechnol, 2012,46(18): 10145-10153. DOI: 10.1021/es300303f.
[24] Yao Y, Cai Y, Lu F, et al. Magnetic recoverable MnFe2O4and MnFe2O4-graphene hybrid as heterogeneous catalysts of peroxymonosulfate activation for efficient degradation of aqueous organic pollutants[J].JournalofHazardousMaterials, 2014,270: 61-70. DOI: 10.1016/j.jhazmat.2014.01.027.
[25] Ding Y, Zhu L, Wang N, et al. Sulfate radicals induced degradation of tetrabromobisphenol a with nanoscaled magnetic CuFe2O4as a heterogeneous catalyst of peroxymonosulfate[J].AppliedCatalysisB:Environmental, 2013,129: 153-162. DOI: 10.1016/j.apcatb.2012.09.015.
[26] Yang S, Wang P, Yang X, et al. A novel advanced oxidation process to degrade organic pollutants in wastewater:Microwave-activated persulfate oxidation[J].JournalofEnvironmentalSciences, 2009,21(9): 1175-1180. DOI: 10.1016/S1001-0742(08)62399-2.
Removalofsulfonamidesinaqueoussolutionbynano-scaledCoFe2O4activatedperoxymonosulfatesystem
Tan Chaoqun Dong Yujie Fu Dafang
(School of Civil Engineering, Southeast University, Nanjing 210096, China)
X131.2
A
1001-0505(2017)05-0963-09
2017-02-06.
谈超群(1989—),男,博士,讲师,tancq@seu.edu.cn.
国家自然科学基金青年科学基金资助项目(51608109)、江苏省自然科学基金青年科学基金资助项目(BK20160675)、同济大学污染控制与资源化研究国家重点实验室开放课题资助项目(PCRRF16015).
谈超群,董雨婕,傅大放.纳米铁酸钴活化过氧单硫酸盐系统去除水中磺胺类药物的研究[J].东南大学学报(自然科学版),2017,47(5):963-971.
10.3969/j.issn.1001-0505.2017.05.020.
10.3969/j.issn.1001-0505.2017.05.020

