河南省副猪嗜血杆菌的分离鉴定与药敏试验
朱文豪,徐引弟,方剑玉,王治方,张青娴,焦文强,李海利,许 峰
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
河南省副猪嗜血杆菌的分离鉴定与药敏试验
朱文豪1,2,徐引弟1,2,方剑玉1,2,王治方1,2,张青娴1,2,焦文强1,2,李海利1,2,许 峰1,2
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002;2.河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
从河南省内不同县市的部分猪场送检疑似感染副猪嗜血杆菌病病料中分离鉴定到9株致病菌。为防治疾病传播,控制疫情蔓延,对分离菌株进行病理剖检、细菌分离培养、生化鉴定以及PCR鉴定和药敏试验。结果表明,分离到的致病菌为副猪嗜血杆菌。药敏试验显示9株分离菌株对氨苄西林、头孢噻呋、头孢他啶、氟苯尼考、阿奇霉素、阿莫西林高敏;对壮观霉素、左氟沙星、氧氟沙星、环丙沙星敏感;对克林霉素、阿米卡星、卡那霉素、恩诺沙星不敏感或耐药;对红霉素、罗红霉素、新霉素、四环素、强力霉素敏感性不稳定,表现不一。
猪;副猪嗜血杆菌;分离鉴定;药敏试验
副猪嗜血杆菌病是近几年危害养猪业比较严重的猪病之一,是由副猪嗜血杆菌(Haemophilus parasuis,HPS)引起的一种传染病。该病主要发生在断奶仔猪和保育猪,发病率为10%~15%,严重时死亡率高达50%[1]。副猪嗜血杆菌是革兰氏阴性菌,属巴氏杆菌科嗜血杆菌属,其形态长丝状小短杆。副猪嗜血杆菌是猪上呼吸道的一种常在菌,具有条件致病性,主要危害2~28周龄仔猪和生长猪,特别是在5~8周龄保育仔猪上,可引发较为严重的身体多部位疾病,以关节炎性肿、脑膜炎和纤维素性多发性浆膜炎为特征病变[2]。该病近几年流行比较广泛,发病后死亡率比较高,治疗缓慢,愈后恢复时间长,给养殖场带来巨大经济损失。临床上,该病表现为气喘咳嗽、发热、精神沉郁、消瘦、被毛凌乱、跛行以及共济失调等症状,个别还有神经症状。剖检多见有胸肺粘连,胸腔内蓄积淡黄色液体;跗关节现黏性混浊积液。本试验结合最近养殖场情况,对副猪嗜血杆菌进行研究。针对该病的流行情况进行细菌分离,并对分离到的致病性菌株进行鉴定和耐药性检测,筛选敏感药物,以便指导养殖场合理用药,为控制副猪嗜血杆菌病的发生提供综合防制措施,为广大兽医工作者提供参考。
1 材料和方法
1.1 材料
1.1.1 病料 采自2016年9月份以来河南省不同县市部分养殖户送检猪只,共22份。无菌条件下抽取关节积液、心包液、腹水和脏器等做为病料进行试验。
1.1.2 主要试剂 烟酰胺腺嘌呤二核苷酸(NAD)由广州鼎国生物有限公司提供;乳牛血清购自北京四季青生物试剂有限公司;巧克力琼脂培养基、胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)培养基均购自北京陆桥技术有限公司;DNA提取试剂盒等购自大连宝生物公司;生化微量发酵管和药敏纸片购自杭州天和微生物试剂有限公司。
1.1.3 培养基 使用胰蛋白胨大豆琼脂(TSA)和胰蛋白胨大豆肉汤(TSB)培养基(Becton Dickinson),另含终浓度5%的乳牛血清,0.001%NAD;巧克力琼脂培养基。
1.1.4 供试动物 30只小白鼠由郑州大学实验动物中心提供。
1.2 方法
1.2.1 病原菌的分离 将病料接种于添加终浓度为0.001%NAD和5%乳牛血清的TSA培养基,37℃培养箱培养48~72 h。
1.2.2 病原菌的纯化培养及形态鉴定 挑取胰蛋白胨大豆琼脂培养基上生长的透明的、水样饱满圆形可疑菌落,接种于TSA培养基纯化培养。把纯化后的菌株挑取单个菌落接种于胰蛋白胨大豆肉汤中在摇床中37℃,180 r/min培养24~48 h;将疑似菌落涂片,革兰氏染色,镜检,观察其生长形态及特征[3]。
1.2.3 卫星现象观察 将纯化菌落接种于5%乳牛血清无NAD的TSA培养基上,于培养基上水平划线,用金黄色葡萄球菌垂直划线点种其上,37℃培养24~48 h,观察在金黄色葡萄球菌周围是否出现卫星现象。
1.2.4 生化试验 挑取经纯培养的可疑菌落并分别接种于乳糖、果糖、甘露醇、麦芽糖等生化反应管中,37℃培养48 h后观察试验结果并记录[4]。
1.2.5 PCR鉴定 根据副猪嗜血杆菌16S rRNA基因(M75065)序列设计引物,由生工生物工程(上海)股份有限公司合成,预期扩增产物的大小为821 bp,上游引物 A1:5'-GGCTTCGTCACCCTCTGT-3';下游引物 A2:5'-GTGATGAGGAAGGGTGGTGT-3'。提取分离细菌的DNA PCR反应体系总 25 μL:2xTaq PCR Master Mix 12.5 μL,4 μL 模板 DNA,引物 A1、A2 各 1 μL,6.5 μL 灭菌超纯水。反应条件:预变性94 ℃ 5 min;95 ℃ 30 s、56 ℃退火 30 s、72 ℃ 30 s,35个循环;延伸72℃5 min。以灭菌超纯水为阴性对照,取10 μL PCR扩增产物进行琼脂糖凝胶电泳,并分析结果。
1.2.6 小鼠致病性试验 将PCR鉴定结果阳性的菌株接种于0.001%NAD和5%乳牛血清的TSB培养基上,37℃培养48 h,用无菌生理盐水5倍稀释,试验组小白鼠皮下接种0.6 mL,对照组小白鼠皮下注射0.6 mL无菌生理盐水,24 h后观察小鼠情况。将死亡小白鼠剖检,采集小白鼠肺和脾脏并进行病料处理,接种于0.001%NAD和5%乳牛血清的TSA培养基上,观察结果,涂片鉴定或者PCR鉴定。
1.2.7 药敏试验 将分离纯化好的菌落均匀涂抹接种到0.001%NAD和5%乳牛血清的TSA培养基上,将不同的药敏片粘贴于培养基上,37℃培养36~48 h,测量各药敏片抑菌环直径,抑菌圈直径≥25 mm为高敏,15~25 mm为中敏,≤14 mm为不敏感或耐药[5]。
2 结果与分析
2.1 剖检病理变化
剖检病猪能够发现病变以关节炎、胸膜炎、腹膜炎最为常见。心脏、肝脏、脾脏、肺脏以及肠道等器官表面有纤维素样渗出;部分病变部位,如心包、胸腔或腹腔可见淡黄色混浊液蓄积;跗关节内有黏性混浊积液。
2.2 细菌培养及形态观察
采集22份病样进行培养,分离到9株细菌。将纯化的菌株分别在普通琼脂、营养肉汤、麦康凯培养基上培养未见细菌生长;在0.001%NAD和5%乳牛血清的TSA培养基上和巧克力琼脂培养基上培养,均有菌落生长。形态呈无色透明或灰白色半透明、露珠状、圆润扁平的小菌落。挑选菌落抹片革兰氏染色油镜下观察,可见革兰氏染色为阴性、具有多种不同的形态,呈单个的球杆状、长杆状、细长杆及丝状细小杆菌(图1)。以上符合副猪嗜血杆菌的菌落和细菌形态[3,6-7]。

图1 油镜下HPS的革兰氏染色形态
2.3 卫星试验
通过划线接种金黄色葡萄球菌,出现在金黄色葡萄球菌线两侧有针尖大小、圆形、边缘整齐的菌落生长,并且距离金黄色葡萄球菌由近及远菌落生长由大变小至未见生长,同时由多变少,呈现出“卫星现象”,符合副猪嗜血杆菌的培养特性。
2.4 生化试验
将分离的细菌接种到生化管,37℃培养48 h结果显示接触酶试验阳性,氧化酶、脲酶、吲哚及硝酸盐还原试验均为阴性;可以发酵葡萄糖、麦芽糖、半乳糖等,不发酵乳糖、山梨醇、葡萄糖酸盐、甘露醇,符合副猪嗜血杆菌的生化鉴定特点。
2.5 小鼠致病性试验
试验组小白鼠24 h后出现死亡,对照组正常。将死亡小白鼠采集病料,分离纯化细菌得到透明、露珠状细小可疑菌落,经PCR鉴定为副猪嗜血杆菌。
2.6 PCR鉴定结果
对分离到的9株菌株进行PCR扩增,琼脂糖凝胶电泳结果显示,在821 bp处出现特异性条带(图2),表明所分离到的9株菌株为副猪嗜血杆菌。
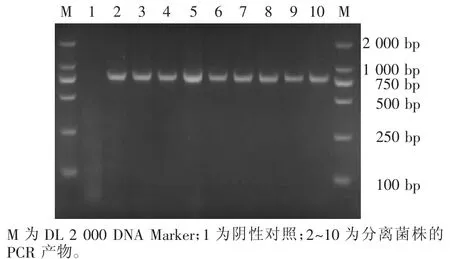
图2 分离菌株的PCR鉴定
2.7 药敏试验结果
从表1我们可以得出:分离菌株对氨苄西林、头孢噻呋、头孢他啶、氟苯尼考、阿奇霉素、阿莫西林高敏;对壮观霉素、左氟沙星、氧氟沙星、环丙沙星敏感;对克林霉素、阿米卡星、卡那霉素、恩诺沙星不敏感或耐药;对红霉素、罗红霉素、新霉素、四环素、强力霉素敏感性不稳定,表现不一。

表1 药敏试验结果
3 讨论
从研究结果表明,副猪嗜血杆菌病现在流行比较广泛,已经成为养猪业普遍存在,危害较大的细菌病之一。过去,副猪嗜血杆菌被认为是一种随机入侵的次要病原,在与猪繁殖与呼吸综合征病毒、圆环病毒、猪瘟病毒、伪狂犬病病毒、胸膜肺炎放线杆菌、链球菌等协同作用时才引发临床症状[6,8]。
在本试验中,病原采集主要在发热期的病猪进行耳缘静脉或前腔静脉采集血液;发病猪死后,采集心血、心包液、胸水、腹水、纤维蛋白性渗出物、肺、肝脏等作为病料。通过分离病原时发现,对患病猪只剖杀采集病原,以及死亡12 h内采集病原进行病原分离,可提高病原的分离率,同时注意病料不可冷冻,否则无法采集病原。在本试验采集病料进行病原菌的分离时发现患病猪只的肾脏、脾脏、肝脏等内脏器官等部位采集的病料较难分离出病原菌,而在肿大的关节液、心包积液和肺支气管等部位分离病原的检出率较高,说明关节、心脏、肺脏是副猪嗜血杆菌重要的感染器官。同时,在病料采集时问询户主是否使用抗生素,如果有使用则病原采集率较低。
在细菌培养过程中,由于副猪嗜血杆菌拥有荚膜,对培养基要求较高,必须使用TSA和TSB含量高的培养基,这样可以大幅缩短培养时间。该菌生长较为缓慢且菌落细小,24 h内只能长出针尖大小的菌落,不仔细观察不易发现,36~48 h后可挑出菌落,进行下一步试验。目前,副猪嗜血杆菌的治疗主要以抗菌药物为主,本试验中使用19种药物进行药敏试验,其中分离菌株对氨苄西林、头孢噻呋、头孢他啶、氟苯尼考、阿奇霉素、阿莫西林高敏,药敏试验结果与他人报道有所不同[9-10]。分析认为可能与畜主使用抗菌药物有关,不同的抗菌药使得临床药敏试验产生不同的结果。这种差异也说明了地方分离菌株对敏感药物的筛选在对本地区副猪嗜血杆菌病的预防及治疗具有重要的指导性作用。也有学者进行中药药敏试验,结果表明金银花及其复方制剂对副猪嗜血杆菌抑制作用明显[11]。
结合本次试验结果,对发病猪场使用高敏药物治疗。通过回访追踪发现,大部分猪场经常使用抗生素,对母猪及猪群进行预防性混饲给药,使其携带的耐药菌株代代相传,使耐药性变得越来越严重,对其菌株的分离以及后续的药敏试验增加难度。因此在临床上,应避免盲目用药,务必结合猪场之前用药情况,同时参考药敏试验结果选取用药。其用药原则是平时使用较少的,药敏试验高敏的,组织分布浓度高且穿透性强的抗菌药物。同时,有条件鉴定血清型的猪场可以根据副猪嗜血杆菌的血清型注射相符的商品疫苗,以达到最佳治疗效果。
[1] 薛国聪,任涛.中国畜牧兽医[J] ,2009,36(5):168-171.
[2] 代广军,吴志明,苗连叶,等.规模养猪精细管理及新型疫病防控技术[M] .北京:中国农业出版社,2006:397-399.
[3] 蔡旭旺,刘正飞,陈焕春,等.华中农业大学学报[J] ,2005(24):55-58.
[4] 陆承平.兽医微生物学[M] .第3版.北京:中国农业出版社,2004:258-261.
[5] 姚火春.兽医微生物学实验指导[M] .第2版.北京:中国农业出版社,2002:35-37.
[6] 斯特劳.猪病学[M] .第8版.刘文军,张中秋,沈建忠,译.北京:中国农业大学出版社,1998:407-416.
[7] 高鹏程,储岳峰,赵萍,等.动物医学进展[J] ,2007,28(12):27-29.
[8] 尹秀凤,张书霞,王艳,等.中国兽医学报[J] ,2007,27(1):91-94.
[9] 方泉明,黄建珍,黄冬艳.中国畜牧兽医[J] ,2009,36(4):161-163.
[10] 刘俊伟,安志兴,葛亚明,等.西北农业学报[J] ,2011,20(2):37-39,109.
[11] 仇微红,张盼锋,郭世宁.动物医学进展[J] ,2009,30(2):53-55.
(编辑:郭玉翠)
S858.28
A
1002-1957(2017)05-0102-03
2017-06-30
河南省农业科学院自主创新项目(2017zc50)
朱文豪(1979-),男,河南西平人,助理研究员,硕士,研究方向为动物微生物免疫学.E-mail:hnwenhao@163.com

