阳极电位对锆在异丙醇中溶解行为的影响
杨喜云,黄海强,杨声海
阳极电位对锆在异丙醇中溶解行为的影响
杨喜云,黄海强,杨声海
(中南大学冶金与环境学院,湖南长沙,410083)
采用循环伏安法(CV)、计时电流法、交流阻抗法(EIS)、扫描电镜(SEM)和X线光电子能谱(XPS)研究不同电位下锆在异丙醇溶液中阳极溶解行为。研究结果表明:当阳极电位为0~1.10 V时,锆表面存在氧化膜导致钝化,不发生活性溶解;交流阻抗复数平面图出现大的容抗弧;自腐蚀电位随时间延长而增大;当阳极电位大于1.10 V,Br−击穿钝化膜使锆发生活性溶解,锆溶解属于点蚀,交流阻抗复数平面图在高频区出现容抗弧,在中频区出现感抗弧,在低频区出现Warburg阻抗;稳态点蚀电位处于1.10~1.20 V之间,点蚀的成核方式为瞬间三维成核,生长过程为扩散控制;提高阳极电位,点蚀加剧,腐蚀面积加大,腐蚀孔加深,容抗弧直径减小;锆表面钝化膜的主要成分为ZrO2,在异丙醇溶液中溶解生成Zr(OC3H7)4。
锆;点蚀;异丙醇; 阳极电位
氧化锆具有良好的热稳定性和化学稳定性,红外传输系数高,耐腐蚀性强,低温催化活性高,并具有较高的介电常数(20~30)、较宽的带隙以及合适的通道势垒高度(>1 eV)。因此,在陶瓷、耐火材料、化工和电子等领域得到广泛应用[1−2]。锆醇盐是制备氧化锆的重要前驱体[3]。合成金属醇盐的方法有卤化物合成法和电化学合成法[4−5]。卤化物在合成过程中产生大量颗粒细小的NH4Cl沉淀,过滤困难且吸附金属醇盐,产品回收率低。电化学合成法以金属为阳极,经电化学合成、常压蒸馏分离醇,减压精馏分离各种杂质醇盐,最终获得高纯金属有机醇盐产品。该方法具有工艺流程短、副产物少、产率高、易于产业化的优点,是目前合成金属有机醇盐最有效的方法[6]。科技工作者已采用电化学法合成了乙醇铌、甲醇钛等醇盐[7−8]。锆与钛是姐妹金属,它们的物理化学性质相似,故电化学法也是一种合成锆醇盐的有效方法[9]。异丙醇是一种重要的有机溶剂,沸点低,与其他溶剂相容性好。异丙醇锆在醇中的溶解度大,不仅可作为氧化锆的前驱体,而且是合成交联剂的主要原料[2]。要合成异丙醇锆,需先了解锆在异丙醇溶液中的溶解行为。锆在水溶液中极易生成氧化膜而钝化,卤素离子会破坏钝化膜诱发点蚀[10−11],而锆在有机溶剂中的溶解行为还未见报道。为此,本文作者以四丁基溴化铵(Bun4NBr)为惰性电解质,分别采用循环伏安法、计时电流法、交流阻抗法研究阳极电位对锆在异丙醇溶液中溶解行为的影响,以便为优化异丙醇锆的电化学合成条件提供依据。
1 材料与方法
1.1 电解池体系
电解液为0.08 mol/L Bun4NBr,体积分数为10% CH3CN的异丙醇溶液,简称Bun4NBr异丙醇溶液。本实验所用试剂均为分析纯,异丙醇含水量(质量分数)为0.2%。研究电极为锆棒,直径为5 mm,长度为 10 cm,用AB 胶封装于玻璃管中并露出下端面作为工作面,研究电极面积为0.19 cm2。铂片电极(长×宽为2 cm×2 cm)为辅助电极,饱和甘汞电极为参比电极,文中的电极电位均是相对于参比电极的电位。每次实验前, 依次用23.0,13.0,6.5和4.5 μm的金相砂纸打磨研究电极至镜面光亮,然后用异丙醇擦洗,吹干快速转入电解液中。电解液通高纯氮气10 min以排除空气,整个实验过程保持体系密闭。
1.2 测试方法
电化学测试系统采用上海辰华CHI660B型电化学工作站。循环伏安曲线测试从自腐蚀电位向正方向扫描,扫描到一定电位后回扫至起扫电位。若无特别说明,则扫描速度为50 mV/s。采用计时电流法记录电流随时间的变化。交流阻抗测试频率范围为1~ 100 000 Hz,施加的电位为5 mV。将锆电极放在电解液中,记录锆电极电位随时间的变化。XPS测试采用美国ThermoFisher-VG Scientific公司的 ESCALAB 250Xi X射线光电子能谱仪,单色化Al K射线源,Mono 650 μm,功率为200 W,分析器通能为30 eV,能量扫描步长为0.05 eV,用C-C或C-H的C1s 284.8 eV进行荷电位仪校正。采用Thermo Avantage软件进行拟合分峰。
2 结果与讨论
2.1 自腐蚀电位
图1所示为锆在Bun4NBr异丙醇溶液中自腐蚀电位随时间变化图。从图1可见:自腐蚀电位随时间增加缓慢上升,然后趋于稳定。自腐蚀电位增加表明锆表面逐渐钝化[11]。锆属于阀金属,标准电极电位−1.54 V,反应活性大,极易在空气、水或含有氧的环境中氧化生成ZrO2氧化膜[12],反应式为。由于钝化膜存在,锆在水溶液中表现出极强的耐蚀性。钛不仅在水溶液中容易钝化,而且在含少量水的有机醇中也发生钝化,比如含水量(质量分数)20%的甲醇溶液,含水量8%的乙醇,含水量2%的正丙醇,含水量0.1%的异丙醇均会使钛表面生成TiO2膜而钝化,并且醇所含碳原子数目越多,钝化所需的水量就越少[13−14]。钛与锆属于同一簇元素,物理化学性质相似,分析纯异丙醇中含有约0.2%的水,足以与锆反应形成钝化膜。图2所示为锆电极放入异丙醇溶液10 min后的表面XPS能谱图。由图2可以看出:在自腐蚀电位,金属锆表面组成主要为ZrO2,金属Zr含量极少,说明锆电极表面生成了一层比较致密的ZrO2钝化膜。
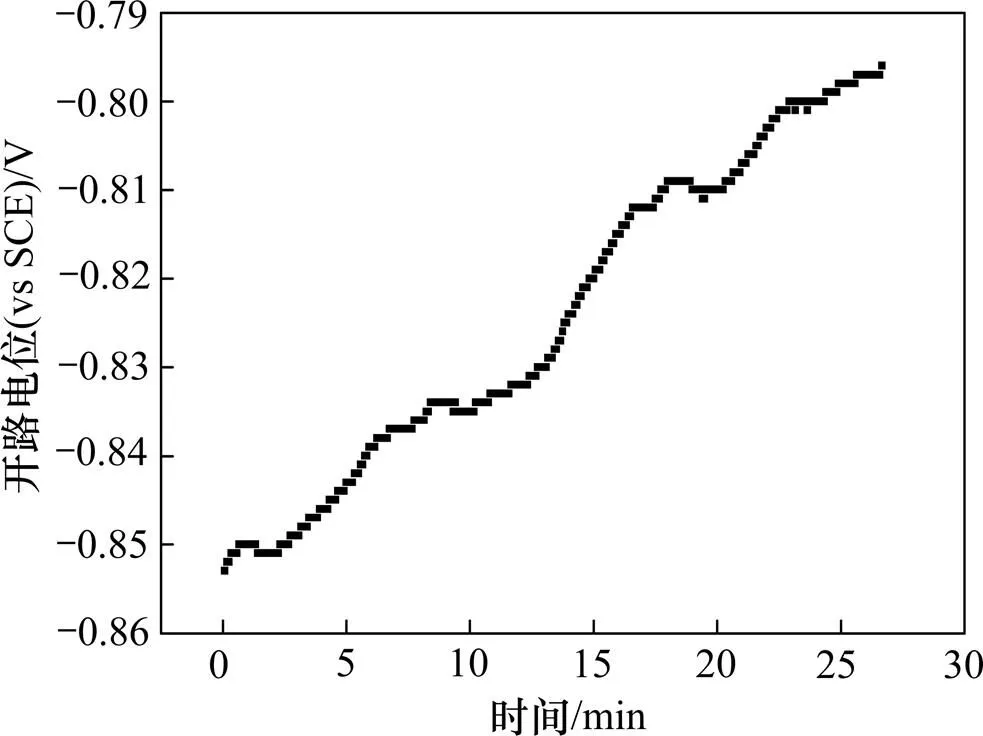
图1 Bun4NBr异丙醇溶液中锆自腐蚀电位随时间变化图

图2 自腐蚀电位下锆在Bun4NBr异丙醇溶液中浸泡10 min后的样品表面Zr 3d XPS图谱
2.2 循环伏安曲线
锆在Bun4NBr异丙醇溶液中循环伏安曲线如图3所示,扫描速率为50 mV/s。当电位从−0.80 V正向扫描至1.50 V时,锆溶解电流密度极低,并且电位对电流密度的影响小。这是因为锆表面生成了一层氧化膜。当电极电位超过临界电位1.50 V左右时,电流密度迅速增大,与电位几乎成直线上升,表明钝化膜上某些活性位点优先吸附Br−,并与其作用使钝化膜减薄,直至被击穿,开始产生点蚀。蚀孔内的金属表面处于活态,电位较负;蚀孔外的金属表面处于钝态,电位较正,于是,孔内和孔外构成1个活态−钝态微电偶腐蚀电池,电池具有“大阴极—小阳极”的面积比,促使点蚀孔不断发展,而孔外金属表面受到阴极保护,维持钝态[15]。当回扫电位为3.50~4.50 V时,回扫时电流密度继续增大,这是点蚀的自催化效应[16]。在自催化过程中电流出现新的小峰,可能生成了新的点蚀坑;随后电流密度开始下降,一方面是回扫电位逐渐减小,另一方面是因为自催化作用将孔内物质消耗过多导致孔内反应速度下降。接着电流密度下降速度变慢,这可能是因为点蚀坑合并成大的蚀孔,使孔内外离子扩散加强,减小了欧姆极化[17]。最后回扫曲线和正扫曲线交于1点,形成1个滞后环,电流密度保持稳定,电极表面又回复到钝化态,交点的电位称为再钝化电位p。
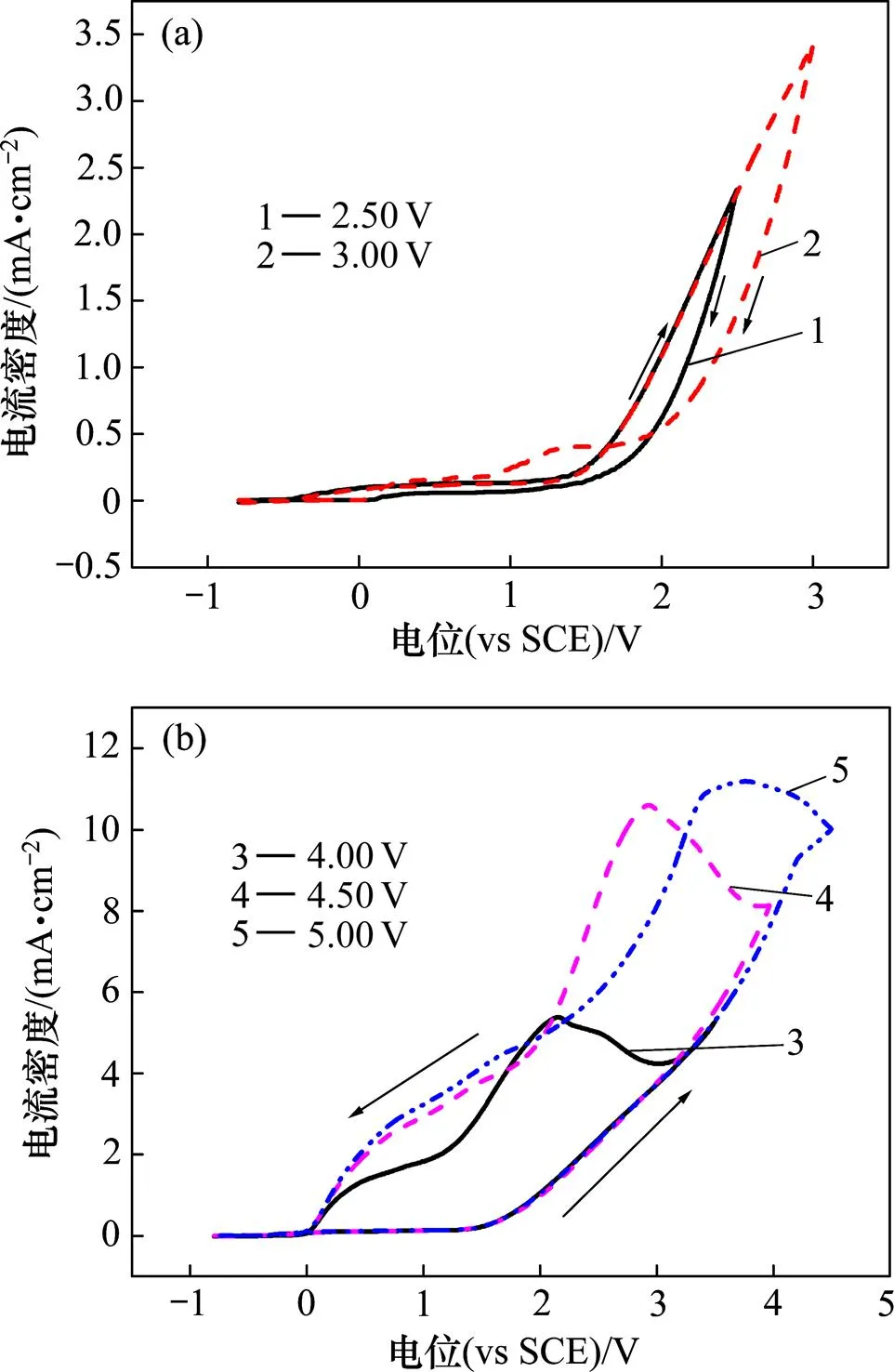
(a) 2.50 V, 3.00 V; (b) 4.00 V, 4.50 V, 5.00 V
当回扫电位分别为2.50 V和3.00 V时,未出现回扫电流峰,说明蚀孔处于发展期,孔内的溶液组成与孔外一致,没有形成自催化效应。
根据阀金属的溶解机理[18],推导出金属锆在异丙醇溶液中阳极溶解反应如下。
阳极:
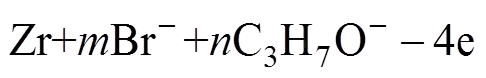
阴极:
→
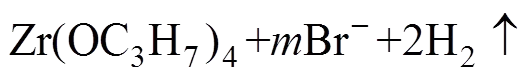
总反应:
(3)
锆在阳极溶解时首先生成中间产物Zr(OC3H7)Br,Zr(OC3H7)Br传输到阴极,在阴极负电位下,Br−被异丙氧离子取代生成异丙醇锆,同时释放H2,脱去的Br−与电解液中季铵根阳离子Bun4N+结合组成四丁基溴化铵,继续承担离子导电的功能。
2.3 计时电流曲线
图4所示为不同电位下锆在Bun4NBr异丙醇溶液中的计时电流曲线。从图4可见:当电位为0.05~ 1.10 V时,电流密度随时间迅速降低并趋于稳定,表明在此电位下锆表面钝化,钝化膜稳定,没有发生点蚀;当电位为1.10~2.50 V时,电流密度先下降后上升,表明此电位下锆表面钝化膜被破坏,发生了点蚀;当电位分别为1.10 V和1.20 V时,稳态电流出现震荡现象,说明出现点蚀,但处于萌发阶段,点蚀生成和钝化同时进行。由图4可知:稳态点蚀电位b处于1.10~ 1.20 V之间。
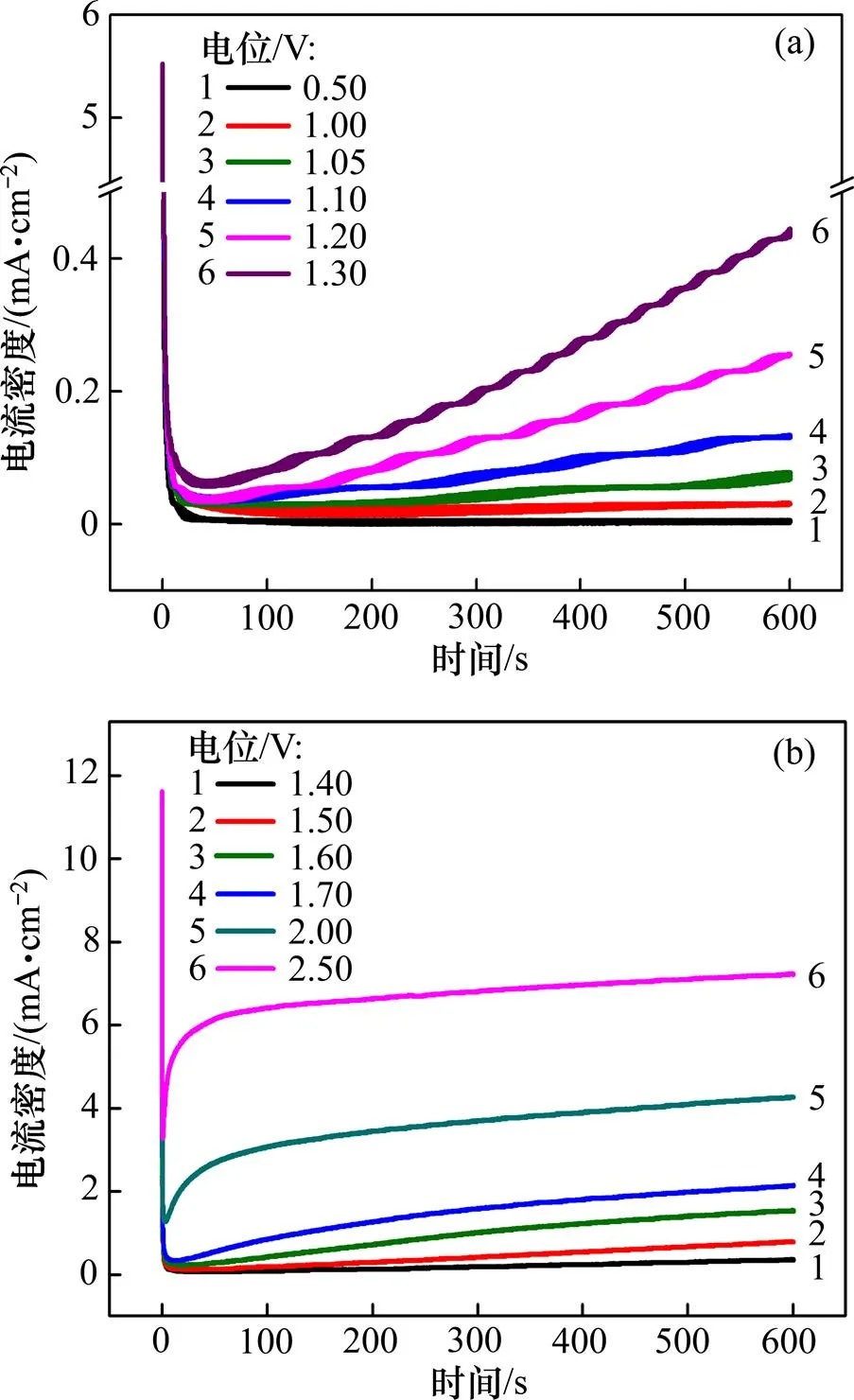
(a) 0.50~1.30 V; (b) 1.40~2.50 V
电流密度最低点对应的时间i称为点蚀诱导时间,通常用1/i来表征点蚀成核速率[19],以1/i对阳极电极电位作图,如图5所示。由图5可知:1/i随电位上升而上升,表明电位越大,点蚀成核速率越大。在电流上升阶段,电极电位越大,电流密度越大,电流达到稳定的时间也越短(见图4),表明点蚀的生长速率越快[20]。以上升部分的电流密度对1/i作图,结果如图6所示。由图6可以看出:和1/i呈线性关系,说明点蚀成核和生长符合Hills模型,蚀孔形成是瞬间三维成核,点蚀生长受扩散控制[21],如式(4)所示。

式中:斜率表征点蚀生长速率[22]。
图5 诱导时间倒数与电极电位的关系
Fig. 5 Relationship between rate of pitting initiation and potential

图6 不同电极电位下的点蚀生长电流密度与t1/2的关系
表1是根据图6中的数据拟合出的相关参数。从表1可以看出:电极电位越高,越大,点蚀生长速率加快。
2.4 交流阻抗曲线
为探究不同电极电位下电极表面的变化情况,测试不同阳极电位下的交流阻抗复数平面图(Nyquist图),结果如图7所示。
由图7可知:当电位为0.5 V时,Nyquist图在高频区和中频区出现1个容抗弧,低频区出现大的容抗弧,由于频率不够低,容抗弧只显示极少一部分,表明锆表面形成了稳定的钝化膜。YANG等[23]报道,钽在含有Bun4NBr乙醇溶液中发生钝化,出现大的容抗弧,说明阀金属钝化容易导致大的容抗谱。当阳极电位升高到1.00 V时,其Nyquist图与0.50 V时的相似,只是容抗弧半径减少,说明钝化膜仍处于稳定状态。当阳极电位为1.50~2.50 V时,Nyquist图在高频区出现1个容抗弧,在中频区出现感抗弧,在低频区出现扩散控制的Warburg阻抗,说明点蚀已经形成并发展,腐蚀产物覆盖在电极表面,阻止了离子的扩散,导致了低频端出现Warburg阻抗[24]。上述结论进一步佐证了本文中的计时电流曲线结果:点蚀生长受扩散控制。随着电位增加,容抗弧直径减小,说明钝化膜溶解和锆腐蚀速度加快。

表1 不同电极电位下点蚀生长速率参数表
2.5 SEM形貌图
图8所示为锆在Bun4NBr异丙醇溶液中不同电极电位下溶解10 min后的扫描电镜(SEM)图。从图8可以看出:当电位为0.50 V时,锆表面没有出现点蚀,只有些许打磨留下的划痕;当电位增大到1.10 V时,锆表面出现少许暗色的点,说明Br−在氧化膜表面的缺陷处吸附,使氧化膜减薄,但是电位又不足以使吸附的Br−穿过氧化膜,渗透到基体[25],于是,形成暗色的点;当电位增大到1.50 V时,锆基体被腐蚀,表面出现点蚀,并且有少量小点蚀孔合并为大孔;当电位增大到2.00 V时,点蚀的数目明显增多,蚀孔深度增加,很多点蚀孔合并;当电极电位为2.50 V时,电极表面发生大面积腐蚀,出现一些很深的小孔。阳极电位增加,点蚀加剧,主要是由于电位增加,电极表面的电场增加,电极表面Br−的吸附量增加,从而使腐蚀加剧。

(a) E=0.50 V, 1.00 V; (b) E=1.50 V, 2.00 V, 2.50 V

电极电位/V:(a) 0.50; (b) 1.00; (c) 1.50; (d) 2.00; (e) 2.50
为探究锆在Bun4NBr异丙醇溶液的表面腐蚀产物,测试了1.50 V电位下电解10 min后的XPS能谱图,图9所示为Zr 3d 特征峰谱图结果。由图9可知:Zr 3d显示Zr 3d5/2,Zr 3d3/2特征峰,经拟合分峰,由结合能可以推断锆电极表面组成为ZrO2,Zr(OC3H7)4和金属锆,以ZrO2为主。XPS图证实了锆表面发生钝化,形成ZrO2膜,锆腐蚀生成Zr(OC3H7)4。

图9 1.50 V电位锆在Bun4NBr异丙醇溶液中电解10 min后Zr 3d XPS图谱
3 结论
1) 锆在异丙醇溶液中生成氧化膜发生钝化,自腐蚀电位随时间增加而增大。
2) 当阳极电位为0.50~1.10 V时,锆溶解缓慢,表面的钝化膜稳定存在;当阳极电位大于1.10 V,Br−击穿钝化膜,锆发生点蚀,稳态点蚀电位在1.10~ 1.20 V之间。
3) 点蚀的成核方式为瞬间三维成核,点蚀生长受扩散控制,提高阳极电位加速点蚀的生长速率,加速锆的阳极溶解。
4) 当电位为0.50~1.00 V时,交流阻抗复数平面图为大的容抗弧;当电位为1.50~2.50 V时,交流阻抗复数平面图在高频区出现容抗弧,在中低频区出现感抗弧,在低频区出现Warburg阻抗。
5) SEM证实了点蚀的发生与发展。XPS分析表明锆表面存在ZrO2钝化膜,在异丙醇溶液中腐蚀溶解生成Zr(OC3H7)4。
[1] WAN C, LU Y, SUN Q, et al. Hydrothermal synthesis of zirconium dioxide coating on the surface of wood with improved UV resistance[J]. Applied Surface Science, 2014, 321: 38−42.
[2] 沈勇, 邬泉周, 李玉光. 氧氯化锆直接热分解制备三维有序大孔氧化锆[J]. 物理化学学报, 2006, 22(9): 1121−1125. SHEN Yong, WU Quanzhou, LI Yuguang. Three dimensional ordered macroporous ZrO2prepared by directly calcining ZrOCl2[J]. Acta Physico-chimica Sinica, 2006, 22(9): 1121−1125.
[3] 苏德亮, 钱国栋, 王智宇, 等.光波导用硅基SiO2-ZrO2二元系统玻璃薄膜的制备[J]. 稀有金属材料与工程, 2004, 33(增刊): 281−286. SU Deliang, QIAN Guodong, WANG Zhiyu, et al. The Preparation of silica based SiO2-ZrO2films as waveguides by sol-gel process[J]. Rare Metal Materials and Engineering, 2004, 33(Suppl): 281−286.
[4] 杨建广, 吴玉山, 杨济豪, 等. 电化学合成5−二乙基胺钽及钽阳极电溶解机理[J]. 稀有金属材料与工程, 2012, 41(10): 1799−1803. YANG Jianguang, WU Yushan, YANG Jihao, et al. Electrochemical synthesis of pentakis(diethylamido)tantalum and electro-dissolving mechanism of tantalum anode[J]. Rare Metal Materials and Engineering, 2012, 41(10): 1799−1803.
[5] BRADLEY D, MEHROTRA R, ROTHWELL I, et al. Alkoxo and aryloxo derivatives of metals[M]. 1st ed. London: Academic Press, 2001: 80−100.
[6] 杨声海, 王亦男, 何静, 等. 高纯纳米氧化钽的制备[J]. 稀有金属材料与工程, 2007, 37(2): 282−286. YANG Shenghai, WANG Yinan, HE Jing, et al. Preparation of high purity tantalum oxide nanoparticles[J]. Rare Metal Materials and Engineering, 2007, 37(2): 282−286.
[7] CAI Yanan, YANG Shenghai, JIN Shengming, et al. Electrochemical synthesis, characterization and thermal properties of niobium ethoxide[J]. Journal of Central South University of Technology, 2011, 18(1): 73−77.
[8] 周幸福,褚道葆, 顾家山, 等.钛醇盐电化学合成的研究[J]. 化学学报, 2000, 58(11): 1327−1331.ZHOU Xingfu, CHU Daobao, GU Jiashan, et al. Direct electrochemical preparation of titanium alkoxides[J].Acta Chimica Sinica, 2000, 58(11): 1327−1331.
[9] YAU T L. Corrosion comparisons between zirconium and titanium[J]. Materials & Corrosion, 1992, 43(7): 358−363.
[10] HURLEN T, HORNKJOL S. Passive behavior of zirconium[J]. Electrochimica Acta, 1987, 32(5): 811−814.
[11] PALIT G C, GADIYAR H S. Pitting corrosion of zirconium in chloride solution[J]. Corrosion, 1987, 43(3): 140−148.
[12] 王志武, 宋涛. 锆-4合金高温高压水蒸气氧化行为[J]. 中南大学学报(自然科学版), 2013, 44(2): 515−519. WANG Zhiwu, SONG Tao. Oxidation behavior of zircaloy-4 in high- temperature and high-pressure water vapor[J]. Journal of Central South University (Science and Technology), 2013, 44(2): 515−519.
[13] TRASATTI S P, SIVIERI E. Electrochemical and stress corrosion cracking behavior of titanium in n-propanol and iso-propanol solutions[J]. Materials Chemistry & Physics, 2004, 83(2/3): 367−372.
[14] MOGODA A S. Influence of some parameters on passivation of zirconium and the stability of the anodic oxide film[J]. Corrosion, 1999, 55(9): 877−882.
[15] AMIN M A, ABD EL REHIMA S S, EL-LITHY A S. Pitting and pitting control of Al in gluconic acid solutions-polarization, chronoamperometry and morphological studies[J]. Corrosion Science, 2010, 52(9): 3099−3108.
[16] AMIN M A, ABD EL-REHIM S S, EI-SHERBINI E E F. Pitting corrosion studies on Al and Al-Zn alloy in SCN−solution[J]. Electrochimica Acta, 2009, 54(18): 4288−4296.
[17] WANG B, LIU J, YIN M, et al. Comparison of corrosion behavior of Al-Mn and Al-Mg alloys in chloride aqueous solution[J]. Materials & Corrosion, 2016, 67(1): 51−59
[18] ZHOU Xingfu, CHU Daobao, LIN Changjian. Anodic dissolution of sponge titanium in ethanol solution for preparation of nano-sized TiO2powder[J]. Electrochimica Acta, 2002, 47(17): 2769−2773.
[19] HASSAN H H, FAHMY K. Pitting corrosion of tin by acetate anion in acidic media[J]. International Journal of Electrochemical Science, 2008, 3(1): 29−43
[20] HASSAN H H. Effect of chloride ions on the corrosion behaviour of steel in 0.1 M citrate[J]. Electrochimica Acta, 2005, 51(3): 526−535.
[21] AMIN M A, ABD EL-REHIM S S. AC and DC studies of the Pitting corrosion of Al in perchlorate solutions[J]. Electrochimica Acta, 2006, 51(22): 4754−4764.
[22] YANG Haiping, YANG Shenghai, CAI Yanan, et al. Electrochemical behavior of tantalum in anhydrous ethanol[J]. Journal of the Electrochemical Society 2010, 157(3): D168−D171.
[23] YANG Haiping, YANG Shenghai, CAI Yanan, et al. Effect of bromide ions on the corrosion behavior of tantalum in anhydrous ethanol[J]. Electrochimica Acta, 2010, 55(8): 2829−2834.
[24] 李翔, 严彪, 董鹏, 等. Fe基非晶合金的晶化及其在NaCl溶液中的电化学腐蚀行为[J]. 中国有色金属学报, 2010, 20(1): 156−162. LI Xiang, YAN Biao, DONG Peng, et al. Crystallization and electrochemical corrosion behaviors of amorphous Fe-based alloys in NaCl solution[J]. The Chinese Journal of Nonferrous Metals, 2010, 20(1): 156−162.
[25] 任建军, 左禹. 铝阳极氧化膜的蚀孔形貌与蚀孔生长机理研究[J]. 中国腐蚀与防护学报, 2003, 23(4): 198−201. REN Jianjun, ZUO Yu. The study on morphology and growth mechanism of pits on anodized aluminum[J]. Journal of Chinese Society for Corrosion and Protection, 2003, 23(4): 198−201.
(编辑 伍锦花)
Effect of anodic potential on dissolution of zirconium in isopropyl alcohol solution
YANG Xiyun, HUANG Haiqiang, YANG Shenghai
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Anodic dissolution of zirconium in isopropyl alcohol solution containing Bun4NBr at different potentials was investigated using cyclic voltammetry, potentiostatic current-time transient, A.C. impedance techniques, SEM and X-ray photoelectron spectroscopy (XPS). The results show that zirconium does not exhibit active dissolution due to the presence of passive film on surface, and the large capacitance loop appears in the anodic potential range of 0 to 1.10 V and open circuit potential increases with time. When the anodic potential is greater than 1.10 V, zirconium suffers from pitting corrosion due to the aggressive attack of passive film by bromide anions. Correspondingly, the Nyquist plot shows a large capacitance loop at high frequencies, an inductive loop at the middle frequencies and a warburg impedance at the low frequencies. The stable pitting potential is between 1.10 V and 1.20 V. The pit growth is an instantaneous three- dimensional nucleation followed by growth controlled by diffusion. With the increase of anodic potential, the pitting corrosion accelerates, which is indicated by deeper pits, larger corrosion area and a smaller capacitance loop at the high frequencies. Zirconium surface has a layer of passive film mainly composed of ZrO2and dissolves to produce Zr(OC3H7)4 .
zirconium; pitting corrosion; isopropyl alcohol; anodic potential
10.11817/j.issn.1672-7207.2017.09.001
TQ150
A
1672−7207(2017)09−2257−07
2016−11−19;
2017−01−12
国家自然科学基金资助项目(51374254) (Project(51374254) supported by the National Natural Science Foundation of China)
杨喜云,博士,教授,从事稀贵金属电化学腐蚀研究;E-mail: yxy7412@csu.edu.cn

