花脸香蘑菌丝体多糖提取条件优化及其体外免疫活性
胡欣蕾,田雪梅,李文香,*,孙亚男,张 欣,于 戈,李 铭
花脸香蘑菌丝体多糖提取条件优化及其体外免疫活性
胡欣蕾1,田雪梅2,李文香1,*,孙亚男1,张 欣1,于 戈1,李 铭1
(1.青岛农业大学食 品科学与工程学院,山东省应用真菌重点实验室,山东 青岛 266109;2.青岛农业大学生命科学学院,山东 青岛 266109)
为探讨花脸香蘑 菌丝体多糖提取工艺及其免疫活性,以花脸香蘑菌丝体为原料,在单因素试验的基础上采用正交试验优化多糖提取条件;将不同质量浓度的花脸香蘑菌丝体多糖溶液作用于小鼠巨噬细胞Ana-1,通过对其细胞存活率、细胞因子TNF-α和IL-6分泌量、中性红吞噬能力以及膜表面蛋白Toll样受 体(Toll-like receptor,TLR)TLR2和TLR4表达量能力的测定,研究花脸香蘑菌丝体多糖的免疫活性。结果表明,花脸香蘑菌丝体多糖最佳提取条件为浸提温度65 ℃、浸提时间2.5 h、液料比40∶1(mL/g),提取率最高为15.88%;在0.05~1.6 mg/mL的有效剂量范围内,花脸香蘑菌丝体多糖能够不同程度地促进小鼠巨噬细胞Ana-1的增殖,提高细胞因子TNF-α和IL-6分泌量,增强中性红吞噬能力、膜表面蛋白TLR2和TLR4表达量能力,其中以1.6 mg/mL效果最佳。表明花脸香蘑菌丝体多糖具有优良的免疫活性。
花脸香蘑菌丝体;多糖;提取工艺;正交试验;免疫活性
花脸香蘑(Lepista sordida(Schum. Fr.)Sing)又名紫晶蘑,隶属于伞菌目,白蘑科,香蘑属,因其菌盖周围具有半透明或水浸状花纹而得名[1],是一种珍稀野生食药用菌,具有很高的开发价值。我国民间认为花脸香蘑具有养血、益神、补肝等功效[2]。秦丹等[3]从花脸香蘑子实体中提取粗多糖,通过实验证明花脸香蘑粗多糖对雏鸡免疫具有一定的调节作用,但是花脸香蘑尚未实现规模化人工栽培,且野生资源稀少,鲜菇价格高。通过发酵获得的花脸香蘑多糖同样具有抗氧化、抗肿瘤、 调节免疫的作用。宋晓琳等[4]通过实验证明发酵获得的花脸香蘑多糖对小鼠急性肝损伤具有一定保护作用;陈湘莲等[5]通过实验证明花脸香蘑菌丝提取物具有抗氧化活性和抗肿瘤活性。因此,利用发酵技术获得花脸香蘑菌丝体及其活性物质是一种有效的替代手段,具有广阔的应用前景。本实验以花脸香蘑菌丝体为实验材料,通过正交试验对多糖提取条件进行优化;通过花脸香蘑菌丝体多糖对小鼠巨噬细胞Ana-1存活率、细胞因子TNF-α和IL-6分泌量、中性红吞噬能力以及膜表面蛋白Toll样受体(Tolllike receptor,TLR)TLR2和TLR4表达量能力的影响来研究其免疫活性,以期为花脸香蘑多糖获得途径以及功能性食品或药物的研发提供理论依据。
1 材料与方法
1.1 材料与试剂
花脸香蘑菌种由山东省应用真菌重点实验室提供,小鼠巨噬细胞Ana-1购于中国科学院上海细胞库。
四甲基噻唑蓝(methyl thiazoltetrazolium bromide,MTT) 美国Sigma公司;胎牛血清 美国Gibco公司;胰蛋白酶、RPMI-1640培养基、青链霉素混合液美国Thermo Scientific公司;鼠源TNF-α、IL-6 Elisa试剂盒、鼠源TLR2、TLR4试剂盒 江苏碧云天生物技术研究所;中性红染色剂 国药集团化学试剂有限公司;乙醇、氯仿、正丁醇、二甲基亚砜(dimethylsulphoxide,DMSO)、苯酚、硫酸(均为分析纯) 莱阳康德化工有限公司。
1.2 仪器与设备
恒温培养箱 德国宾德公司;TFA型通风柜 北京太极傲飞机房装备开发中心;XW-80A微型旋涡混合仪上海沪西分析仪器厂有限公司;TGL-16C离心机 上海安亭科学仪器厂;电热恒温水浴锅 龙口市先科仪器公司;SP-754紫外-可见分光光度计 上海光谱仪器有限公司;AR1530/C电子分析天平 奥豪斯国际贸易(上海)有限公司;MCO-18AIC CO2培养箱 日本Sanyo公司;CKX-41倒置显微镜 日本Olympus公司;Elx808自动酶标仪 美国BioTek公司;超净工作台 苏州净化设备有限公司;冷冻干燥机 德国Christ公司。
1.3 方法
1.3.1 花脸香蘑菌丝体多糖提取
1.3.1.1 工艺流程
花脸香蘑菌丝体→冷冻干燥→粉碎→浸提→离心→滤渣复提→浓缩→醇沉→离心→加水复溶→冷冻干燥→粗多糖
经冷冻干燥的花脸香蘑菌丝体用粉碎机粉碎后,采用热水浸提法对多糖进行提取,将提取液在4 000 r/min的条件下离心15 min,采用同样的方法再次浸提,以提高多糖的提取率,将离心后的上清液合并,旋转蒸发至原体积的1/10,加3 倍体积分数75%乙醇溶液,4 ℃静置24 h,4 000 r/min离心15 min,将离心后的沉淀加水复溶,冷冻干燥后即得花脸香蘑菌丝体粗多糖。
1.3.1.2 多糖含量的测定
采用苯酚-硫酸法测定总糖含量,然后采用水杨酸法测定同一样品的还原糖含量,计算见公式(1)和(2):

苯酚-硫酸法:将葡萄糖标准品置于105 ℃的烘箱中干燥2 h,放入干燥器中进行冷却。准确称取0.01 g冷却后的葡萄糖,溶解,用蒸馏水定容至100 mL,用移液枪准确移取葡萄糖溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL于试管中,加入1.0 mL质量分数5%的苯酚溶液和5 mL浓硫酸,静置5 min后摇匀,100 ℃水浴锅中加热15 min,冷却至室温,在490 nm波长处测定其吸光度,绘制标准曲线。
水杨酸法:精密量取0.1 mg/mL葡萄糖标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,分别置于25 mL具塞试管中,用蒸馏水定容至2 mL,分别加入3,5-二硝基水杨酸试剂(将6.3 g 3,5-二硝基水杨酸和262 mL 2 mol/L氢氧化钠溶液加到500 mL含有182 g酒石酸钾钠的热水溶液中,加5 g重蒸苯酚和5 g无水亚硫酸钠,搅拌溶解,冷却后移入1 000 mL容量瓶,用蒸馏水定容至刻度,混匀,贮于棕色瓶中,于暗处放置7 d后使用)2 mL,混合均匀后,沸水浴加热5 min,迅速冷却,于540 nm波长处测定吸光度,绘制标准曲线。
1.3.2 单因素试验
采用热水浸提的方法,分别就浸提温度、浸提时间、液料比进行单因素试验。
最佳浸提温度的确定:在浸提时间3 h、液料比40∶1(mL/g)条件下,分别测定浸提温度为45、55、65、75、85 ℃时多糖的提取率;最佳浸提时间的确定:在浸提温度65 ℃、液料比40∶1(mL/g)条件下,分别测定浸提时间为2、2.5、3、3.5、4 h时多糖的提取率;最佳液料比的确定:在浸提温度65 ℃、浸提时间2.5 h条件下,分别测定液料比20∶1、30∶1、40∶1、50∶1、60∶1(mL/g)时多糖的提取率。
1.3.3 正交试验
在单因素试验的基础上,采用三因素三水平,按L9(33)正交试验设计对花脸香蘑菌丝体多糖提取条件进行优化,各因素及水平设计如表1所示,每个组合设置3次重复实验,多糖提取率取平均值。

表1 L9(3)正交试验因素与水平Table 1 Coded levels of independent variables used for L9(3))orthogonal array design
1.3.4 验证实验
采用热水浸提法,以1.3.3节正交试验所得多糖提取最佳实验条件组合为提取条件,重复提取3 次,分别测定多糖提取率。
1.3.5 细胞培养
将小鼠巨噬细胞Ana-1培养于含体积分数10%胎牛血清、100 IU青霉素和l00 μg/mL链霉素的RPMI-1640培养基中,在37 ℃、体积分数5% CO2的恒温培养箱中培养,当细胞浓度达到1.0×107个/mL时,对细胞进行传代。
1.3.6 多糖对细胞存活率的影响
参考谷鸿喜等[6]的方法,并稍作修改,取对数生长期的Ana-1细胞,用含体积分数10%胎牛血清、100 IU青霉素和l00 μg/mL链霉素的 RPMI-1640培养基配成单细胞悬液,以1.0×105个/mL细胞浓度接种于96孔细胞培养板中,每孔100 μL,置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,实验组每孔添加含有不同质量浓度花脸香蘑菌丝体多糖的完全培养基100 μL,使每孔的多糖终质量浓度分别为0.05、0.1、0.2、0.4、0.8、1.6 mg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6 个复孔。将培养板置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,每孔加入5 mg/mL MTT染色液20 μL,反应4 h,小心吸取孔内上清液,每孔分别加入150 μL DMSO,振荡溶解后用酶标仪检测490 nm波长处实验组吸光度A实验组和对照组吸光度A对照组,并按照公式(3)计算细胞存活率:
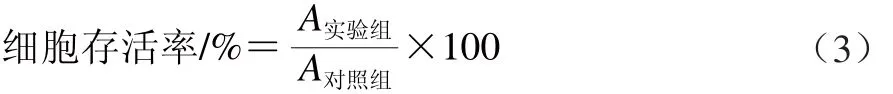
1.3.7 多糖对细胞因子分泌量的影响
以1.0×105个/mL细胞浓度接种于96孔培养板中,每孔100 μL,置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,实验组加入待测的多糖样品(100 μL/孔),使每孔多糖终质量浓度分别为0.05、0.1、0.2、0.4、0.8、1.6 mg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6 个复孔。将培养板置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,收集细胞培养上清液,1 000 r/min离心10 min,细胞因子TNF-α和IL-6含量的测定严格按照Elisa试剂盒上说明进行。
1.3.8 多糖对中性红吞噬能力的影响
参考张祺等[7]的方法,并稍做修改,以1.0×105个/mL细胞浓度接种于96 孔培养板中,每孔100 μL,置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,实验组加入待测的多糖样品(100 μL/孔),使每孔终质量浓度分别为0.05、0.1、0.2、0.4、0.8、1.6 mg/mL,空白对照组每孔添加等体积的完全培养基,每组处理设置6 个复孔。将培养板置于CO2恒温培养箱(37 ℃、体积分数5% CO2),培养24 h后,小心吸取孔内上清液,再向孔中加入质量分数0.1%中性红溶液(200 μL/孔),置于CO2恒温培养箱(37 ℃、体积分数5% CO2)培养1 h后,吸取细胞上清液,用磷酸缓冲液清洗培养板,加入200 μL细胞裂解液(V(乙酸)∶V(乙醇)=1∶1),裂解2 h后,用酶标仪检测490 nm波长处各孔吸光度。
1.3.9 多糖对膜蛋白表达的影响
细胞布板情况及培养条件同上,培养结束,分别收集各组细胞培养液,反复冻融,高速离心10 min,得到细胞裂解液,膜表面蛋白TLR2、TLR4含量的测定严格按照Elisa试剂盒上说明进行。
1.4 统计学处理
采用Excel绘图、线性回归和SPSS 17.0统计软件分析,每组实验设置3 次重复。
2 结果与分析
2.1 葡萄糖含量测定标准曲线结果
总糖含量测定标准曲线所建立的回归方程为y=0.012 4x+0.010 3,R2=0.999 1。还原糖标准曲线所建立的回归方程为y=0.028 3x-0.016 4,R2=0.999 8。
2.2 单因素试验结果
2.2.1 浸提温度对多糖提取率的影响
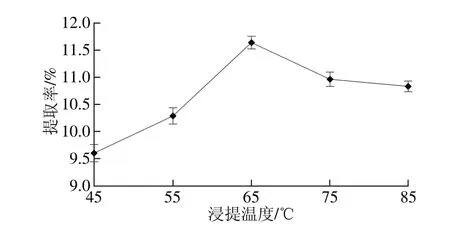
图1 浸提温度对提取率的影响Fig. 1 Effects of extraction temperature on extraction yield
由图1可知,液料比为40∶1(mL/g),浸提3 h,浸提温度在45~85 ℃范围内,随温度的升高花脸香蘑菌丝体多糖提取率呈先上升后下降的趋势,当温度为65 ℃时提取率最大,当温度高于65 ℃时提取率逐渐下降。这可能是因为当温度低于65 ℃时,随着温度的升高多糖的溶解度随之增加,当温度高于65 ℃部分糖会被高温破坏,从而导致多糖提取率下降[8]。所以提取的最佳温度应该在65 ℃左右。
2.2.2 浸提时间对多糖提取率的影响
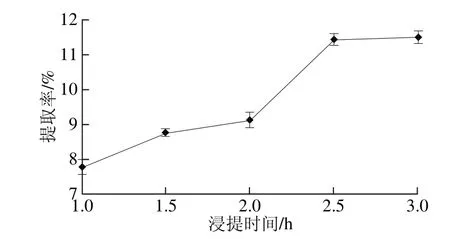
图2 浸提时间对提取率的影响Fig. 2 Effects of extraction time on polysaccharide yield
由图2可知,在液料比40∶1(mL/g)、浸提温度65 ℃条件下,随浸提时间的延长提取率增加,这可能是因为随着浸提时间的延长多糖溶出量逐渐增大,当浸提时间为2.5 h时,提取率最大;当浸提时间大于2.5 h,提取率几乎保持不变,这可能是因为随着浸提时间的延长其他溶质的溶出量增大对多糖的溶出产生了一定的抑制作用[8],但多糖的结构不会因此发生改变。
2.2.3 液料比对多糖提取率的影响

图3 液料比对提取率的影响Fig. 3 Effects of solvent-to-solid ratio on polysaccharide yield
由图3可知,在65 ℃温度条件下浸提3 h,随着液料比的增大,多糖提取率逐渐呈现先增后降的变化趋势。在液料比小于40∶1时,多糖提取率随着液料比的增加而呈上升趋势,这可能是因为随着固相和液相之间多糖质量浓度差的增大,加快了多糖的浸提速度[9];当液料比为40∶1时,提取率达到最大;当液料比大于40∶1以后,多糖提取率随液料比的增大而下降,这可能是因为其他溶质的溶出抑制了多糖的溶出[10],但多糖的结构不会因此发生改变,所以提取的最佳液料比为40∶1(mL/g)。
2.3 正交试验结果

表2 正交试验设计与结果Table 2 Orthogonal array design with experimental results
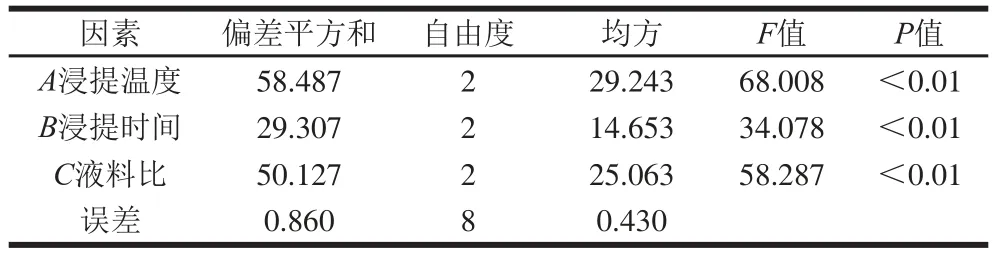
表3 方差分析Table 3 Analysis of variance
由表2可知,在试验范围内各因素对花脸香蘑菌丝体多糖提取率的影响程度依次为浸提温度>液料比>浸提时间,由k值大小可知,优化工艺最佳组合为浸提温度65 ℃、浸提时间2.5 h、液料比40∶1(mL/g),多糖提取率最高可达15.79%。由表3方差结果分析可知,浸提温度、浸提时间、液料比对提取率的影响极显著。
2.4 验证实验
在最佳提取条件下进行3 次验证实验,多糖提取率分别为15.88%、15.90%、15.86%,平均提取率为15.88%。
2.5 花脸香蘑菌丝体多糖对Ana-1存活率的影响

图4 花脸香蘑菌丝体多糖对Ana-1存活率的影响Fig. 4 Effect of the polysaccharides on survival rate of Ana-1 cells
如图4所示,当花脸香蘑菌丝体多糖质量浓度小于0.8 mg/mL时,对Ana-1细胞存活率影响不显著(P>0.05),当多糖质量浓度大于等于0.8 mg/mL时,对Ana-1细胞存活率影响显著(P<0.05),细胞存活率随多糖质量浓度的增大而增加。当花脸香蘑菌丝体多糖质量浓度为1.6 mg/mL时,Ana-1细胞的存活率为145.14%。
2.6 花脸香蘑菌丝体多糖对Ana-1分泌细胞因子TNF-α、IL-6的影响
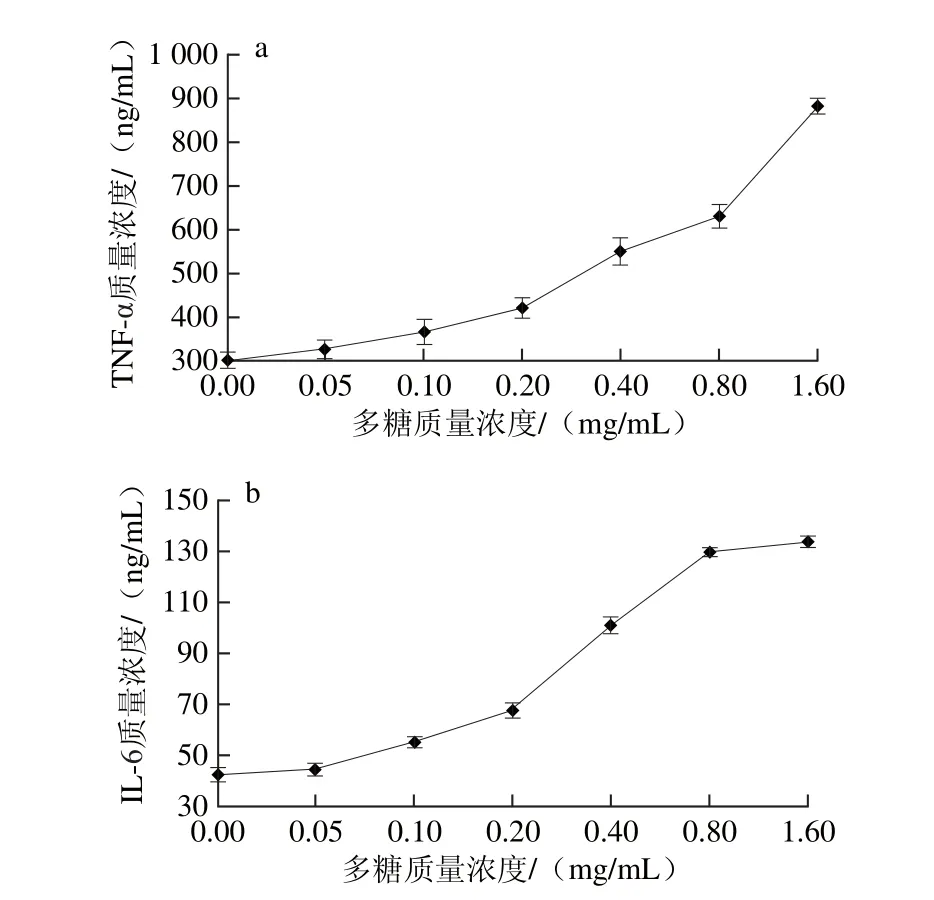
图5 花脸香蘑菌丝体多糖对细胞因子TNF-α(a)和IL-6(b)的影响Fig. 5 Effect of the polysaccharides on TNF-α (a) and IL-6 (b)secretion
由图5a可以看出,Ana-1细胞加入花脸香蘑菌丝体多糖溶液后细胞因子TNF-α分泌量随多糖质量浓度的增大而增加。当多糖质量浓度为1.6 mg/mL时,细胞上清液中TNF-α的质量浓度达到了885.25 ng/mL,与未添加组相比提高了192.40%(P<0.05)。由图5b可以看出,花脸香蘑菌丝体多糖质量浓度在0.05~0.8 mg/mL有效剂量范围内细胞因子IL-6分泌量呈明显的上升趋势,当多糖质量浓度大于0.8 mg/mL时,IL-6分泌量上升速度缓慢。当多糖质量浓度为0.8 mg/mL时,细胞上清液中IL-6的质量浓度达到133.87 ng/mL,与未添加组相比提高了214.99%(P<0.05)。结果表明,花脸香蘑菌丝体多糖对Ana-1分泌细胞因子TNF-α和IL-6有良好的促进作用。
2.7 花脸香蘑菌丝体多糖对Ana-1细胞中性红吞噬能力的影响

图6 花脸香蘑菌丝体多糖对Ana-1吞噬活性的影响Fig. 6 Effect of the polysaccharides on the phagocytosis of neutral red by Ana-1 cells
从图6可以看出,当花脸香蘑多糖质量浓度高于0.2 mg/mL时,小鼠巨噬细胞Ana-1吞噬中性红能力显著提高(P<0.05),呈明显的量效关系。当花脸香蘑多糖质量浓度为1.6 mg/mL时, Ana-1吞噬中性红能力提高了38.1%。结果表明,花脸香蘑多糖对Ana-1吞噬中性红能力有一定的促进作用。
2.8 花脸香蘑多糖对Ana-1细胞膜蛋白表达的影响
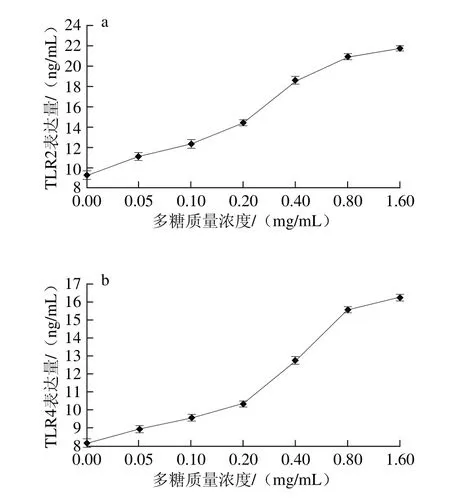
图7 花脸香蘑菌丝体多糖对TLR2(a)和TLR4(b)表达的影响Fig. 7 Effect of the polysaccharides on TLR2 (a) and TLR4 (b)expression
由图7a可知,随花脸香蘑菌丝体多糖质量浓度的增加,细胞膜蛋白TLR2表达量显著增加(P<0.05)。当多糖质量浓度为1.6 mg/mL时,TLR2表达量最高为21.79 ng/mL。由图7b可知,随花脸香蘑菌丝体多糖质量浓度的增加,细胞膜蛋白TLR4表达量也显著增加(P<0.05),升高趋势与TLR2的变化相同。当多糖质量浓度为1.6 mg/mL时,TLR4表达量最高为16.245 ng/mL。表明花脸香蘑菌丝体多糖对Ana-1细胞膜蛋白Toll样受体TLR2和TLR4表达有良好的促进作用。
3 讨 论
已有研究表明,多种真菌水溶性多糖能够通过诱导免疫细胞增殖、提高机体免疫应答能力来达到抗癌效果[11-15],而对于花脸香蘑多糖的免疫活性研究则相对较少。众所周知,巨噬细胞在机体固有免疫与适应性免疫中发挥着复杂的功能,尤其在对抗感染和损伤的宿主防御中起到重要作用[16]。增殖是免疫细胞分化成多种功能形态、并在免疫应答中发挥相应作用的前提和基础,巨噬细胞的增殖对于其各种免疫应答功能的实现是必需的[17]。本研究以花脸香蘑菌丝体为原料,利用正交试验对热水浸提法提取多糖条件进行优化,得到最佳提取条件为浸提温度65 ℃、浸提时间2.5 h、液料比40∶1(mL/g),在该条件下多糖的提取率为15.88%,其准确性和重现性良好;并将提取物作用于小鼠巨噬细胞Ana-1,通过比较不同质量浓度花脸香蘑菌丝体多糖对Ana-1细胞存活率的影响后发现:花脸香蘑菌丝体多糖质量浓度小于0.8 mg/mL时,对Ana-1细胞存活率影响不显著(P>0.05),在多糖质量浓度为0.05 mg/mL时,细胞存活率有所下降,这可能是与多糖没有达到能够诱导免疫细胞增殖的有效质量浓度有关,在其质量浓度为1.6 mg/mL时,对Ana-1细胞增殖的促进作用最强,Ana-1细胞的存活率达到145.14%。
巨噬细胞是一种位于组织内的白血球,源自单核细胞[18],它是生物体抵抗微生物的第一道防线之一。激活的巨噬细胞可以直接杀伤病原微生物[19],在对病原体的免疫反应[20]和组织修复[21]中发挥重要的作用。巨噬细胞的吞噬作用是通过将各类病原微生物、机体衰老死亡的细胞和肿瘤细胞等大颗粒抗原摄入胞内,形成吞噬溶酶体,在多种酶的作用下,杀灭和消化抗原性异物[22];巨噬细胞的毒性作用是通过分泌各种免疫活性分子[23],如TNF-α、IL-6、IL-10等,发挥抗肿瘤和病原菌的作用[24]。本研究中,Ana-1细胞在多糖质量浓度1.6 mg/mL和0.8 mg/mL的刺激作用下,TNF-α和IL-6这2种细胞因子分别出现了分泌高峰;中性红吞噬活性实验结果显示,1.6 mg/mL花脸香蘑菌丝体多糖能极显著增强Ana-1的吞噬活性。表明适量花脸香蘑菌丝体多糖能起到激活巨噬细胞,提高其免疫活性的作用。
TLR是参与非特异性免疫的一类重要蛋白质分子[25],TLR可以通过各自不同的配基识别相应的病原相关分子模式[26],激活一系列的信号通路启动宿主抵抗病原微生物的天然免疫,并对特异性免疫应答进行调控[27]。巨噬细胞在接受外界刺激后,通过TLR产生激活信号,激活转录因子NF-κB,进而激活一系列免疫反应[28],如增强吞噬活性[29]、分泌细胞因子[30]等。本研究通过观察不同质量浓度花脸香蘑菌丝体多糖作用于巨噬细胞后对TLR2、TLR4两种膜蛋白表达量的影响,结果显示:花脸香蘑菌丝体多糖能够显著上调TLR2、TLR4的表达量,表明巨噬细胞免疫应答中的NF-κB通路能够被花脸香蘑菌丝体多糖激活,而在本研究中观察到的Ana-1细胞增殖、细胞因子分泌量升高、吞噬活性增加等现象可能与NF-κB通路的激活有关。
[1] 黄年来. 中国大型真菌图鉴[M]. 北京∶ 中国农业出版社, 1998∶ 113.
[2] 罗倩, 王莹, 张林, 等. 贵州花脸香蘑HL-07液体发酵条件优化研究[J]. 种子, 2015, 34(5)∶ 88-91. DOI∶10.3969/j.issn.1001-4705.2015.05.024.
[3] 秦丹, 孔超, 孙效乐, 等. 花脸香蘑粗多糖对雏鸡免疫调节作用的研究[J].食用菌学报, 2013, 20(2)∶ 37-41. DOI∶10.3969/j.issn.1005-9873.2013.02.008.
[4] 宋晓琳, 沈明花. 花脸蘑多糖对小鼠急性肝损伤的保护作用[J].食品科技, 2011, 36(7)∶ 49-54. DOI∶10.13684/j.cnki.spkj.2011.07.021.
[5] 陈湘莲, 曾宏彬, 李泰辉. 花脸香蘑菌丝体提取物的体外抗氧化活性[J]. 微生物学报, 2011, 36(8)∶ 958-963. DOI∶10.13344/j.microbiol.china.2011.06.009.
[6] 谷鸿喜, 张凤民, 凌虹. 细胞培养技术[M]. 北京∶ 北京大学医学出版社, 2012∶ 139-140.
[7] 张祺, 李学敏, 李兆杰, 等. 海参岩藻聚糖硫酸酯对巨噬细胞的调节作用及信号通路研究[J]. 中国药理学通报, 2015, 31(1)∶ 87-92.DOI∶10.3969/j.issn.1001-1978.2015.01.019.
[8] 许晓燕, 余梦瑶, 江南, 等. 用正交试验法优化毛木耳多糖提取工艺[J]. 中国食用菌, 2013, 32(1)∶ 41-44. DOI∶10.13629/j.cnki.53-1054.2013.01.015.
[9] 董红敏, 李素清, 牛小勇, 等. 正交实验优化川明参多糖超声提取工艺[J]. 食品工业科技, 2014, 35(8)∶ 306-309. DOI∶10.13386/j.issn1002-0306.2014.08.061.
[10] 范三红, 原超, 刘艳荣, 等. 超声波辅助提取南瓜籽油及其脂肪酸组成研究[J]. 食品科学, 2010, 31(24)∶ 107-110. DOI∶10.7506/spkx1002-6630-201024022.
[11] 杨文建, 赵立艳, 安辛欣, 等. 食用菌营养与保健功能研究进展[J].食药用菌, 2011, 19(1)∶ 15-18.
[12] 张化朋, 张静, 刘阿娟. 杏鲍菇营养成分及生物活性物质分析[J]. 营养学报, 2013(3)∶ 307-309. DOI∶10.13325/j.cnki.acta.nutr.sin.2013.03.002.
[13] 杨志钧, 殷瑜, 王志强, 等. 一株马兜铃内生真菌Colletotrichum sp.代谢产物中细胞毒活性成分的研究[J]. 天然产物研究与开发, 2012,24(3)∶ 329-332. DOI∶10.16333/j.1001-6880.2012.03.002.
[14] 陈健, 向莹. 滑子菇多糖的免疫活性及抗肿瘤作用[J]. 现代食品科技, 2013, 29(8)∶ 1800-1804. DOI∶10.13982/j.mfst.1673-9078.2013.08.006.
[15] 叶振梅. 茯苓多糖的响应面提取条件优化及体外免疫活性研究[J].北方园艺, 2013(17)∶ 135-138.
[16] 杜金, 胡静, 隋玉龙, 等. 小刺猴头菌发酵浸膏寡糖对荷瘤小鼠免疫功能的影响[J]. 菌物研究, 2013, 11(2)∶ 116-119. DOI∶10.13341/j.jfr.2013.02.023.
[17] 陈永生, 扶雄, 周林, 等. 亮叶杨桐叶中酚类物质的抗氧化和抗HepG2细胞增殖作用[J]. 现代食品科技, 2016, 32(8)∶ 14-20.DOI∶10.13982/j.mfst.1673-9078.2016.8.003.
[18] 贾薇, 樊华. 姬松茸多糖组分对小鼠巨噬细胞作用研究[J]. 食品科学,2011, 32(11)∶ 277-280.
[19] MACIEJ C, KATARZYNA K. Toll-like receptors and their contribution to innate immunity∶ focus on TLR4 activation by lipopolysaccharide[J]. Advances in Cell Biology, 2014, 4(1)∶ 1-23.DOI∶10.2478/acb-2014-0001.
[20] GORDON S, MARTINEZ F O. Alternative activation of macrophages∶ mechanism and functions[J]. Immunity, 2010, 32∶ 593-604. DOI∶10.1016/j.immuni.2010.05.007.
[21] BUDDINGTON K K, DONAHOO J B, BUDDINGTON R K. Dietary oligofructose and inulin protect mice from enteric and systemic pathogens and tumor inducers[J]. The Journal of Nutrition, 2002,132(3)∶ 472-477.
[22] WVTHRICH M, DEEPE G S, KLEIN B. Adaptive immunity to fungi[J]. Annual Review of Immunology, 2012, 30∶ 115-148.DOI∶10.1146/annurev-immunol-020711-074958.
[23] 任燕, 曾艳玲, 李攀, 等. 雷公藤多甙抑制EM患者腹腔巨噬细胞及相应细胞模型分泌TNF-α的实验研究[J]. 现代中西医结合杂志,2012, 21(7)∶ 702-704.
[24] 尚庆辉, 解怀玉, 张桂国, 等. 植物多糖的免疫调节作用及其机制研究进展[J]. 动物营养学报, 2015, 27(1)∶ 49-58. DOI∶10.3969/j.issn.1006-267x.2015.01.008.
[25] IAIN M S, SIAN E O, MATTHEW L T. Innate immunity and the sensing of infection, damage and danger in the female genital tract[J].Journal of Reproductive Immunology, 2016, 7(2)∶ 621-625.DOI∶10.1016/j.jri.2016.07.002.
[26] 曾星, 连绘, 欧润妹, 等. 猪苓多糖协同卡介苗对小鼠巨噬细 胞TLRs表达的影响[J]. 中国免疫学杂志, 2008, 24(9)∶ 341-346.
[27] HAN E H, HWANGY P, KIM H G, et al. Inhibitory effect of Pleurotus eryngii extracts on the activities of allergic mediators in antigen-stimulated mast cells[J]. Food and Chemical Toxicology,2011, 49(6)∶ 1416-1425. DOI∶10.1016/j.fct.2011.03.034.
[28] 王松, 王微, 罗猛, 等. 复方甘草酸苷制剂对脂多糖诱导小鼠RAW264.7细胞分泌炎症因子的调节作用[J]. 药学进展, 2012,36(10)∶ 465-470. DOI∶10.3969/j.issn.1001-5094.2012.10.005.
[29] 郭玲芝, 刘呈雄, 徐帮, 等. 一株昆虫内生真菌Ahernaria sp.次级代谢产物研究[J]. 化学研究与应用, 2014, 26(2)∶ 306-310.
[30] 刘静, 张巍, 杨峰, 等. 槐定碱预处理对LPS诱导的RAW 264.7巨噬细胞c-Jun表达的影响[J]. 宁夏医科大学学报, 2010, 32(2)∶ 161-164.DOI∶10.16050/j.cnki.issn1674-6309.2010.02.014.
Extraction and Immune Modulatory Activities in Vitro of Polysaccharides from Lepista sordida Mycelia
HU Xinlei1, TIAN Xuemei2, LI Wenxiang1,*, SUN Yanan1, ZHANG Xin1, YU Ge1, LI Ming1
(1. Shandong Provincial Laboratory of Applied Mycology, College of Food Science and Engineering, Qingdao Agricultural University,Qingdao 266109, China; 2. College of Life Science, Qingdao Agricultural University, Qingdao 266109, China)
This study aimed to improve the extraction yield and evaluate the immune modulatory activity of polysaccharides of Lepista sordida mycelia. Optimization of the extraction conditions was carried out using one-factor-at-a-time and orthogonal array design methods. The immune modulatory effect of the polysaccharides extracted was evaluated by measuring cell survival, TNF-α and IL-6 secretion, the percentage of neutral red phagocytosis and the expression levels of Toll-like receptor (TLR) TLR2 and TLR4 when mouse Ana-1 macrophages were exposed to different concentrations of the polysaccharides. The optimal extraction cond itions were determined as follows∶ extraction temperature, 65 ℃; extraction time, 2.5 h; solvent-to-solid ratio, 40∶1 (mL/g), leading to an extraction yield of 15.88%. In the concentration range of 0.05–1.6 mg/mL, the polysaccharides could promote the proliferation of macrophages, TLR2 and TLR4 expression, the phagocytosis of neutral red and TNF-α and IL-6 production; the most effective concentration was 1.6 mg/mL. These data illustrated that the polysaccharides possessed good immune modulatory activity.
Lepista sordida mycelium; polysac charides; extraction; orthogonal array design; immune modulatory activities DOI∶10.7506/spkx1002-6630-201720026
S567.3
A
1002-6630(2017)20-0185-06
胡欣蕾, 田雪梅, 李文香, 等. 花脸香蘑菌丝体多糖提取条件优化及其体外免疫活性[J]. 食品科学, 2017, 38(20)∶185-190. DOI∶10.7506/spkx1002-6630-201720026. http∶//www.spkx.net.cn
HU Xinlei, TIAN Xuemei, LI Wenxiang, et al. Extraction and immune modulatory activities in vitro of polysac charides from Lepista sordida mycelia[J]. Food Science, 2017, 38(20)∶ 185-190. (in Chine se with English abstract) DOI∶10.7506/spkx1002-6630-201720026. http∶//www.spkx.net.cn
2016-12-12
山东省科技发展计划项目(2014GNC113007);山东省现代农业产业技术体系建设经费资助项目(SDAIT-07-07)
胡欣蕾(1992—),女,硕士研究生,研究方向为农产品深加工。E-mail:15964266296@163.com
*通信作者:李文香(1963—),女,教授,博士,研究方向为农产品贮藏与加工。E-mail:xiang7332@126.com

