固定化溶菌酶的缓蚀机理及性能
姜国飞,刘芳,李佳蔓,王洪喜,赵朝成,王永强
固定化溶菌酶的缓蚀机理及性能
姜国飞,刘芳,李佳蔓,王洪喜,赵朝成,王永强
(中国石油大学(华东)化学工程学院,青岛266580)
采用物理吸附方法将溶菌酶固定在MCM-41介孔分子筛上,并与化学缓蚀剂[氨基三亚甲基膦酸(ATMP)与聚天冬氨酸(PASP)]复配用作循环冷却水缓蚀剂。利用电化学法分析复配缓蚀剂的缓蚀机理,并用失重法所测得的复配缓蚀剂缓蚀性能为指标优化复配条件。结果表明:复配缓蚀剂为混合型缓蚀剂,可以同时抑制腐蚀过程的阴极反应与阳极反应,最佳复配方案为固定化溶菌酶投加量0.7 g/L、ATMP质量浓度10 mg/L、PASP质量浓度20 mg/L,缓蚀率可达88.55%,循环冷却水对碳钢腐蚀速率降至0.017 3 mm/a,作用时间为11~13 d。
溶菌酶;固定化;缓蚀剂;缓蚀率;作用时间
Abstract:Lysozyme was immobilized on MCM-41 mesoporous molecular sieve by physical adsorption method,and then compounded with chemical inhibitors amino trimethylene phosphonic acid(ATMP)and sodium of polyaspartic acid(PASP)to act as the circulating cooling water inhibitor.Electrochemical methods were used to analyze the inhibition mechanism of the compound inhibitor,and the method of weight loss of was used to analyze the inhibition performance of the compound inhibitor which would be the index of the optimized compound condition.The results showed that the compound inhibitor was a mixed inhibitor,which could inhibit the cathodic reaction and the anodic reaction in the corrosion process at the same time.The optimal compound scheme was as follows,when the adding amount of immobilize lysozyme was 0.7 g/L,ATMP was 10 mg/L and PASP was 20 mg/L,theinhibition rate could be up to 88.55%,the corrosion rate of carbon steel in circulating cooling water would decrease to 0.0173 mm/a,and the action time could be up to 11-13 days.
Key words:lysozyme;immobilization;corrosion inhibitor;inhibition rate;action time
循环冷却水是指在生产过程中,通过直接或间接接触来交换介质热量并经冷却塔凉水后,可以循环使用的冷却水。在石油化工、冶金、钢铁、电力等行业中,循环冷却水的使用量可占到工业用水的85%~92%[1]。在使用循环冷却水时,由于其含有一定的盐分,会对设备造成不同程度的腐蚀,加重工业运行成本。
为了解决工业循环冷却水造成的设备腐蚀问题,常用的防护方法是向循环冷却水中投加化学缓蚀剂[2],化学缓蚀剂虽然缓蚀性能较强,但却不能够重复利用,且在使用过程中易造成二次污染。段成龙等[3]研究发现溶菌酶具有缓蚀性能,并且在使用过程中不会产生二次污染,但缓蚀性能相对化学缓蚀剂略低,稳定性易受环境条件如温度、p H等因素影响,且价格较高。
SUNDARAM等[4]提出了“固定化酶”这一概念,即将生物散酶固定到一种不溶性载体上,使其具有催化效应,并能提高稳定性,可回收及重复利用[5]。因此,本工作将溶菌酶进行固定化后与化学缓蚀剂 ATMP(amino trimethylene phosphonic acid,氨基三亚甲基膦酸)、PASP(sodium of polyaspartic acid,聚天冬氨酸)进行复配使用,力求能够高效、稳定、无二次污染地解决循环冷却水造成的设备腐蚀问题。
1 试验
1.1 试样与试剂
试验材料为A3碳钢,尺寸为50 mm×25 mm×2 mm。用砂纸(100~2 000号)逐级打磨试样表面后,依次用去离子水酒精,去离子水冲洗后,吹干待用。
试验溶液为按照国标《GB/T 18175-2000旋转挂片法》配制的循环冷却水。
1.2 溶菌酶的固定化
首先用锥形瓶取1.500 g MCM-41介孔分子筛,向内加入100 mL 0.8 g/L溶菌酶(酶活>40 000 U/mg)缓冲溶液,室温下使用六联搅拌器连续低速搅拌10 h;然后将所得溶液用真空抽滤机抽干,并用p H为6.5的Na2HPO4-KH2PO4缓冲液反复冲洗至滤液中无溶菌酶活性为止;最后将抽干后固体置于烘箱中30℃恒温烘6 h,所得白色固体粉末即为固定化溶菌酶。固定化路线如图1所示。
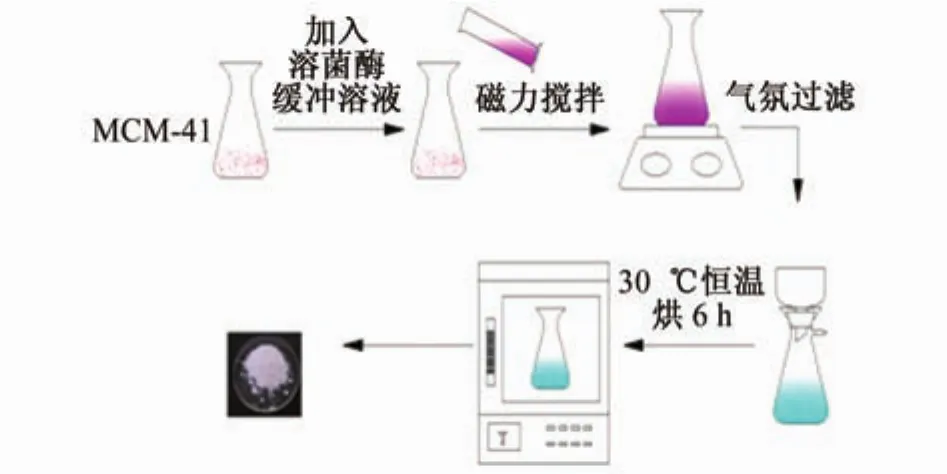
图1 溶菌酶固定化路线图Fig.1 Immobilization roadmap of lysozyme
1.3 固定化溶菌酶与化学缓蚀剂复配
以投加固定化溶菌酶浓度、PASP浓度、ATMP浓度为影响因素,以腐蚀速率及缓蚀率作为指标设计正交试验,每个影响因素选取三个水平,选择L9(34)型正交表,试验因素水平表如表1所示。

表1 正交试验因素水平表Tab.1 Factor and level table of orthogonal test
根据选取的L9(34)型正交表总共需设计9组缓蚀剂进行试验,这9组试验将按照表2所给顺序进行。

表2 正交试验试验组次表Tab.2 Experimental group table of orthogonal test
1.4 复配缓蚀剂缓蚀机理分析方法
利用CHI660E电化学工作站,以A3碳钢挂片为工作电极、饱和甘汞电极(SCE)为参比电极、铂丝对电极为辅助电极组成三电极系统,以循环冷却水为腐蚀介质,测量A3碳钢挂片在复配缓蚀剂添加前后的塔菲尔曲线与电化学阻抗谱,通过塔菲尔曲线及电化学阻抗谱的变化来分析复配缓蚀剂的缓蚀机理。
1.5 复配药剂缓蚀性能的测定方法
利用国标《GB/T 18175-2000旋转挂片法》中所给方法进行缓蚀率及腐蚀速率的计算。试验温度为40℃,挂片转速为75 r/min,腐蚀速率及缓蚀率的计算公式见式(1)和式(2)。

式中:S为试片的表面积,cm2;ρ为试片的密度,g/cm2;t为试片的试验时间,h;v0、v1为试片在未加和添加水处理剂试验溶液中腐蚀速率,mm·a-1。
2 结果与讨论
2.1 固定化酶表征分析
将固定化酶与MCM-41介孔分子筛利用IR Affinity-1型红外光谱仪进行红外光谱分析,结果如图2所示。
由图2可见:曲线a相较于曲线b在3 450 cm-1处与1 180 cm-1处吸光度大幅增加,而3 300~3 500 cm-1与1 180~1 360 cm-1处为胺基吸收峰[6],证明有胺固定在介孔分子筛上;在1 650~1 690 cm-1处吸光度上升,而1 650~1 690 cm-1为酰胺吸收峰,证明有酰胺固定在介孔分子筛上。

图2 生物酶固定化前后红外光谱对比图Fig.2 Comparison diagrams of infrared spectra before and after the lysozyme immobilization
由上述红外光谱分析,固定化后MCM-41介孔分子筛上氮含量大幅上升,即可判断溶菌酶已成功固定在MCM-41介孔分子筛上。
利用JSM-64901LV型扫描电子显微镜对固定化酶及介孔分子筛进行观察,结果如图3所示。

图3 介孔分子筛与固定化溶菌酶SEM图Fig.3 SEM images of mesoporous molecular sieves(a)and immobilized lysozyme(b)
由图3可见:介孔分子筛的粒径约为0.5μm,而在相同放大倍数(15 000倍)下,固定化酶比介孔分子筛多出许多细小颗粒,这些细小颗粒即为溶菌酶颗粒,这些酶颗粒吸附在分子筛颗粒上,即可确定酶与介孔分子筛通过物理吸附的方式结合在一起。
2.2 复配缓蚀剂缓蚀机理分析
当循环冷却水中固定化溶菌酶质量浓度为0.7 g/L时,对 碳 钢 的 腐 蚀 速 率 可 下 降 至0.037 2 mm/a,缓蚀率可达75.36%。由图4可见:循环冷却水对碳钢的腐蚀主要为点蚀;加入固定化溶菌酶后,碳钢表面腐蚀程度明显下降。

图4 空白与添加固定化溶菌酶后碳钢在溶液中的腐蚀形貌Fig.4 Corrosion morphology of carbon steel after corroded in the solution without(a)and with immobilized lysozyme(b)
为研究固定化溶菌酶的缓蚀机理,对循环冷却水系统运行情况进行模拟。在循环冷却水中添加固定化溶菌酶后使碳钢挂片在内运转,并每天对挂片进行SEM扫描,直至固定化溶菌酶缓蚀性能丧失。
由图5可见:挂片表面有许多微小颗粒,这些微小颗粒交错排布,中间有较大空隙,证明固定化溶菌酶从使用至失效均没有明显的成膜现象。

图5 固定化溶菌酶失效时挂片表面SEMFig.5 SEM of the coupon surface after the aging of immobilized lysozyme
由于试验在普通非无菌条件下进行,试验过程中会有细菌的滋生,在循环冷却水中添加溶菌酶后,细菌数目与腐蚀速率的关系如图6所示。
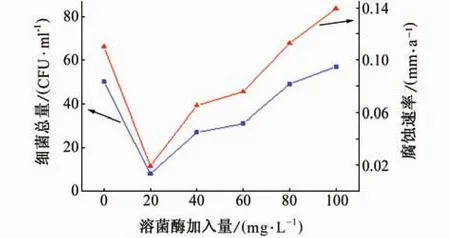
图6 细菌数目与腐蚀速率关系图Fig.6 Relation graph of the total bacterial count and the crossion rate
由图7可见:细菌数量与腐蚀速率呈正相关。这是因为在循环冷却水中,有铁细菌以及异养菌附着在碳钢表面,这些菌可以在碳钢表面形成一层微生物黏膜,这层微生物黏膜将挂片包覆,使其代谢气体与水及碳钢组成电极体系,发生的电化学反应可以加快碳钢的腐蚀[7],并且阻止一部分缓蚀剂作用于碳钢表面。溶菌酶又称胞壁质酶,可以破坏铁细菌及异养菌的细胞壁,使其无法存活,从而破坏微生物黏膜,使电化学反应无法发生,起到抑制腐蚀反应的作用。

图7 试样在含不同复配缓蚀剂试验溶液中的极化曲线和电化学阻抗谱Fig.7 Polarization curves and EISof samples in the solution containing different conbined inhibitors
采用电化学方法研究9组复配缓蚀剂的缓蚀性能。
由图7可见:添加复配缓蚀剂后极化曲线的高度在极化电位两侧均有所下降,证明复配产物既阻碍了阴极过程,又阻碍了阳极过程。由塔菲尔外延法计算自腐蚀电流密度,根据腐蚀电流密度计算缓蚀率见式(3)[8]:

式中:J0、J1分别为空白样腐蚀电流密度、加入缓蚀剂后的自腐蚀电流密度,μA·cm-2。
根据加入缓蚀剂前后自腐蚀电流密度的变化量即可算出缓蚀率,见表3。

表3 极化曲线拟合结果及固定化溶菌酶复配缓蚀剂的缓蚀率Tab.3 Fitting results of polarization curves and the inhibition rates of immobilized lysozyme combined inhibitors
由表3可见:添加复配缓蚀剂后,自腐蚀电位并没有明显的改变,证明所添加的复配缓蚀剂对于腐蚀过程的阳极反应和阴极反应的抑制作用接近相等,复配缓蚀剂属于混合型缓蚀剂[9]。由自腐蚀电流密度的变化可见,向循环冷却水中加入复配缓蚀剂后,阳极和阴极的极化曲线的电流密度均出现降低,这表示缓蚀剂降低了碳钢在阳极的溶解,也延缓了阴极的氧去极化腐蚀,这是由于缓蚀剂在电极表面的吸附造成的[10]。3号复配缓蚀剂的ATMP和PASP大于2号复配缓蚀剂的,这是因为随着缓蚀剂浓度的增大,循环冷却水中缓蚀剂分子的数目不断增多,缓蚀剂分子间的作用力不断增大,导致吸附在碳钢表面的能力减弱,从而使缓蚀率降低[11]。
由图7还可见:4组试验的电化学阻抗谱均出现了容抗弧,这表明腐蚀反应正在进行[12]。阻抗谱上出现的弧为半圆弧,意味着存在一个时间常数,其等效电路常可用一个电容和电阻的并联电路来表征。因此,此电化学阻抗谱所对应的等效电路如图8所示[13]。

图8 等效电路图Fig.8 Equivalent circuit
由于必须先排除掉原来吸附在碳钢表面的水分子层后缓蚀剂才可以吸附在碳钢表面,此时碳钢与溶液之间的相界层将由原来的水分子层变为缓蚀剂层。又由于吸附的水分子的介电常数大于缓蚀剂的,并且缓蚀剂吸附层的厚度比水吸附层的厚度大,因此缓蚀剂组成的界面层的电容值要比由水分子层的小[14]。在图8所示的电路中,电极过程由电荷传递过程控制。电化学阻抗谱上半圆弧的直径对应的阻抗实轴值即为电荷转移电阻Rct,Rct越大,缓蚀性能越强。根据图7(b)计算出4组试验的Rct,见表4。
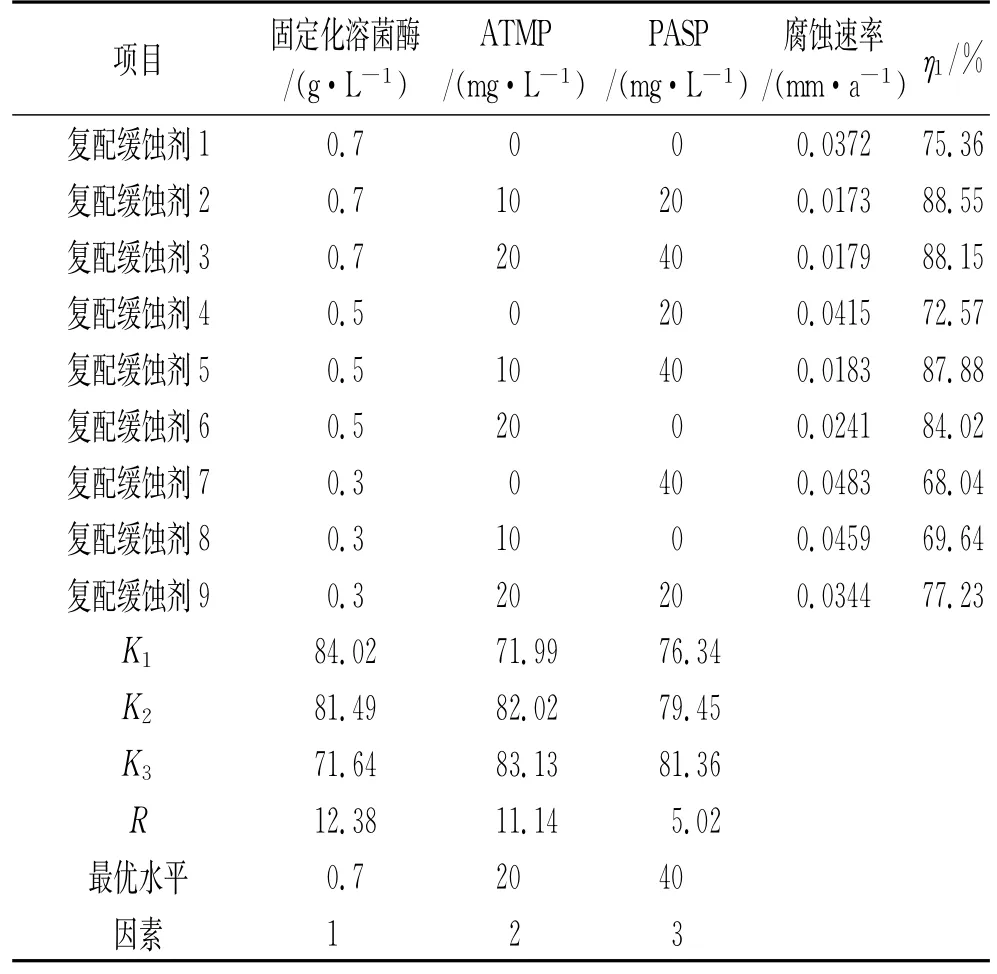
表4 复配缓蚀剂正交试验结果Tab.4 Orthpgonal test results of conbined inhibitors
由表4可见:添加不同复配缓蚀剂后,电荷转移电阻Rct由大到小依次为复配缓蚀剂2>复配缓蚀剂3>复配缓蚀剂1>空白,证明复配缓蚀剂2的缓蚀性能最强。
总结复配缓蚀剂的缓蚀机理,复配缓蚀剂为混合型缓蚀剂,对阴极及阳极的腐蚀反应均有较好的抑制作用。在使用时首先固定化溶菌酶可以将循环水中的铁细菌及异养菌杀死,使复配缓蚀剂在碳钢表面成膜时不会将部分的微生物夹在碳钢与缓蚀剂膜之间,阻止生物黏膜的生成,进一步降低腐蚀速率,通过这种固定化溶菌酶与化学缓蚀剂的协同作用使复配缓蚀剂的缓蚀性能更强。
2.3挂片试验结果
由表4可见:极差最大的因素是固定化溶菌酶浓度,故应首先将其控制在最佳水平。由于因素固定化溶菌酶质量浓度的三个主效应大小依次为84.02、81.49、71.64,所以固定化溶菌酶的最佳加入量为0.7 g·L-1。同理得第二重要因子为ATMP质量浓度,最佳加入量为20 mg·L-1,最后为PASP质量浓度,最佳加入量为40 mg·L-1。
通过以上分析得较优复配方案为固定化溶菌酶质量浓度0.7 g·L-1,ATMP质量浓度20 mg·L-1,PASP质量浓度40 mg·L-1。但复配缓蚀剂2的缓蚀率为88.55%,且ATMP与PASP的用量更低,从高效性及节约原料两方面来考虑,故将复配缓蚀剂2(固定化溶菌酶0.7 g·L-1、ATMP 10 mg·L-1、PASP 20 mg·L-1)定为最佳复配缓蚀剂,此时碳钢的腐蚀速率为0.017 3 mm/a。在国标GB 50050-2007中规定循环冷却水中对碳钢腐蚀速率不得高于0.075 mm/a,虽然在本次复配试验组中基本都满足这一要求,但在单纯使用0.7 g/L固定化溶菌酶时腐蚀速率相较于最佳复配方案增大了115%,相当于腐蚀速率增加了一倍,因此以绿色发展、可持续发展的原则,仍将复配缓蚀剂2定为最佳复配缓蚀剂。
2.4 复配产物与化学缓蚀剂作用时间对比
定义作用时间为缓蚀剂投加到循环冷却水中时至缓蚀剂缓蚀效果不能达到标准要求所经历的时间。为考察复配产物的作用时间是否得到明显的延长,将复配缓蚀剂2与化学缓蚀剂ATMP和PASP的作用时间进行对比,试验结果见图9。

图9 几种缓蚀剂的失效时间Fig.9 Aging time of several inhibitors
根据国标(GB 50050-2007)要求,循环水对碳钢腐蚀速率不得高于0.075 mm/a,即缓蚀剂的缓蚀率应高于50%,因此,当所用药剂缓蚀率低于50%时即失效。
由图9可见:复配缓蚀剂2的缓蚀率在第5天开始有所下降,但下降幅度不大,从第9天开始快速下降,第14天的缓蚀率仅为36.28%,低于50%算作失效,故其作用时间约为11~13 d。
当ATMP质量浓度为20 mg/L时,在第3天缓蚀率达72.76%,第4天缓蚀率已下降至59.2%,第5天缓蚀率降至43.2%,此时ATMP已经失效,故其作用时间约为4~5 d。
当PASP质量浓度为40 mg/L时,缓蚀率第1天仅50.7%,在第2天缓蚀率就降至31.7%,故其作用时间约为1 d。
从以上结论可看出,固定化酶与化学缓蚀剂复配后作用时间远远长于化学缓蚀剂单独使用时的,这是因为在单独使用PASP时,其缓蚀机理是因为PASP中电负性较大的羧基和氨基这些极性基团与C、H原子组成了非极性结构,这个结构的极性基团能够吸附在金属表面上从而改变其双电层结构,提高金属离子化的活化能使金属离子化困难,而非极性基团远离则金属表面形成一层保护膜,从而使腐蚀反应受到抑制[15];单独使用ATMP时,其缓蚀机理是因为ATMP属于供电子型阴极缓蚀剂,其极性[-PO(OH)]基团上P、O等原子存在未成对电子,这些未成对电子容易与金属表面的空轨道结合形成配位键,产生由化学吸附而形成的具有缓蚀作用的吸附膜,从而起到缓蚀作用[16]。但是ATMP与PASP在碳钢表面成膜时都会将一部分铁细菌等包覆,这部分铁细菌在进行生化反应时会破坏缓蚀剂形成的保护膜[17],因此在单独使用PASP或ATMP时作用时间不强。而在使用复配缓蚀剂时,一方面可以通过溶菌酶的杀菌作用增强保护膜的耐久性,另一方面固定化溶菌酶通过缓慢释放可以将溶菌酶浓度长期维持在较高水平,使溶菌酶与化学缓蚀剂之间的协同作用更为持久,从而使作用时间大幅增强。
3 结论
(1)通过表征证明溶菌酶成功固定在介孔分子筛MCM-41上,并将所得固定化溶菌酶与化学缓蚀剂(ATMP与PASP)进行复配,找出的最佳复配条件为固定化溶菌酶质量浓度为0.7 g·L-1、ATMP质量浓度为20 mg·L-1、PASP质量浓度为40 mg·L-1,缓蚀率可达88.55%,循环冷却水对碳钢腐蚀速率降至0.017 3 mm/a。
(2)复配缓蚀剂为混合型缓蚀剂,对腐蚀过程的阳极反应和阴极反应都有较好的抑制作用。
(3)复配缓蚀剂通过固定化溶菌酶与化学缓蚀剂之间的协同作用使作用时间可以延长至11~13 d,相较于化学缓蚀剂延长了300%。
[1] 徐素芳.化工企业循环冷却水系统的节能技术探讨[J].广州化工,2011,39(7):141-143.
[2] LIU F,LU X,YANG W,et al.Optimizations of inhibitors compounding and applied conditions in simulated circulating cooling water system[J].Desalination,2013,313(11):18-27.
[3] 段成龙,尚东华,刘博文,等.生物酶在循环冷却水中的缓蚀作用研究[J].广州化工,2013,41(22):64-67.
[4] SUNDARAM P V,KENDAL P E.Enzyme engineering[M].New York:Plenum Perss,1973:449-452.
[5] FERNANDEZ-FERNANDEZ M. Recent developments and applications of immobilized laccase[J].Biotechnology Advances,2013,31(8):1808-1825.
[6] 刘文钦.仪器分析[M].东营:石油大学出版社,2004(4):147-148.
[7] 应一梅,周瑞云,杨崇豪,等.循环冷却水输水管壁生物膜生长发育及微生物腐蚀问题研究[J].给水排水,2008,34(6):117-121.
[8] PRADEEP K A,NITYANANDA S.Electrochemical investigation on the corrosion of 18%Ni M250 grade maraging steel under welded condition in sulfuric acid medium[J].Surface Engineering& Applied Electrochemistry,2013,49(3):253-260.
[9] 李莉,李学坤,孙平,等.新型咪唑啉类缓蚀剂的合成和缓蚀性能研究[J].化学工程师,2014,28(12):14-17.
[10] 张红红,谢彦,杨仲年.2-羟基-4-甲氧基苯甲醛缩氨基硫脲对碳钢的缓蚀作用[J].应用化工,2014,43(11):1973-1976.
[11] 刘琳,潘晓娜,张强,等.噻二唑衍生物分子结构与其缓蚀性能的关系[J].化工学报,2014,65(10):4039-4048.
[12] 田继强.钨铝合金在NaCI溶液中的电化学腐蚀行为研究[D].青岛:中国海洋大学,2013.[13] RARYA K,JOSEPH A.Synergistic effects and hydrogen bonded interaction of alkyl benzimadazoles and thiourea pair on mild steel in hydrochloric acid[J].Journal of the Taiwan Institute of Chemical Engineers,2015,52(2015):127-139.
[14] 曹楚南.腐蚀电化学原理[M].第三版.北京:化学工业出版社,2008:208.
[15] 霍宇凝,蔡张理,赵岩,等.聚天冬氨酸及其与锌盐的复配物对碳钢缓蚀性能的影响[J].华东理工大学学报,2001,27(6):669-672.
[16] MUTOMBO P,HACKERMAN N.The effect of some organophosphorus compounds on the corrosion behaviour of iron in 6 M HCI[J].Anti-Corrosion Methods and Materials,1998,45(6):413-418.
[17] 王洋,张晓健,陈雨乔,等.给水管网管壁铁细菌生长特性模拟及控制对策研究[J].环境科学,2009,30(11):3293-3299.
Corrosion Inhibition Mechanism and Performance of Immobilized Lysozyme
JIANG Guofei,LIU Fang,LI Jiaman,WANG Hongxi,ZHAO Chaocheng,WANG Yongqiang
(College of Chemical Engineering,China University of Petroleum,Qingdao 266580,China)
X505;TQ085
A
1005-748X(2017)09-0715-06
10.11973/fsyfh-201709012
2016-02-01
刘芳(1976-),教授,博士,从事循环冷却水对设备的防腐抑菌相关工作,18660203832,liufangfw@163.com

