IP、EP方案治疗广泛期小细胞肺癌的临床对比观察
李琛,杨晓光,钱海红,陈丽萍,张志华,肖丽
(1河北北方学院附属第一医院,河北张家口075000;2张家口市第二医院)
IP、EP方案治疗广泛期小细胞肺癌的临床对比观察
李琛1,杨晓光2,钱海红1,陈丽萍1,张志华1,肖丽1
(1河北北方学院附属第一医院,河北张家口075000;2张家口市第二医院)
目的比较IP方案与EP方案治疗广泛期小细胞肺癌(ED-SCLC)的临床疗效、安全性及其对患者血清Ki-67、血管内皮生长因子(VEGF)水平的影响。方法选择ED-SCLC 患者60例,随机分为IP组和EP组,各30例。IP组采用IP方案(伊立替康+顺铂)进行治疗,EP组采用EP方案(足叶乙甙+顺铂)进行治疗,21天为1个化疗周期,连续化疗2个周期。化疗结束后评价近期疗效,记录两组化疗期间毒性反应;化疗后随访,随访终点为化疗后1年或死亡,记录两组总生存期(OS)及1年生存率;采用ELISA法检测两组化疗前后血清Ki-67、VEGF。结果IP组完全缓解2例、部分缓解17例、病情稳定7例、病情进展4例,近期有效率为63.33%,疾病控制率为86.67%;EP组完全缓解2例、部分缓解15例、病情稳定8例、病情进展5例,近期有效率为56.67%,疾病控制率为83.33%;两组近期有效率、疾病控制率比较P均>0.05。IP组中性粒细胞减少、血小板减少发生率均低于EP组(P<0.05或<0.01),两组其他毒性反应发生率比较P均>0.05。两组OS及1年生存率比较P均>0.05。与化疗前比较,两组化疗后血清Ki-67、VEGF水平均降低,但IP组降低更明显(P<0.05或<0.01)。结论IP方案与EP方案对ED-SCLC患者近期疗效及生存情况的影响无明显差异,但IP方案毒性反应较轻,降低血清Ki-67、VEGF水平作用更明显。
肺癌;广泛期小细胞肺癌;伊立替康;顺铂;足叶乙甙;Ki-67;血管内皮生长因子
小细胞肺癌(SCLC)约占肺癌的13%,其肿瘤细胞增殖能力及侵袭能力均较强,恶性程度高,约2/3的患者就诊时已处于广泛期小细胞肺癌(ED-SCLC)[1]。ED-SCLC患者对放化疗敏感,但预后较差,目前针对ED-SCLC的化疗方案主要有IP、EP方案[2]。近年来一项于日本、 北美等地开展的临床试验比较了IP方案与EP方案治疗ED-SCLC的临床效果,证实IP方案较EP方案更有助于提高患者的总生存期(OS),且在日本人群中获益最明显,其次为欧洲人群,再次为北美/澳大利亚人群[3]。在我国关于IP、EP方案治疗ED-SCLC的临床对比观察较多,但是关于其治疗效果及安全性的争议较大[4,5],为此我们进行了如下研究。
1 资料与方法
1.1 临床资料 选择2013年6月~2014年6月河北北方学院附属第一医院呼吸内科收治的ED-SCLC患者60例,男39例、女21例,年龄41~72岁、中位年龄55岁,均伴淋巴结转移及远处转移。纳入标准:①符合国际肺癌研究协会制定的SCLC诊断标准,并经病理学或细胞学确诊处于广泛期[6];②预计生存时间>3个月,美国东部肿瘤协作组体能状态(ECOG-PS)评分为0~2分;③经CT检查证实至少存在1处可测量病灶;④无明显化疗禁忌证;⑤治疗前未经放化疗、手术及免疫治疗。排除标准:①预计生存时间≤3个月;②心、肝、肾等重要脏器功能严重障碍;③合并难以控制的严重感染;④CT检查未找到可供测量的实体瘤;⑤骨髓造血功能异常;⑥拟行放疗、免疫治疗等其他治疗。将患者按照随机数字表法分为IP组、EP组,每组30例。两组性别构成比及年龄等一般资料均具有可比性。本研究通过医院伦理委员会批准,患者及其家属均知情同意。
1.2 治疗方法 IP组采用IP方案治疗:伊立替康(CPT-11)65 mg/m2静脉滴注,第1、8天;顺铂(DDP)25 mg/m2静脉滴注,第1~3天。EP组采用EP方案治疗:足叶乙甙(VP-16)100 mg/m2静脉滴注,第1~3天;DDP 25 mg/m2静脉滴注,第1~3天。两组均以21天为1个化疗周期,连续化疗2个周期。治疗期间给予止吐、抗腹泻等对症治疗。
1.3 疗效观察 ①近期疗效:2个化疗周期结束后两组均行CT检查,参照RECIST1.1标准[7,8]评价近期疗效:完全缓解(CR):病灶消失;部分缓解(PR):基线病灶长径总和缩小≥30%;病情稳定(SD):基线病灶长径总和缩小<30%或增加,但未达到PD;病情进展(PD):基线病灶长径总和增加≥20%或出现新的病灶。以CR+PR计算近期有效率,以CR+PR+SD计算疾病控制率。②毒性反应:记录两组化疗期间骨髓抑制(中性粒细胞减少、血红蛋白降低、血小板减少)、消化道反应(食欲减退、恶心呕吐、腹泻)、皮疹、肝功能异常、周围神经毒性发生情况[9]。③生存情况:治疗后随访,随访终点为化疗后1年或死亡,记录两组OS及1年生存率。④血清Ki-67、血管内皮生长因子(VEGF)水平:化疗前及2个化疗周期结束后,两组抽取空腹肘静脉血5 mL,室温放置30 min,3 000 r/min离心10 min,分离血清1 mL,-80 ℃保存备用。采用ELISA法检测血清Ki-67、VEGF水平。试剂盒均购自武汉博士德公司,严格按照试剂盒说明书进行操作。
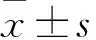
2 结果
2.1 两组临床疗效比较 IP组CR 2例、PR 17例、SD 7例、PD 4例,近期有效率为63.33%,疾病控制率为86.67%;EP组CR 2例、PR 15例、SD 8例、PD 5例,近期有效率为56.67%,疾病控制率为83.33%;两组近期有效率、疾病控制率比较P均>0.05。
2.2 两组毒性反应情况比较 IP组发生骨髓抑制37例(中性粒细胞减少22例、血红蛋白降低8例、血小板减少7例),消化道反应44例(食欲减退10例、恶心呕吐25例、腹泻9例),皮疹6例,肝功能异常5例,周围神经毒性6例;EP组骨髓抑制51例(中性粒细胞减少28例、血红蛋白降低9例、血小板减少14例),消化道反应39例(食欲减退8例、恶心呕吐24例、腹泻7例),皮疹7例,肝功能异常6例,周围神经毒性5例;IP组中性粒细胞减少、血小板减少发生率均低于EP组(P<0.05或<0.01),两组其他毒性反应发生率比较P均>0.05。
2.3 两组生存情况比较 IP组患者OS为(12.1±3.4)个月,1年生存率为43.33%(13/30);EP组OS为(11.9±2.8)个月,1年生存率为40%(12/30);两组OS及1年生存率比较P均>0.05。
2.4 两组血清Ki-67、VEGF水平比较 见表1。

表1 两组化疗前后血清Ki-67、VEGF水平比较
注:与同组化疗前比较,*P<0.01;与EP组化疗后比较,#P<0.05。
3 讨论
SCLC具有恶性程度高、早期易广泛转移的特点,ED-SCLC患者生存时间仅为8~13个月,2年生存率约为5%[10]。目前,ED-SCLC的治疗主要为化疗,推荐药物为铂类药物和拓扑异构酶Ⅰ/Ⅱ型抑制剂[11]。拓扑异构酶Ⅰ/Ⅱ型抑制剂如CPT-11、VP-16和拓扑替康已被美国食品及药物管理局(FDA)批准用于广泛期一线和复发耐药SCLC的治疗。 CPT-11是喜树碱的水溶性衍生物,内含抗肿瘤生物碱,可通过抑制DNA拓朴构型异构酶Ⅰ型活性而阻碍DNA的合成,从而发挥抗肿瘤活性的作用[12]。DDP为铂类的金属络合物,主要作用于DNA链间及链内交链,形成DDP-DNA复合物或与核蛋白及细胞质蛋白结合,阻碍DNA复制[13]。VP-16为细胞周期特异性抗肿瘤药物,作用于DNA拓扑异构酶Ⅱ型,可形成药物-酶-DNA特异性复合物,阻碍DNA修复[14]。
2002年,Noda等[15]报道了一项关于CPT-11联合DDP与VP-16联合DDP治疗ED-SCLC的Ⅲ期多中心研究,前者治疗后患者中位生存期(12.8个月)及2年生存率(9.5%)均明显高于后者(9.4个月、5.2%),证实IP方案治疗ED-SCLC效果优于EP方案,能明显延长患者的生存时间。但Schmittel等[16]研究结果表明,IP方案与EP方案在治疗ED-SCLC的近期有效率和无进展生存期方面比较无明显差异,但IP方案不良反应发生率明显低于EP方案。本研究结果显示,两组近期有效率、疾病控制率、OS及1年生存率比较差异均无统计学意义,证实IP与EP方案对ED-SCLC患者近期疗效及生存情况的影响无明显差异。本研究两组主要毒性反应集中在骨髓抑制(中性粒减少、血红蛋白降低、血小板减少)、消化道反应(食欲减退、恶心呕吐、腹泻)、皮疹、肝功能异常、周围神经毒性等方面,IP组中性粒细胞减少、血小板减少发生率均明显低于EP组,其余毒性反应发生率比较未见明显差异,说明IP方案治疗ED-SCLC的安全性更高。
Ki-67是目前应用最广泛、最可靠的细胞增殖标志物之一,与多种肿瘤的发展、浸润、转移及患者预后有关[17],其在G/S、G2及M期细胞中均有表达,是全面准确评估细胞增殖活性的客观指标。VEGF能刺激血管内皮细胞增殖及迁移,从而促进肿瘤血管形成,在肿瘤浸润、转移过程中发挥重要作用。本研究结果显示,与化疗前比较,两组化疗后血清Ki-67、VEGF水平均降低,但IP组降低更明显,说明IP方案对ED-SCLC患者血清Ki-67、VEGF水平的抑制作用更为明显。
综上所述,IP方案与EP方案对ED-SCLC患者近期疗效及生存情况的影响比较无明显差异,但IP方案毒性反应较轻,对血清Ki-67、VEGF水平的抑制作用更为明显。但是本研究随访时间较短、纳入病例数相对较少,未来还需扩大样本量、延长随访时间进行深入研究。
[1] Cai Q, Luo HL, Gao XC, et al. Clinical features and prognostic factors of small cell lung cancer: a retrospective study in 148 patients[J]. J Huazhong Univ Sci Technolog Med Sci, 2016,36(6):916-922.
[2] Ogino H, Hanibuchi M, Kakiuchi S, et al. Analysis of the prognostic factors of extensive disease small-cell lung cancer patients in tokushima university hospital[J]. J Med Invest, 2016,63(3-4):286-293.
[3] 石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识(2016年版)[J].中国肺癌杂志2016,19(1):1-14.
[4] 王文娴,凌明珠,宋正波,等.伊立替康或依托泊苷联合铂类药物一线治疗广泛期小细胞肺癌的meta分析[J].临床肿瘤学杂志,2015,20(1):36-41.
[5] 王慧娟,闫相涛,路平,等.伊立替康联合顺铂与依托泊苷联合顺铂方案一线治疗广泛期小细胞肺癌的多中心临床研究结果[J].中国癌症杂志,2011,21(10):783-788.
[6] Argiris A, Murren JR. Staging and clinical prognostic factors for smal lung cancer[J]. Cancer J, 2001,75(5):437-447.
[7] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009,45(2):228-247.
[8] 杨旭,许光,雷振,等.RECIST1.1与WHO、RECIST1.0标准评价周边型肺癌疗效比较[J].中国医学影像学杂志,2012,20(5):255-258.
[9] 曾晓媛,周承志,欧阳铭,等.肺腺癌患者培美曲塞二线化疗时维生素支持治疗的临床疗效分析[J].中华肿瘤杂志,2015,37(11):868-872.
[10] Koinis F, Kotsakis A, Georgoulias V. Mall cell lung cancer (SCLC): no treatment advances in recent years[J]. Transl Lung Cancer Res, 2016,5(1):39-50.
[11] Shi Y, Hu Y, Hu X, et al. Cisplatin combined with irinotecan or etoposide for untreated extensive stage small cell lung cancer: a multicenter randomized controlled clinical trial[J]. Thorac Cancer, 2015,6(6):785-791.
[12] Abou-Taleb HA, Koshiyama M, Matsumura N, et al. Clinical efficacy of neoadjuvant chemotherapy with irinotecan (CPT-11) and nedaplatin followed by radical hysterectomy for locally advancedcervical cancer[J]. J Int Med Res, 2016,44(2):346-356.
[13] Chen F, Zhao Q, Wang S, et al. Upregulation of Id3 inhibits cell proliferation and induces apoptosis in A549/DDP human lung cancer cells in vitro[J]. Mol Med Rep, 2016,14(1):313-318.
[14] Sun Y, Cheng Y, Hao X, et al. Randomized phase Ⅲ trial of amrubicin/cisplatin versus etoposid-e/cisplatin as first-line treatment for extensive small-cell lung cancer[J]. BMC Cancer, 2016,16(10):265-276.
[15] Noda K, Nishiwaki Y, Kawahara M, et al. Irinotecan plus cisplatin compared with etoposide plus cisplatin for extensive small-cell lung cancer[J]. N Engl J Med, 2002,346(2):85-91.
[16] Schmittel A, Sebastian M, Fischer L, et al. A German multicenter, randomized phase Ⅲ trial comparing irinotecan-carboplatin with etoposide-carboplatin as first-line therapy for extensive-disease small-cell lung cancer[J]. Ann Oncol, 2011,22(8):1798-7804.
[17] 薛军,武雪亮,高晓斌,等.结直肠腺癌组织survivin和Ki-67的表达及其与预后的关系[J].基础医学与临床,2015,35(11):1169-1174.
河北省卫生和计划生育委员会基金资助项目(20150471)。
张志华(E-mail: zzh19641229@163.com)
10.3969/j.issn.1002-266X.2017.32.022
R734.2
B
1002-266X(2017)32-0070-03
2017-01-13)

