广藿香醇对幽门螺杆菌酸抵抗能力的影响及其机制探讨
连大卫,许艺飞,扶丽君,任文康,魏文辉,庄惠玲,黄 萍,操红缨
(广州中医药大学中药学院,广州510405)
广藿香醇对幽门螺杆菌酸抵抗能力的影响及其机制探讨
连大卫,许艺飞,扶丽君,任文康,魏文辉,庄惠玲,黄 萍,操红缨
(广州中医药大学中药学院,广州510405)
目的观察广藿香醇对于幽门螺杆菌(Hp)酸抵抗能力的影响,并探讨其机制。方法体外培养并鉴定Hp后随机分为5组,受试药高、中、低剂量组分别加入20、10、5 mg/L广藿香醇,阳性对照组加入尿素酶(Ure)抑制剂AHA,空白对照组加入等体积DMSO;干预0.5 h后应用琼脂稀释法测定Hp菌落数,观察其抗酸能力。通过大肠杆菌系统表达和纯化得到Hp尿素酶A(UreA)、UreB、UreG,取UreA/UreB蛋白混合溶液体外模拟Ure成熟过程,将UreG蛋白单体溶液和镍离子(Ni2+)溶液混合,均分别以20、10、5 mg/L广藿香醇(受试药高、中、低剂量组)和等体积DMSO处理(对照组);采用Berthelot显色法检测Ure活性,判断Ure成熟度;以原子吸收光谱法检测Ni2+浓度,判断UreG携带Ni2+的能力。结果在中性环境中,受试药各剂量组和阳性对照组与空白对照组Hp菌落数比较无统计学差异;在酸性环境中,受试药各剂量组和阳性对照组均较空白对照组Hp菌落数减少(P均<0.01),且受试药高剂量组、阳性对照组<受试药中剂量组<受试药低剂量组(P均<0.01)。受试药高、中、低剂量组和对照组Ure活性分别为54.89%±11.47%、63.99%±9.46%、83.88%±11.81%、101.53%±2.55%,Ni2+浓度分别为(0.77±0.24)、(0.80±0.22)、(1.12±0.35)、(1.56±0.42)μmol/L,受试药高、中剂量组<受试药低剂量组<对照组(P均<0.01)。结论广藿香醇可以降低Hp的酸抵抗能力,可能与阻断Ni2+的传递途径和Ure的成熟过程进而抑制Ure活性有关。
幽门螺杆菌;酸抵抗;广藿香醇;尿素酶成熟;镍离子传递
据调查显示[1],在幽门螺杆菌(Hp)的高感染地区,慢性胃炎与Hp感染呈正相关,若不根除体内Hp则发生消化道溃疡或胃癌的概率显著增加。空腹状态下人体胃液的pH在1左右,而Hp只能生存于中性或弱酸性环境中;所以,Hp进入宿主的胃部后必须迅速游动到胃酸较少的胃窦处,黏附于上皮细胞并发挥酸抵抗的功能[2]。这种机制可以让Hp在外周低pH的环境中维持细菌体内的pH在4~5,保证其生存。其中,尿素酶(Ure)属于一种镍离子(Ni2+)依赖金属酶,占据细菌可溶性蛋白的10%~15%,发挥分解尿素生成氨的作用,可在Hp周围形成一片“氨云”,是Hp具有酸抵抗特性最重要的蛋白酶[3,4]。因此,Hp高表达成熟的Ure是维持细菌生存定植的最重要因素[5]。广藿香醇是广藿香的主要有效成分[6],其药理作用包括抗氧化、抗炎及杀灭细菌、真菌、寄生虫等[7~9]。2016年8月~2017年4月,我们观察了广藿香醇对于Hp耐酸性和Ure成熟途径的影响,为进一步研究广藿香醇清除体内Hp的机制提供药理学依据。
1 材料与方法
1.1 材料与仪器 Hp(SS1)由澳大利亚莫纳什大学Richard Ferrero教授馈赠;感受态细菌BL21(DE3),表达载体质粒DNA(UreA和UreB)基因序列的设计与优化由德泰生物(南京)有限公司完成;表达载体质粒DNA(UreG)由香港中文大学黄锦波教授课题组提供。广藿香醇(HPLC>98%),由广州中医药大学新药研究与开发中心苏子仁教授提供;临用前用溶解于DMSO,配制成20 mg/L的母液保存于4 ℃冰箱中,实验前再稀释成20、10、5 mg/L的含药BHI培养液。
弯曲杆菌琼脂培养基(Thermo Fisher Scientific);无菌脱纤维羊血(青岛雅各化学试剂有限公司);脑浸心培养基 (Thermo Fisher Scientific);革兰染色液试剂盒(海博生物);快速Ure试剂(上海榕柏生物技术有限公司);异丙基硫代半乳糖苷(Biocolor);40%丙烯酰胺(BIO-RAD); 咪唑(Bomei);HisPur Ni-NTA 离心柱(Thermo),硫酸卡那霉素(Biosharp);UreA/B抗体(Abcom);尿素(Amresco);GTPγS(Sigma);镍标准溶液(国家标准物质研究中心);6~8 kDa透析袋(Spectrum);溶菌酶、LB培养基(Sigma);Ure抑制剂乙酰氧肟酸(AHA,Sigma)。
全波长酶标仪(TECAN);超声裂解仪(New Brunswick Scientific);恒温摇床(New Brunswick Scientific);恒温金属浴锅 (Benchmark);冷冻离心机、小型抽真空机、pH检测仪(Becmkan Coulter);蛋白纯化系统(Akta,美国);恒压压力泵(Akta);紫外吸收检测器(Eppendorf);AA-7000原子吸收光谱(Shimadzu)。
1.2 实验方法
1.2.1 Hp培养及菌株鉴定 Hp(SS1)菌株复苏于以弯曲杆菌琼脂培养基为基础,含7%脱纤维新鲜羊血及联合抗生素(万古霉素10 mg/L,甲氧苄氨嘧啶5 mg/L、头孢磺啶5 mg/L、两性霉素5 mg/L) 的固体培养基上,在微需氧(37 ℃,5% O2,10% CO2,85% N2)的培养箱中培养48~72 h。快速Ure方法鉴定:使用接种环刮取少量Hp,转移至快速Ure试剂液中,在37 ℃孵育4 h后观察试剂颜色变为紫红色。形态学鉴定:使用接种环刮取少量Hp,用少量蒸馏水将细菌在载玻片上均匀涂抹开后,使用革兰染色液对细菌染色,油镜下观察Hp形态呈红色弯曲杆状、无球变。
1.2.2 Hp酸抵抗能力观察 采用酸性冲击实验。收集传代后生长良好的Hp菌落,使用麦氏比浊仪调整密度为1×109CFU/mL,再按1∶9的比例分别将其置于酸性(pH=1.0)和中性(pH=7.0)的液体培养基中(以脑浸心培养基为基础,含10%胎牛血清和250 mmol/L尿素),使最终细菌密度为1×108CFU/mL;将酸性和中性菌液分别平均分为5组,受试药高、中、低剂量组分别加入20、10、5 mg/L广藿香醇,阳性对照组加入Ure抑制剂AHA 5 mmol/L,空白对照组加入等体积DMSO。在微需氧环境中培养30 min,取出500 μL菌液按照1∶1~1∶105等比例稀释;再每个浓度取出100 μL接种于固体培养基中,微需氧环境中培养72 h后计数Hp菌落。Hp菌落数越多,表明Hp酸抵抗能力越强。
1.2.3 UreA、UreB、UreG在大肠杆菌系统中的表达与纯化 分别将100 ng 的UreA、UreB、UreG表达载体质粒DNA 直接加入感受态细菌BL21(DE3)中,轻微摇动混和后置于冰水浴中30 min;取出后放入42 ℃水浴锅中热激90 s,迅速放回冰水浴中3 min;复温后加入200 μL 的LB 培养基中,放入摇床(37 ℃,195 r/min) 生长 60 min。吸取50 μL 悬液均匀涂布含有50 μg/mL 的硫酸卡那霉素LB 平板中,37 ℃培养过夜。从转化平板中接种单克隆,加入含50 μg/mL硫酸卡那霉素12 mL的LB 培养基中,放入摇床(37 ℃ ,200 r/min)培养4 h;待培养液出现浑浊,取出样品检测其OD600约为0.6。向试管培养液中加入异丙基硫代半乳糖苷(终浓度0.5 mmol/L),15 ℃诱导过夜。重悬细菌,在冰浴中超声裂解(每次超声3 s,间歇8 s,总计20 min);4 ℃以13 000 r/min离心30 min,保留上清并用0.45 μm 滤膜过滤;将过滤的上清液加入HisPur Ni-NTA 分离柱中置于旋转混合仪上于4 ℃孵育80 min,用含有100 mmol/L的咪唑的缓冲液洗脱目标蛋白,流速控制在1.5 mL/min。
1.2.4 UreA、UreB、UreG的鉴定 收集UreA和UreB的洗脱液组分,采用SDS-PAGE凝胶电泳和Western blotting法鉴定。取牛血清白蛋白(BSA)作为对照,BSA及目标蛋白UreA、UreB分别取50 μL,加入等体积的2×SDS上样缓冲液,迅速在100 ℃加热样品15 min 使蛋白变性;4 ℃下以12 000 r/min离心5 min,取上清液20 μL加入凝胶槽中;以200 V 稳压电泳至溴酚蓝带迁移至离凝胶底部1 cm,取出凝胶用考马斯亮兰染色液染色;随后转入脱色液中,脱色至背景清晰。同样条件电泳完毕后将蛋白转移至PVDF膜上,室温封闭3 h后分别加入1∶5 000稀释的UreA、UreB抗体,4 ℃孵育过夜。用PBS冲洗3次,再加入1∶4 000稀释的HRP羊抗兔IgG孵育2 h;最后用ECL化学增强发光试剂盒曝光、显影,鉴定目的蛋白为UreA和UreB。收集UreG洗脱成分并过直径0.22 μm的膜,再注入AKTA系统之中进行鉴定;收集UreG蛋白单体附近的组份,加入上样缓冲液后迅速在95 ℃加热样品10 min 使蛋白变性;取20 μL加入凝胶槽之中,以恒流50 A电泳60 min,至溴酚蓝带迁移至离凝胶底部1 cm;取出凝胶用考马斯亮兰染色液染色,随后转入脱色液中,脱色至背景清晰,观察结果为UreG蛋白单体形式。
1.2.5 Hp中Ure成熟过程观察 取等浓度的UreA和UreB蛋白溶液,按照2∶1混合后制备成Ure复合前体,随机分为4组。受试药高、中、低、剂量组分别加入20、10、5 mg/L的广藿香醇,对照组加入等体积的DMSO;各组再加入NiSO4使Ni2+终浓度为0.1 mol/L,在37 ℃环境中孵育2 h。取各组反应液加入等体积尿素溶液(10 mmol/L)混匀,在室温避光条件下反应20 min;然后依次加入配制的Berthelot显色液A液和B液[10],混匀后室温显色10 min;吸取反应液,在酶标仪上检测其OD635的吸光度值,计算Ure活性。Ure活性=(OD样本-OD空白)/(OD对照-OD空白)×100%。Ure活性越高,其成熟度越高。
1.2.6 Hp中UreG结合Ni2+能力观察 采用原子吸收光谱法。取等浓度的UreG蛋白单体溶液和Ni2+溶液,按照2∶1混合;加入GTPγS使其终浓度为1 mmol/L ,在37 ℃水浴60 min;得到UreG聚合体(2.5 μmol/L)后,随机分为4组。受试药高、中、低、剂量组分别加入20、10、5 mg/L的广藿香醇,对照组加入等体积的DMSO,使每组最终体积为1 mL;37 ℃水浴60 min后,转移至透析袋中;再置于加入100 mL蒸馏水的烧杯中,在预冷的摇床中(4 ℃,100 r/min)摇动2 h;随后更换渗出液,重复上述步骤继续透析2次。收集透析袋中的保留液样品,同时使用国家标准Ni2+溶液制作标准级差溶液,每份样品进样量为10 μL 。在测定波长232 nm、灯电流12 mA、光谱通带宽度0.2 nm 的原子吸收光谱条件下,使用石墨炉法制作镍离子标准工作曲线并检测样品中Ni2+浓度。Ni2+浓度越高,表明UreG结合Ni2+能力越差。
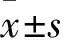
2 结果
2.1 广藿香醇对Hp酸抵抗能力的影响 见表1。

表1 广藿香醇对Hp酸抵抗能力的影响
注:与空白对照组比较,aP<0.01;与受试药低剂量组比较,bP<0.01;与受试药中剂量组比较,cP<0.01。
2.2 广藿香醇对Hp中Ure成熟过程的影响 Ure活性受试药高、中、低剂量组和对照组分别为54.89%±11.47%、63.99%±9.46%、83.88%±11.81%、101.53%±2.55%,受试药高、中剂量组<受试药低剂量组<对照组(P均<0.01)。
2.3 广藿香醇对UreG结合Ni2+浓度的影响 Ni2+浓度受试药高、中、低剂量组和对照组分别为(0.77±0.24)、(0.80±0.22)、(1.12±0.35)、(1.56±0.42)μmol/L,受试药高、中剂量组<受试药低剂量组<对照组(P均<0.01)。
3 讨论
目前,酶已成为药物研发的重要作用靶点,特别是酶抑制剂,高度亲和力与特异性酶抑制剂可使药物具有更专一的治疗价值[11]。研究[12]证实,广藿香醇具有较高的安全性。研究其作用机制不仅为研发抗Hp感染的中药先导化合物奠定药理学基础,同时也为治疗相关疾病开辟新的途径。
Hp能抵抗酸性环境是定植的关键,其中Ure是细菌拥有酸抵抗能力的最重要因素[13]。Hp的Ure属于金属酶,其活性依赖于金属活性中心。Ure成熟过程从细菌胞膜上NixA蛋白转运Ni2+开始,在细菌胞质中Ni2+诱导两个单体UreG蛋白在含有GTP的条件下形成二聚体,并填充在二聚体表面形成结合位点;二聚体会携带Ni2+与UreA和UreB蛋白形成Ure复合前体活性中心部位发生结合,传递Ni2+进入活性位点是Ure成熟的必要条件[14]。因此,不论是抑制UreA和UreB成熟或UreG与Ni2+结合的过程,均可阻断Ure成熟过程,从而降低Hp酸抵抗能力,是清除Hp体内定植的作用靶点之一。
本课题组前期研究已证实,广藿香醇对体内外的Ure活性均有良好抑制作用[15,16]。但是,对于广藿香醇是否具有阻断Ure传递及Ure成熟的过程仍然未知。本研究证实,在中性条件下,广藿香醇各剂量组均对Hp生存无明显影响;而在酸性冲击条件下,广藿香醇各剂量组均表现出了强大的杀菌能力,说明药物可能抑制了Ure的活性使Hp丧失对酸性环境的耐受力从而降低其生存活性。在进一步的研究中,为了探讨阻断Ni2+传递途径及Ure成熟过程是否是药物发挥作用的机制,实验使用大肠杆菌系统表达并提纯了Ure蛋白,使用特定的蛋白模拟Ure的成熟途径,避免其他因素的干扰。首先,在体外模拟了UreA和UreB构成的Ure前体成熟过程,通过检测Ure活性证实了广藿香醇具有阻断Ure成熟过程的作用。然后模拟了UreG单体蛋白与Ni2+结合形成携带Ni2+的UreG二聚体过程,操作中使用GTPγS替代GTP可以延缓UreG二聚体自身的水解过程;通过检测未解离的Ni2+含量,证实了广藿香醇具有抑制UreG二聚体携带Ni2+的能力。因此,广藿香醇可降低Hp酸抵抗能力,其机制与阻断细菌体内Ni2+的传递途径和Ure的成熟过程有关。实验中广藿香醇高剂量相比中剂量表现出对Hp酸抵抗能力更强的抑制效果,但并未体现出更加明显阻断Ni2+作用,这可能与广藿香醇抑制Ure其他相关辅酶蛋白的表达有关,进而抑制Ure的成熟或底物尿素的传递,这部分设想有待下一步的实验探讨。
[1] 张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265-270.
[2] Kim CG, Choi IJ, Lee JY, et al. Biopsy site for detecting Helicobacter pylori infection in patients with gastric cancer[J]. J Gastroenterol Hepatol, 2009,24(3):469-474
[3] Follmer C. Ureases as a target for the treatment of gastric and urinary infections[J]. J Clin Pathol, 2010,63(5):424-430.
[4] Sachs G, Weeks DL, Wen Y, et al. Acid acclimation by Helicobacter pylori[J]. Physiology, 2005,20(6):429-438.
[5] Sachs G, Scott DR, Wen Y. Gastric infection by Helicobacter pylori[J]. Current Gastroenterol Rep, 2011,13(6):540.
[6] 张仲敏,黎玉翠,彭绍忠,等.广藿香醇研究概述[J].中国中医药信息杂志,2012,19(1):110-112.
[7] Wei A, Shibamoto T. Antioxidant activities and volatile constituents of various essential oils[J]. J Agric Food Chem, 2007,55(5):1737-1742.
[8] El-Shazly AM, Hussein KT. Chemical analysis and biological activities of the essential oil of Teucrium leucocladum Boiss[J]. Bioch Systemat Ecology, 2004,32(7):665-674.
[9] Xian YF, Li YC, Ip SP, et al. Anti-inflammatory effect of patchouli alcohol isolated from Pogostemonis Herba in LPS-stimulated RAW264. 7 macrophages[J]. Exp Ther Med, 2011,2(3):545-550.
[10] Yang X, Zhang X, Yang SP, et al. Evaluation of the antibacterial activity of patchouli oil[J]. Iran Pharm Res, 2013,12(3):307-316.
[11] Kosikowska P, Berlicki. Urease inhibitors as potential drugs for gastric and urinary tract infections: a patent review[J]. Expert Opin Ther Pat, 2011,21(6):945-957.
[12] 何景进,彭绍忠,谢庆凤,等.广藿香醇的急性毒性研究[J].时珍国医国药,2012,23(2):274-275.
[13] Conteduca V, Sansonno D, Lauletta G, et al. H.pylori infection and gastric cancer: state of the art (review)[J]. Int J Oncology, 2013,42(1): 5-18.
[14] Sachs G, Scott DR, Wen Y. Gastric infection by Helicobacter pylori[J]. Curr Gastroenterol Rep, 2011,13(6): 540.
[15] Yu XD, Xie JH, Wang YH, et al. Selective antibacterial activity of patchouli alcohol against Helicobacter pylori based on inhibition of urease[J]. Phytother Res, 2015,29(1):67-72.
[16] 连大卫,许艺飞,任文康,等.广藿香醇抑制幽门螺杆菌尿素酶活性及其机制[J].中国中药杂志,2017,42(3):562-566.
Effect of patchouli alcohol on acid resistance of Helicobacter pylori
LIANDawei,XUYifei,FULijun,RENWenkang,WEIWenhui,ZHUANGHuiling,
HUANGPing,CAOHongying(GuangzhouUniversityofChineseMedicine,Guangzhou510405,China)
ObjectiveTo investigate the effect of patchouli alcohol on acid resistance of Helicobater pylori (Hp) and its mechanism.MethodsAfter Hp were cultured in vitro and identified, Hp were divided into 5 groups. The high-, medium-, and low-dose drug groups were added with 20, 10, and 5 mg/L patchouli alcohol; the positive control group was added with urea enzyme inhibitor AHA; the blank control group was added with the same amount of DMSO. Agar dilution method was used to detect the bacterial survival rates in the acidic (pH=1.0) and neutral (pH=7.0) conditions after 0.5 hour. We obtained the Hp urease protein A (UreA) , urease protein B (UreB), and urease protein G (UreG) by E.coli expression system, and mixed up UreA and UreB protein. Then, we took the UreA/UreB protein mixed solution to simulate the Ure maturation process and mixed the UreG protein monomer solution with the nickel ion (Ni2+) solution. The Ure activity was detected by Berthelot method to determine the Ure maturity. The concentration of Ni2+was measured by atomic absorption spectrometry to determine the ability of UreG carrying Ni2+.ResultsIn the neutral condition, there was no significant difference in the Hp colony forming units among the high-, medium-, and low-dose drug groups, positive control group, and blank control group. Compared with the blank control group, the Hp colony forming units of the high-, medium-, and low-dose drug groups and positive control group decreased in neutral conditions (allP<0.05), and the order was as follows: the high-dose drug group, positive control group < medium-dose drug group < low-dose drug group (allP<0.01). The urease activities of the high-, medium-, low-dose drug groups and the control group were 54.89%±11.47%, 63.99%±9.46%, 83.88%±11.81%, and 101.53%±2.55%; the concentrations of Ni2+were (0.77±0.24), (0.80±0.22), (1.12±0.35), (1.56±0.42) μmol/L, and the order was as follows: the high-dose drug group, medium-dose drug group < low-dose drug group < control group (allP<0.01).ConclusionsPatchouli alcohol can decrease the acid resistance of Hp, which may be associated with blocking the transmission pathway of Ni2+and Ure's maturation process and thus inhibiting Ure activity.
Helicobacter pylori; acid resistance; patchouli alcohol; urease mature; nickel ion transfer
10.3969/j.issn.1002-266X.2017.34.005
R975;R573
A
1002-266X(2017)34-0014-04
2017-06-10)
国家自然科学基金资助项目(81374043);广东省科技计划资助项目(2016A020217019);广东省广州市科技计划资助项目(201607010336)。
连大卫(1988-),男,博士研究生,主要研究方向为中药复方药理。E-mail: 675836257@qq.com
操红缨(1974-),女,教授,主要研究方向为中药复方药理。E-mail: 1171629708@qq.com

