经腹腔机器人精准肾根治性切除术手术要点及应用体会
赵健 符伟军 洪宝发 王忠新 时京 宋勇 孟龙 王云鹏 任省身 张旭
1中国人民解放军总医院泌尿外科 100853 北京
论著
经腹腔机器人精准肾根治性切除术手术要点及应用体会
赵健1符伟军1洪宝发1王忠新1时京1宋勇1孟龙1王云鹏1任省身1张旭1
1中国人民解放军总医院泌尿外科 100853 北京
目的探讨经腹腔途径机器人精准肾根治性切除术临床应用效果及其应用体会。方法回顾分析2016年2月~2016年11月间由单一术者完成的24例经腹腔机器人辅助腹腔镜肾根治性切除术的临床资料,其中男20例,女4例,年龄22~73岁,平均55岁。手术采用4臂左侧5孔(右侧6孔)法,即1个镜头孔,3个操作孔,左侧1个(右侧2个)辅助孔,经过9个步骤的精细操作完成手术。对所有患者的术前、术中、术后资料进行统计分析并总结手术体会。结果所有手术均顺利完成,无中转开腹。手术时间:80~184 min,平均(122.46 ±22.55)min;出血量:20~400 ml,平均65 ml,术中均未输血;术后平均住院时间(7.08±1.56)d;肿瘤位于左肾7例,右肾17例;肿瘤最大径2~7 cm,平均(4.40±1.20)cm。术后病理:透明细胞癌21例,嗜酸细胞腺瘤1例,乳头状肾细胞癌1例,Xp11.2易位/TF3融合基因相关性肾细胞癌1例。结论将科学设计精细化的手术步骤应用于机器人肾根治性切除术具有手术时间短、术中出血少、术后并发症少、安全性高等优点,能缩短学习曲线,并为开展该手术的泌尿外科医生提供了有效的手术步骤参考。
机器人;肾肿瘤;腹腔镜肾根治性切除术
开放肾根治性切除术(open radical nephrectomy, ORN)一直以来都是治疗肾脏巨大肿瘤的金标准。自从1991年第一例腹腔镜肾根治性切除术(laparoscopic radical nephrectomy, LRN)开展以来,LRN已逐步取代ORN成为肾根治性切除的主要手术方式[1]。2004年Klingler团队首先报道了他们完成的5例机器人辅助腹腔镜肾根治性切除术(robotic radical nephrectomy, RRN),掀起了机器人应用于上尿路手术的热潮[2]。2016年2月~2016年11月,我们对RRN的手术步骤及要点进行改进,对24例肾肿瘤患者实施经腹腔机器人精准肾根治性切除术,手术效果良好,详细阐述手术要点并总结经验体会,报告如下。
1 资料与方法
1.1临床资料
本组患者24例,男20例,女4例,年龄22~73岁,平均55岁。患者体质指数(body mass index, BMI)19.2~40.1 kg/m2,平均25.8 kg/m2。5例术前有1次腹部手术史。术前影像学检查均诊断为肾脏肿瘤,其中左肾7例,右肾17例。肿瘤大小2~7 cm,平均(4.40±1.20)cm。按照国际抗癌联盟TNM分期法,T1期20例,T3期4例。
1.2手术方法
1.2.1体位与Trocar设计 患者在全身麻醉下取健侧斜卧体位,手术野常规消毒铺巾,留置F18号导尿管。取脐上2 cm患侧腹直肌外侧缘皮肤12 mm切口,此处标记为镜头孔。以右侧为例,分别于腹直肌外缘肋弓下1指、髂前上嵴上及腹直肌外缘平髂嵴做8 mm皮肤切口,标记为第1、2、3机械臂孔,于镜头孔与第一机械臂之间下方腹部正中线处做12 mm皮肤切口作为第一辅助孔,于剑突下做5 mm皮肤切口为第二辅助孔(抬举肝脏);左肾肿瘤时Trocar位置与右侧一样,没有第二辅助孔。取脐部,巾钳提起皮肤,气腹针置入腹腔,注入CO2气体,保持气腹压1.862 kPa(14 mm Hg),在镜头监视下将不同Trocar置入上述各位点。将床旁机械臂手术系统移入位。
1.2.2操作步骤 以机器人辅助腹腔镜右肾根治性切除术为例。①抬起肝脏、显露肾周筋膜外肾上极。手术从抬起肝脏开始,离断肝结肠韧带,必要时离断部分肝三角韧带,使用持针器将肝脏抬起(图1-1)。②切开侧腹膜、游离升结肠。在肾周筋膜前层与结肠融合筋膜之间少血管区分离(图1-2)。③切开肾周筋膜、显露下腔静脉。锐性分离下腔静脉和十二指肠融合处筋膜(图1-3)。④切开肾周筋膜、找到生殖静脉。切开肾周筋膜,寻找生殖静脉,定位腰大肌平面(图1-4)。⑤游离并离断肾动脉。沿生殖静脉向肾门方向游离找到肾静脉,肾动脉在肾静脉后方,上中下不同位置,使用Hem-o-lok夹闭后离断,注意处理异位肾动脉(图1-5)。⑥解剖并离断肾静脉。处理肾静脉时,注意腰静脉及肾上腺静脉(图1-6)。⑦分离肾上极、保留肾上腺。沿下腔静脉外侧向上游离,注意离断肾上腺肾面血管(图1-7)。⑧离断输尿管,游离肾下极。在肾下极找到输尿管,使用Hem-o-lok夹闭后离断(图1-8)。⑨完整游离肾脏,放入标本袋。取出肾脏标本,留置引流管(图1-9)。
2 结果
24例手术均顺利完成,无一例中转开腹。手术时间:80~184 min,平均(122.46±22.55)min;术中出血量:20~400 ml,平均65 ml,术中均未输血;术后住院6~12 d,平均(7.08±1.56)d,肿瘤最大直径2~7 cm,平均(4.40±1.20)cm。术后病理学结果:透明细胞癌21例,Fuhrman分级Ⅱ级18例,Ⅲ级1例,Ⅳ级2例,其中2例肾被膜、肾盂肾窦及肾门血管受浸润,1例仅肾被膜受浸润,其余均无浸润。嗜酸细胞腺瘤1例,乳头状肾细胞癌1例,Xp11.2易位/TF3融合基因相关性肾细胞癌1例。术后出现并发症2例,1例为术后乳糜漏,术后住院11 d;1例为肝功能受损及胰腺炎,术后住院12 d,均对症治疗后痊愈出院。
3 讨论
达芬奇机器人手术系统是继腹腔镜技术之后微创外科领域又一里程碑式的创新,自从2000年第1例机器人辅助腹腔镜前列腺癌根治术取得成功之后,机器人技术在多种泌尿外科手术中得到应用,甚至出现逐渐取代传统腹腔镜技术的趋势。机器人手术优势包括先进的七自由度内手腕装置、三维立体视野、符合人体工程学原理以及比传统腹腔镜手术更短的学习曲线。
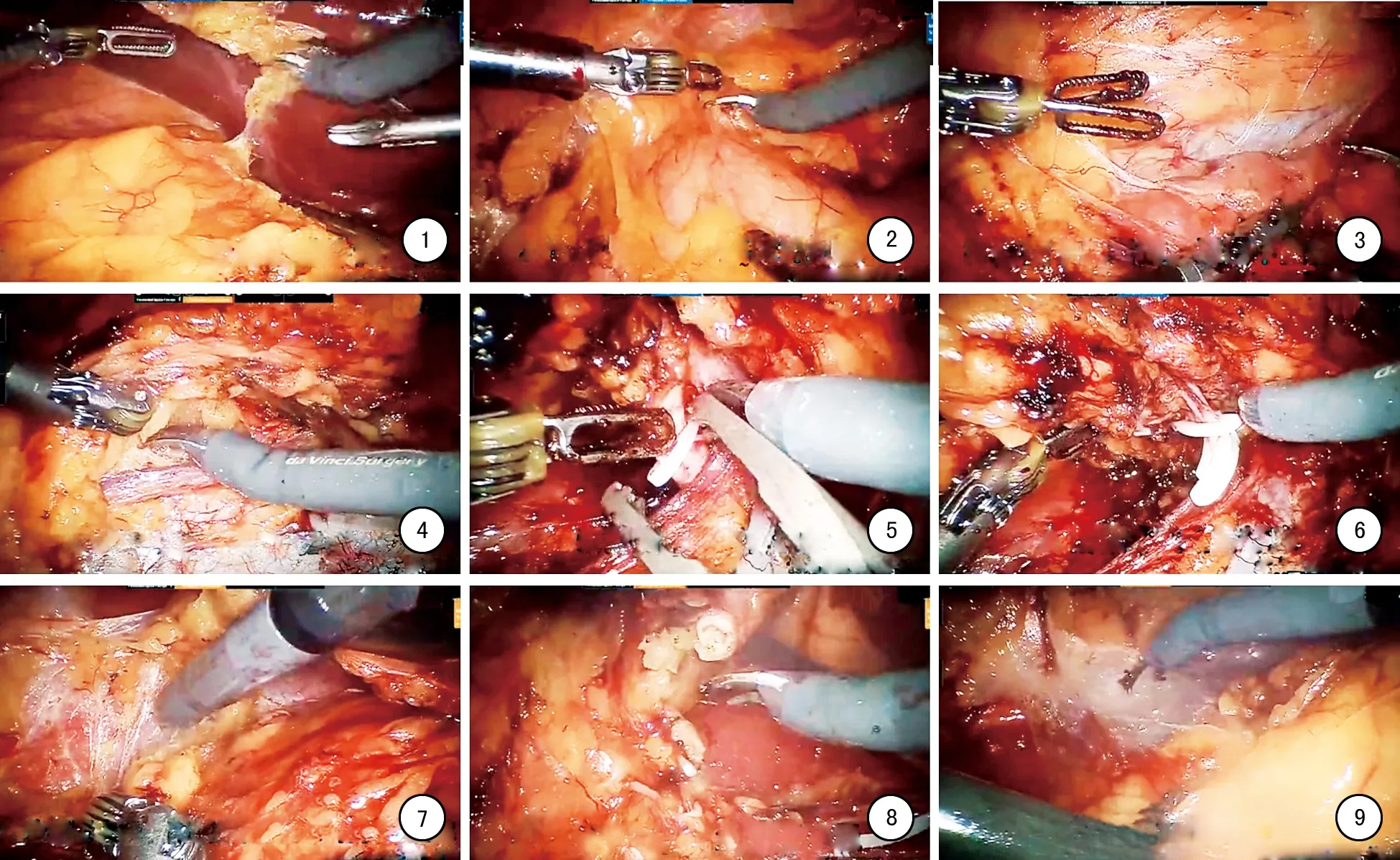
1:抬起肝脏、显露肾周筋膜外肾上极; 2:切开侧腹膜、游离升结肠; 3:切开肾周筋膜、显露下腔静脉; 4:切开肾周筋 膜、找到生殖静脉; 5:游离并离断肾动脉; 6:解剖并离断肾静脉; 7:分离肾上极、保留肾上腺; 8:离断输尿管,游离肾 下极; 9:完整游离肾脏,放入标本袋。
图1机器人辅助腹腔镜右肾根治性切除术
20世纪90年代以来,LRN一直是肾根治性切除术的标准手术方式,但学习期曲线太长。有研究表明机器人辅助腹腔镜肾根治性切除术,具有传统微创手术的所有优点,有效地克服LRN的缺点,是一种安全、有效的手术方式[3]。同时,机器人辅助腹腔镜肾根治性切除术为其他复杂的机器人手术的开展,打下基础并提供了必要的训练平台[4]。在单中心的机器人辅助腹腔镜肾部分切除术的研究中,明确提出每一个手术步骤的标准化才能促成整个手术的最优化,从而最终改善手术效果[5]。
我们通过细化总结RRN每一个手术步骤得出应用经验:①在设计Trocar位置时要根据肿瘤的位置适当调整,以使机械臂在腹腔内形成最优化的角度和操作长度。众所周知,操作器械长度一定且都以Trocar为轴转动,根据杠杆原理,腹腔内器械越长,器械尖端移动相同的距离,外部机械臂移动的距离越小,从而发生碰撞的机会就越小。以RRN为例,当肿瘤位于肾上极时,所有Trocar位置可相应向头侧调整1 cm,当肿瘤位于肾下极时,所有Trocar位置可相应向脚侧调整1 cm,当瘤体较大,常规Trocar完整游离肾脏及肿瘤有困难时,可将Trocar向外侧调整1~2 cm,便于操作。另外先置入镜头Trocar,在镜头直视下根据实际情况相应调整Trocar位置也是一个很好的选择;②因机器人系统缺乏触觉反馈,在分离肾门粘连时一定小心仔细,切忌用力过猛导致出血,Dogra报道他们中心的23例机器人肾根治性切除,其中3例因为分离粘连时出血而中转开腹[6];③通过生殖静脉寻找肾门是寻找肾门血管的一个捷径;④骨骼化肾门部血管,肾动静脉的夹闭一定要确实,本资料术者均用Hem-o-lok夹闭后(患者侧双重夹闭,标本侧一重夹闭)离断;⑤整个手术过程切记无瘤原则,防止肿瘤播散。有报道机器人肾根治性切除术后2年,发现网膜种植转移[7];⑥手术团队成员配合的默契程度直接影响手术的节奏。腹腔镜肾根治性切除术手术模式的流程化可以明显缩短该手术的学习曲线[8]。通过分离肾下极、肾门部血管的处理、分离肾上极及后外侧这三个步骤及机器人器械的配合使得操作台医生获得更多的自主性[9]。
本研究中所有手术均顺利完成,无一例中转开放,平均出血量65 ml,与精细化的手术步骤是密不可分的。其中有1例患者术后出现乳糜漏,考虑是因为肾血管周围淋巴管比较丰富,术中损伤到淋巴管后没有结扎导致,经对症治疗于术后11 d痊愈出院。
该手术的缺点和不足包括设备成本高,需要专门的维护保养人员;手术费用高,患者负担大;机器人系统缺乏触觉反馈,容易造成组织损伤。因而机器人应用于肾根治性切除更多的是技术上的进步而非治疗上的优势[10]。但机器人系统应用于泌尿外科手术已经势不可挡。机器人肾根治性切除联合下腔静脉癌栓取出术及单孔机器人辅助腹腔镜肾根治性切除术相继开展,近期更有机器人肾根治性切除联合胰尾及脾切除术成功的个案报道[11]。机器人肾根治性切除术在单孔腹腔镜手术和肾癌联合下腔静脉癌栓取出术这两个领域中有很好的应用前景[12]。
本文总结了机器人辅助腹腔镜精准肾根治性切除术的手术经验,通过不断完善和精细化手术步骤,在顺利完成手术的基础上,降低手术风险及术后并发症,尽可能的减轻患者的痛苦和负担。
[1] De Lorenzis, Palumbo C, Cozzi G, et al. Robotics in uro-oncologic surgery. Ecancermedicalscience, 2013,7(1):354.
[2] Klingler DW, Hemstreet GP, Balaji KC. Feasibility of robotic radical nephrectomy-initial results of single-institution pilot study. Urology, 2005,65(6):1086-1089.
[3] Hemal AK, Kumar A. A prospective comparison of laparoscopic and robotic radical nephrectomy for T1-2N0M0 renal cell carcinoma. World J Urol, 2009,27(1):89-94.
[4] Rogers C, Laungani R, Krane LS, et al. Robotic nephrectomy for the treatment of benign and malignant disease. BJU Int, 2008,102(11):1660-1665.
[5] Kaouk JH, Khalifeh A, Hillyer S, et al. Robot-assisted laparoscopic partial nephrectomy: step-by-step contemporary technique and surgical outcomes at a single high-volume institution. Eur Urol, 2012,62(3):553-561.
[6] Dogra PN, Abrol N, Singh P, et al. Outcomes following robotic radical nephrectomy: a single-center experience. Urol Int, 2012,89(1):78-82.
[7] Ploumidis A, Panoskaltsis T, Gavresea T, et al. Tumor seeding incidentally found two years after robotic-assisted radical nephrectomy for papillary renal cell carcinoma. A case report and review of the literature. Int J Surg Case Rep, 2013,4(6):561-564.
[8] 邵世修,王永华,王晓,等.手术模式的流程化设计对腹腔镜根治性肾切除术学习曲线的影响.临床泌尿外科杂志,2011,26(12):909-911.
[9] Davila HH, Storey RE, Rose MC. Robotic-assisted laparoscopic radical nephrectomy using the Da Vinci Si system: how to improve surgeon autonomy. Our step-by-step technique. J Robot Surg, 2016,10(3):285-288.
[10] Merseburger AS, Herrmann TRW, Shariat SF, et al. EAU guidelines on robotic and single-site surgery in urology. Euro Urol, 2013,64(2):277-291.
[11] Abdul-Muhsin HM, Stern KL, Katariya NN, et al. Robot assisted "en bloc" radical nephrectomy, splenectomy and distal pancreatectomy for renal cell carcinoma: case report and illustration of technique. J Robot Surg, 2016,10(4):375-378.
[12] Asimakopoulos AD, Miano R, Annino F, et al. Robotic radical nephrectomy for renal cell carcinoma: a systematic review. BMC Urol, 2014,14(1):75-80.
Keypointsandexperienceofpreciselytransperitonealroboticradicalnephrectomy
ZhaoJian1FuWeijun1HongBaofa1WangZhongxin1ShiJing1SongYong1MengLong1WangYunpeng1RenXingshen1ZhangXu1
(1Department of Urology, Chinese PLA General Hospital, Beijing 100853, China)
Fu Weijun, fuweijun@hotmail.com
Objective: To explore the clinical application and experience of precise robotic radical nephrectomy (RRN) through a transperitoneal approach.MethodsWe retrospectively reviewed the records of patients who underwent RRN by the same surgeon at our institute from February 2016 to November 2016. Four robotic arms (one camera arm and three operation arms) were applied, and one assistant trocar was used for left kidney tumors as well as two for right ones. Twenty-four patients (20 males and 4 females) with a mean age of 55 (22-73) years old whose preoperative demographics, intraoperative parameters, postoperative parameters and complications were recorded and the operation experience was summarized.ResultsAll the operations were successfully completed with no convertion to open surgery. The mean operation time was (122.46±22.55) min (80-184 min). The mean blood loss was 65 (20-400) mL. The mean length of hospital stay was (7.08±1.56) d. Tumors in 7 cases were located in the left kidney and those in 17 cases in the right one. The mean maximum tumor diameter was (4.40±1.20) cm (2-7 cm). Pathological results showed that there were 21 cases of clear cell carcinoma, 1 case of oncocytoma, 1 case of papillary renal cell carcinoma, and 1 case of Xp11.2 translocation/TF3 fusion gene-related renal cell carcinoma.ConclusionsThe application of scientificly and precisely designed surgical procedures to the RRN has the advantage of shorter operation time, less blood loss, less postoperative complications and higher safety. It can shorten the learning curve and provide urologists an effective surgical procedure for reference.
robot; renal neoplasm; laparoscopic radical nephrectomy
R737.11
A
符伟军,fuweijun@hotmail.com
2017-02-19
10.19558/j.cnki.10-1020/r.2017.05.001

