海岛棉苗期盐胁迫下形态学和生理学指标变化
赵海燕,王建设,刘林强,陈勇全,李梦飞,卢全伟,刘方,彭仁海
(1安阳工学院生物与食品工程学院,河南安阳455000;2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳455000)
海岛棉苗期盐胁迫下形态学和生理学指标变化
赵海燕1,2,王建设1,刘林强1,陈勇全1,李梦飞1,卢全伟1,刘方2,彭仁海1
(1安阳工学院生物与食品工程学院,河南安阳455000;2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳455000)
【目的】在300 mmol·L-1NaCl 胁迫下,观察并测定海岛棉耐盐性强的品系越海9号和耐盐性弱的品系PS-7叶片、茎细胞解剖结构和生理学指标,从形态学和生理学两个水平研究海岛棉苗期响应盐胁迫的应答机制,为棉花耐盐材料的筛选提供理论依据和技术方案。【方法】采用水培方法,待棉苗生长至3叶期时,开始进行300 mmol·L-1NaCl胁迫处理。运用光学显微技术及生理学指标测定法,在不同NaCl胁迫处理时间下,对海岛棉耐盐性强的品系越海9号和耐盐性弱的品系PS-7进行形态学观察及生理学指标分析。【结果】2份海岛棉材料对 NaCl 胁迫的反应不同。随着300 mmol·L-1NaCl处理时间的延长,与对照相比,越海9号和PS-7的叶片和茎的横切面面积均显著变小,处理24 h时,分别变小14.10%、54.69%与45.30%、87.90%,PS-7的变化幅度大于越海9号;处理12 h时,PS-7维管束中木质部已经损害严重,越海9号维管束中木质部则没有明显变化;PS-7的栅栏组织细胞在处理24 h时由长圆柱形变为卵圆形,越海9号的栅栏组织细胞的形状则没有变化。生理学研究表明,越海9号叶片中的叶绿素含量、超氧化物歧化酶和过氧化物酶活性在整个处理过程中均高于PS-7,而其丙二醛含量却明显低于PS-7;在300 mmol·L-1NaCl处理8 h时,越海9号和PS-7中的丙二醛含量、叶绿素含量、超氧化物歧化酶和过氧化物酶活性均达到了显著性差异。【结论】叶片中栅栏组织和茎中木质部可能是海岛棉响应盐胁迫的最敏感部分,叶绿素、丙二醛、超氧化物歧化酶和过氧化物酶可作为鉴定耐盐棉花材料的生理学指标。
海岛棉;苗期;盐胁迫;形态学;生理学
Abstract:【Objective】The changes of cell structures and physiological characteristics in leaves and stems of two Gossypium barbadense varieties, Yuehai 9 (salt tolerance) and PS-7 (salt sensitive), were investigated under different salt stress conditions.Morphological and physiological mechanism of salt tolerance in Gossypium barbadense to salt stress at seedling stage was studied to offer a theoretical basis and technical reference for selecting salt-tolerant genes in cotton cultivars. 【Method】In a water culture experiment, three-leaf cotton seedlings were treated with NaCl at 300 mmol·L-1NaCl for different times. This study involved observation of morphological features and comparison of physiological indexes of two Gossypium barbadense, Yuehai 9 (salt tolerance) and PS-7 (salt sensitive) under different salt stress treatments by means of optical microscopy and measurement ofphysiological indices.【Result】There was a difference in effect on two cotton cultivars by salt stress. At 300 mmol·L-1of NaCl, with the prolongation of treatment period, the transections of the leaves and stems of Yuehai 9 and PS-7 were both significantly smaller compared with the control groups, decreased, respectively, by 14.10%, 54.69% and 45.30%, 87.90% at 300 mmol·L-1of NaCl after 24 h, and the variation range of PS-7 was larger than that of Yuehai 9. The xylem of the vascular bundle of PS-7 was severely damaged while the xylem of the vascular bundle of Yuehai 9 showed no significant change in 300 mmol·L-1of NaCl treatment for 12 h. The long cylindrical palisade tissue cell of PS-7 became smaller and ovoid in 300 mmol·L-1of NaCl treatment after 24 h while the shape of the palisade tissue cell of Yuehai 9 showed no change. The chlorophyll contents, superoxide dismutase and peroxidase activities in leaves of Yuehai 9 were significantly higher than those of PS-7, while its malondialdehyde contents was lower than that of PS-7. Yuehai 9 and PS-7 were different in chlorophyll contents, malondialdehyde contents, superoxide dismutase and peroxidase activities, and the differences reached a significant level at 300 mmol·L-1of NaCl after 8 h. 【Conclusion】 The most sensitive plant part to salt stress may be the palisade tissues of leaves and xylem in the stem. The chlorophyll, malondialdehyde, superoxide dismutase and peroxidase can be used as the physiological indexes for evaluating and selecting salt tolerance cotton materials.
Key words:Gossypium barbadense L.; seedling; salt stress; morphological index; physiological index
0 引言
【研究意义】土壤盐渍化是一个世界性的资源问题和环境问题,是农业生产主要的限制条件之一[1]。中国盐碱化耕地面积约3 467万hm2(5.2亿亩),在世界上居第四位。其中,新疆的盐碱化土地约占中国盐碱地总面积的1/3。改良和利用这些盐碱土地,可扩大有效的耕地面积,对于中国农业的可持续发展具有重要意义[2-3]。作为盐碱地的先锋作物,棉花不仅具有耐盐碱、耐瘠薄的能力,还具有改良盐碱地的能力。如在中国北方山东东营和河北沧州等盐碱地区,约有40万hm2土地,由于土壤盐碱化程度较高,不适于种植粮食作物,如果用于棉花生产,经过5—10年改良,可逐步发展小麦、玉米等粮食生产[2]。因此,开展棉花耐盐机理研究,挖掘棉花耐盐遗传资源,对培育耐盐作物品种,扩大可利用耕地面积,恢复生态环境,保证农业可持续发展具有深远意义。【前人研究进展】关于棉花的耐盐机制,研究者从棉株体内的离子平衡[4]、渗透调节[5]、活性氧清除[5]、耐盐相关基因克隆及转化[6]、蛋白质组学[7]、甲基化[8]、单核苷酸多态性[9]、简单重复序列标记鉴定[10]等方面进行了研究,取得了一定进展。当前研究对象多为陆地棉,迄今对海岛棉耐盐性及其机理的研究较少。海岛棉最初发现于美洲大西洋沿岸群岛,其品质优于陆地棉,纤维长、细度高、强度大、抗性强,是纺制高档和特种棉纺织品的重要原料[11]。刘国强等[12]对棉花4个栽培种4 078份品种资源进行了耐盐性鉴定,结果表明非洲棉高耐盐和耐盐的材料有4个;海岛棉高耐及耐盐的材料有12个;陆地棉中耐盐材料只有3个,没有高耐盐材料;亚洲棉中没有高耐及耐盐品种。【本研究切入点】从以上分析可看出海岛棉的耐盐性比较突出。而盐胁迫对海岛棉叶、茎等组织解剖结构的影响研究尚未见报道。为此,本试验以人工培养室中水培的海岛棉为材料,从解剖结构及生理指标特征入手,探究不同盐胁迫处理时间对耐盐性不同的海岛棉形态学和生理学的影响。【拟解决的关键问题】以海岛棉耐盐性强的品系越海9号和耐盐性弱的品系PS-7为试验材料,进行不同时间盐胁迫处理,观察对照与处理组茎、叶的显微结构,分析不同盐胁迫时间处理下叶片生理学指标变化,以期明确不同耐盐海岛棉材料细胞结构和生理学指标对盐胁迫的响应,进而探讨它们之间的关系。本研究从形态学和生理学角度阐明其耐盐机制,旨在丰富海岛棉耐盐胁迫逆境理论,为海岛棉耐盐材料筛选提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试材料为海岛棉耐盐性强的品系越海9号和耐盐性弱的品系PS-7。越海9号由中国农业科学院棉花研究所王坤波研究员于2002年从越南引进,PS-7为2007年从美国棉花种质库引进,2份材料都已经过多代自交和耐盐性鉴定(图1)。
1.2 试验方法
2016年3 月,在中国农业科学院棉花研究所将两份供试材料经浓硫酸脱绒、洗净、晾干后,选择籽粒饱满一致的种子用20%双氧水消毒并用蒸馏水冲洗干净,参照王俊娟等[13]的方法进行双夹层滤纸发芽试验。将发芽后的种子用簿的海绵条裹住胚根并插入带孔泡沫悬浮板中,放入装6 L去离子水配制的Hoagland营养液的培养盆中,每盆12株。将培养盆移入培养室进行培养,培养条件设置为:昼夜温度28℃/23℃,相对湿度 65%—70%,光照强度 400 μmol·m-2·s-1,光周期14 h/10 h(昼/夜)。培养期间,使用电动气泵为培养液持续通入氧气,每3 d换一次营养液。待棉苗生长至3叶期时,开始对棉株进行盐胁迫处理。处理组NaCl的浓度为 300 mmol·L-1,对照组 NaCl的浓度为 0,分别采集盐处理组4、8、12、24 h及对照组的茎和叶片,进行相应试验。
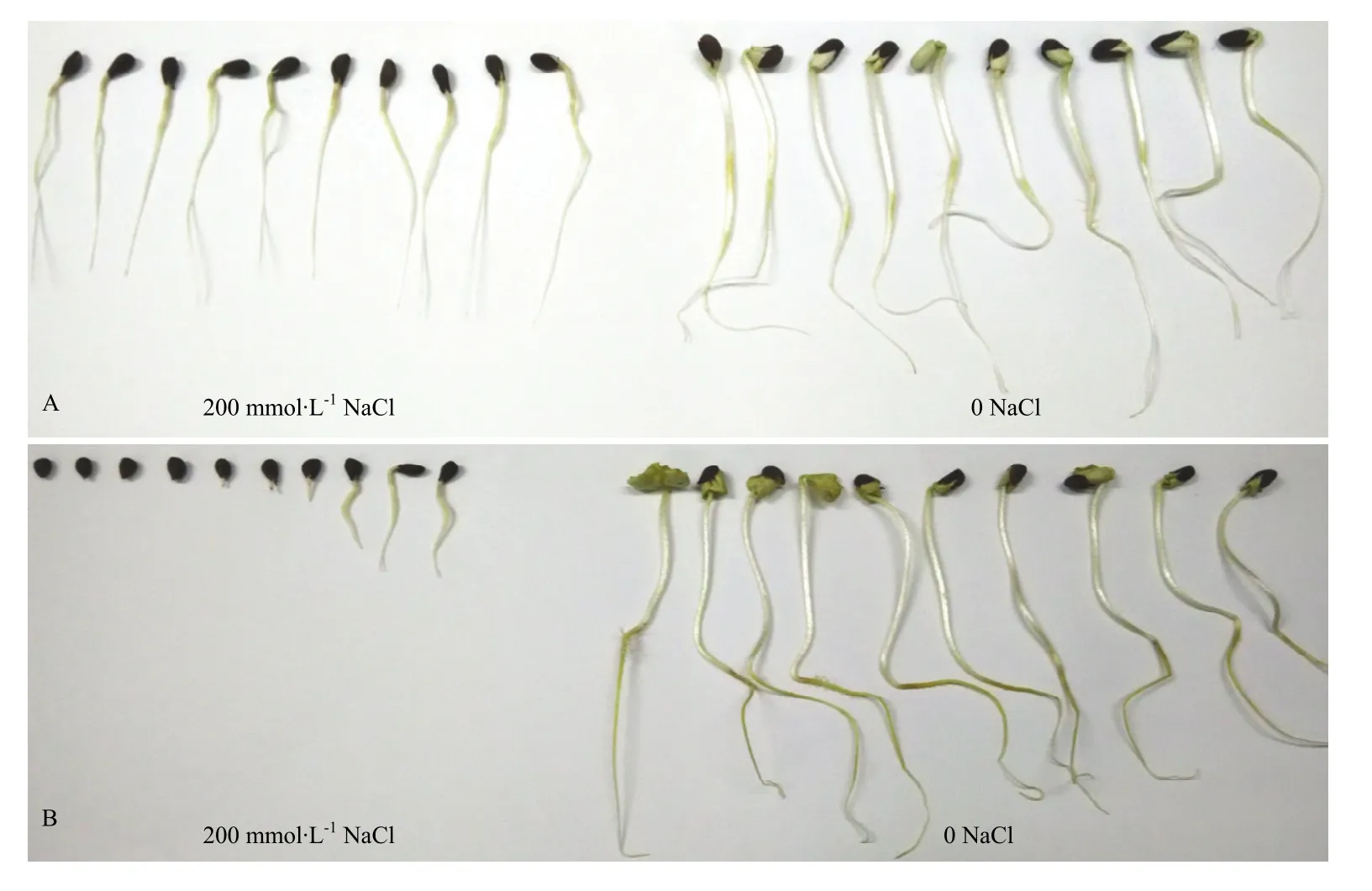
图1 越海9号(A)和PS-7(B)发芽期耐盐性评价Fig. 1 The appraisal of the salt tolerance between Yuehai 9 (A) and PS-7 (B) in germination phase
1.2.1 形态学观察 将采集的盐处理与对照组的叶片和茎分别放入FAA固定液中抽气并固定,24 h后转入 70%乙醇中低温(4℃)保存。材料经各级乙醇脱水、石蜡包埋和切片(蜡带厚度为8 μm)后,用番红-固绿染色液染片,中性树胶封片,制成永久片,在Motic AE31生物显微镜下观察不同处理的叶片和茎的细胞形态特征并拍照。所拍照片采用Motic Images Plus 2.0ML图像分析系统进行测量。
1.2.2 生理指标测定 采用SPAD-502Plus便携式叶绿素仪,分别测定不同盐处理组及对照组棉株最大功能叶的叶绿素含量。将采集的不同盐处理与对照组的叶片称重、分装,采用硫代巴比妥酸比色法测定丙二醛的含量[14]。采用氮蓝四唑光还原法测定超氧化物歧化酶活性[15]。采用愈创木酚-过氧化氢法测定过氧化物酶活性[15]。
2 结果
2.1 盐胁迫对海岛棉叶片组织显微结构影响
对海岛棉耐盐性强的品系越海9号和耐盐性弱的品系 PS-7在不同盐胁迫处理下叶片的石蜡切片进行观察,结果如下:
对照组:即正常无盐胁迫。从横切面上看,越海9号和PS-7叶片均为异面叶,由上表皮、栅栏组织、海绵组织和下表皮 4部分组成(图 2-Y1,P1)。其中,越海9号上下表皮均由单层不规则四边形细胞紧密排列而成,栅栏组织在上表皮下方,呈长柱状,排列较整齐、紧凑,细胞内含较多叶绿体,细胞染色较深;海绵组织在栅栏组织与下表皮之间,多呈椭圆形,排列松散;栅栏组织与海绵组织之间分布有叶脉组织细胞(图 2-Y1)。PS-7上下表皮也均由单层不规则四边形细胞紧密排列而成;栅栏组织细胞特征与越海 9号的相似,但排列比越海9号的疏松;海绵组织细胞多呈杆状,排列也较松散;栅栏组织与海绵组织之间也分布有叶脉组织细胞(图 2-P1)。从表 1可看出,PS-7的上表皮、下表皮、栅栏组织、海绵组织和叶片横切面的厚度及栅栏组织/海绵组织的比值均小于越海9号。
300 mmol·L-1NaCl处理4 h:越海9号上下表皮、栅栏组织细胞特征与排列变化不明显;海绵组织细胞呈卵圆形,排列稍紧密;海绵组织、叶片横切面的厚度比对照分别变薄23.3%和13.9%(图2-Y2,表1)。PS-7上表皮细胞排列整齐;栅栏组织细胞数目增多、排列紧密;海绵组织细胞也呈卵圆形,排列稍紧密;海绵组织、叶片横切面的厚度比对照分别变薄18%和8.4%(图2-P2,表1)。
300 mmol·L-1NaCl处理8 h:越海9号上下表皮、栅栏组织的细胞排列无明显变化;海绵组织细胞变小,数目增多,排列较紧密;上表皮、下表皮、栅栏组织、海绵组织和叶片横切面的厚度比300 mmol·L-1NaCl处理4 h时显著变小,分别变小55.4%、45.1%、55.4%、55.2%和 54.5%,栅栏组织/海绵组织的比值变化不明显(图2-Y3,表1)。PS-7上表皮、下表皮细胞厚度分别变小0.6%、18.2%;栅栏组织细胞变厚 15.9%;海绵组织细胞厚度变小1.4%,形状不规则,排列较紧密;叶片横切面的厚度变小 3.8%,栅栏组织/海绵组织的比值增大16%(图2-P3,表1)。
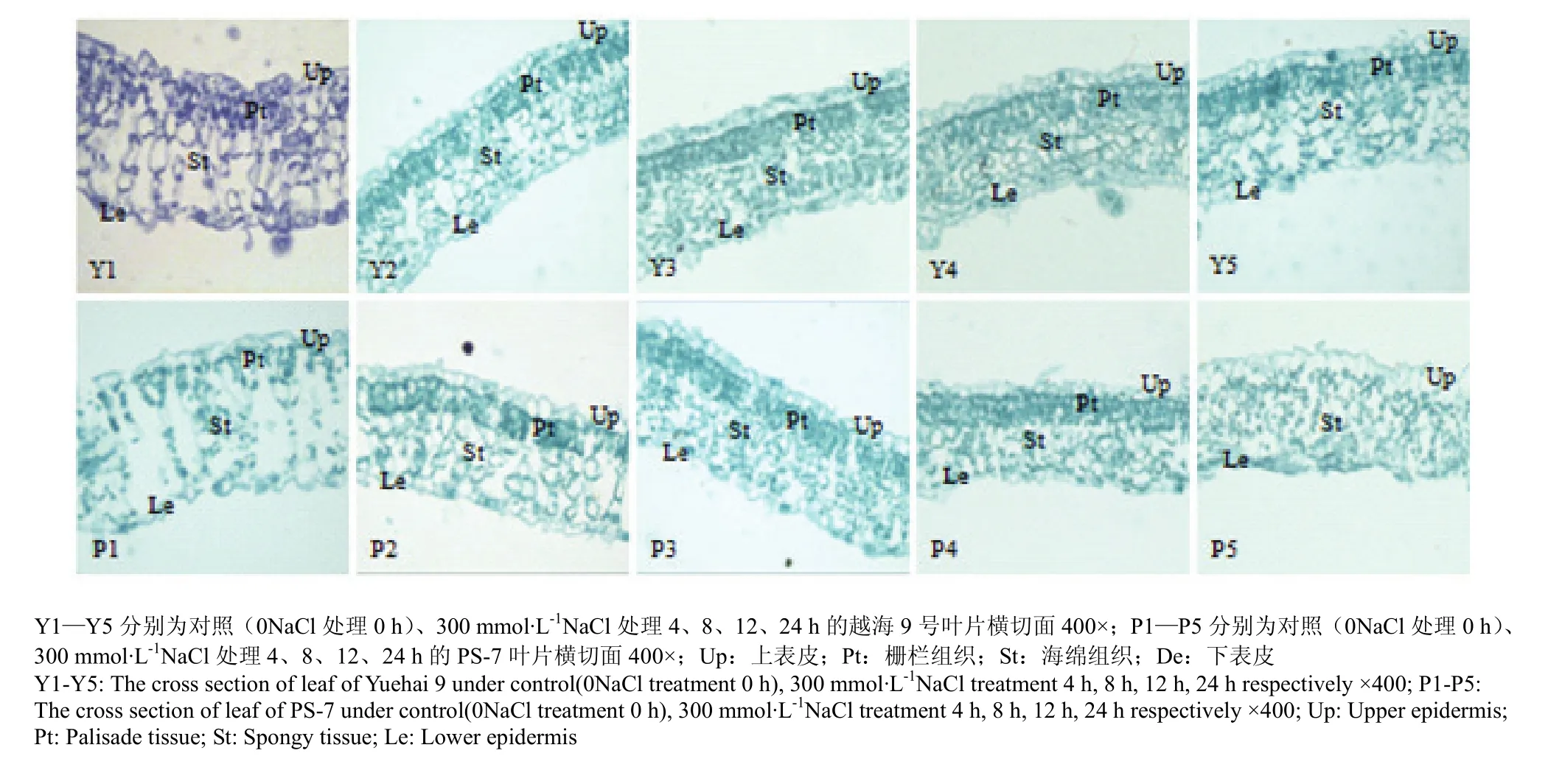
图2 不同盐胁迫下越海9号和PS-7的叶片显微结构Fig. 2 The microstructure of the leaves of Yuehai 9 and PS-7 under different NaCl treatments
300 mmol·L-1NaCl处理 12 h:越海 9 号及 PS-7 上下表皮、栅栏组织细胞排列均变化不明显,海绵组织细胞排列更加紧密(图2-Y4,图2-P4)。越海9号的上表皮、下表皮和海绵组织细胞厚度的降幅分别为0.8%、1.1%、6.7%;栅栏组织、叶片横切面厚度及栅栏组织/海绵组织的比值分别增大9.3%、3.3%、15.7%(图2-Y4,表1)。PS-7上表皮、下表皮、栅栏组织、海绵组织和叶片横切面的厚度分别减小 57.3%、45.7%、56.5%、61.2%和 57.6%,栅栏组织/海绵组织的比值增大10.7%(图2-P4,表1)。
300 mmol·L-1NaCl处理24 h:越海9号上下表皮、栅栏组织细胞排列无明显变化,它们的厚度显著增加,分别增加87.8%、99.5%、80.7%;海绵组织细胞排列稍松散,其厚度增加了1.3倍;叶片横切面的厚度增加了1.1倍;栅栏组织/海绵组织的比值下降了20.3%(图2-Y5,表1)。PS-7上表皮、下表皮细胞的厚度分别增大77.9%、13.7%;栅栏组织与海绵组织均变为不易区分的小卵圆形细胞,松散排列在上下表皮细胞间,海绵组织细胞的厚度增加了 61.4%;叶片横切面的厚度增加了21.1%(图2-P5,表1)。越海9号上下表皮、海绵组织、叶片横切面厚度的增加幅度大于PS-7。
2.2 盐胁迫对海岛棉幼茎组织显微结构影响
对海岛棉耐盐性强的品系越海9号和耐盐性弱的品系 PS-7在不同盐胁迫处理下茎的石蜡切片进行观察,结果如下:
对照组即正常无盐胁迫时,越海9号和PS-7茎的横切面呈卵圆形,从外到内分别由表皮、皮层、维管束、髓射线和髓5部分组成。表皮由单层排列整齐的矩形细胞组成,细胞较小,细胞外壁分布着稀疏表皮毛。皮层由厚壁细胞和薄壁细胞组成,靠近表皮的几层细胞比较小,染色比较深,为厚壁细胞。厚壁细胞内侧为数层薄壁细胞,这些细胞体积较大,排列紧密。皮层内部为维管束,不等距排列成环形,包围着髓。在维管束中,靠近皮层的一侧为韧皮部,细胞较小,染色较深,靠近髓侧的为木质部,由细胞壁加厚的 2—5列导管分子组成,韧皮部和木质部之间的部分为形成层,细胞小,壁薄,染色浅。位于茎中央的髓由体积较大、壁薄的细胞组成。两个维管束之间的薄壁细胞群为髓射线,髓射线在靠近皮层一端的细胞较小,靠近髓一端细胞较大。越海9号和PS-7茎的横切面无明显差别(图3-1,6)。

表1 不同盐胁迫下越海9号和PS-7叶片解剖结构变化Table 1 Changes of anatomical structure of the leaves of Yuehai 9 and PS-7 under different NaCl treatments (mean ± SD, n =10)
随着NaCl处理时间的延长,越海9号和PS-7茎内部结构也发生了相应的变化,呈现出一定的规律性,主要变化特征为:
(1)茎的横切面面积逐步缩小,与对照相比,在NaCl处理24 h,越海9号和PS-7茎横切面面积分别缩小 45.3%、87.9%,越海 9号横切面面积是PS-7的4.3倍。茎横切面横向直径的收缩程度大于纵向,PS-7横切面在NaCl处理4 h由卵圆形变为椭圆形,而越海9号横切面由卵圆形变为椭圆形则出现在NaCl处理8 h,PS-7横切面横向直径的收缩速度大于越海9号。
(2)茎的表皮细胞壁染色逐渐加深,表皮厚度逐步减小,与对照相比,在NaCl处理24 h,越海9号和PS-7茎表皮厚度分别减小29.5%、65.7%,越海9号表皮厚度是PS-7的2.3倍。
(3)茎的皮层细胞在整个横切面分布逐渐不对称,皮层细胞厚度逐步减小,与对照相比,在 NaCl处理24 h,越海 9号和 PS-7的茎皮层细胞厚度分别减小30%、70.9%,越海9号的茎皮层细胞厚度是PS-7的2.3倍。
(4)维管束逐步变小,与对照相比,在 NaCl处理24 h,越海9号和PS-7维管束的长和宽分别减小30.1%和22.1%、69.8%和71.7%,越海9号维管束长和宽分别为PS-7维管束长和宽的2.3倍和2.7倍。在NaCl处理12 h时,PS-7木质部开始损害严重,越海9号木质部则没有明显变化。
(5)两维管束间横向髓射线细胞数量逐渐减少,与对照相比,在NaCl处理24 h,越海9号和PS-7横向髓射线平均厚度分别减小 55.6%和 89.5%,越海 9号横向髓射线平均厚度为PS-7的3.6倍。
(6)髓腔面积逐步减小,与对照相比,在 NaCl处理24 h,越海9号和PS-7髓腔的长和宽分别减小44%和41.2%、76.8%和74.5%,越海9号髓腔的长和宽分别为PS-7髓腔的长和宽的2.4倍和2.37倍(图3,表2)。

图3 不同盐胁迫下越海9号和PS-7的茎显微结构Fig. 3 The microstructure of the stems of Yuehai 9 and PS-7 under different NaCl treatment
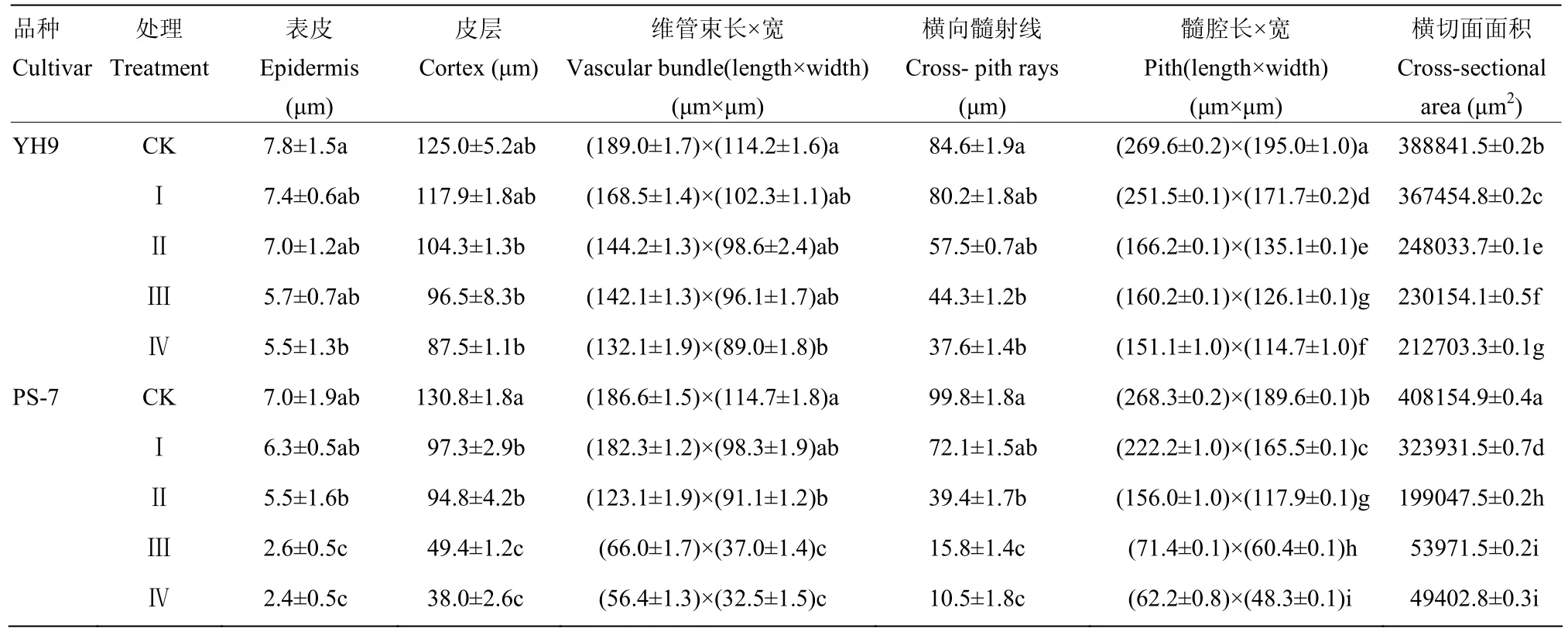
表2 不同盐胁迫下越海9号和PS-7茎解剖结构变化Table 2 Changes of anatomical structure of the stem of Yuehai 9(YH9) and PS-7 under different NaCl treatments (n =10)
2.3 盐胁迫下不同海岛棉叶片组织的生理生化指标变化
盐胁迫导致植物细胞内离子不平衡,引起离子毒害、渗透压力和活性氧的产生,从而影响植物的生长、形态和生存[16]。本研究对海岛棉耐盐性强的品系越海9号和耐盐性弱的品系PS-7在不同盐胁迫处理下的叶片进行了叶绿素含量、丙二醛含量、超氧化物歧化酶和过氧化物酶活性的测定,结果如下:
从图4-A中可以看出,随着300 mmol·L-1NaCl胁迫时间延长,耐盐性强的品系越海9号叶片中丙二醛含量呈现先升高后降低的趋势,在NaCl胁迫12 h达最大值,整个过程变化幅度不大。耐盐性弱的品系PS-7叶片中丙二醛含量随着NaCl胁迫时间延长呈上升趋势,在NaCl胁迫24 h达最大值。
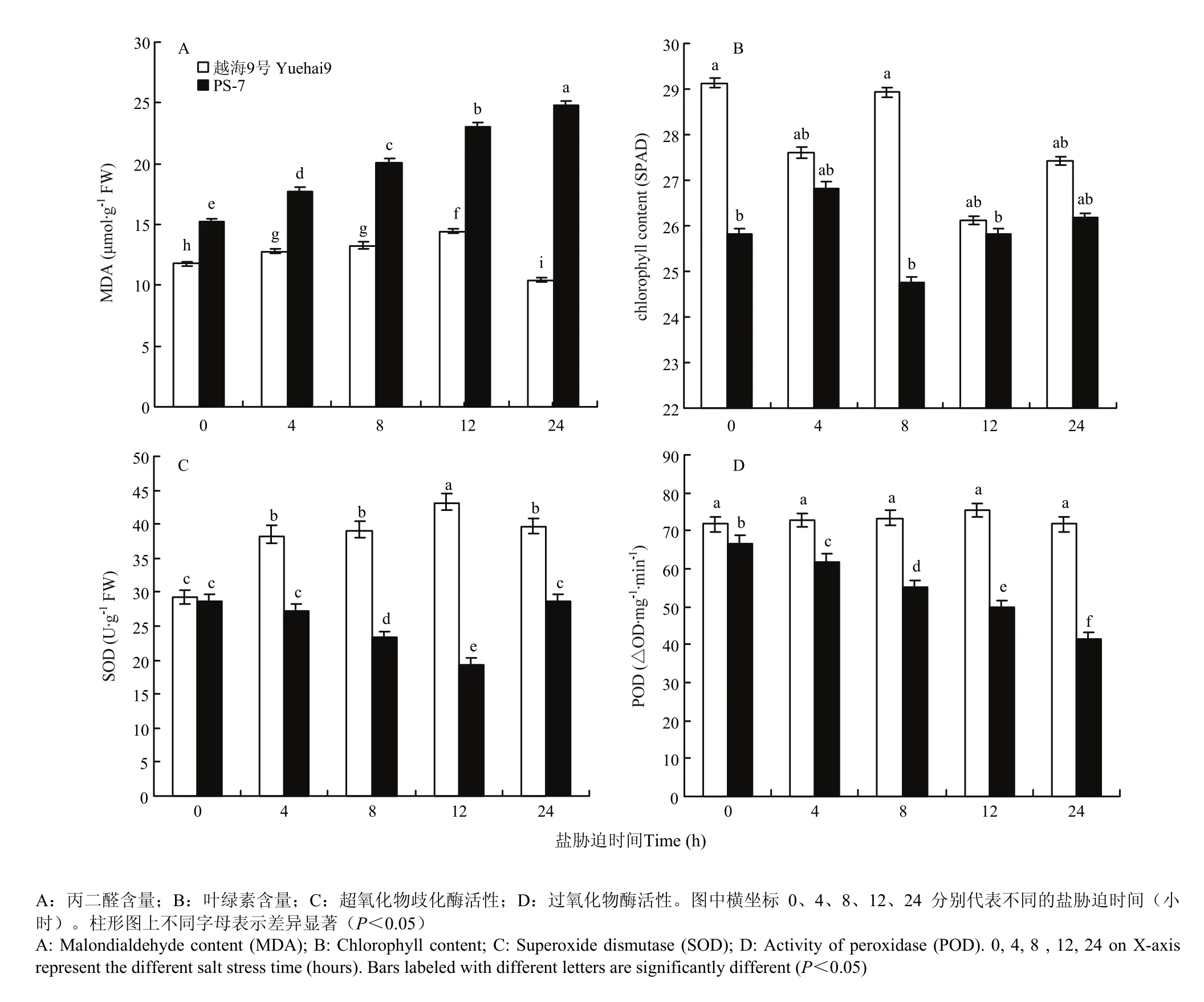
图4 盐胁迫对不同海岛棉生理指标的影响Fig. 4 Effect of salt stress on physiological indexes of leaves of different sea island cotton
从图4-B中可以看出,耐盐性弱的品系PS-7叶片中叶绿素含量在300 mmol·L-1NaCl胁迫不同时间下均低于耐盐性强的品系越海9号。其中越海9号叶片中叶绿素含量随着 NaCl胁迫时间延长呈现低-高-低-高的趋势,NaCl处理组中叶绿素含量低于对照组。PS-7叶片中叶绿素含量随着NaCl胁迫时间延长呈现高-低-高的趋势,且NaCl胁迫24 h时的叶绿素含量略高于对照组。
从图4-C中可以看出,耐盐性强的品系越海9号叶片中超氧化物歧化酶活性随300 mmol·L-1NaCl胁迫时间延长呈先升高后降低的趋势,在NaCl胁迫12 h上升至最大值。但耐盐性弱的品系PS-7叶片中超氧化物歧化酶活性则为先降低后升高的趋势,在 300 mmol·L-1NaCl胁迫12 h降到了最低。PS-7叶片中超氧化物歧化酶活性在 NaCl胁迫不同时间下均低于越海9号。
从图4-D中可以看出,随着NaCl胁迫时间延长,耐盐性强的品系越海9号叶片中过氧化物酶活性总体呈先升高后降低的趋势,在NaCl胁迫12 h达到最大值。耐盐性弱的品系PS-7叶片中过氧化物酶活性则呈降低的趋势,在NaCl胁迫24 h降到最低。
3 讨论
3.1 盐胁迫对海岛棉叶片解剖结构的影响
叶片是植物在进化过程中对环境变化较敏感且可塑性较强的器官,在不同的选择压力下会形成不同的适应类型,不同适应类型的结构特征能体现植物受环境因子的影响或对环境的适应[17]。盐胁迫下,植物叶片内部解剖结构会发生显著的变化,从而反映植物对盐胁迫的响应程度。田晨霞等[18]研究发现,随着盐浓度的增加,紫花苜蓿叶片整体变薄,对海绵组织的影响大于栅栏组织;李学孚等[19]研究认为葡萄在盐胁迫下表皮层、栅栏组织、海绵组织变厚,海绵组织和栅栏组织细胞间隙变大。本研究中,盐胁迫下海岛棉叶片各组成部分均显著变薄(表 1),这与田晨霞等[18]的研究结果一致。在相同浓度、相同时间盐胁迫条件下,对盐敏感度不同海岛棉品系叶片内部显微结构对盐胁迫的响应不同。在300 mmol·L-1NaCl处理24 h,越海9号栅栏组织细胞呈长柱形,PS-7栅栏组织由长柱形变为与海绵组织无明显区分的小卵圆形或不规则形(图 2),这与王秀丽等[20]对盐胁迫下银叶树幼苗叶片解剖特征研究结果一致,也与曹享云等[21]、王秀荣等[22]研究营养缺乏时作物的解剖结构结果相似。在NaCl胁迫下,越海9号和PS-7叶片各组成细胞失水收缩,导致越海9号和PS-7叶片横切面厚度变薄,PS-7对盐敏感度可能大于越海9号,使PS-7叶脉结构受破坏的程度大于越海9号,对其正常的水分及营养物质运输的影响也大于越海9号,进而对PS-7栅栏组织等细胞形态的影响也大于越海9号。
3.2 盐胁迫对海岛棉茎解剖结构的影响
茎将根部吸收的水分和矿物质通过木质部向上运输到各营养器官,同时将叶片光合作用的产物通过韧皮部向下运输,并把叶产生的有机物质运送到根内或暂存茎内[23]。田晨霞等[18]通过对不同浓度NaCl处理紫花苜蓿茎的细胞结构研究发现,随着盐浓度的增加,紫花苜蓿茎中的髓腔面积显著减小。李斌等[24]的研究发现,黄瓜茎中维管束总面积在盐胁迫下显著降低,同时导管数量明显变小、减少。本研究发现,随着盐胁迫时间延长,越海9号和PS-7茎内部的维管束总面积逐步变小,髓腔面积也逐步变小(表2),这与李斌等[24]、田晨霞等[18]的研究结果相似,这可能是植物茎应对盐胁迫的指示特征,这种变化增加了水分从根系向叶片流动的阻力[25],降低了维管组织的运输能力,极大地限制了由根系吸收的溶解有盐离子的水分向地上部分的运输[26]。在相同盐胁迫条件下,对盐敏感度不同海岛棉品系茎内部显微结构对盐胁迫的响应不同,PS-7维管束中木质部已经损害严重,越海9号维管束中木质部则无明显损害现象(图3)。根据GUO等[27]提出阐述质膜Na+/H+逆向转运蛋白(SOSI)与高亲和性K+转运蛋白(HKT)协同作用模型,在NaCl处理12 h,PS-7对盐敏感度可能大于越海9号,越海9号叶片中Na+积累量可能低于液泡区域化 Na+的能力,SOSI从木质部薄壁细胞将Na+装载进木质部导管能力超过HKT介导的Na+从木质部导管卸载入木质部薄壁细胞的能力,导致 Na+能正常装载进木质部导管的蒸腾流中运至植物的地上部分;PS-7叶片中液泡存储Na+的能力可能已达饱和,HKT介导的 Na+从木质部卸载旳能力超过由SOSI介导的Na+向木质部导管的装载,从而导致Na+从木质部导管卸载至木质部薄壁细胞,Na+在木质部薄壁细胞的过量积累就造成木质部的损害,从而抑制Na+等离子向地上部的运输。
3.3 海岛棉盐胁迫下叶片生化指标变化与耐盐性的关系
叶绿素是一类与光合作用有关的重要色素。在盐胁迫下,叶片中叶绿素含量的变化不仅是导致光合作用受到抑制的重要原因之一,而且是反映植物受盐胁迫伤害程度高低的重要指标之一。关于叶绿素含量与盐胁迫的关系,目前存在2种不同观点,一部分研究者认为盐胁迫提高了叶绿素酶的活性,促使叶绿素降解或遭到破坏,导致叶绿素含量减少[28];另外一观点认为,低钠盐可以增加植物体内叶绿素含量[29]。本研究发现,随着NaCl胁迫时间延长,耐盐性强的品系越海9号与耐盐性弱的品系PS-7叶片中叶绿素含量均呈现出先降低后升高的变化(图4),这说明越海9号与PS-7可通过调节叶片中叶绿素的含量来抵御NaCl胁迫的伤害。此外,在整个实验过程中,耐盐性强的品系中的叶绿素含量均大于耐盐性弱的品系,在盐胁迫8 h两者之间的差异最大(图4),这说明相同盐胁迫条件可能导致耐盐性强的品系的光合作用效率比耐盐性弱的品系更大一些,8 h可为后续的转录组、蛋白质组等研究提供材料处理时间的筛选依据。
植物在逆境条件下,通常发生膜脂过氧化作用,作为膜脂过氧化作用的分解产物,丙二醛含量的高低在一定程度上可以表示细胞膜脂过氧化的程度和植物对逆境条件反应的强弱[30]。在盐胁迫下,丙二醛含量的高低在一定程度上可以作为评价植物耐盐性低高的生理指标[31]。本研究发现,随着300 mmol·L-1NaCl胁迫时间延长,耐盐性强的品系越海9号叶片中丙二醛含量总体呈降低趋势,耐盐性弱的品系PS-7叶片中丙二醛含量则呈上升趋势(图 4),这与汪保华等[32]、ZHANG等[5]的研究结果相似。这说明在盐胁迫过程中,耐盐性强的品系越海9号能通过启用细胞内各种保护机制有效地减轻膜脂质过氧化的诱导,从而减少丙二醛的产生;耐盐性弱的品系PS-7则对盐胁迫反应比较敏感,产生了较多的超氧自由基,诱导膜脂质过氧化,从而使植物体内产生了更多的丙二醛。此外,耐盐性强的品系与耐盐性弱的品系中的丙二醛含量在盐胁迫24 h差异最大(图4),这说明相同盐胁迫条件可能导致耐盐性强的品系中的细胞膜脂过氧化的程度低于耐盐性弱的品系,24 h可为后续的转录组、蛋白质组等研究提供材料处理时间的筛选依据。
超氧化物歧化酶和过氧化物酶是植物体内活性氧清除系统的重要保护酶。当植物受到一定范围的逆境胁迫时,体内会产生大量的活性氧,诱导超氧化物歧化酶、过氧化物酶等抗氧化酶活性水平升高和协同作用,清除体内过量的活性氧,防止膜脂过氧化,使植物在一定程度上忍耐、减缓或抵御逆境胁迫的伤害[33]。然而,逆境胁迫一旦超过植物所承受范围,超氧化物歧化酶、过氧化物酶等抗氧化酶则无法清除体内多余的活性氧,打破了活性氧代谢平衡,最终会严重影响植物生长。
超氧化物歧化酶能催化过氧阴离子发生歧化反应,生成过氧化氢,是植物体内防御和抵抗活性氧毒害的第一道防线[34]。过氧化氢仍然是活性氧存在的一种形式,过氧化物酶等抗氧化酶分别通过不同的反应途径将过氧化氢转化为水和氧气,从而提高植物对逆境的耐受能力[35]。本研究发现,随着300 mmol·L-1NaCl胁迫时间延长,耐盐性强的品系越海9号叶片中超氧化物歧化酶和过氧化物酶活性均呈先升高后降低趋势,耐盐性弱的品系PS-7叶片中超氧化物歧化酶和过氧化物酶活性则呈降低趋势(图4),这与杨淑萍[36]、史华平等[37]的研究结果相似。这说明在盐胁迫过程中,耐盐性强的品系越海9号能通过提高超氧化物歧化酶和过氧化物的酶活性来清除体内多余的活性氧,以抵御盐胁迫伤害;耐盐性弱的品系PS-7叶片中超氧化物歧化酶和过氧化物酶活性却受到抑制,引起膜脂质过氧化,影响了棉花的生长。此外,耐盐性强的品系与耐盐性弱的品系中的超氧化物歧化酶和过氧化物酶活性分别在盐胁迫12 h、24 h差异最大(图4),这与材料的盐敏感性及超氧化物歧化酶和过氧化物酶清除活性氧的反应原理不同相关,12 h、24 h可为后续的转录组、蛋白质组等研究提供材料处理时间的筛选依据。
3.4 海岛棉盐胁迫下形态学研究与生理学研究的一致性和互补性
3.4.1 形态学研究与生理学研究具有一致性 盐分不仅改变植物的代谢机制,而且影响植物的正常生长,尤其是植物的形态学和解剖学[38],植物在盐胁迫下所表现出的细胞形态和生理学指标变化能反映出该植物对盐的敏感性。
形态学研究发现,在盐胁迫下,PS-7和越海9号的叶片和茎的横切面面积均显著变小,PS-7的变化幅度大于越海9号,PS-7茎中木质部、叶中栅栏组织细胞分别在NaCl处理12 h、24 h出现损害,并呈现由长圆柱形变为卵圆形的形状变化,越海9号的相应组织在相应胁迫时间下则无明显变化(图2—3),这说明在相同盐胁迫条件下,PS-7受盐胁迫的伤害大于越海9号,越海9号的耐盐性大于PS-7。生理学研究发现,越海9号叶片中的叶绿素含量、超氧化物歧化酶和过氧化物酶活性在 NaCl处理过程中均显著高于PS-7,而其丙二醛含量却明显低于PS-7(图4),这表明在相同盐胁迫条件下,与PS-7相比,越海9号叶片中具有较高的光合效率、活性氧清除酶活性及较低的膜脂过氧化,越海9号的耐盐性大于PS-7,与形态学研究结果一致。可见,形态学研究与生理学研究在鉴定材料的盐敏感性方面具有一致性。
3.4.2 形态学研究与生理学研究具有互补性 植物的耐盐机理是非常复杂的,盐胁迫不仅影响植物的生理和代谢过程,而且引起植物形态、解剖结构等多方面的变化[39],这些多方面变化之间的综合分析在耐盐机理的解析上具有互补性。
NaCl处理12 h,PS-7茎中木质部出现损害,此时叶内超氧化物歧化酶的活性降到整个盐胁迫过程中最低点,随后在NaCl处理24 h,其叶内栅栏组织细胞由长圆柱形变为卵圆形,这时叶内过氧化物酶的活性降到整个盐胁迫过程中最低,丙二醛的含量却上升到整个盐胁迫过程中最高点(图2—4)。这些现象产生的可能原因:在盐胁迫初期,PS-7茎中木质部在质膜Na+/H+逆向转运蛋白(SOSI)作用下,将根从溶液中吸收的 Na+向叶片中运输。随着盐胁迫时间延长,当叶片细胞中存储 Na+的能力达到饱和时,高亲和性K+转运蛋白(HKT)介导Na+从木质部导管卸载至木质部薄壁细胞,Na+在木质部薄壁细胞的过量积累就造成木质部的损害,从而抑制水、无机盐等离子向地上部运输。叶片一旦缺少水、无机盐等离子就打破了细胞内活性氧代谢平衡,造成超氧化物歧化酶、过氧化物酶等活性氧清除系统酶活性下降,引起栅栏组织细胞形状改变。以上推测虽然有待进一步进行试验证明,但不同水平试验现象和数据的综合分析为耐盐机理的解析提供依据。
4 结论
越海9号和PS-7的茎、叶内部结构在300 mmol·L-1NaCl胁迫4 h的过程中差异不大,随着NaCl胁迫时间的延长,越海9号和PS-7的叶片和茎的横切面面积均显著变小,PS-7的变化幅度大于越海 9号;在300 mmol·L-1NaCl处理12 h时,PS-7维管束中木质部已经损害严重,越海9号维管束中木质部则没有明显变化;PS-7的栅栏组织细胞在 300 mmol·L-1NaCl处理24 h时由长圆柱形变为卵圆形,越海9号的栅栏组织细胞的形状则没有变化。
生化研究表明,越海9号叶片中的叶绿素含量、超氧化物歧化酶和过氧化物酶活性在 300 mmol·L-1NaCl处理过程中均显著高于 PS-7,而其丙二醛含量却明显低于PS-7。
本研究进一步验证了越海 9号为耐盐性强的品系,PS-7为耐盐性弱的品系。叶片中栅栏组织和茎中木质部可能是海岛棉响应盐胁迫最敏感的部分,叶绿素、丙二醛、超氧化物歧化酶和过氧化物酶可作为鉴定棉花耐盐材料的生理学指标。
[1]周忠丽, 蔡小彦, 王春英, 张健, 刘方, 李卫平, 王玉红, 王星星,王坤波. 半野生棉耐盐碱筛选初报. 中国棉花, 2015, 42(1): 15-18.ZHOU Z L, CAI X Y, WANG C Y, ZHANG J, LIU F, LI W P, WANG Y H, WANG X X, WANG K B. Primary report of the tolerance identification to saline on Gossypium hirsutum races. China Cotton,2015, 42(1): 15-18. (in Chinese)
[2]叶武威, 阴祖军, 王俊娟, 王德龙. 旱地盐碱地的利用是我国棉花生产发展的必由出路//中国棉花学会 2013年年会论文集. 中国棉花学会, 2013: 3.YE W W, YING Z J, WANG J J, WANG D L. The but approach to enhance the cotton production and development is the utilization of saline draught land//Proceedings of the 2013 annual meeting of the cotton society of China. Chinese Cotton Society, 2013: 3. (in Chinese)
[3]李文昊, 王振华, 郑旭荣, 张金珠. 新疆绿洲盐碱滴灌区域荒地土壤盐分变化. 排灌机械工程学报, 2016, 34(8): 722-729.LI W H, WANG Z H, ZHENG X R, ZHANG J Z. Variation of soil salinity in wasteland of oasis saline drip irrigation area in Xinjiang.Journal of Drainage and Irrigation Machinery Engineering, 2016,34(8): 722-729. (in Chinese)
[4]IBRAHIM W, AHMED I M, CHEN X H, CAO F B, ZHU S J, WU F B. Genotypic differences in photosynthetic performance, antioxidant capacity, ultrastructure and nutrients in response to combined stress of salinity and Cd in cotton. Biometals, 2015, 28(6): 1063-1078.
[5]ZHANG L, MA H J, CHEN T T, PEN J, YU S X, ZHAO X H.Morphological and physiological responses of cotton (Gossypium hirsutum L.) plants to salinity. PLoS ONE, 2014, 9(11): e112807.
[6]CHEN J, WAN S B, LIU H H, FAN S L, ZHANG Y J, WANG W,XIA M X, YUAN R, DENG F N, SHEN F F. Overexpression of an Apocynum venetum DEAD-box helicase gene (AvDH1) in cotton confers salinity tolerance and increases yield in a saline field.Frontiers in Plant Science, 2016. Doi:10.3389/fpls.2016.01041.
[7]CHEN T T, ZHANG L, SHANG H H, LIU S D, PENG J, GONG W K,SHI Y Z, ZHANG S P, LI J W, GONG J W, GE Q, LIU A Y, MA H J,ZHAO X H, YUAN Y L. iTRAQ-based quantitative proteomic analysis of cotton roots and leaves reveals pathways associated with salt stress. PLoS ONE, 2016, 11(2): e0148487.
[8]WANG B H, ZHANG M, FU R, QIAN X W, RONG P, ZHANG Y,JIANG P, WANG J J, LU X K, WANG D L, YE W W, ZHU X Y.Epigenetic mechanisms of salt tolerance and heterosis in upland cotton (Gossypium hirsutum L.) revealed by methylation-sensitive amplified polymorphism analysis. Euphytica, 2016, 208(3): 477-491.
[9]WANG X G, LU X K, WANG J J, WANG D L, YIN Z J, FAN W L,WANG S, YE W W. Mining and analysis of SNP in response to salinity stress in upland cotton (Gossypium hirsutum L.). PLoS ONE,2016, 11(6): e0158142.
[10]ZHAO Y L, WANG H M, SHAO B X, CHEN W, GUO Z J, GONG H Y, SANG X H, WANG J J, YE W W. SSR-based association mapping of salt tolerance in cotton (Gossypium hirsutum L.). Genetics and Molecular Research, 2016. Doi: 10.4238/gmr.15027370.
[11]杨淑萍, 危常州, 梁永超. 海岛棉不同基因型幼苗对盐胁迫的生理响应. 石河子大学学报(自然科学版), 2010, 28(6): 668-673.YANG S P, WEI C Z, LIANG Y C. Physiological response to NaCl stress of different sea island cotton genotypes in seedlings. Journal of Shihezi University (Natural Science), 2010, 28(6): 668-673. (in Chinese)
[12]刘国强, 鲁黎明, 刘金定. 棉花品种资源耐盐性鉴定研究. 作物品种资源, 1993(2): 21-22.LIU G Q, LU L M, LIU J D. The appraisal research of salt resistance of cotton variety resources. Crop Variety Resources, 1993(2): 21-22.(in Chinese)
[13]王俊娟, 叶武威, 周大云, 吕有军, 樊保香, 宋丽艳. 盐胁迫下不同耐盐类型棉花的萌发特性. 棉花学报, 2007,19(4): 315-317.WANG J J, YE W W, ZHOU D Y, LÜ Y J, FAN B X, SONG L Y.Studies on germination characteristics of different salinity-resistant cotton under salt stress. Cotton Science, 2007, 19(4): 315-317. (in Chinese)
[14]邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2007:173-174.ZOU Q. Plant Physiology Experiment Guidance. Beijing: China Agriculture Press, 2007: 173-174. (in Chinese)
[15]王金胜. 农业生物化学技术. 太原: 山西科学技术出版社, 1997:191-194.WANG J S. Agriculture Biological Chemical Technology. Taiyuan:Shanxi Science and Technology Press, 1997: 191-194. (in Chinese)
[16]KHAN M A, UNGAR I A, SHOWALTER A M. Effects of salinity on growth, water relations and ion accumulation of the subtropical perennial halophyte, atriplex griffithii var. stocksii. Annals of Botany,2000, 85(2): 225-232.
[17]王勋陵, 王静. 植物的形态结构与环境. 兰州: 兰州大学出版社,1989: 105-138.WANG X L, WANG J. The Morphological Structure and the Environment of Plants. Lanzhou: Lanzhou University Press, 1989:105-138. (in Chinese)
[18]田晨霞, 张咏梅, 王凯, 张万. 紫花苜蓿组织解剖结构对 NaHCO3盐碱胁迫的响应. 草业学报, 2014, 23(5): 133-142.TIAN C X, ZHANG Y M, WANG K, ZHANG W. The anatomical structure response in alfalfa to salinity-alkalinity stress of NaHCO3.Acta Prataculturae Sinica, 2014, 23(5): 133-142. (in Chinese)
[19]李学孚, 倪智敏, 吴月燕, 李美芹, 刘蓉, 饶慧云. 盐胁迫对‘鄞红’葡萄光合特性及叶片细胞结构的影响. 生态学报, 2015, 35(13):4436-4444.LI X F, NI Z M, WU Y Y, LI M Q, LIU R, RAO H Y. Effects of salt stress on photosynthetic characteristics and leaf cell structure of‘Yinhong’ grape seedlings. Acta Ecologica Sinica, 2015, 35(13):4436-4444. (in Chinese)
[20]王秀丽, 韩维栋. 盐胁迫处理对银叶树幼苗叶片光合及解剖特征影响. 泉州师范学院学报, 2015, 33(6): 8-11, 23.WANG X L, HAN W D. The salt stress on photosynthetic characteristics and anatomy of the leaves of Heritiera littoralis seedlings. Journal of Quanzhou Normal University, 2015, 33(6): 8-11,23. (in Chinese)
[21]曹享云, 刘武定, 皮美美. 硼对棉花叶片解剖结构的影响. 华中农业大学学报,1988, 7(3): 251-254.CAO X Y, LIU W D, PI M M. The effects of Boron on the anatomical structures of cotton leaves. Journal of Huazhong Agricultural University, 1988, 7(3): 251-254. (in Chinese)
[22]王秀荣, 严小龙, 卢仁骏. 磷素营养对菜豆叶片解剖结构的影响.华南农业大学学报, 1999, 20(1): 57-62.WANG X R, YAN X L, LU R J. Effects of P nutrition on the leaf anatomic structure of common beans. Journal of South China Agricultural University, 1999, 20(1): 57-62. (in Chinese)
[23]李瑞梅, 周广奇, 符少萍, 胡新文, 郭建春. 盐胁迫下海马齿叶片结构变化. 西北植物学报, 2010, 30(2): 287-292.LI R M, ZHOU G Q, FU S P, HU X W, GUO J C. Leaf anatomical structure of Sesuvium portulacastrum L. under salt stress. Acta Botanica Boreali Occidentalia Sinica, 2010, 30(2): 287-292. (in Chinese)
[24]李斌, 郭世荣, 李鹤, 何立中, 杜南山. 外源亚精胺对盐胁迫下黄瓜叶片、茎和根显微结构的影响//蔬菜优质安全生产技术研讨会论文摘要集. 中国园艺学会设施园艺分会, 2013.LI B, GUO S R, LI H, HE L Z, DU N S. The effects of spermidine on the microscopic of leaves, stems and roots of cucumber under NaCl stress//Abstracts of the symposium on high quality and safe production technology. Chinese Horticultural Society Facilities Branch Academic Annual Conference, 2013. (in Chinese)
[25]AKRAM M, AKHTAR S, JAVED I U H, WAHID A, RASUL E.Anatomical attributes of different wheat (Triticum aestivum)accessions/varieties to NaCl salinity. International Journal of Agriculture and Biology, 2002, 4: 166-168.
[26]张咏梅, 田晨霞. 黄花草木樨耐 NaHCO3盐碱胁迫的解剖学解释.草业学报, 2016, 25(9): 83-95.ZHANG Y M, TIAN C X. Anatomical mechanism of Melilotus of ficinalis tolerance to NaHCO3aline-alkaline stress. Acta Prataculturae Sinica, 2016, 25(9): 83-95. (in Chinese)
[27]GUO Q, WANG P, MA Q, ZHANG L L, BAO A K, WANG S M.Selective transport capacity for K+over Na+is linked to the expression levels of PtSOSl in halophyte Puccinellia tenuiflora. Functional Plant Biology, 2012, 39(12): 1047-1057.
[28]张其德. 盐胁迫对植物及其光合作用的影响(中). 植物杂志,2000(1): 28-29.ZHANG Q D. The effects of NaCl stress on the plant and its photosynthesis (middle). Plants, 2000(1): 28-29. (in Chinese)
[29]MATOH T, MURATA S. Sodium stimulates growth of panicum coloratum through enhanced photosynthesis. Plant Physiology, 1990,92(4): 1169-1173.
[30]陈贵, 胡文玉, 谢甫绨, 张立军. 提取植物体内 MDA 的溶剂及MDA作为衰老指标的探讨. 植物生理学通讯, 1991, 27(1): 44-46.CHEN G, HU W Y, XIE F T, ZHANG L J. Solvent for extracting malonaldehyde in plant as an index of senescence. Plant Physiology Communication, 1991, 27(1): 44-46. (in Chinese)
[31]费伟, 陈火英, 曹忠, 刘杨. 盐胁迫对番茄幼苗生理特性的影响.上海交通大学学报(农业科学版), 2005, 23(1): 5-9, 30.FEI W, CHEN H Y, CAO Z, LIU Y. Effects of salininty stress on physiological characteristics of tomato seedling. Journal of Shanghai Jiaotong University (Agricultural Science), 2005, 23(1) : 5-9, 30. (in Chinese)
[32]汪保华, 王亚峰, 王长彪, 朱新宇, 赵洁, 高佳文, 鲍颖佼. 中棉所35及中棉所12盐胁迫下的丙二醛含量变化及其SSR指纹图谱构建. 中国棉花, 2011, 38(11): 20-31.WANG B H, WANG Y F, WANG C B, ZHU X Y, ZHAO J, GAO J W,BAO Y J. Effect of salt stress on malondialdehyde content variation and SSR fingerprint construction for CCRI 35 and CCRI 12. China Cotton, 2011, 38(11): 20-31. (in Chinese)
[33]LIANG Y C, CHEN Q, LIU Q, ZHANG W H, DING R X. Exogenous silicon (Si) increases antioxidant enzyme activity and reduces lipid peroxidation in roots of salt-stressed barley (Hordeum vulgare L.).Journal of Plant Physiology, 2003, 160(10): 1157-1164.
[34]GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants. Plant Physiology Biochemistry, 2010, 48(12): 909-930.
[35]JIANG L, YANG H. Prometryne-induced oxidative stress and impact on antioxidant enzymes in wheat. Ecotoxicology and Environmental Safety, 2009, 72(6): 1687-1693.
[36]杨淑萍, 危常州, 梁永超. 盐胁迫对海岛棉不同基因型幼苗生长及生理生态特征的影响. 生态学报, 2010, 30(9): 2322-2331.YANG S P, WEI C Z, LIANG Y C. Effects of NaCl stress on growth and ecology physiological characteristics of different in sea island cotton genotypes in seedlings. Acta Ecologica Sinica, 2010, 30(9):2322-2331. (in Chinese)
[37]史华平, 胡晓丽, 王计平. NaCl胁迫对棉花幼苗根系抗氧化系统的影响. 中国农学通报, 2016, 32(18): 53-59.SHI H P, HU X L, WANG J P. Effects of NaCl stress on antioxidative system of cotton seedling roots. Chinese Agricultural Science Bulletin,2016, 32 (18): 53-59. (in Chinese)
[38]晏石娟, 马晖玲, 曹致中. 紫花苜蓿抗旱耐盐碱转基因抗性苗耐盐性研究. 甘肃农业大学学报, 2006, 41(5): 91-94.YAN S J, MA H L, CAO Z Z. Study on the salt tolerance of transgenic plants of alfalfa. Journal of GanSu Agricultural University, 2006,41(5): 91-94. (in Chinese)
[39]PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants:A review. Ecotoxicology and Environmental Safety, 2005, 60(3):324-349.
(责任编辑 杨鑫浩)
Morphological and Physiological Mechanism of Salt Tolerance in Gossypium barbadense to Salt Stress at Seedling Stage
ZHAO HaiYan1,2, WANG JianShe1, LIU LinQiang1, CHEN YongQuan1, LI MengFei1,LU QuanWei1, LIU Fang2, PENG RenHai1
(1School of Biotechnology and Food Science, Anyang Institute of Technology, Anyang 455000, Henan;2Institute of Cotton Research,Chinese Academy of Agricultural Sciences/State Key Laboratory of Cotton Biology, Anyang 455000, Henan)
2017-01-09;接受日期:2017-03-27
棉花生物学国家重点实验室开放课题(CB2015A23)、河南省高等学校重点科研项目(15A180026)、安阳工学院校科研基金项目(YJJ2015014)、博士启动金项目(400721)、安阳工学院2016-2017学年大学生科技创新项目(36,97)
联系方式:赵海燕,E-mail:zhaohaiyan111111@163.com。王建设,E-mail:wongjaction@163.com。赵海燕和王建设为同等贡献作者。通信作者刘方,E-mail:liufcri@163.com。通信作者彭仁海,E-mail:aydxprh@163.com

