苦荞全生育期芦丁积累与其生物合成途径相关基因表达分析
孙朝霞,侯思宇,令狐斌,刘荣华,王丽,杨武德,韩渊怀
(山西农业大学农学院,山西太谷030801)
苦荞全生育期芦丁积累与其生物合成途径相关基因表达分析
孙朝霞,侯思宇,令狐斌,刘荣华,王丽,杨武德,韩渊怀
(山西农业大学农学院,山西太谷030801)
【目的】探究苦荞全生育期芦丁含量变化与其合成途径关键酶基因和调控因子 MYB基因表达量之间的相关性,以期进一步明确苦荞植株体内芦丁生物合成的分子机制。【方法】以九江苦荞为试验材料,整个生育期分别在萌发期、子叶期、真叶期、盛叶期、现蕾期、盛花期、灌浆期和籽粒成熟期共8个时期取材(S1—S8)。采用RT-PCR方法,克隆获得与黄酮类代谢相关的MYB类转录因子基因。采用T-coffee软件进行氨基酸同源序列比对及保守结构域分析。与拟南芥黄酮类代谢相关的MYB转录因子及荞麦同源MYB转录因子序列比对,基于邻近法构建系统进化树;实时荧光定量PCR技术分析芦丁合成途径中5个关键酶FtCHS、FtF3H、Ft4CL、FtFLS-like和FtUFGT及上述克隆到的MYB转录因子在不同组织中的表达模式。基于高效液相色谱法(HPLC)测定全生育期取材组织的芦丁含量。同时采用相关性分析方法分析不同组织中芦丁含量变化与基因表达模式的相关性。转换上述数据为矩阵,采用欧式距离法构建共表达层次聚类图谱。【结果】克隆到2个MYB类转录因子,即FtMYB7和FtMYB9,其核酸序列长度分别为876和912 bp,分别编码291和303个氨基酸残基。氨基酸序列同源性比对分析结果表明,二者均具有典型的R2R3保守结构域,为R2R3类型的MYB转录因子。结合Nr数据库中17个苦荞和3个拟南芥黄酮类代谢相关MYB转录因子同源氨基酸序列构建系统进化树,结果表明这22个基因分成6大类群,其中FtMYB7属于第II类群,FtMYB9属于第IV类群,二者分属于不同类群,暗示这2个MYB转录因子可能涉及调控植物生长发育过程中不同功能类型。荧光定量结果显示,FtMYB7在 S3(真叶期)和S5(现蕾期)基因相对表达量最高,达到501和867倍;FtMYB9在S1(萌发期)和S2(子叶期)相对表达量最高,分别为34和72倍。上述基因表达量与芦丁含量变化模式相关性分析表明,8个生长时期中,Ft4CL、FtCHS、FtF3H、FtUFGT和FtMYB7相对表达模式与芦丁含量变化幅度呈正相关,其相关系数分别为0.748、0.683、0.704、0.890和0.862。而FtFLS-like和FtMYB9与芦丁含量的变化幅度呈负相关,其相关系数分别为-0.442和-0.501。【结论】FtMYB7和FtMYB9转录因子在整个生育时期中表达模式存在明显差异。其中 FtMYB7可能在苦荞芦丁积累的过程中起到正调控作用,而FtMYB9则为负调控作用。
苦荞;芦丁;MYB基因;基因表达
Abstract:【Objective】 To explore the relationship among the rutin content at different developmental stages with rutin biosynthesis genes and MYB regulation genes, it will be very meaningful to understand the underlying molecular metabolism of rutin accumulation in tartary buckwheat. 【Method】 The whole developmental stages of F. tatarium Jiujiang were classified into 8 stages(germination, first pair of leaf formation, true leaf growth, vegetative growth, flowering, peak flowering, immature seeds , matured seeds),which were named S1-S8 stages. The whole seedlings from S1and S2 stage, leaves from S3 and S4 stage, flowers from S5 and S6 stage, seed formation organ from S7 and S8 stage were used as test materials. Two MYB genes, FtMYB7 and FtMYB9, were cloned and sequenced. The homologous amino acid sequence and conservative structure domain analysis were carried out by T-coffee software. The phylogenetic tree was constructed by the NJ method (neighbor-joining). The multiple sequence alignment of MYB transcription factors related with flavonoids among Arabidopsis and buckwheat were analyzed by MEGA 7.0 software. The rutin content of these tissues at S1-S8 stages was detected by HPLC. In the meantime, the expression level of rutin-biosynthesis-related genes (FtCHS, FtF3H, Ft4CL, FtFLS-like and FtUFGT) and regulator genes (FtMYB7 and FtMYB9) were investigated by qRT-PCR. The correlation of rutin content and the gene expression pattern during the whole developmental stage was estimated by Pearson correlation method. These data were transformed to matrix data, and constructed a Hierarchical cluster heat map by Euclidean distance method. 【Result】Cloned two MYB transcriptional factors, FtMYB7 and FtMYB9, their nucleic acid sequences were 876 and 912 bp, respectively, encoding 291 and 303 amino acid residues. The sequences of 17 MYB transcription factor from buckwheat, and 3 genes related to flavonoids metabolism in Arabidopsis were constructed for a phylogenetic tree. The phylogenetic tree showed that these genes were divided into six groups. Among them, FtMYB7 belongs to the group II, and FtMYB9 belongs to IV groups, the result indicated that the two MYB transcription factors involved in function diversity at regulation of plant growth and development process. The qRT-PCR results showed that the relative expression levels of FtMYB7 at S3 and S5 stages were the highest at 501 and 867 times, respectively. To FtMYB9, the highest gene expression levels were detected at S1 and S2 stages,and 34 and 72 times, respectively. Correlation analysis showed that during 8 growth stages, Ft4CL, FtCHS, FtF3H, FtUFGT and FtMYB7 expression patterns were positively correlated with rutin content, and the correlation coefficient was 0.748, 0.683, 0.704,0.890 and 0.862, respectively. However, FtFLS-like and FtMYB9 were negatively correlated with rutin content, and the correlation coefficients were -0.442 and -0.501, respectively. 【Conclusion】 The FtMYB7 and FtMYB9 were characterized by two R2R3 MYB genes. The different gene expression patterns and rutin content at the whole developmental stage of tartary buckwheat suggested that the FtMYB7 is positively regulated in rutin biosynthesis, but the FtMYB9 is negatively regulated.
Key words:Fagopyrum tataricum; rutin; MYB genes; gene expression
0 引言
【研究意义】苦荞又称鞑靼荞麦(Fagopyrum tataricum),系蓼科荞麦属一年生的双子叶杂粮作物。苦荞是典型的药食同源作物,其籽粒含有的特殊的黄酮类化合物——芦丁(rutin),具有较高的抗氧化活性,有抗癌作用,且可有效降低高血压和高血脂的风险[1-2]。苦荞籽粒中芦丁含量高达 2%,其叶、花和茎也均有较高含量芦丁存在[3]。当前,从植物中提取有效的天然药用化合物来代替化学合成的药用化合物或直接供人们食用,从而降低化学合成药物对人体的副作用,已在一些专家学者中达到共识。因此,培育高芦丁含量苦荞品种(系)作为天然药用化合物提取的资源库或直接提供给特殊人群食用作为专性功能食品,已成为苦荞育种的一个重要方向。MYB类转录因子在调控植物次生代谢中起到重要的作用,其家族成员庞大(如拟南芥中有196个,白菜中有256个),每个成员担负着调控不同生物代谢过程的功能[4-5]。目前,调控苦荞黄酮醇类化合物的MYB转录因子研究报道较少,因此分离鉴定调控苦荞芦丁生物合成的MYB转录因子,对进一步阐明苦荞植株中芦丁生物合成的分子机制具有重要意义[6]。【前人研究进展】拟南芥中共有125个具有R2R3结构域的MYB转录因子,已证实这些转录因子参与多种生物功能,聚类分析表明这些转录因子被分为25类(S1—S25)。其中AtMYB11、AtMYB12和AtMYB111归为S7类,分别调控不同组织内黄酮类化合物的生物合成,因此,这类基因也称为PFG1-3(production of flavonol glycosides)[7-9]。在柑橘全基因组分析中,获得101个R2R3 MYB转录因子,已被证实参与生长发育调节、非生物胁迫及植物激素响应的过程[10];CZEMMEL等[11]也证实 VvMYBF1直接调控葡萄果实黄酮醇的合成。芦丁生物合成途径已经研究较为清楚,参考KEGG(Kyoto Encyclopedia of Genes and Genomes)代谢途径数据库中关于黄酮和黄酮醇类生物合成途径图谱,芦丁生物合成途径中的关键酶包括苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、肉桂酸-4-羟化酶(cinnamate-4-hydroxylase,C4H)、4-香豆酸辅酶 A 连接酶(4-coumarate coenzyme A ligase,4CL)、查耳酮合成酶(chalcone synthase,CHS)、查耳酮异构酶(chalconeisomerase,CHI)、黄酮醇-3-脱氢酶(flavonol-3-dehydrogenase,F3H)、黄酮醇合成酶(flavonol synthetase,FLS)和黄酮糖基转移酶(UDP-glucoronosyl/UDP-glucosyl transferase,UFGT)。先前从苦荞叶片和花cDNA中克隆到芦丁合成途径中 5个关键酶基因Ft4CL、FtCHS、FtF3H、FtFLS-like和FtUFGT[12]。植物中CHS(EC 2.3.1.74)是黄酮类生物合成的第一个关键酶,也是整个合成过程中的第一步限速酶,直接影响下游次生代谢产物的产量[13-14];而 4CL(EC 6.2.1.12)是植物苯丙烷类代谢途径转向黄酮类物质代谢的关键酶之一,也是该途径的限速酶[15];F3H(EC1.14.11.9)是黄酮类合成途径分支点的一个核心酶,可将柚皮素转化为二氢黄酮醇,而二氢黄酮醇是黄酮和异黄酮化合物合成的重要底物,因此该酶是类黄酮合成途径上的一个关键中枢,直接影响下游类黄酮产物的合成[16];FLS(EC1.14.11.23)是黄酮醇类化合物合成途径中最重要的下游关键酶基因,同时也是花青素和芦丁合成的一个分支[12,17];UFGT(EC 2.4.1.115)是芦丁合成途径中的最后一步关键酶,其功能为糖基化槲皮素,从而最终转化为芦丁化合物[18]。荞麦中黄酮醇合成途径关键酶基因的表达模式已有相关研究报道,赵海霞等[19]报道了种子不同萌发时间下,苦荞芽期总黄酮含量与2个MYB转录因子的相对表达量呈显著相关,同时黄酮醇合成途径中 3个关键酶CHI、PAL和FLS相对表达量也呈显著正相关;GUPTA 等[20]报道了苦荞不同生育阶段,PAL、CHS、CHI和FLS表达量与芦丁含量也呈现正相关。以上研究一定程度上揭示了苦荞植株体内芦丁含量的积聚与芦丁生物途径关键酶基因的表达具有正相关性,同时受到MYB转录因子的调控。但针对整个生长周期中苦荞植株中芦丁合成的变化趋势与相关基因的表达是否相关,目前仍需进一步探索研究。最新的研究表明,8个苦荞MYB转录因子受到ABA、NaCl、PEG等不同非生物胁迫的诱导表达,可能在苦荞次生代谢物合成中起到重要的调控作用[21]。【本研究切入点】前人已报道的苦荞MYB转录因子大多与非生物胁迫和花青素代谢调控相关,而与苦荞不同组织中关键黄酮类物质-芦丁代谢调控相关的MYB转录因子研究报道较少。【拟解决的关键问题】通过研究苦荞全生育期不同组织中芦丁含量变化趋势是否与其生物合成途径中5个关键酶基因和2个MYB转录因子表达水平相关性,以期明确2个MYB基因调控芦丁生物合成途径关键酶基因组织特异表达特征。
1 材料与方法
1.1 供试植物材料
自繁的高代纯系九江苦荞种子,2015年6月种植于山西农业大学农学院实验站。按苦荞生长时期进行取材,命名为S1—S8。具体取材时期即部位如下:S1为萌发期,即种子播种后6 d萌发的幼苗整株取材;S2为子叶期,即播种10 d后,子叶完全展开,整株取材;S3为真叶期,即播种15 d后,第一片真叶展开,取第一片真叶;S4为盛叶期,即播种35 d后,叶片大量生长,取顶端完全展开叶;S5为现蕾期,即生长45 d后,取第一批出现的幼嫩花蕾;S6为盛花期,即生长55 d后,大量花朵出现,受精的花蕾出现籽粒形态,取受精后花蕾;S7为灌浆期,即生长65 d后,大量的籽粒形成,取幼嫩籽粒;S8为成熟期,籽粒颜色由绿转灰黑,生产上为可采收阶段,取健康饱满籽粒。
1.2 总RNA提取及基因克隆
取0.1 g上述苦荞不同生育期不同组织放入预冷的研钵中,液氮研磨成粉末状,使用植物 RNA试剂盒提取各组织中RNA(天恩泽基因有限公司,北京),DNase I(宝生物大连有限公司)消化处理 1 µg总RNA,微量高精度紫外分光光度计(NanoDrop 2000,美国)检测总 RNA浓度及纯度,1.5%琼脂糖凝胶电泳检测总RNA完整度。cDNA第一链合成采用总反应体系 10 µL,其中 1 µg 总 RNA(1 µL·µg-1)、5 µL 2×PrimeScript RT Master Mix(包含 10 mmol·L-1dNTP mixture、50 µmol·L-1Oligo dT primer 和 200 U PrimeScript RTase),4 µL RNase-free超纯水补足体系。试剂购于宝生物(大连)有限公司。反转录PCR程序为37℃ 15 min;85℃ 5 s。根据苦荞转录组测序数据(未发表),设计FtMYB7和FtMYB9完整CDS区克隆引物(引物名称及序列见表1),采用RT-PCR方法从苦荞叶片 cDNA文库中克隆其序列,RT-PCR反应程序为95℃ 5 min;95℃ 30 s,55℃ 45 s,72℃ 90 s,30个循环;72℃ 5 min。样品测序由华大基因(北京)完成。
1.3 基因的结构域及系统进化分析
采用T-Coffee Multiple Sequence Alignment Server(http://tcoffee.vital-it.ch/apps/tcoffee/index.html)在线分析工具[22],分析 FtMYB7(GenBank登录号:KM588379)、FtMYB9(KM588380)、AtMYB11(NP191820)、AtMYB111(NP199744)和AtMYB12(NP182268)的保守结构域。下载 NCBI数据库(https://www.ncbi.nlm.nih.gov)中已公布的17个苦荞MYB转录因子序列和本试验提交的 2个序列,以及AtMYB11、AtMYB111和AtMYB12为外类群,共22个氨基酸序列,利用 MEGA 6.0软件,采用邻近法(neighbor-joining,NJ)构建系统进化树。
1.4 基因表达分析
设计 Ft4CL(GenBank登录号:KM362863)、FtCHS(KJ139980)、FtF3H(HM587134)、FtFLS-like(GU388434)、FtUFGT(未提交)、FtMYB7 和 FtMYB9引物(表 1),以九江苦荞的根、茎、叶、花、幼胚cDNA第一链为模板进行qRT-PCR分析,每个样品设置3个生物重复,3个技术重复。荧光定量PCR总反应体系 10 µL,包含 5 µL 2×SYBR Premix Ex Taq II、1 µL 50 ng·µL-1cDNA 模板、上下游引物各0.5 µL和3 µL RNase-free H2O。扩增程序为95℃ 30 s;95℃ 5 s,58℃ 30 s,40个循环。以内参基因FtHis(JF769134)的 Ct值作为对照,采用 2-ΔΔCt法计算基因相对表达量[12]。所用荧光定量试剂购置于宝生物(大连)有限公司。

表1 试验所用引物序列Table 1 The primer sequences
1.5 芦丁含量测定
高效液相色谱法检测苦荞不同生长时期试验材料的芦丁含量,具体测定方法参考郭彬等[3]方法。所有测定样品均设置3次生物学重复。
1.6 相关性及热图聚类分析
统计上述基因表达值和芦丁含量数据,基于SPSS软件,采用Pearson相关性分析方法,考察8个生长时期7个基因表达值与芦丁含量变化之间的线性相关性,假设t检验值设置P<0.05。使用R语言软件,将上述表达值和芦丁含量值标准化处理后,转化为矩阵,采用欧式距离法绘制层次聚类热图。
2 结果
2.1 基因序列特征分析
克隆获得FtMYB7完整CDS序列,其中包含876 bp核苷酸,编码291个氨基酸残基;FtMYB9完整CDS序列,包含912 bp核苷酸,编码303氨基酸。保守结构域(motif)分析表明FtMYB7和FtMYB9与苦荞所提交的其他MYB基因,以及 AtMYB11、AtMYB12和AtMYB111的蛋白序列中都含保守R2和R3重复基序结构域,结构域中高度保守的色氨酸(W)残基,代表着DNA结合域的关键位点(图1)。氨基酸序列同源性分析表明,FtMYB7与其他苦荞MYB转录因子氨基酸同源性范围为41%—65%,FtMYB9与其他苦荞MYB转录因子氨基酸同源性范围为42%—71%。系统进化树分析,共获得6个亚类(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ)。其中,第Ⅰ类(FtMYB7、FtMYB10、FtMYB11、FtMYB13和 FtMYB21)和第Ⅲ类(FtMYB3和FtMYB17),这些转录因子均与植物非生物胁迫相关;FtMYB9、FtMYB22、2个FtMYB1以及2个FtMYB2聚为一类,这些基因与苯丙烷类代谢调控相关(Ⅴ类);拟南芥AtMYB11、AtMYB12和AtMYB111聚为第Ⅵ类,已证实调控黄酮醇代谢;克隆获得的FtMYB9与FtMYB-like、金荞麦 FcMYB-like等序列聚为Ⅳ类,而FtMYB7单独为聚为第Ⅱ类(图2),以上结果表明获得2个新苦荞MYB转录因子。
2.2 苦荞FtMYB7和FtMYB9表达模式
FtMYB7和 FtMYB9相对表达量在整个生育期存在明显差异(图3)。FtMYB7相对表达量呈现先升高后下降趋势;在S1—S3时期,基因表达量逐步升高,S4时期(盛叶期)表达量略有下降,而到了S5时期(现蕾期),该基因相对表达量达到最高值(高达867倍),说明FtMYB7花蕾中的表达量最高;随后在花、未成熟籽粒和成熟籽粒中表达量较低。在苦荞生育期的S1和S2时期(萌发期和子叶期),FtMYB9相对表达量较高(达到34和72倍),而其他生育期基因表达量较低,说明该基因在叶中的表达量高于其他组织。

图1 FtMYB7和FtMYB9转录因子CDS结构域分析Fig. 1 Conservative structure domain analysis of FtMYB7 and FtMYB9
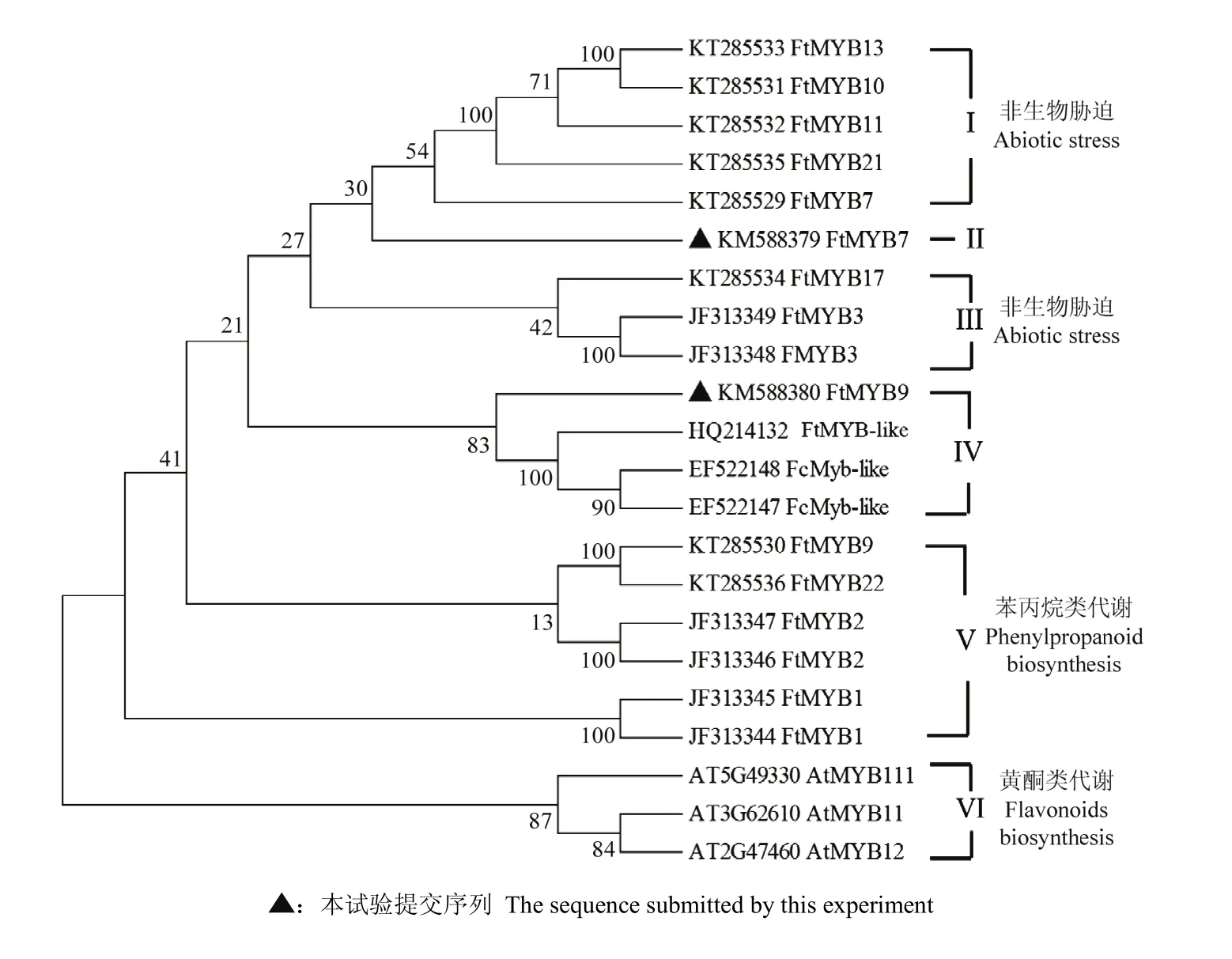
图2 苦荞FtMYB7和FtMYB9系统进化树分析Fig. 2 The phylogenetic tree of FtMYB7 and FtMYB9 and other MYBs from F. tataricum
2.3 芦丁含量与基因表达相关性分析
利用高效液相色谱法(HPLC)测定苦荞 8个生长时期组织中芦丁含量,结果表明在真叶和花蕾中芦丁含量最高,分别为7.39和12.95 mg·g-1DW;而在萌发期植株,子叶和盛花组织中芦丁含量较低,分别为2.56、1.46和1.98 mg·g-1DW;在S8时期,即成熟籽粒中,芦丁含量达到6.77 mg·g-1DW(图4)。
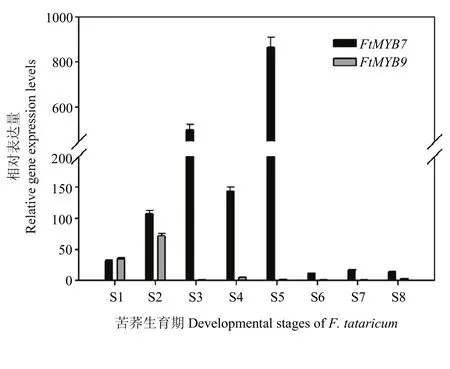
图3 苦荞全生育期期FtMYB7和FtMYB9相对表达量分析Fig. 3 FtMYB7 and FtMYB9 expression levels in 8 developmental stages of F. tataricum

图4 九江苦荞全生育期芦丁含量Fig. 4 Rutin content in Jiujian variety
芦丁生物合成途径5个关键酶基因、FtMYB7和FtMYB9表达值相关性分析见表2,FtUFGT、Ft4CL、FtCHS、FtF3H和FtMYB7的表达值与芦丁含量变化显著正相关(相关系数分别为0.890、0.748、0.683、0.704和 0.862),而 FtFLS-like和 FtMYB9表达值与芦丁含量变化显著负相关(相关系数分别为-0.442和-0.501)。基因相对表达量层次聚类分析表明,在苦荞全生育期,Ft4CL、FtCHS和FtF3H表达模式相近聚为一类;而 FtUFGT、FtMYB7、FtFLS-like和FtMYB9的表达趋势相近划分为另一类。除 FtFLS-like和FtMYB9之外,其余基因在S3和S5期相对表达值均高于其他时期,即在真叶和花蕾中表达量最高(图5)。
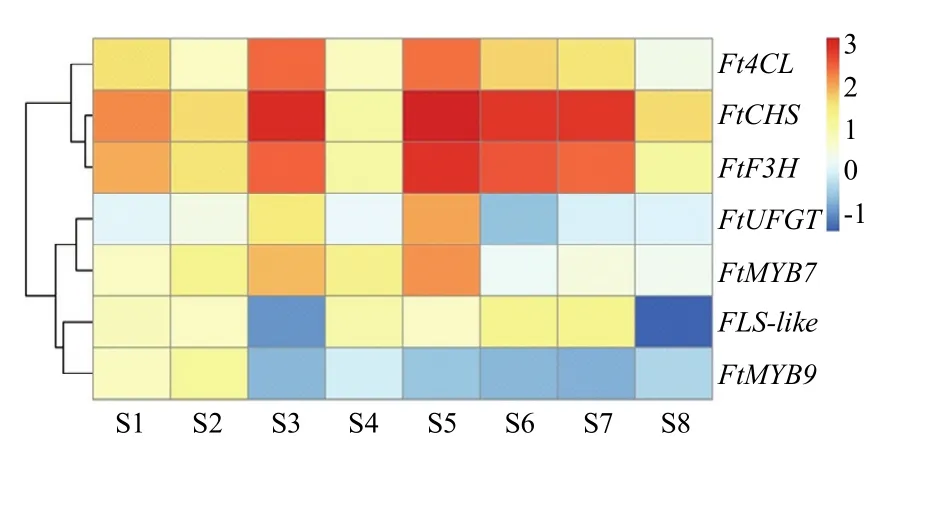
图5 苦荞芦丁合成途径相关基因表达量热图Fig. 5 Heatmap for correlated with rutin content and gene expression in F. tataricum
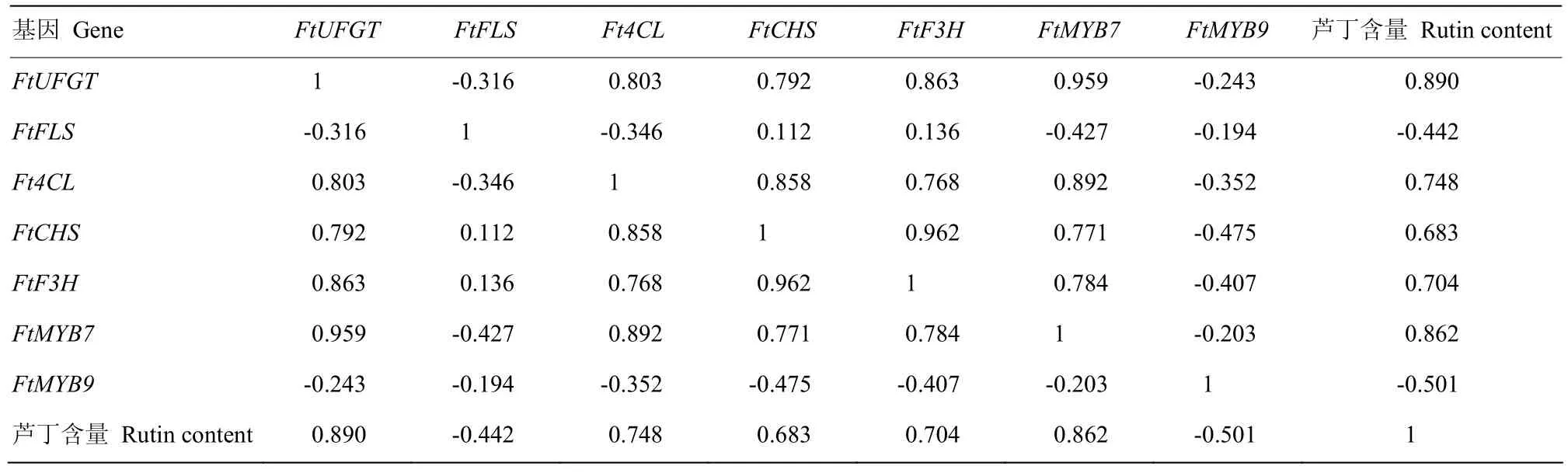
表2 芦丁生物合成途径相关基因表达量与芦丁含量相关性分析Table 2 Correlation analysis of rutin content and rutin-related gene expression
3 讨论
苦荞属于小杂粮作物,芦丁作为苦荞中特有的黄酮醇衍生物,其生物合成途径属于植物体内苯丙烷代谢途径下游分支途径之一[23]。尽管该生物合成途径上关键酶基因的研究已在许多植物中有报道[24-25],但由于苦荞以及近缘物种基因组序列信息的缺乏,导致获得这些关键酶基因的序列仍然比较困难。对于芦丁代谢的分子调控机理还有待于进一步深入研究,目前研究较多的转录因子集中在MYB和WD40两类[26-27]。本研究通过二代测序技术获得苦荞叶片转录组数据,根据原始Reads序列拼接去冗余,获得109个MYB转录因子基因序列,采用RT-PCR法获得2个MYB基因的完整CDS序列,暂命名为FtMYB7和FtMYB9。结合先前克隆到芦丁生物合成途径的 5个关键酶基因,试图探讨苦荞全生育期芦丁含量变化与这些基因表达之间的关系。GUPTA等[20]研究表明,苦荞发育阶段芦丁含量动态变化与芦丁生物合成途径上游的PAL、CHS、CHI和FLS表达量呈正相关。同样,本研究也发现全生育期中苦荞植株芦丁合成积累的动态变化与芦丁生物合成途径上游的 3个关键酶基因(Ft4CL、FtCHS和 FtF3H)表达呈正相关。与前者不同的是本研究中克隆到的FtFLS-like表达在真叶和成熟籽粒中降低,而在其他组织中都表现较高的表达趋势,且与芦丁含量的动态变化呈负相关。这可能是因为本研究中的FtFLS-like与前人克隆到FLS为同一基因家族中基因功能发生了分化,负责苦荞植株不同生长时期的芦丁生物合成功能[12]。同时,芦丁合成途径最后一步关键酶UFGT和MYB7表达与芦丁含量动态变化也呈正相关,同样有2个表达量最高的时期,分别是在S3和S5期,即真叶期和现蕾期。而MYB9与其他基因的表达模式具有明显差异,仅在S1和S2期(幼苗期)表达上调。上述结果表明,MYB7和MYB9可能负责调控苦荞不同生长时期的芦丁合成。综上所述,除MYB9以外,其他5个关键酶基因和MYB7均在真叶期和现蕾期有表达峰值。而真叶期为种子萌发转到营养生长期,现蕾期为营养生长转向生殖生长期。这2个时期均属于苦荞生长发育的转折时期,此时芦丁含量增加以及合成途径上关键酶基因上调表达可能是由于植株叶形态和花形态建成过程中受到体内激素极性运输和调节,导致黄酮类物质大量合成。而最近的研究也表明,拟南芥中WRKY23转录因子调节黄酮醇类物质的合成反馈抑制根部生长素的转运最终调控根发育形成[28]。拟南芥中AtMYB11、AtMYB12和 AtMYB111负责调控幼苗和成株期中黄酮醇类衍生物合成类型和合成途径关键酶基因的表达[29]。前人研究表明FtMYB1和FtMYB2参与调控原花青素(PAs);FtMYB9和FtMYB22调控苦荞对盐胁迫响应[30]。本研究所克隆的FtMYB9与前人克隆的FtMYB-like聚为一类,这类基因并没有明确的功能划分,推测FtMYB9可能负责调控花青素或者非生物胁迫响应的下游基因,也间接解释了该基因与全生育期苦荞芦丁合成呈负相关性的结果。MYB转录因子调控苦荞黄酮醇合成关键酶基因表达及芦丁合成不同生长时期和组织部位的分子机制仍比较复杂,尚需进一步深入研究。
4 结论
揭示了 2个 MYB类转录因子基因 FtMYB7和FtMYB9序列具有保守的R2R3结构域特征,明显区别于前人所克隆到的苦荞MYB基因。这2个基因可能与黄酮类代谢功能相关。不同组织中 FtMYB7和FtMYB9表达量与芦丁含量存在明显相关性,推测其可能调控不同生育时期芦丁合成。
[1]KITABAYASHI H, UJIHARA A, HIROSE T, MINAMI M. On the genotypic differences for rutin content in tatary buckwheat,Fagopyrum tataricum. Gaertn. Breeding Science, 1995, 45(2):189-194.
[2]KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways.Trends in Plant Science, 2005, 10(5): 236-242.
[3]郭彬, 韩渊怀, 黄可盛, 路阳, 侯思宇. HPLC法测定30个荞麦品种芦丁含量的研究. 山西农业科学, 2013, 41(1): 26-29.GUO B, HAN Y H, HUANG K S, LU Y, HOU S Y. Researched on rutin contents among 30 buckwheat cultivars by HPLC. Journal of Shanxi Agricultural Sciences, 2013, 41(1): 26-29. (in Chinese)
[4]CHEN Y H, YANG X Y, HE K, LIU M H, LI J G, GAO Z F, LIU Z Q,ZHANG Y F, WANG X X, QIU X M, SHEN Y P, ZHANG L, DENG X H, LUO J C, DENG X W, CHEN Z L, GU H Y, QU L J. The MYB transcription factor superfamily of Arabidopsis: Expression analysis and phylogenetic comparison with the rice MYB family. Plant Molecular Biology, 2006, 60(1): 107-124.
[5]WANG Z, TANG J, HU R, WU P, HOU X L, SONG X M, XIONG A S. Genome-wide analysis of the R2R3-MYB transcription factor genes in Chinese cabbage (Brassica rapassp.pekinensis) reveals their stress and hormone responsive patterns. BMC Genomics, 2015,16: 17.
[6]DUBOS C, STRACKE R, GROTEWOLD E, WEISSHAAR B,MARTIN C, LEPINIEC L. MYB transcription factors in Arabidopsis.Trends in Plant Science, 2010, 15(10): 573-581.
[7]KATIYAR A, SMITA S, LENKA S K, RAJWANSHI R,CHINNUSAMY V, BANSAL K C. Genome-wide classification and expression analysis of MYB transcription factor families in rice and Arabidopsis. BMC Genomics, 2012, 13: 544.
[8]STRACKE R, WERBER M, WEISSHAAR B. The R2R3-MYB gene family in Arabidopsis thaliana. Current Opinion in Plant Biology,2001, 4(5): 447-456.
[9]FALCONE M L, RIUS S P, CASATI P. Flavonoids: Biosynthesis,biological functions, and biotechnological applications. Frontiers in Plant Science, 2012, 3: 222.
[10]XIE R J, LI Y J, HE S L, ZHENG Y Q, YI S L, LÜ Q, DENG L.Genome-wide analysis of Citrus R2R3MYB genes and their spatiotemporal expression under stresses and hormone treatments.PLoS ONE, 2014, 9(12): e113971.
[11]CZEMMEL S, STRACKE R, WEISSHAAR B, CORDON N,HARRIS N N, WALKER A R, ROBINSON S P, BOGS J. The grapevine R2R3-MYB transcription factor VvMYBF1 regulates flavonol synthesis in developing grape berries. Plant Physiology, 2009,151(3): 1513-1530.
[12]SUN Z X, HOU S Y, YANG W D, HAN Y H. Exogenous application of salicylic acid enhanced the rutin accumulation and influenced the expression patterns of rutin biosynthesis related genes in Fagopyrum tataricum Gaertn leaves. Plant Growth Regulation, 2012,68(1): 9-15.
[13]SCHIJLEN E G, DE VOS C H, MARTENS S, JONKER H H, ROSIN F M, MOLTHOFF J W, TIKUNOV Y M, ANGENENT G C, VAN TUNEN A J, BOVY A G. RNA interference silencing of chalcone synthase, the first step in the flavonoid biosynthesis pathway, leads to parthenocarpic tomato fruits. Plant Physiology, 2007, 144(3):1520-1530.
[14]孙朝霞, 侯思宇, 郭彬, 令狐斌, 黄可盛, 许冬梅, 韩渊怀. 苦荞查尔酮合成酶基因序列特征及分子进化分析. 分子植物育种, 2014,12(4): 772-779.SUN Z X, HOU S Y, GUO B, LINGHU B, HUANG K S, XU D M,HAN Y H. Sequence characterization and molecular evolution analysis of chalcone synthase gene in tartary buckwheat. Molecular Plant Breeding, 2014, 12(4): 772-779. (in Chinese)
[15]侯思宇, 赵盖超, 刘荣华, 孙朝霞, 令狐斌, 韩渊怀, 许冬梅, 李红英. 苦荞Ft4CL基因克隆、生物信息学及分子进化分析. 山西农业大学学报(自然科学版), 2015, 35(1): 24-28.HOU S Y, ZHAO G C, LIU R H, SUN Z X, LINGHU B, HAN Y H,XU D M, LI H Y. Cloning, bioinformatics and molecular evolution analysis of Ft4CL gene in tartary buckwheat. Journal of Shanxi Agricultural University (Natural Science Edition), 2015, 35(1): 24-28.(in Chinese)
[16]TU Y H, LIU F, GUO D D, FAN L J, ZHU Z X, XUE Y R, GAO Y,GUO M L. Molecular characterization of flavanone 3-hydroxylase gene and flavonoid accumulation in two chemotyped safflower lines in response to methyl jasmonate stimulation. BMC Plant Biology,2016, 16(1): 132.
[17]OWENS D K, ALERDING A B, CROSBY K C, BANDARA A B,WESTWOOD J H, WINKEL B S. Functional analysis of a predicted flavonol synthase gene family in Arabidopsis. Plant Physiology, 2008,147(3): 1046-1061.
[18]ZHAO Z C, HU G B, HU F C, WANG H C, YANG Z Y, LAI B. The UDP glucose: flavonoid-3-O-glucosyltransferase (UFGT) gene regulates anthocyanin biosynthesis in litchi (Litchi chinesis Sonn.)during fruit coloration. Molecular Biology Reports, 2012, 39(6):6409-6415.
[19]赵海霞, 吴小峰, 白悦辰, 李成磊, 陈惠, 邵继荣, 吴琦. 苦荞芽期黄酮合成关键酶和MYB转录因子基因的表达分析. 农业生物技术学报, 2012, 20(2): 121-128.ZHAO H X, WU X F, BAI Y C, LI C L, CHEN H, SHAO J R, WU Q.Gene expression analysis of key enzymes and MYB transcription factors in flavonoid biosynthesis pathway during germination of Fagopyrum tataricum. Journal of Agricultural Biotechnology, 2012,20(2): 121-128. (in Chinese)
[20]GUPTA N, SHARMA S K, RANA J C, CHAUHAN R S. Expression of flavonoid biosynthesis genes vis-à-vis rutin content variation in different growth stages of Fagopyrum species. Jounral of Plant Physiology, 2011, 168(17): 2117-2123.
[21]GAO F, YAO H P, ZHAO H X, ZHOU J, LUO X P, HUANG Y J, LI C L, CHEN H, WU Q. Tartary buckwheat FtMYB10 encodes an R2R3-MYB transcription factor that acts as a novel negative regulator of salt and drought response in transgenic Arabidopsis. Plant Physiology and Biochemistry, 2016, 109: 387-396.
[22]NOTREDAME C, HIGGINS D G, HERINGA J. T-Coffee: A novel method for fast and accurate multiple sequence alignment. Journal ofMolecular Biology, 2000, 302(1): 205-217.
[23]LI X H, NAMIL P, CHULHO P, SU K, LEE Y, PARK S. Influence of sucrose on rutin content and flavonoid biosynthetic genes expression in seedlings of common buckwheat (Fagopyrum esculentum Moench).Plant Omics Journal, 2011, 4(4): 215-219.
[24]KOES R, VERWEIJ W, QUATTROCCHIO F. Flavonoids: A colorful model for the regulation and evolution of biochemical pathways.Trends in Plant Science, 2005, 10(5): 236.
[25]ZHAO S, PARK C H, LI X, KIM Y B, YANG J, SUNG G B, PARK N I, KIM S, PARK S U. Accumulation of rutin and betulinic acid and expression of phenylpropanoid and triterpenoid biosynthetic genes in mulberry (Morus alba L.). Journal of Agricultural & Food Chemistry,2015, 63(38): 8622.
[26]FERREYRA M L F, RIUS S P, CASATI P. Flavonoids: Biosynthesis,biological functions, and biotechnological applications. Frontiers in Plant Science, 2012, 3: 222.
[27]YAO P, ZHAO H, LUO X, GAO F, LI C, YAO H, CHEN H, PARK S U, WU Q. Fagopyrum tataricum FtWD40, functions as a positive regulator of anthocyanin biosynthesis in transgenic tobacco. Journal of Plant Growth Regulation, 2017, 36(3): 755-765.
[28]GRUNEWALD W, DE SMET I, LEWIS D R, LÖFKE C, JANSEN L, GOEMINNE G, VANDEN B R, KARIMI M, DE RYBEL B,VANHOLME B, TEICHMANN T, BOERJAN W, VAN MONTAGU M C, GHEYSEN G, MUDAY G K, FRIML J,BEECKMAN T. Transcription factor WRKY23 assists auxin distribution patterns during Arabidopsis root development through local control on flavonol biosynthesis. Proceedings of the National Academy of Sciences of the United States of America,2012, 109(5): 1554-1559.
[29]STRACKE R, JAHNS O, KECK M, TOHGE T, NIEHAUS K,FERNIE A R, WEISSHAAR B. Analysis of PRODUCTION OF FLAVONOL GLYCOSIDES-dependent flavonol glycoside accumulation in Arabidopsis thaliana plants reveals MYB11, MYB12 and MYB111 independent flavonol glycoside accumulation. New Phytologist, 2010,188(4): 985-1000.
[30]BAI Y C, LI C L, ZHANG J W, LI S J, LUO X P, YAO H P, CHEN H,ZHAO H X, PARK S U, WU Q. Characterization of two tartary buckwheat R2R3-MYB transcription factors and their regulation of proanthocyanidin biosynthesis. Physiology Plant, 2014, 152(3):431-440.
(责任编辑 李莉,岳梅)
Correlation Analysis on Rutin Accumulation and Gene Expression of Rutin Synthetic Enzymes and MYBs in the Whole Developmental Stage of Fagopyrum tataricum
SUN ZhaoXia, HOU SiYu, LINGHU Bin, LIU RongHua, WANG Li, YANG WuDe, HAN YuanHuai
(College of Agronomy, Shanxi Agricultural University, Taigu 030801, Shanxi)
2017-03-07;接受日期:2017-05-03
国家自然科学基金(31301385)、山西省科技攻关项目(20150311007-1)、山西省回国留学人员科研项目(2017-069)、山西省主要农作物种质创新与分子育种重点科技创新平台(2016-246)
联系方式:孙朝霞,E-mail:18636071356@163.com。通信作者杨武德,E-mail:sxauywd@126.com

