复合抗原ESAT-6/CFP-10/Rv3615cELISPOT辅助诊断活动性肺结核的应用价值*
史会影,刘振华,占卫红,雷 航,王 琳,梁瑞霞,任伟宏,汤兵祥#
1)郑州大学第一附属医院呼吸内科 郑州 450052 2)复旦大学附属闵行中心医院检验科 上海201100 3)上海交通大学基础医学院病原生物学教研室 上海 200025 4)复旦大学附属公共卫生临床中心 上海 200540 5)河南省胸科医院呼吸内科 郑州 450008 6)河南中医药大学第一附属医院检验科 郑州 450008
复合抗原ESAT-6/CFP-10/Rv3615cELISPOT辅助诊断活动性肺结核的应用价值*
史会影1),刘振华2),占卫红3),雷 航3),王 琳4),梁瑞霞5),任伟宏6),汤兵祥5)#
1)郑州大学第一附属医院呼吸内科 郑州 450052 2)复旦大学附属闵行中心医院检验科 上海201100 3)上海交通大学基础医学院病原生物学教研室 上海 200025 4)复旦大学附属公共卫生临床中心 上海 200540 5)河南省胸科医院呼吸内科 郑州 450008 6)河南中医药大学第一附属医院检验科 郑州 450008
肺结核;ESAT-6;CFP-10;Rv3615c
目的:评估结核分枝杆菌复合抗原ESAT-6/CFP-10/Rv3615c在活动性肺结核诊断中的应用价值。方法选取肺结核病患者78例,非结核性肺部疾病患者27例和健康体检者39例,分别用复合抗原ESAT-6/CFP-10/Rv3615c、ESAT-6肽段库和CFP-10肽段库作为抗原刺激单个核淋巴细胞(PBMCs),采用酶联免疫斑点试验检测斑点形成细胞数,判断肺结核感染情况。结果复合抗原ESAT-6/CFP-10/Rv3615c、ESAT-6肽段库和CFP-10肽段库检测结核分枝杆菌感染的敏感性依次为87.2%(68/78)、80.8%(63/78)、76.9%(60/78),特异性依次为81.8%(54/66)、84.8%(56/66)、87.9%(58/66)。结论复合抗原ESAT-6 /CFP-10 /Rv3615c有较高的敏感性和特异性,对活动性肺结核的辅助诊断有一定的临床应用价值。
结核病(TB)是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起的慢性传染病,主要通过呼吸道传播。全身各个脏器均能引起结核感染,其中以肺部感染最为常见。目前TB仍是严重威胁人类健康的传染病。2015年全球新增TB病例1 040万,死亡180万,但仅有610万人明确诊断[1]。因此早期快速诊断MTB感染是控制和预防TB的关键。目前的TB诊断方法仍不能满足早期快速诊断的需要。由于MTB是一种胞内寄生菌,因此,血清中的抗体很难进入细胞内对其进行杀灭;机体抗结核感染需T淋巴细胞介导的细胞免疫参与,细胞介导的免疫反应是机体对结核感染防御的主要免疫机制[2]。2011年,Millington等[3]发现Rv3615c在细胞免疫中发挥重要作用,能够产生与传统用于MTB感染检测的ESAT-6、CFP-10抗原相当水平的T细胞免疫反应。因此,该研究采用MTB重组抗原ESAT-6/CFP-10/Rv3615c(E/C/R)进行酶联免疫斑点实验(ELISPOT),检测产生γ干扰素效应T淋巴细胞的数量,判断结核菌的感染情况,并与结核菌特异性抗原ESAT-6、CFP-10进行比较,探讨其对活动性肺结核的辅助诊断价值。
1 对象与方法
1.1研究对象肺结核组为河南省胸科医院的住院患者,共78例,其中菌阳33例,菌阴45 例;年龄18~78(41.8±17.4)岁;女23例,男55例。非结核性肺部疾病组(简称肺部疾病组)为河南省胸科医院住院患者,共27例,其中肺炎15 例,肺癌9 例,支气管囊肿1例,支气管扩张2例,年龄28~84(43.3±16.5)。健康对照组为在复旦大学附属闵行中心医院进行健康体检的健康人,共39例,年龄18~51(30.3±7.1岁)。肺结核组入选标准参照2001年中华医学会结核病分会肺结核诊断标准[4]。(1)菌阳肺结核:痰抗酸杆菌涂片连续2次(+),或1次(),或1次培养阳性。(2)菌阴肺结核(痰抗酸杆菌涂片3次阴性及1次培养阴性):①典型肺结核临床症状和胸部X线表现。②抗结核治疗有效。③临床可排除其他非结核性肺部疾患。④PPD强阳性;血清抗结核抗体阳性。⑤痰结核菌PCR+ 探针检测呈阳性。⑥肺外组织病理证实结核病变。⑦BALF检出抗酸分枝杆菌。⑧支气管或肺部组织病理证实结核病变,具备①~⑥项中3项或⑦、⑧项中任何1项可确诊。所有患者无 HIV 感染,无糖尿病、肝炎等并发症,无严重的肝、肾功能障碍,均有 BCG 接种史,抗结核治疗时间小于2周。
1.2主要仪器和试剂96孔ELISPOT板购自美国Millipore公司,植物凝集素(PHA)、ESAT-6肽段库、CFP-10肽段库购自深圳达科为生物技术有限公司,人IFN-γ ELISPOT 检测试剂盒购自美国eBioScience公司;二级生物安全柜(力新仪器上海有限公司),CO2培养箱(HERACELL 150i),BioReader4000型酶联斑点分析仪(德国Biosys GmbH公司),复合抗原E/C/R由北京旷博生物科技有限公司提供。
1.3外周血单个核淋巴细胞的分离和计数采集5 mL外周血标本于肝素钠抗凝的真空采血管内,血标本注入管内后,立即轻轻颠倒5次,充分混匀。在抗凝血中加入RPMI 1640培养基进行稀释混匀。新的离心管中加入一定体积的Ficoll淋巴细胞分离液,然后将稀释后的血样轻轻地平铺到分离液液面上方(分离液抗凝血RPMI 1640=111,体积比);放入离心机,18 ℃、800g离心20 min;离心结束后用吸管吸取白色云雾状外周血单核细胞(peripheral blood mononuclear cells,PBMCs)层至另一15 mL无菌尖底离心管中,加入RPMI 1640培养基至10 mL,18 ℃、800g离心10 min;弃上清,重悬后加入7 mL RPMI 1640培养基,700g离心10 min;弃上清,加0.5 mL AIM-V培养基重悬,吸取10 μL,使用台盼蓝染色显微镜下计数,根据计数结果调整细胞悬液密度为2.5×106mL-1。
1.4IFN-γ释放水平的ELISPOT检测在无包被的96孔ELISPOT板中加入稀释后的捕获单克隆抗体,4 ℃过夜。加入含体积分数10%胎牛血清(FBS)的RPMI 1640培养基室温封闭1 h;每孔加入细胞密度2.5×106mL-1PBMCs悬液,阴性对照孔加入100 μL AIM-V培养基,阳性对照孔加入100 μL植物血凝素,实验孔分别加入ESAT-6、CFP-10及复合抗原E/C/R,终质量浓度均为10 mg/L。样品加完后,放入37 ℃、体积分数5% CO2培养箱中孵育18~24 h。加入100 μL稀释后的检测抗体,室温孵育2 h。洗板,加入100 μL酶结合物液,室温孵育45 min。洗板,每孔加入100 μL显色底物AEC,室温避光孵育15 min,弃显色液,用去离子水终止反应。反应板置于背光、通风良好干燥的环境中;应用Biosys GmbH公司的BioReader 4000型酶联免疫斑点分析仪计数斑点。结果判定标准:当阴性对照孔内斑点数<10并且对照孔内斑点数>20时视为实验有效,空白对照孔斑点数为0~5个,任何一个检测孔斑点数减去空白对照孔斑点数≥6;空白对照孔斑点数为6~10个,且检测孔斑点数≥2倍空白对照孔斑点数,以上两种情况均判定为阳性,如果不符合上述标准且阳性质控孔正常时检测结果为阴性。采用E/C/R、ESAT- 6、CFP- 10作为结核分枝杆菌抗原刺激每个受检者的PBMCs分泌IFN-γ,同时设定阴性对照及阳性对照进行质控,实验孔的SFCs依照上述“结果判定标准”进行分析。
1.5统计学处理采用SPSS 19.0进行分析,散点图绘制采用GraphPad Prism 5。应用校正χ2检验比较E/C/R与ESAT-6、CFP-10的EILSPOT阳性率的差异,应用Mann-WhitneyU检验比较两组间斑点形成细胞数(spot forming cells,SFCs)的差异,检验水准α=0.05。
2 结果
2.1肺结核组和对照组ELISPOT斑点形成结果见图1。

A、F:阴性对照;B、G:阳性;C、H:ESAT- 6;D、I:CFP- 10;E、J:E/C/R。 图1 健康对照组(A~E)与肺结核组(F~J)ELISPOT结果
2.2复合抗原E/C/R与ESAT-6、CFP-10的ELISPOT结果比较复合抗原E/C/R和ESAT-6、CFP-10检测肺结核病患者、肺部疾病患者及健康对照组的结核菌抗原阳性率见表1,正常对照组与肺部疾病组2组间差异无统计学意义,而肺结核组结核菌抗原阳性率均高于肺部疾病组和正常对照组,复合抗原E/C/R和ESAT-6、CFP-10敏感性分别为87.2%(68/78)、80.8%(63/78)、76.9%(60/78);特异性分别为81.8%(54/66)、84.8%(56/66)、87.9%(58/66)。
表1复合抗原E/C/R、ESAT-6
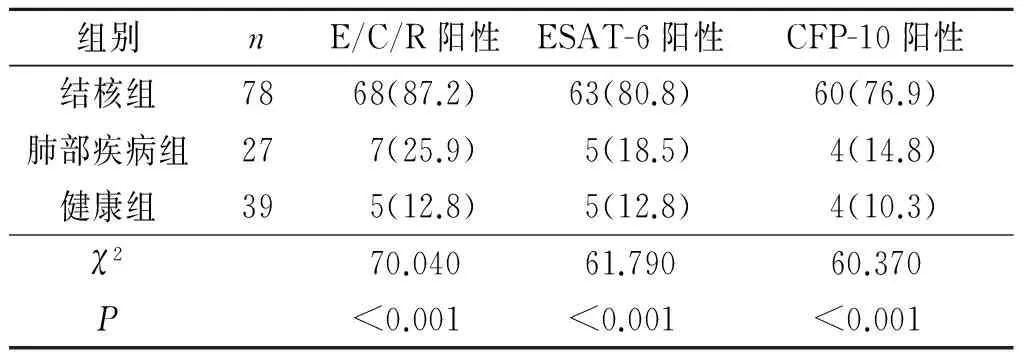
和CFP-10的ELISPOT诊断结果比较例(%)
2.3复合抗原E/C/R作用后3组受试者分泌IFN-γT淋巴细胞应答水平比较结果见图2。复合抗原E/C/R在肺结核组的SFC数均高于健康组及肺部疾病组(U=283.000、217.500,P均<0.001),肺部疾病组与健康组的SFC数比较差异无统计学意义(U=398.000,P=0.082)。
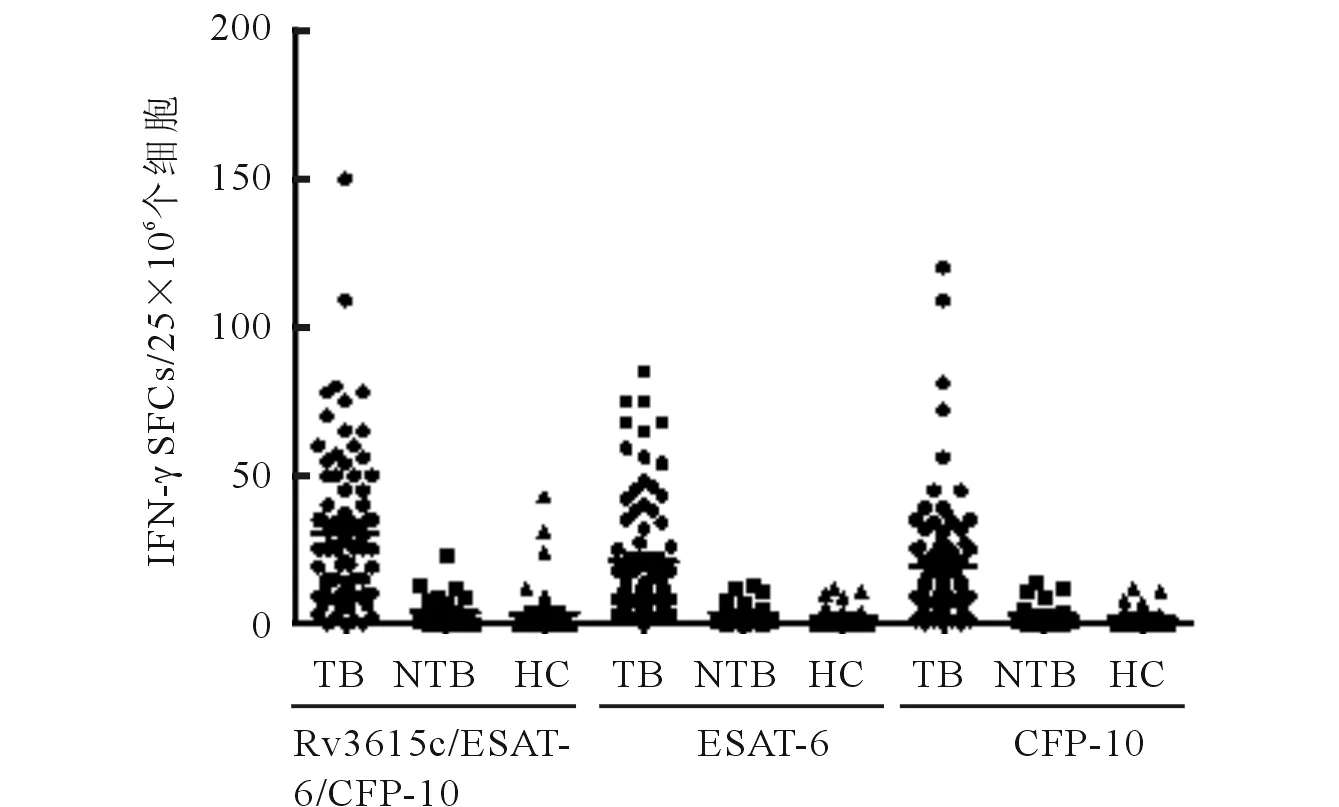
图2 不同抗原在结核组、非结核性 肺部疾病组和健康对照组间SFCs形成数量的比较
2.4 3个抗原分别检测菌阳和菌阴肺结核组的结果见表2。

表2 E/C/R、ESAT-6、CFP-10分别在菌阳和菌阴肺结核中的检测结果 例(%)
3 讨论
前期该课题组用血清学评估出一个敏感性和特异性都较高的M.tuberculosisRD5区的特异性抗原Rv3117,证实DDA/MPL佐剂具有提高免疫BCG小鼠的体液免疫和细胞免疫的作用[5-7];同时通过ELISA实验对重组蛋白Rv0315进行初步的血清学抗原活性评价[8],显示Rv0315具有一定的血清学诊断价值,其后分别采用MTB重组蛋白Rv0315及E/C/R进行ELISPOT试验,探讨基于Rv0315及E/C/R抗原的ELISPOT对活动性肺结核病的辅助诊断价值[9-10]。2011年有学者[3]报道Rv3615c是一个高度依赖结核分枝杆菌基因组RD1区免疫调控的分泌抗原,非RD1区编码,与CFP-10和ESAT-6大小相近及序列具有同源性,包含了多个肽段的集合体,可以提高检测的灵敏度,该研究将3种复合抗原作为结核分枝杆菌刺激抗原,评估其在细胞免疫诊断价值。
建立在细胞免疫基础上的γ干扰素释放实验(IFN-gamma release assays,IGRAs)近年来得到了迅速发展,目前商品化的IGRA共有2种:QuantiFERON-TB(CellestisLtd,Australia)及T-SPOT.TB(Oxford Immunotec,UK),这些实验都是用MTB RD1区域编码的早期分泌抗原靶蛋白(early secreting antigen target 6kd,ESAT-6)和培养滤液蛋白(culture filtrate protein 10kd,CFP10)作为检测刺激抗原,通过IFN-γ释放水平,间接检测MTB感染。相比结核菌素皮肤试验(TST)所应用的抗原——纯化蛋白衍生物(PPD),这些抗原具有更高的特异性,王晓艳等[11]对985例结核病患者同时进行PPD皮肤测试和ELISA法定量检测血清IFN-γ的含量,对其结果进行回顾性分析,TB-IGRA的敏感性和特异性(88.4%、90.8%)显著高于PPD(77.3%、56.7%)。但现有的IGRAs仍然存在诸多不足,限制了其在结核病诊断中的应用,主要集中在敏感性仍然有待提高,特别是在使用免疫抑制剂、吸烟、淋巴细胞减少症患者容易出现假阴性结果[12-14]。为了改进现有的IGRA诊断技术,采用增加MTB特异性抗原的方法来提高肺结核诊断的敏感性和特异性。因为任何单一或两个MTB特异性抗原多肽不足以覆盖MTB引起T淋巴细胞免疫应答的所有表位,采用多种特异性抗原联合可以提高敏感性。因此寻找用于诊断的新型抗原标志物就显得尤为重要。
该研究结果显示,肺结核组3种蛋白的T淋巴细胞反应均高于健康组及肺部疾病组。为了评价非结核感染是否会影响抗原的特异性免疫反应,作者比较了肺部疾病组与健康组抗原特异性T细胞反应,结果显示3种抗原差异均无统计学意义。以上结果表明非特异性免疫刺激对E/C/R、ESAT-6、CFP-10抗原的细胞免疫反应无影响。
复合抗原E/C/R的ELISPOT阳性率明显高于ESAT-6、CFP-10,表明Rv3615c在结核病的细胞学诊断中发挥了重要的作用;其特异性略低于ESAT-6、CFP-10,说明该抗原在提高敏感性的同时不可避免地会引起特异性的下降,可能与Rv3615c存在一些非特异性表位有关。Qiu等[15]研究发现,以细菌学诊断为金标准,应用Rv3615c、ESAT-6和CFP-10 3抗原组成的肽库与T-SPOT.TB及TB-IGRA相比较,其敏感度及特异度(86.2%,87.2%)高于TB-IGRA(83.9%,88.6%),稍低于T-SPOT.TB(89.7%,91.1%),差异无统计学意义,作者的研究结果与该研究结果相似。因此,应用Rv3615c、ESAT-6、CFP-10抗原组合能够有效地提高结核菌感染的检出率,但当合并其他疾病时(尤其是免疫抑制性疾病)可能产生较高的假阴性,需慎重考虑。作者对菌阳及菌阴肺结核病患者结核特异抗原的阳性率分析表明,痰菌阳性与阴性结核病患者的阳性率差异无统计学意义。由于临床上存在大量的痰菌阴性的TB患者,因此不依赖病原菌检测,对痰菌阴性的肺结核具有重要的诊断价值。
综上所述,复合抗原E/C/R在肺结核的细胞免疫学诊断中具有较高的敏感性和特异性,对肺结核具有重要的辅助诊断价值。
[1] ANSUMANA R,KEITELL S,ROBERTS GM,et al.Impact of infectious disease epidemics on tuberculosis diagnostic,management,and preventionservices:experiences and lessons from the 2014-2015 Ebola virus disease outbreak in West Africa[J].Int J Infect Dis,2017,56:101
[2] DHAR N, RAO V, TYAGI AK. Skewing of the Th1/Th2 responses in mice due to variation in the level of expression of an antigen in a recombinant BCG system[J].Immunol Lett,2003,88(3):175
[3] MILLINGTON KA,FORTUNE SM,LOW J,et al.Rv3615c is a highly immunodominant RD1 (region of difference 1)-dependent secreted antigen specific for Mycobacterium tuberculosis infection[J].Proc Natl Acad Sci USA,2011,108(14):5730
[4] 中华医学会结核病学分会.肺结核诊断和治疗指南[J].中国实用乡村医生杂志,2013,20(2):7
[5] ZHANG MM,ZHAO JW,SUN ZQ,etal.Identification of RD5-encoded mycobacterium tuberculosis proteins as B-cell antigens used for serodiagnosis of tuberculosis[J].Clin Dev Immunol,2012,2012:738043
[6] 叶娟,高孟哲,张舒林,等.结核分枝杆菌新型抗原Rv3117联合DDA/MPL佐剂作为亚单位疫苗在小鼠体内的免疫评估[J].上海交通大学学报(医学版),2015,35(1):1
[7] 汤俊明,陈翠翠,王学才,等.结核分枝杆菌特异性抗原 Rv3117的克隆表达和诱导小鼠免疫应答的实验研究[J].上海交通大学学报(医学版),2012,32(11):1444
[8] 陈芳芳,周业成,赵静,等.结核分枝杆菌蛋白Rv0315的克隆表达及其抗原性研究[J].中国热带医学,2012,12(10):1172
[9] 周业成,陈翠翠,叶娟,等.结核分枝杆菌Rv0315重组蛋白ELISPOT辅助诊断活动性肺结核的应用价值[J].上海交通大学学报(医学版),2013,33(7):970
[10]陈翠翠,叶娟,赵军伟,等.复合抗原ESAT-6/CFP-10/Rv0315在活动性肺结核辅助诊断中的价值[J].郑州大学学报(医学版),2014,49(2):211
[11]王晓艳,刘慧,朱俊,等.TB-IGRA检测在结核病诊断中的价值[J].临床肺科杂志,2014,19(5):944
[12]JEON YL, NAM YS,YOU E, et al.Factors influencing discordant results of the QuantiFERON-TB Gold in-tube test in patients with active TB[J].J Infect,2013,67(4):288
[13]HANG NT, LIEN LT, KOBAYASHI N, et al.Analysis of factors lowering sensitivity of interferon-γ release assay for tuberculosis[J].PLoS One,2011,6(8):e23806.
[14]Pan L, Jia H, Liu F, et al. False negative results of QuantiFERON TN-TB Gold in-tube test in active tuerculosis[J].Tuberc Respir Dis, 2012, 72(5):416
[15]QIU Y,WANG Y,LIN N,et al.Multicenter clinical evaluation of three commercial reagent kits based on the interferon-gamma release assay for the rapiddiagnosis of tuberculosis in China[J].Int J Infect Dis,2015,40:108
(2016-11-24收稿 责任编辑赵秋民)
Diagnositc value of ELISPOT by multiple antigens in detection of active pulmonary tuberculosis
SHIHuiying1),LIUZhenhua2),ZHANWeihong3),LEIHang3),WANGLin4),LIANGRuixia5),RENWeihong6),TANGBingxiang5)
1)DepartmentofRespiratoryMedicine,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofClinicalLaboratory,MinhangCentralHospital,FudanUniversity,Shanghai201100 3)DepartmentofPathogenicBiology,CollegeofBasicMedicalSciences,ShanghaiJiaotongUniversity,Shanghai200025 4)ClinicalCenterofPublicHealth,FudanUniversity,Shanghai200540 5)DepartmentofRespiratoryMedicine,HenanChestHospital,Zhengzhou450008 6)DepartmentofClinicalLaboratory,theFirstAffiliatedHospital,HenanUniversityofTraditionalChineseMedicine,Zhengzhou450008
pulmonary tuberculosis;ESAT-6;CFP-10;Rv3615c
Aim: To evaluate the value of mycobacterium tuberculosis composite antigen ESAT-6/CFP-10/Rv3615c in the diagnosis of active pulmonary tuberculosis. Methods: Seventy-eight patients with pulmonary tuberculosis, 27 patients with non-tuberculous lung disease and 39 healthy control were selected. The peripheral blood mononuclear cells (PBMCs) were stimulated with the composite antigen ESAT-6/CFP-10/Rv3615c, ESAT-6 peptide or CFP-10 peptide. SFCs was detected by ELISPOT to determine the situation of tuberculosis infection. Results: The sensitivities of mycobacterium tuberculosis infection detected by the composite antigen ESAT-6/CFP-10/Rv3615c, ESAT-6 peptide and CFP-10 peptide were 87.2%(68/78), 80.8%(63/78), 76.9%(60/78) , respectively, and the specificities were 81.8%(54/66), 84.8%(56/66) and 87.9%(58/66) , respectively. Conclusion: The complex antigen ESAT-6/CFP-10/Rv3615c has high sensitivity and specificity, and is of certain clinical value for the auxiliary diagnosis of active pulmonary tuberculosis.
10.13705/j.issn.1671-6825.2017.05.028
*“十二·五”国家科技重大专项 2013ZX10003002-005;国家自然科学基金 81271794;河南省卫生厅科技攻关项目 201204110
R521
#通信作者,男,1956年4月生,硕士,主任医师,研究方向:呼吸系统疾病基础及临床,E-mail:tangbingxiang01@sina.com

