大黄酸酯类衍生物的合成及体外抗肿瘤活性研究*
黄新炜
(西安文理学院 化学工程学院,陕西 西安 710065)
大黄酸酯类衍生物的合成及体外抗肿瘤活性研究*
黄新炜
(西安文理学院 化学工程学院,陕西 西安 710065)
以天然产物大黄酸为先导化合物,通过酯化反应合成了10个大黄酸酯类衍生物,对于位阻较小的醇以SOCl2作催化剂,合成了大黄酸甲酯、乙酯和正丁酯;对于位阻较大的醇以DCC作脱水剂、DMAP作催化剂,合成了大黄酸异丙酯、异丁酯、异戊酯、苄酯、2-苯乙醇酯、2-氯乙醇酯,并通过熔点、IR和1H NMR对目标产物的结构进行了表征,其中5个化合物未见文献报道。通过MTT法对部分目标产物抑制人宫颈癌细胞Hela活性进行了体外评价,结果表明:化合物2对Hela具有较高的抑制活性,在浓度为100μg·mL-1时抑制率为70%。
大黄酸;酯化;合成;抗肿瘤活性
1844年,Schossberger等首次从中药大黄中提取纯化出大黄酸,其分子式为C15H8O6,分子量为284.21,黄色针状结晶,熔点 321~322℃,330℃分解,几乎不溶于水,可溶于碱性水溶液和吡啶。大黄酸属于单蒽核类1,8-二羟基蒽醌衍生物,是中药大黄、何首乌、虎杖的主要活性成分之一,具有广泛的药理活性,如:抗肿瘤、抗炎、抗菌、抗病毒、抗氧化、降糖调脂、保肝抗纤维化等,并且在治疗骨关节炎、糖尿病、肾病等疾病及抗肿瘤方面表现突出,成为研究的热点之一。大黄酸含有多个羟基和羰基,易与生物体靶酶中的金属离子鳌合,形成较稳定的鳌合物,这也是其生物作用广泛的原因之一[1,2]。大黄酸能够抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管形成,逆转肿瘤细胞多药耐药等多方面的抗肿瘤活性[3]。鉴于其较广泛的药理作用及低毒性、低成本等特点,大黄酸有望得到进一步开发。但是由于大黄酸具有蒽醌类三环芳香结构,溶解性较差,既不溶于水和醇,又不溶于绝大多数有机溶剂,生物利用度较低,这使大黄酸的临床使用受到了很大限制。如果通过结构改造的方法来改善大黄酸的溶解性能,增加其水溶性或脂溶性,其生物利用度将会有所提高,将会有很广阔的临床应用前景。
近年来,对大黄蒽醌类化合物的结构改造主要是针对大黄素进行的,而对大黄酸进行的改造还相对较少。大黄酸与大黄中其它蒽醌类化合物最显著的区别就是大黄酸存在一个游离的羧基,因此,我们选择大黄酸的羧基进行结构改造,通过酯化反应合成了10个大黄酸酯类衍生物,同时进行体外抗肿瘤活性研究,以期能够发现活性抗肿瘤较好、且毒性较 小可用于新药开发的候选药物,合成路线见图1。

图1 大黄酸酯的合成路线Fig.1 Synthetic route of ester of rhein
1 实验部分
1.1 主要仪器与试剂
X-5显微熔点测定仪(未校准 北京泰克仪器有限公司);傅里叶变换红外光谱仪(KBr压片法 美国Pekin Elmer公司);Bruker Avance-400MHz核磁共振仪(TMS作内标,CDCl3为溶剂,瑞士Bruker公司);EL311型酶标免疫检测仪(美国Bio Tek公司);3164型水套式CO2孵箱(美国Forma Scientific公司);IX71型倒置荧光相差显微镜(日本Olympus公司);四氮唑蓝(MTT)购于瑞士Fluka公司;RPMI-1640培养基购于美国HyClone公司。
大黄酸(98%陕西森弗生物技术有限公司);氯化亚砜、DMAP、DCC、2-氯乙醇、苯甲醇、2-苯乙醇、异丙醇、正丁醇、异丁醇、异戊醇均为分析纯。
1.2 合成方法
1.2.1 大黄酸甲酯、乙酯及正丁酯的合成[4]称取0.57g大黄酸(2mmol)溶于30mL甲醇中,冰浴冷却下将0.2mL SOCl2(3mmol)滴入反应物中,整个滴加时间控制在10mins左右,控制反应温度为0~5℃。室温搅拌反应,TLC监测反应进程,反应完全后,减压蒸除溶剂,加入25mL水,用乙酸乙酯(3×20mL)萃取后,20mL饱和碳酸钠溶液洗涤后,无水Na2SO4干燥,减压浓缩得粗品,柱层析分离得目标产物。
大黄酸甲酯(1):黄色粉末,mp:185.2~186.2℃;1H NMR(400MHz,CDCl3):δ12.03(IH,s),11.97(IH,s),8.43 (1H,bs),7.95 (1H,d,J=1.2Hz),7.88(1H,d,J=7.2Hz),7.74(1H,t,J=8Hz),7.34(1H,d,J=8.6Hz),4.00(3H,s);IR(KBr)ν:3433(br),2953,1726,1626,1449,1378,1206,840,751 cm-1。
大黄酸乙酯(2):橙黄色粉末,mp:169.3~171.8℃;1H NMR(400MHz,CDCl3):δ12.02(IH,s),11.97(IH,s),8.41 (1H,s),7.94 (1H,s),7.87 (1H,d,J=7.2Hz),7.73 (1H,t,J=8Hz),7.33 (1H,d,J=8Hz),4.45(2H,q,J=7.6Hz),1.45 (3H,t,J=7.2Hz);IR(KBr)ν:3422(br),2987,1722,1631,1454,1380,1202,845,748 cm-1。
大黄酸正丁酯(3):橙黄色粉末,mp:127.8~129.9℃ ;1H NMR (400MHz,CDCl3): δ12.02(IH,s),11.96(IH,s),8.40(1H,bs),7.93(1H,d,J=1.2Hz),7.87(1H,d,J=7.2Hz),7.72(1H,t,J=8Hz),7.33(1H,d,J=8Hz),4.39 (2H,t,J=6.4Hz),1.80 (2H,m,J=6.8Hz),1.50(2H,m,J=7.2Hz),1.01(3H,t,J=7.2Hz);IR(KBr)ν:3420(br),2969,2877,1724,1627,1447,1376,1201,841,752cm-1。
1.2.2 大黄酸异丙酯、异丁酯、叔丁酯、异戊酯、苯甲酯、2-苯乙醇酯、2-氯乙醇酯的合成[5]将0.57g大黄酸(2mmol)和 0.5mL异丙醇(2mmol)溶于 30mL二氯甲烷中,冰浴冷却下将0.3gDCC(2mmol)和0.01g DMAP(0.06mmol)加入反应物中,0~5℃反应 1h 后,撤去冰浴室温搅拌反应,TLC监测反应进程,反应完全后,过滤,减压浓缩蒸除溶剂后,柱层析分离得目标产物。
大黄酸异丙酯(4):橙黄色粉末,mp:183.4~184.8℃;1H NMR(400MHz,CDCl3):δ12.04(1H,s),11.99(1H,s),8.42(1H,d,J=1.6Hz),7.95(1H,d,J=1.2Hz),7.89(1H,dd,J=8.4,1.2Hz),7.74(1H,t,J=8Hz),7.34 (1H,dd,J=8.4,1.2Hz),5.31 (1H,m,J=6Hz),1.42(6H,d,J=6Hz);IR (KBr)ν:3204,2984,1717,1627,1452,1373,1202,840,749cm-1。
大黄酸异丁酯(5):橙黄色粉末,mp:154.7~155.9℃;1H NMR (400MHz CDCl3):δ12.06(1H,s,OH),11.99(IH,s,OH),8.44(1H,s),7.95(1H,s),7.89(1H,d,J=7.2Hz),7.74(1H,t,J=8Hz),7.35(1H,d,J=8Hz),4.18(2H,d,J=6.8Hz),2.13(1H,m,J=6.8Hz),1.05(6H,d,J=6.8Hz);IR(KBr)ν:3198,2951,1720,1624,1453,1377,1198,811,751cm-1。
大黄酸叔丁酯(6):橙黄色粉末,mp:179.9~181.7℃;1H NMR(400MHz,CDCl3):δ12.03(1H s),11.98 (1H,s),8.40 (1H,d,J=2Hz),7.93(1H,d,J=2Hz),7.88(1H,d,J=7.2Hz),7.73(1H,t,J=8Hz),7.33(1H,d,J=7.2Hz),1.43(9H,s);IR(KBr)ν:3417,3204,3094,2983,1716,1625,1474,1371,1202,822,751 cm-1。
大黄酸异戊酯(7):橙黄色粉末,mp:123.3~125.9℃;1H NMR (400MHz,CDCl3):δ12.06(1H,s),11.99(1H,s),8.42(1H,d,J=1.6Hz),7.94(1H,d,J=1.2Hz),7.89(1H,d,J=7.2Hz),7.74(1H,t,J=8.4Hz),7.34(1H,d,J=8.4Hz),4.42 (2H,t,J=6.4Hz),1.81(2H,q,J=6.8Hz),1.04(1H,m,J=6.4Hz),0.99(6H,d,J=6.8Hz)。
大黄酸苄酯(8):橙色粉末,mp:155.7~157.7℃;1H NMR(400MHz,CDCl3): δ12.05(IH,s),11.99(IH,s),8.46(1H,d,J=1.2Hz),7.97(1H,d,J=1.2Hz),7.88(1H,d,J=8Hz),7.74(1H,t,J=8Hz),7.34(1H,d,J=8Hz),7.49-7.36(5H,m),5.42(2H,s)。
大黄酸-2-苯乙醇酯(9):黄色粉末,mp:148.6~151.5℃;1H NMR (400MHz,CDCl3):δ12.06(IH,s),12.00(IH,s),8.42(1H,d,J=1.6Hz),7.91(1H,d,J=2.0Hz),7.89(1H,d,J=7.2Hz),7.74(1H,t,J=8Hz),7.37(1H,d,J=7.2Hz),7.34-7.29(5H,m),4.59(2H,t,J=6.8Hz),3.13(2H,t,J=6.8Hz)。
大黄酸-2-氯乙醇酯(10):橙色粉末,mp:163.2~163.7℃;1H NMR (400MHz,CDCl3):δ12.07(IH,s),11.98(IH,s),8.45(1H,d,J=1.2Hz),7.94(1H,d,J=1.2Hz),7.87(1H,d,J=7.2Hz),7.75(1H,t,J=8Hz),7.35(1H,d,J=7.6Hz),4.65(2H,t,J=5.2Hz),3.86(2H,t,J=5.6Hz);IR(KBr)ν:3430,3084,2947,1723,1678,1449,1189,819,749 cm-1。
1.3 MTT法体外抗肿瘤活性实验
取肿瘤细胞株,用RPMI-1640培养液于CO2孵箱中37℃,5%CO2饱和湿度下培养,细胞贴壁后用胰蛋白酶消化传代。将处于对数生长期肿瘤细胞以5×104个·mL-1的密度接种于96孔培养板中,每孔100 μL。次日,每孔分别加入不同浓度受试化合物,每药设4个剂量组,每组设3个平行孔,另设空白组和对照组(以喜树碱为阳性对照药)。加药完毕后于CO2孵箱中在37℃,5%CO2饱和湿度下培养48h,然后每孔再加入5mg·mL-1MTT溶液20μL,继续培养4h后,吸弃上清液,每孔加入150μLDMSO,振荡10min(60次·min-1)后,用自动酶标仪于 490 nm波长处测定吸光度(OD)值,取各组平均值,计算每种浓度药物的抑制率,结果见表1。
抑制率(%)=(1-试验组平均OD值/对照组平均OD值)×100%
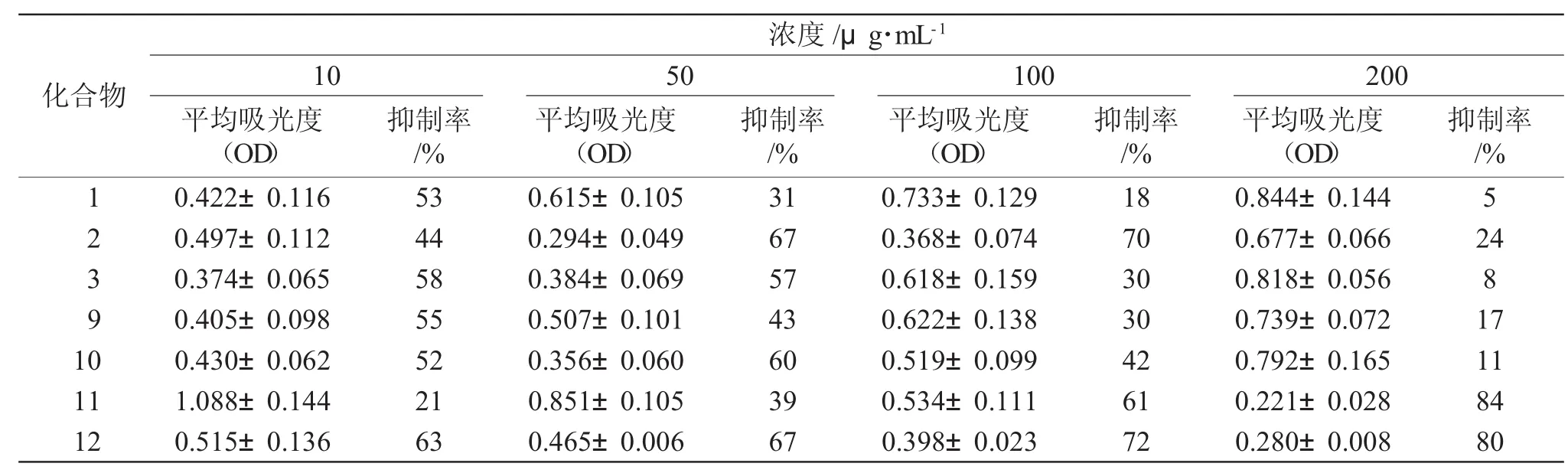
表1 部分目标产物对Hela细胞的抑制作用Tab.1 Inhibitory effects of some compounds against Hela
2 结果与讨论
2.1 合成
针对不同的醇,采用不同的方法进行酯化反应:对于位阻较小的醇(如甲醇、乙醇或正丁醇),以SOCl2作催化剂,合成了大黄酸甲酯、乙酯和正丁酯。在合成时,一是SOCl2需要滴加,并在整个滴加过程中要注意控制反应温度为0~5℃;对于位阻较大的醇(如异丙醇、异丁醇、异戊醇、苯甲醇、2-苯乙醇及2-氯乙醇),以DCC作脱水剂、DMAP作催化剂,合成了大黄酸异丙酯、异丁酯、异戊酯、苄酯、2-苯乙醇酯、2-氯乙醇酯。
2.2 活性
以喜树碱(12)作为阳性对照药,对表中数据进行分析后发现,喜树碱在4种不同浓度下对Hela细胞株均呈现出较强的抑制作用;随着浓度的增加,大黄酸(11)对Hela细胞株的抑制作用依次增强,并且这种抑制作用呈剂量依赖性的关系,这说明大黄酸只有在高浓度时,对肿瘤细胞的抑制作用才较强;大黄酸酯类衍生物在浓度为10g·mL-1时对Hela细胞株的抑制作用普遍强于相同浓度下大黄酸对Hela细胞株的抑制作用,但低于阳性对照药喜树碱相同浓度下的抑制作用,其中化合物2对Hela具有较高的抑制活性,在浓度为100μg·mL-1时,抑制率可达70%。
3 结论
本文以大黄酸及各种醇为原料,通过酯化反应合成了10个大黄酸的酯类衍生物,并通过熔点、IR和1H NMR对目标产物的结构进行了表征,其中5个化合物未见文献报道。体外抗肿瘤活性实验表明,化合物2对Hela具有较高的抑制活性,在浓度为100μg·mL-1时抑制率为 70%。
[1] 赵芳,梁慧,程惠,等.大黄酸金属配合物的合成、表征及抗氧化活性研究[J].化学学报,2011,69(8):925-930.
[2] 向晖,潘晓丽,谭玉柱,等.大黄酸金属配合物的抑菌活性研究[J].中药与临床,2014,5(4):19-22.
[3] 万宗明,孙文军,陈虹.大黄酸抗肿瘤作用的研究进展[J].武警医学,2006,17(8):611-612.
[4] Hosangadi,B.D.;Dave,R.H.An efficient general method for esterification ofaromatic carboxylic acids[J].TetrahedronLetters,1996,37(35):6375-6378.
[5] Jin,G.Z.;You,Y.J.;Kim,Y.,et al.Esters of chlorambucil with 2-substituted 1,4-dihydroxy-9,10-anthraquinones as multifunctional anticancer agents[J].Eur.J.Med.Chem,2001,36:361-366.
Study on the synthesis of some ester derivatives of Rhein and their in vitro antitumor activities*
HUANG Xin-wei
(School of Chemical Engineering,Xi'an University,Xi'an 710065,China)
Taking rhein as lead compound,ten esters of rhein were synthesized by esterification.For the smaller steric hindrance alcolhols,SOCl2was used as catalyst to synthesize methyl,ethyl and butyl esters;but for the lager steric hindrance alcohols,DCC was used as dehydrating agent,and DMAP was used as catalyst to synthesize isopropyl,isobutyl,tert-butyl,isoamyl,benzyl,2-phenyl ethyl,2-chloro ethyl esters.The structures of target compounds were characterized by melting point,IR and 1H NMR.Five of them were new compounds.Some compounds were evaluated for antitumor activities in vitro against Hela human cervical cartcinoma cell lines.The results showed that compound 2 exhibited high activity against Hela at 100μg·mL-1which inhibition rate is 70%.
rhein;esterification;synthesis;antitumor activities
O625.5
A
10.16247/j.cnki.23-1171/tq.20170918
2017-08-18
西安市科技计划项目(CXY1443WL13);陕西省教育厅基金项目(15JK2145)
黄新炜(1976-),男,讲师,博士,主要从事天然产物的合成及结构改造研究。

