重组酶聚合酶扩增结合横向流体试纸条快速检测人腺病毒
赵康辰 葛以跃 崔仑标 陈银 史智扬 朱凤才 周明浩
210009 南京,江苏省疾病预防控制中心 国家卫计委肠道病原微生物重点实验室
·技术方法·
重组酶聚合酶扩增结合横向流体试纸条快速检测人腺病毒
赵康辰 葛以跃 崔仑标 陈银 史智扬 朱凤才 周明浩
210009 南京,江苏省疾病预防控制中心 国家卫计委肠道病原微生物重点实验室
目的建立一种快速、敏感的人腺病毒等温核酸扩增检测方法。方法针对人腺病毒hexon基因保守区序列设计特异性重组酶聚合酶扩增(RPA)引物及探针、优化反应时间和温度、用横向流体试纸条(LFD)和毛细管电泳检测扩增产物,建立人腺病毒RPA-LFD快速检测方法,评价该方法的敏感度和特异性并与Real-time PCR法比较。结果RPA-LFD方法检测人腺病毒的最低检出限为2 拷贝DNA分子/反应,且与其他呼吸道病原无交叉反应,临床样本检测结果与Real-time PCR法一致性为100 %。结论建立的RPA-LFD方法具有敏感性、特异性高、快速且不需要昂贵的仪器设备等优点,为人腺病毒快速检测提供了新工具。
腺病毒(Adenovirus, ADV)是一种引起儿童与成人疾病的重要病原。迄今为止,共发现超过50种型别[1],大约1/3与人类疾病相关[2]。其中,大部分与上、下呼吸道,肠道以及眼部感染有关。最近,一些基于哺乳动物模型和人类恶性疾病的研究结果显示腺病毒感染还可能导致人类肿瘤的发生[3-5]。
腺病毒感染很容易在人与人之间传播。快速、高效的诊断方法无疑有助于阻止疾病的蔓延。病毒分离作为确认腺病毒感染的金标准,实验周期过长而且对实验人员的操作要求较高。免疫学试验,例如直接免疫荧光法能够快速检测出病毒,但这种检测方法也有着灵敏度较低且需要特异的抗血清的缺点。随着分子检测技术的发展,PCR与Real-time PCR技术逐渐作为一种快速、灵敏的诊断方法被用于腺病毒的分型和监测[6-8]。然而,在实验条件有限的环境下,潜在的污染可能性和昂贵的仪器设备成为限制其现场应用的瓶颈。新型的等温扩增技术不需要热循环仪便可检测腺病毒。目前,一些用于检测腺病毒的等温扩增方法已经被研发[9-11]。这些方法的建立全部基于环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)。本研究利用重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)方法,在短时间且较低的温度下扩增人腺病毒核酸,结合横向流体试纸条(Lateral Flow Dipstick,LFD)判读结果,以满足其现场检测的需求。
1 材料与方法
1.1毒株和临床样本199份临床样本收集于2004年至2013年间,其中包括176份咽拭子和23份结膜拭子。199份样本中共分离16株腺病毒毒株,其中包括: ADV-3型7株,ADV-7型5株,ADV-11型3株,ADV-55型1株。用于评价试验特异性的阳性样本或毒株包括:肺炎衣原体、肺炎支原体、军团菌、流感嗜血杆菌、肺炎链球菌、脑膜炎奈瑟菌、人博卡病毒和单纯疱疹病毒。以上毒株和阳性样本均由本实验室分离、鉴定并与临床样本一同冻存于-70 ℃。
1.2仪器与试剂pMD19-T Vector和MiniBEST Plasmid Purification Kit购自TaKaRa公司,TwistAmp nfo kit购自twistDX公司,QIAquick PCR Purification Kit、QIAamp® MinElute® Virus Spin Kit、QIAxcel毛细管电泳仪及其配套试剂购自QIAgen公司,LightCycler Real-time PCR仪购自Roche公司,封闭式LFD核酸检测装置购自杭州优思达生物技术公司。3130测序仪购自ABI公司。
1.3引物与探针的设计、筛选按照TwistAmp nfo kit说明书基于腺病毒hexon基因保守区序列设计RPA的引物及探针,并在正向引物的5’端标记生物素,探针的5’端标记异硫氰酸荧光素(FITC),中间标记四氢呋喃(THF),3’端标记C3间隔(SpC3)。以上引物和探针的合成均由上海生工生物有限公司完成。选择5套引物并通过2%的琼脂糖电泳进行筛选,确定一套引物后再以相似的方法筛选探针。选择琼脂糖电泳中目的条带最亮的一组用于RPA检测。
1.4标准质粒的制备与核酸提取将ADV hexon基因的扩增产物连接至T载体,使用TaKaRa pMD19-T Vector 试剂盒制备质粒。按照TaKaRa MiniBEST Plasmid Purification Kit说明书提取质粒,在波长260 nm处测定浓度,并将其换算为靶基因的拷贝数[12]。质粒纯化后用于优化RPA方法。根据QIAamp® MinElute® Virus Spin Kit操作说明提取毒株及临床样本核酸,最终洗脱体积50 μl,冻存于-70 ℃。
1.5Real-timePCR方法根据文献[7]设计Real-time PCR方法检测腺病毒。使用Premix Ex Taq Kit配制体系,体系包含10 μl 2×PCR buffer,200 nmol/L引物混合液,100 nmol/L探针混合液,2 μl模板DNA,总体系为20 μl。使用LightCycler Real-time PCR仪进行扩增,扩增条件为:95°C,30 s; 95°C,5 s,56°C,20 s扩增40个循环。
1.6RPA反应体系根据TwistAmp nfo kit试剂盒说明书配制50 μl反应体系,其中包括420 nmol/L引物,120 nmol/L探针以及1×rehydration buffer。向装有试剂干粉的反应管中加入上述混合液和2 μl模板DNA,并将2.5 μl醋酸镁(MgOAc, 280 mmol/L)加入管盖内侧,盖上管盖,短暂混匀、离心使醋酸镁滑落管中与扩增试剂混合,放入加热器中孵育。
1.7RPA产物分析使用横向流体试纸条和高分辨率毛细管电泳检测RPA产物。其中用于毛细管电泳检测的扩增产物按照QIAquick PCR Purification Kit说明书纯化后,通过QIAxcel毛细管电泳仪分析扩增结果。电泳程序设定为DM400,alignment markers 选择QX 15-bp/3-kb。
1.8RPA-LFD方法优化以1 000 拷贝的标准质粒DNA作为模板,设定反应时间为15 min,根据检测结果从37 ℃、39 ℃、42 ℃中选择最佳反应温度。测试不同反应时间(5 min、10 min、15 min、20 min、25 min、30 min)对RPA法检测结果的影响,并选择最佳反应时间。
1.9RPA方法的敏感度和特异性将质粒10倍稀释为1×100~1×104拷贝/ μl用以进行敏感度实验,实验重复3次。以建立的方法对16株腺病毒毒株和肺炎衣原体、肺炎支原体、军团菌、流感嗜血杆菌、肺炎链球菌、脑膜炎奈瑟菌、人博卡病毒、单纯疱疹病毒阳性样本或毒株进行检测评价RPA-LFD方法的特异性。
1.10RPA-LFD方法检测临床样本以患有急性呼吸道感染或结膜炎的儿童中采集到的176份咽拭子样本及23份结膜拭子样本提取的核酸作为模板,同时使用Real-time PCR 和本研究建立的RPA-LFD方法的进行检测,比较检测结果的一致性。根据文献设计腺病毒测序引物[13],对检出的阳性样本进行扩增,标记纯化后使用3130测序仪检测核酸序列并于GeneBank中进行比对以确定是否为腺病毒。
2 结果
2.1RPA引物和探针按照上文提出的方法,筛选出一套引物和探针,正向引物ADV-RPA-F:biotin-GCTCATTGGAACAACTGCCGTAAATAGTGT,反向引物ADV-RPA-R:GGCCGAGAACGGTGTACGCAGGTAGACTGTC,探针ADV-RPA-P:FITC-CTCGATGACGCCGCGGTGTGGCTGGTGCAC-THF-CTGACCACGTCGAAGA(SpC3),以JS201501(GenBank: KX289874.1)作为参考毒株,正向引物、反向引物和探针分别位于基因组的:20761~20790、21025~21055、20979~21025位核苷酸。使用这套引物经RPA扩增后将产生片段大小为295 bp的产物。
2.2RPA-LFD检测方法的优化RPA-LFD扩增结果显示不同的扩增温度对扩增结果无明显影响。因此,选择37 ℃作为RPA方法的反应温度。反应开始5 min后便可通过流体试纸条检测到扩增信号。不同反应时间(5 min、10 min、15 min、20 min、25 min)对RPA法扩增信号强度差别不大,但反应时间达30 min时阴性对照出现假阳性结果,为避免RPA检测中出现假阳性结果,将反应时间设置在20 min。
2.3RPA-LFD检测方法的敏感性通过检测2~20 000 拷贝的质粒DNA确定RPA-LFD方法的检出限,使用LFD与毛细管电泳分别检测反应产物。两种方法的检出限均能达到2拷贝DNA分子/反应。(图1)
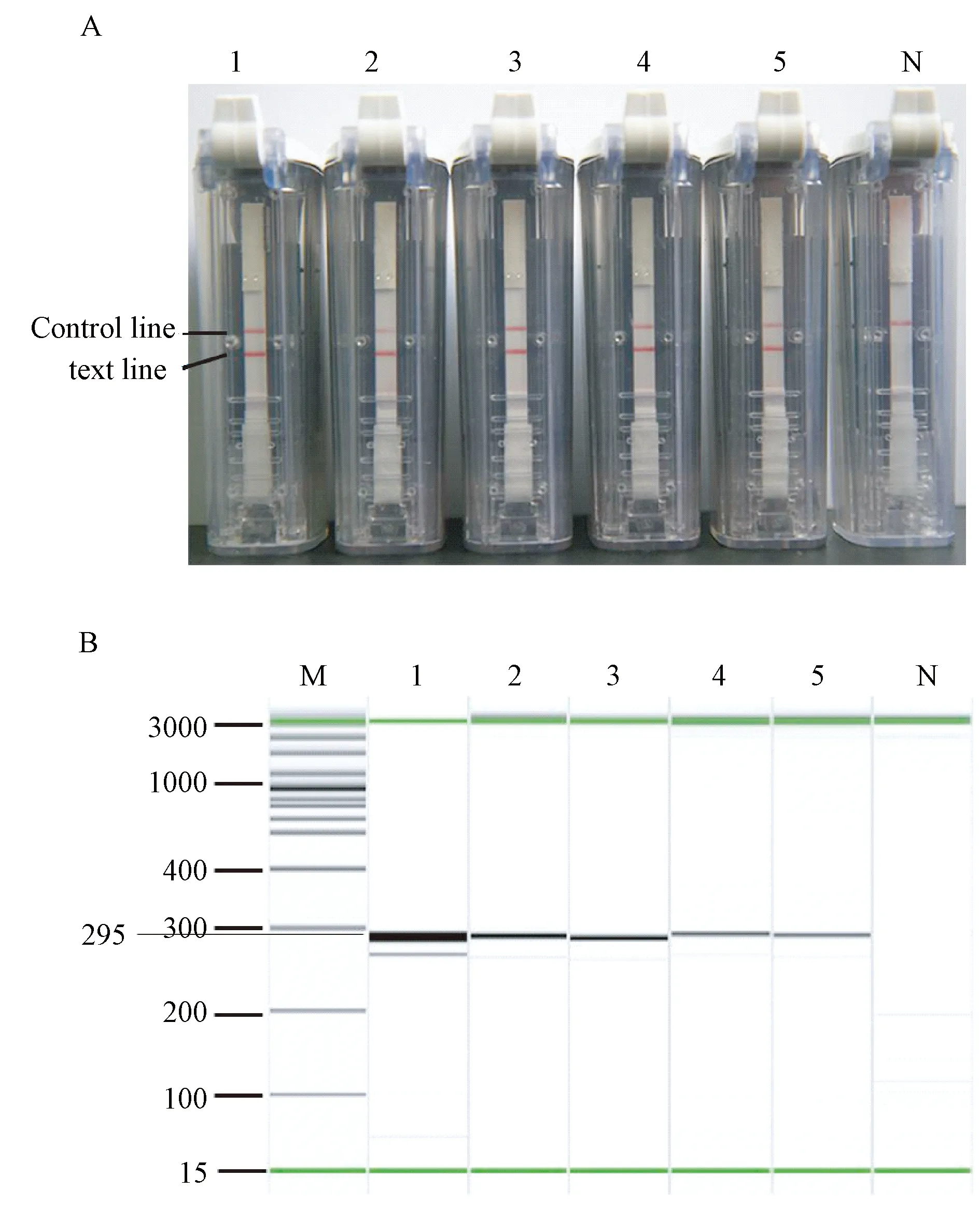
1-5:人腺病毒质粒, DNA拷贝数分别为2×104~2×100 拷贝;N:阴性对照M: DNA marker 100 bp~2.5 kb图1 LFD(A)和 毛细管电泳(B)检测的RPA敏感性Fig.1 Sensitivity detection by LED(A) and capillary electrophoresis (B)of RPA assay1-5∶2×104 -2×100 copies for ADV;N: No template control;M:DNA marker 100 bp-2.5kb
2.4RPA-LFD检测方法的特异性16株人腺病毒毒株的反应管均出现阳性反应,其他病原包括:肺炎衣原体、肺炎支原体、军团菌、流感嗜血杆菌、肺炎链球菌、脑膜炎奈瑟菌、人博卡病毒和单纯疱疹病毒均为阴性反应(图2A),与毛细管电泳结果一致(图2B),表明RPA-LFD方法具有高特异性。

N.阴性对照;1.肺炎衣原体;2.肺炎支原体;3.军团菌;4.流感嗜血杆菌;5.肺炎链球菌;6.脑膜炎奈瑟菌;7.人博卡病毒;8.单纯疱疹病毒;9.人腺病毒 M.DNAmarker 100 bp~2.5 kb图2 LFD和.毛细管电泳检测的RPA特异性实验N.No template control,1. Chlamydia pneumoniae,2. Mycoplasma pneumoniae,3. Legionella pneumophila,4. Haemophilus influenzae,5.Streptococcus pneumoniae,6.Neisseria meningitidis,7.Human bocavirus,8. Herpes Simplex Virus,9. Human adenovirus, M.DNA marker 100 bp-2.5 kbFig.2 Specificity detection by LFD (A) and capillary electrophoresis (B) of RPA assay
2.5RPA-LFD与Real-timePCR方法的一致性199份临床样本同时以Real-time PCR 和RPA-LFD方法的进行检测,其中Real-time PCR以Ct值小于35判读为阳性。结果如表1所示,16份咽拭子样本和19份结膜拭子样本经Real-time PCR方法检测结果呈阳性,与RPA-LFD方法检测结果完全一致。经3130测序仪测序鉴定此35份阳性样本均为腺病毒。
3 讨论
ADV是一种引起儿童与成人急性呼吸道感染的重要病原。其症状与其他病原引起的呼吸道感染症状极为相似,临床上难以区分。因此,敏感、快速、特异的腺病毒检测方法将为临床诊断提供重要依据,尤其是在发展中国家,能起到防止药物滥用,限制疾病传播的作用。本项研究将RPA与LFD相结合,建立了一种新型人腺病毒分子检测方法。RPA法的反应温度相对较低(37 ℃~42 ℃),且不需要热循环仪,一台水浴装置即可完成扩增反应。另一方面,通过封闭式LFD检测装置判读结果可有效避免交叉污染[14-15]。这些特点让该方法摆脱了对价格昂贵的扩增仪器的依赖,更适合用于现场快速检测。
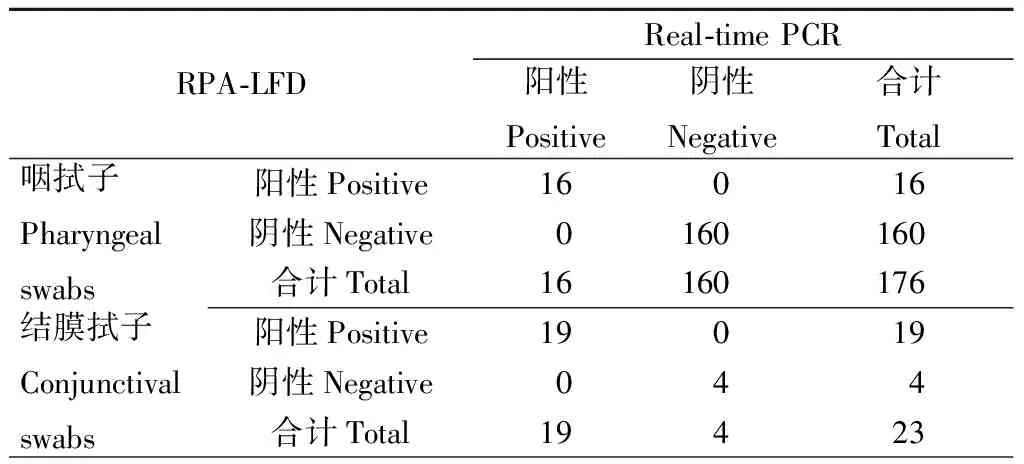
表1 RPA-LFD方法与Real-time PCR方法检测结果比较
目前,基于LAMP技术建立的人腺病毒等温扩增检测方法的检测时间为45~60 min[9-11]。与之相比,RPA-LFD方法的检测时间更短,从反应开始到完成结果判读仅需25 min(20 min RPA反应,5 min LFD结果判读)。LAMP法需要6条引物而RPA-LFD法仅仅只需要3条引物。以往的研究表明,RPA方法的敏感性与LAMP方法相同,但特异性较高[16]。本研究建立的RPA-LFD方法检测人腺病毒与Real-time PCR方法具有相同的敏感性。且RPA-LFD方法能够准确的检测出16株腺病毒毒株和35份拭子标本也表明该方法具有较高的特异性。值得一提的是,ADV的血清型多达50种,现阶段很难设计出针对所有血清型的引物。虽然,我们成功地检测出所有经Real-time PCR方法鉴定的阳性标本,但将RPA-LFD方法作为检测ADV的常规检测手段之前,仍需测试更多不同血清型的临床标本。
当反应时间超过30 min时会出现非特异性扩增,这可能是由于反应时间超过30 min后RPA反应体系中的结合蛋白与引物形成复合物所致。尽管如此,我们将反应时间设定在20 min内可准确的检测出所有阳性临床样本。
综上所述,本研究结合重组酶聚合酶扩增技术与流体试纸条建立了一种快速、敏感的人腺病毒感染检测方法,为人腺病毒现场快速检测提供了新工具。
[1] Koren MA, Arnold JC, Fairchok MP, et al. Type-specific clinical characteristics of adenovirus associated influenza-like illness at five US military medical centers, 2009-2014[J]. Influenza Other Respir Viruses, 2016,10(5):414-420. doi: 10.1111/irv.12392.
[2] Cesario TC. Viruses Associated With Pneumonia in Adults[J]. Clin Infect Dis, 2012,55(1):107-113. doi: 10.1093/cid/cis297.
[3] Jariwalla RJ, Aurelian L, Ts'o PO. Tumorigenesis by adenovirus type12 in newborn Syrian hamsters[J]. Proc Natl Acad Sci U S A, 1980,77(4):2279-2283.
[4] Kosulin K, Hoffmann F, Clauditz TS, et al. Presence of adenovirus species C in infiltrating lymphocytes of human sarcoma[J]. PLoS One, 2013,8(5):e63646. doi: 10.1371/journal.pone.0063646. Print 2013.
[5] Kosulin K, Haberler C, Hainfellner JA, et al. Investigation of adenovirus occurrence in pediatric tumor entities[J]. J Virol, 2007, 81(14):7629-7635. doi:10.1128/JVI.00355-07
[6] van Heerden J, Ehlers MM, Heim A, et al. Prevalence, quantification and typing of adenoviruses detected in river and treated drinking water in South Africa[J]. J Appl Microbiol, 2005,99(2):234-242. DOI: 10.1111/j.1365-2672.2005.02617.x.
[7] Heim A, Ebnet C, Harste G, et al. Rapid and quantitative detection of human adenovirus DNA by real-time PCR[J]. J Med Virol, 2003,70:228-239. doi: 10.1002/jmv.10382.
[8] He JW, Jiang S. Quantification of enterococci and human adenoviruses in environmental samples by Real-Time PCR[J]. Appl Environ Microbiol, 2005,71(5):2250-2255. doi:10.1128/AEM.71.5.2250-2255.2005.
[9] 李凡,赵林清,邓洁,等.儿童急性呼吸道感染中腺病毒环介导等温扩增技术检测方法的建立.中华儿科杂志,2013,51(1): 52-60. doi: 10.3760/cma.j.issn. 0578-1310.2013. 01.010.
[10] Ziros PG, Kokkinos PA, Allard A, et al.Development and evaluation of a Loop-Mediated Isothermal Amplification Assay for the detection of adenovirus 40 and 41[J]. Food Environ Virol, 2015,7(3):276-285. doi: 10.1007/s12560-015-9182-8.
[11] Wakabayashi T, Yamashita R, Kakita T, et al. Rapid and sensitive diagnosis of adenoviral keratoconjunctivitis by loop-mediated isothermal amplification (LAMP) method[J]. Curr Eye Res, 2004,29(4-5):219-224.
[12] Min BS, Noh YJ, Shin JH, et al. Assessment of the quantitative real-time polymerase chain reaction using a cDNA standard for human group A rotavirus[J]. J Virol Methods, 2006,37(2):280-286.
[13] Lu X,and Erdman D D, Molecular typing of human adenoviruses by PCR and sequencing of a partial region of the hexon gene. Arch Virol, 2006,151(8):1587-1602. doi: 10.1007/s00705-005-0722-7.
[14] Cui L, Ge Y, Qi X, et al. Detection of severe fever with thrombocytopenia syndrome virus by reverse transcription-cross-priming amplification coupled with vertical flow visualization[J]. J Clin Microbiol, 2012,50(12):3881-3885. doi: 10.1128/JCM.01931-12.
[15] Ge Y, Wu B, Qi X, et al. Rapid and sensitive detection of novel avian-origin influenza A (H7N9) virus by reverse transcription loop-mediated isothermal amplification combined with a lateral-flow device[J]. PLoS One, 2013,8(8):e69941. doi: 10.1371/journal.pone.0069941
[16] Yang Y, Qin X, Wang G, et al. Development of an isothermoal amplification-based assay for rapid visual detection of an Orf virus [J]. Virol J, 2016,13:46. doi: 10.1186/s12985-016-0502-x.
Rapiddetectionofhumanadenovirusbyrecombinasepolymeraseamplificationassayandlateralflowdipstick
ZhaoKangchen,GeYiyue,CuiLunbiao,ChengYin,ShiZhiyang,ZhuFengcai,ZhouMinghao
KeyLaboratoriesofEntericPathogenicMicrobiologyofNationalHealthandFamilyPlanningCommission,JiangsuProvincialCenterforDiseaseControlandPrevention,Nanjing210009,China
CuiLunbiao,Email:lbcui@jscdc.cn
ObjectiveTo establish a rapid and sensitive isothermal amplification assay for the detection of human Adenovirus.MethodsPrimers and probe used for recombinase polymerase amplification(RPA)were designed based on the conserved region of the adenoviruses hexon gene. After optimizing the reaction temperature and times, the products of RPA were detected by capillary electrophoresis and lateral flow dipstick(LFD). Sensitivity and specicity of the assay were evaluated. The diagnostic value of the RPA-LFD assay was verified using clinical samples which were simultaneously tested by real time PCR assay.ResultsThe analytical sensitivity of RPA-LFD assay was 2 copies DNA molecules per reaction and no cross reaction with other pathogens was observed. Compared with real-time PCR assay, the sensitivity, and specificity of the present assay were all 100%.ConclusionsThe RPA-LFD assay developed in this study has the characteristics of high specificity, sensitivity, rapid and no requirement of expensive equipment which provided a new tool for rapid detection of human adenovirus.
Adenovirus; Rapid detection; Recombinase polymerase amplification; Lateral flow dipstick
腺病毒;快速检测;重组酶聚合酶扩增;横向流体试纸条
2017-05-18)
(本文编辑:唐浏英)
崔仑标,Email: lbcui@jscdc.cn
10.3760/cma.j.issn.1003-9279.2017.04.018
江苏省重大新发传染病综合防控科技示范工程(BE2015714);江苏省科技强卫重点学科(ZDXKA2016008)
Fundprograms: Jiangsu Province Science & Technology Demonstration Project for Emerging Infectious Diseases Control and Prevention (BE2015714);Jiangsu Provincial Key Medical Discipline (ZDXKA2016008)

