毛乌素沙地2种蒿属植物光合作用特征1)
李征珍 石莎 李熙萌 冯金朝
(中央民族大学,北京,100081)
毛乌素沙地2种蒿属植物光合作用特征1)
李征珍 石莎 李熙萌 冯金朝
(中央民族大学,北京,100081)
用LI-6400光合仪和PAM-2100荧光仪测定了油蒿(Artemisiaordosica)和籽蒿(A.sphaerocephala)的气体交换及叶绿素荧光参数日变化规律,探讨了2种蒿属植物光合作用对沙地强光环境的适应机制。结果表明:2种蒿属植物净光合速率(Pn)均出现“午休”现象,根据Pn、气孔导度(Gs)、胞间CO2摩尔分数(Ci)、气孔限制值(Ls)的变化方向,推测油蒿叶片午间光合下调主要是由非气孔因素引起的,籽蒿则主要是由气孔因素引起的;2种蒿属植物午间最大光化学效率(Fv/Fm)均显著降低,说明2种蒿属植物可能受到光抑制;随着午间实际光化学效率(ΦII)的下降,2种蒿属植物调节性能量耗散量子产量(ΦN,P,Q和ΦN,O)均上升,暗示调节性热耗散可能是其光保护途径之一。从而说明蒿属植物光合作用对午间环境的适应机制存在种间差异。
强光;油蒿;籽蒿;叶绿素荧光;光抑制
油蒿(Artemisiaordosica)和籽蒿(A.sphaerocephala)是我国北方荒漠及半荒漠地区的标志性半灌木,广泛分布于内蒙古、陕西、宁夏、甘肃、青海和新疆等地[1-2]。油蒿和籽蒿有耐旱、耐沙埋、抗风蚀、耐贫瘠、易繁殖等特性,是我国西北地区的重要固沙植物。虽然油蒿和籽蒿亲缘关系很近,地理分布范围也相似,在同一地区内它们却表现出明显的生态位分化,油蒿多分布于固定和半固定沙地,籽蒿则多分布于流动和半流动沙地[1,3]。迄今为止,已有许多学者比较分析了油蒿和籽蒿在固沙能力[4-5]、生长速率[4]、幼苗存活率[6]、菌根特征[7-8]和染色体核型[9]等方面的差异,然而关于其光合生理特征差异尚未见报道。植物的光合生理特征对环境条件变化敏感,因此,能够反映植物对其生境适应能力的强弱,研究自然条件下油蒿和籽蒿的光合作用特征,有助于了解其生态位分化原因,为合理利用这2种蒿属植物具有重要的指导意义。
气体交换参数可反映植物光合作用对外界环境变化的响应结果,叶绿素荧光作为快速灵敏且对植物叶片无损的“探针”,能反映光合机构内在变化。两者相结合,可以全面了解光合机构运转情况[10-11],揭示植物光合适应机制。本研究通过分析毛乌素沙地的油蒿和籽蒿在自然条件下的气体交换和叶绿素荧光日变化,探讨2种蒿属植物对荒漠环境的光合作用适应机制及差异,为今后优化荒漠地区生态恢复与植被重建工程,以及植物选择和引种驯化提供科学依据。
1 研究地概况
试验地点位于内蒙古自治区乌审旗(108°17′36″~109°40′22″E,37°38′54″~39°23′50″N),该区地处毛乌素沙地腹地,海拔1 300~1 400 m,属温带大陆性季风气候,年均温7.1 ℃;降水主要集中在7—9月份,年降水量300~400 mm;年蒸发量2 590 mm,为降水量的7倍;年均日照时间为2 886 h;土壤类型以沙土为主。
2 材料与方法
试验采用的蒿属植物为该地区半固定沙地上的油蒿(Artemisiaordosica)和籽蒿(A.sphaerocephala)。试验选取同一生境长势相似的油蒿和籽蒿植株,于7月份油蒿和籽蒿生长旺盛时期进行试验。测定时选取同一级别枝条上的叶龄相似的成熟叶片,每次测定至少重复5次。在晴天的07:00—19:00用Li-6400型便携式光合作用测定仪(LI-COR,USA)每隔2 h测定一次2种蒿属植物叶片的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳摩尔分数(Ci)等气体交换参数。大气二氧化碳摩尔分数(Ca)、大气温度(Ta)、光合有效辐射(PA,R)、空气相对湿度(RH)等环境参数由仪器自动记录。测定结束后,剪下叶片上已标记的测量区域,用网格法计算出叶面积,利用Li-6400系统软件进行数据回算。气孔限制值(Ls)由公式Ls=1-Ci/Ca求得[12]。
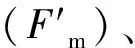
所有数据采用SPSS 17.0统计软件进行分析;当P<0.05时,认为不同时刻参数间的差异达到了显著水平。不同环境因子间的相关关系用Pearson相关系数评价;当P<0.05时,认为相关性达到显著水平。
3 结果与分析
3.1 2种蒿属植物生长的环境因子日变化规律
07:00—19:00,PA,R和Ta的日变化均呈先升高再降低的趋势(表1)。PA,R在13:00达到最大值,为1 913.33 μmol·m-2·s-1;Ta全天变化于25.92~36.37 ℃,于13:00达到最大值。Ca从早晨开始逐渐降低,于13:00到达最小值,此后又缓慢回升,全天变化于361.24~381.63 μmol·mol-1,变化幅度不大;RH最大值在07:00出现,为54.27%,全天呈下降趋势,19:00达到最小值(23.38%)(表1)。

表1 2种蒿属植物生长的环境因子日变化
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
相关性分析结果表明,07:00—13:00,Ca与PA,R呈极显著负相关(R2=0.996,P<0.01),Ta与PA,R呈显著正相关(R2=0.961,P<0.05),RH与PA,R的相关性却不甚明显(R2=-0.940,P>0.05)。由此可知,PA,R可在一定程度上影响当地Ta和Ca的变化。其中,PA,R可能通过影响植物光合作用效率间接影响Ca。
3.2 2种蒿属植物叶片气体交换参数日变化特征
由表2可以看出,油蒿和籽蒿的Pn均从清晨开始迅速升高,在15:00左右再次上升,15:00—19:00快速下降,有明显的光合“午休”现象。油蒿Pn的最大值出现在11:00左右,籽蒿Pn的最大值则出现在09:00左右。油蒿和籽蒿的Gs日进程全天基本上呈递减趋势,最大值均出现在07:00左右,此后随着PA,R和Ta的上升迅速下降,到19:00出现全天最小值。2种蒿属植物的Ls的日变化均于13:00达到全天最大值,此后持续下降,至19:00达到全天最小值。油蒿和籽蒿的Ci日变化趋势有些许差异,油蒿Ci从早晨07:00开始下降至11:00之后达到最小值,此后持续上升;籽蒿Ci的最小值则出现在13:00。
3.3 2种蒿属植物叶片叶绿素荧光参数日变化特征
由表3可看出,Fv/Fm指经过充分暗适应的植物叶片PSII潜在光化学效率,可反映植物受胁迫情况[11]。本研究中,油蒿和籽蒿的Fv/Fm从07:00开始显著下降,11:00达到最小值(分别为0.77和0.79),之后缓慢回升,到19:00籽蒿的Fv/Fm基本恢复到清晨水平,油蒿的Fv/Fm则略低于07:00水平,说明2种蒿属植物均受到不同程度的光抑制。2种蒿属植物实际光照条件下PSII的表观电子传递速率ET,R日进程基本相同,均于07:00—09:00快速上升,到17:00之后迅速下降,全天维持在较高水平。

表2 2种蒿属植物气体交换参数日变化特征
注:-.净光合速率为负数代表呼吸作用比光合作用强;表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
ΦII表示光适应条件下PSII实际光化学效率,可反映PSII反应中心的活性;调节性能量耗散量子产量参数ΦN,P,Q和非调节性能量耗散量子产量参数ΦN,O则与非光化学猝灭相关[13]。结果显示,油蒿和籽蒿的ΦII日变化规律与其Fv/Fm走势相似,最小值均在11:00出现(与黎明值相比分别下降了41.46%和35.70%);同ΦII全天走势相反,2种蒿属植物ΦN,P,Q均于07:00—11:00显著上升,并在11:00达到全天最大值(黎明值相比各自上升了62.95%和136.37%)。然而,油蒿和籽蒿的ΦN,O日变化趋势却不相同:籽蒿ΦN,O07:00—17:00基本维持在同一水平上,无显著性差异,于19:00显著升高;油蒿ΦN,O则在11:00—13:00上升明显(最大值与黎明值相比上升了11.88%),之后缓慢下降,到19:00已基本恢复到黎明水平。
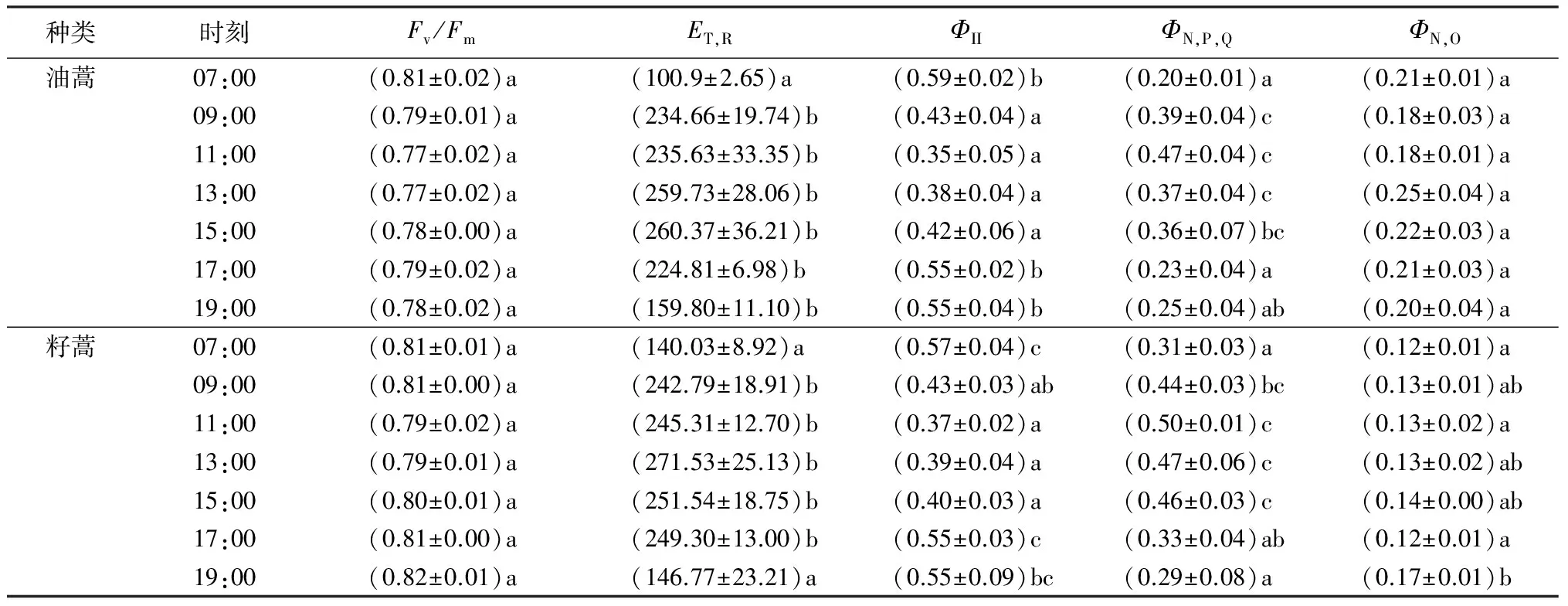
表3 2种蒿属植物叶绿素荧光参数日变化特征
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
4 结论与讨论
本研究中,毛乌素沙地油蒿和籽蒿均出现了光合“午休”现象,与前人研究结果相似[14-15]。沙生植物在午间强光、高温及干旱环境下往往以降低自身光合效率为代价来避免自身光合机构遭到破坏和叶片过度失水[16],故2种蒿属植物的光合“午休”可以看作是对其生境的一种有益的生态适应和自我保护机制。然而,尽管多种植物都可以利用光合“午休”的方式来避开午间恶劣环境,但其生理机制却不一定相同,如周海燕[17]研究发现,科尔沁沙地中差不嘎蒿以及冷蒿的午间光合下调是由不同因素引起的。
导致植物光合下调的因素一般可为气孔因素和非气孔因素。气孔响应失水关闭是植物对干旱胁迫的早期反应之一,气孔关闭可有效防止植物体内水分过度丧失[18],但是同时也会限制空气中CO2由气孔向叶片中扩散,使植物Pn因底物供给不足而下降,即光合作用的气孔限制。根据Farquhar et al.[19]的观点,只有当Pn和Ci同时降低,且Ls增大时,才可认为此时Pn的降低主要是由气孔因素引起的,否则Pn的降低则主要是受非气孔因素限制。由此可以判断,本研究中籽蒿09:00—13:00光合下调主要是由于气孔限制,而油蒿11:00—13:00Pn降低主要是由于非气孔限制。
叶绿素荧光的测量结果表明,2种蒿属植物午间均受到了不同程度的光抑制,其中油蒿Fv/Fm的下降幅度较籽蒿更大,且在傍晚也没有完全恢复到清晨水平,说明油蒿受到的光抑制程度比籽蒿更大。ΦII、ΦN,P,Q及ΦN,O这3个参数可以用来描述植物PSII反应中心激发能的去向[13]。植物叶片PSII所吸收的全部光能中只有一部分被用于推动光化学反应(ΦII),其余则全部以非光化学形式耗散(ΦN,P,Q、ΦN,O)[20],三者符合公式ΦII+ΦN,P,Q+ΦN,O=1。其中,ΦN,P,Q为与非光化学猝灭相关的通过叶黄素循环等过程以热的形式耗散的光能所占的比例,反映了PSII处理过剩光能的能力,是光保护的重要指标[21-22];ΦN,O为因PSII反应中心关闭引起的以热和荧光的形式耗散的过剩光能所占的比例,是一种被动的能量耗散机制,其值的上升可以作为光伤害的重要指标[13,23]。本研究中,随着正午ΦII下降,油蒿和籽蒿ΦN,P,Q上升,说明2种蒿属植物在午间可能依赖叶黄素循环的非辐射能量耗散等途径来保护PSII免受过剩光能的损伤。吴雅娟等[24]对油蒿的研究中也报道过类似的现象。另外,11:00—13:00油蒿ΦN,O显著上升,说明油蒿PSII可能受到了一定程度的光损伤。
高等植物叶片的光合机构在光能过剩时还会通过提高光合能力以及加强耗能代谢(如光呼吸和梅勒反应)等方式来消耗反应中心传递的电子以此来防止还原型QA积累,保护PSII免受损伤[25-26]。研究结果显示,2种蒿属植物的ET,R全天一直维持在较高水平,说明油蒿和籽蒿PSII反应中心的电子生成或传递并未受阻。在电子产量未减少的情况下,2种蒿属植物午间Pn降低,说明大量的电子可能被用于光呼吸或梅勒反应等能量耗散途径。
综上所述,在长期适应过程中,毛乌素沙地的油蒿和籽蒿均形成了有效的生理调节机制来避免其光合机构受到午间强光以及伴随的高温、干旱等恶劣环境的损伤。首先,2种蒿属植物都通过光合“午休”来适应中午环境,但其机理却不尽相同:籽蒿的光合“午休”主要和气孔因素有关,是其为减少叶片水分丧失而降低气孔导度或关闭气孔时的附加产能损失;油蒿午间光合下调则主要由非气孔因素引起,是午间环境下叶肉活性受抑制的结果。其次,2种蒿属植物均会利用热耗散途径释放来自叶绿素的过剩光能,以此来保护PSII免遭光破坏,但其利用的热耗散类型有区别:籽蒿主要依靠调节性热耗散;油蒿则需要同时依靠非调节性热耗散。从整体上看,籽蒿对荒漠生境午间高温强光环境的适应能力比油蒿强,这可能是籽蒿不仅能在半流动沙地分布,同时还能在流动沙地分布的原因之一。
[1] 王铁娟,杨持,马静,等.籽蒿的地理分布与遗传分化[J].植物生态学报,2005,29(1):122-127.
[2] 王铁娟,杨持,吕桂芬,等.中国北部六种沙蒿的地理替代规律及其主导生态因子[J].生态学报,2005,25(5):1012-1018.
[3] 郭柯.毛乌素沙地油蒿群落的循环演替[J].植物生态学报,2000,24(2):243-247.
[4] 詹科杰,王继和,马全林,等.沙蒿、油蒿空间构件及固沙机制研究[J].甘肃林业科技,2005,30(4):1-4.
[5] 马全林,卢琦,张德魁,等.沙蒿与油蒿灌丛的防风阻沙作用[J].生态学杂志,2012,31(7):1639-1645.
[6] 樊宝丽,马全林,张德魁,等.腾格里沙漠南缘3种优势植物种子出苗对土壤类型和沙埋的响应[J].干旱区研究,2011,28(6):1038-1044.
[7] 山宝琴,姜在民.沙漠生境白沙蒿(Artemisiasphaerocephala)根围丛枝菌根真菌多样性[J].生态学杂志,2010,29(9):1729-1735.
[8] 山宝琴,贺学礼,白春明,等.荒漠油蒿(Artemisiaordosica)根围AM真菌分布与土壤酶活性[J].生态学报,2009,29(6):3044-3051.
[9] 乌云格日勒.白沙蒿和油蒿的染色体核型分析研究[J].草原与草业,2010,22(2):33-36.
[10] LONG S P, BERNACCHI C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error[J]. Journal of Experimental Botany,2003,54:2393-2401.
[11] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence-a practical guide[J]. Journal of Experimental Botany,2000,51:659-668.
[12] BERRY J A, DOWNTON W J S. Environmental regulation of photosynthesis[M]. New York: Acamemic Press,1982.
[13] KLUGHAMMER C, SCHREIBER U. Complementary PS II quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the Saturation Pulse method[J]. PAM Application Notes,2008,1:27-35.
[14] 张盹明,唐进年,徐先英,等.两种蒿属植物的光合特性研究[J].西北农业学报,2009,18(2):163-168.
[15] 马阔东,高丽,闫志坚,等.库布齐沙地三种植物光合、蒸腾特性和水分利用效率研究[J].中国草地学报,2010,32(2):116-120.
[16] 刘冰,赵文智.荒漠绿洲过渡带柽柳和泡泡刺光合作用及水分代谢的生态适应性[J].中国沙漠,2009,29(1):101-107.
[17] 周海燕.科尔沁沙地主要植物种的生理生态学特性[J].应用生态学报,2000,11(4):587-590.
[18] 许大全.光合作用效率[M].上海:上海科学技术出版社,2002.
[19] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology,1982,33:317-345.
[20] KRAMER D M, JOHNSON G, KIIRATS O, et al. New fluorescence parameters for the determination of QA redox state and excitation energy fluxes[J]. Photosynthesis Research,2004,79:209-218.
[22] MÜLLER P, LI X P, NIYOGI K K. Non-photochemical quenching. A response to excess light energy[J]. Plant Physiology,2001,125:1558-1566.
[23] BÜRLING K, HUNSCHE M, NOGA G. Quantum yield of non-regulated energy dissipation in PSII (Y(NO)) for early detection of leaf rust (Pucciniatriticina) infection in susceptible and resistant wheat (TriticumaestivumL.) cultivars[J]. Precision Agriculture,2010,11(6):703-716.
[24] 吴雅娟,查天山,贾昕,等.油蒿(Artemisiaordosica)光化学量子效率和非光化学淬灭的动态及其影响因子[J].生态学杂志,2015,34(2):319-325.
[25] ANDERSON J M, ARO E M. Grana stacking and protection of photosystem II in thylakoid membranes of higher plant leaves under sustained high irradiance: An hypothesis[J]. Photosynthesis Research,1994,41:315-326.
[26] MELIS A. Photosystem-II damage and repair cycle in chloroplasts: what modulates the rate of photodamage in vivo?[J]. Trends in Plant Science,1999,4(4):130-135.
PhotosyntheticCharacteristicsinTwoArtemisiaSpeciesinMuUsSandyLand//
Li Zhengzhen, Shi Sha, Li Ximeng, Feng Jinchao
(Minzu University of China, Beijing 100081, P. R. China)//Journal of Northeast Forestry University,2017,45(9):31-34.
High irradiance;Artemisiaordosica;Artemisiasphaerocephala; Chlorophyll fluorescence; Photoinhibition
S793.9;Q945.11
1)中央民族大学青年学术团队引领计划项目(2017MDYL33)、中央民族大学少数民族事业发展协同创新中心项目。
李征珍,1988年1月生,中央民族大学生命与环境科学学院,博士研究生。E-mail:liz.lizhengzhen@foxmail.com。
石莎,中央民族大学生命与环境科学学院,副教授。E-mail:yunnanss@126.com。
2017年3月12日。
责任编辑:任 俐。
In order to study the photosynthetic adaptation and acclimation to Mu Us sandy land inArtemisiaordosicaandA.sphaerocephala, we measured the diurnal dynamics of gas exchange and chlorophyll (Chl) fluorescence parameters of these two species by using LI-6400 portable gas exchange system and PAM-2100 portable pulse-amplitude modulated chlorophyll fluorometer. A midday depression of net photosynthesis (Pn) was observed in both these twoArtemisiaspecies.Pndeclination inA.ordosicawas controlled by non-stomatal factors while the declination inA.sphaerocephalawas controlled by stomatal factors base on the tendency of changes inPn, stomatal conductance (Gs), intercellular CO2concentration (Ci), and stomatal limitation (Ls). The values of maximum photochemical efficiency (Fv/Fm) in these twoArtemisiaspecies typically decreased during the midday hours, indicating in particular the phenomenon of photoinhibition. The midday depression of effective photochemical efficiency (ΦII) along with the increase of regulated non-photochemical quenching of excitation energy (ΦN,O) indicates that regulated (ΦN,P,Q) thermal energy dissipation may be one of the photoprotection mechanisms in these twoArtemisiaspecies. Therefore, the photosynthesis adaptation mechanisms ofArtemisiaspecies to midday high irradiance stress vary among species.

