热带山地雨林不同结构与功能幼树的叶片特征比较1)
张明 刘福德 安树青 欧阳琰
(环境保护部南京环境科学研究所,南京,210042) (天津理工大学) (南京大学) (环境保护部南京环境科学研究所)
热带山地雨林不同结构与功能幼树的叶片特征比较1)
张明 刘福德 安树青 欧阳琰
(环境保护部南京环境科学研究所,南京,210042) (天津理工大学) (南京大学) (环境保护部南京环境科学研究所)
植物的生理生态特征决定了植物在生态系统中的分布模式和物种的丰度。在样地调查的基础上,应用Li-6400光合测定系统,研究了海南热带山地雨林3个层次的6个优势种与10个伴生种的光合作用参数,并测定了相应叶片的比叶面积。结果表明:16个树种的比叶面积为71.16~139.90 cm2·g-1、单位面积最大光合速率(A-area)为2.95~13.27 μmol·m-2·s-1、单位干质量最大光合速率(A-mass)为22.7~126.5 μmol·kg-1·s-1,单位面积暗呼吸速率(Rd-area)为0.02~1.15 μ mol·m-2·s-1、单位干质量暗呼吸速率(Rd-mass)为0.19~12.61 μmol·kg-1·s-1,光补偿点(LCP)为2.5~32.2 μmol·m-2·s-1,表观量子效率(Ф)为0.006 6~0.042 8 μmol·μmol-1。幼树的比叶面积随物种成树所在层次降低而减少(上层种>中层种>下层种),与单位干质量最大光合速率的次序一致,而与光补偿点的次序相反,但差异均不显著(P>0.05)。中层种的幼树具有较高的暗呼吸速率和表观量子效率。优势种的单位面积最大光合速率显著大于伴生种(P<0.05);优势种的单位质量最大光合速率、暗呼吸速率(Rd)和表观量子效率也大于伴生种,但差异不显著(P>0.05);优势种的比叶面积和光补偿点低于伴生种,但差异不显著(P>0.05)。优势种的暗呼吸速率和比叶面积显著正相关(P<0.05);伴生种的暗呼吸速率和比叶面积不相关(P>0.05)。不同类型幼树的叶片结构与功能的生态位分化,从功能性状的角度,为热带雨林维持高生物多样性以及保持物种长期共存提供了一个可能的解释。
光合速率;呼吸速率;优势种;伴生种;比叶面积
热带森林具有极丰富的植物多样性。迄今为止有超过120种假说来解释为什么有如此多的物种生存在热带森林中(如:空间异质性假说、竞争假说、生产力假说、竞争不平衡假说和能量稳定面积假说等[1-5]),但是没有一个假说能完全解释热带森林高生物多样性的原因[6-7]。海南岛热带雨林在演替中后期具有很高的生物多样性和复杂的群落结构[6],而林下幼树对群落结构的更新和生物多样性的维持有重要作用。
叶片是植物进行光合作用的主要器官,也是生态系统中初级生产者的能量转换器。叶片特征直接影响到植物的基本行为和功能。热带雨林中,林下低光照强度对幼树的成长和存活是一个非常严峻的挑战[8]。对此,不同的树种有不同的适应方式[9],树种能改变其幼树适应能力[10],以适应于强光或弱光的不同光环境,顶极树种也能与需要强光的先锋树种在林下共存[11]。研究热带雨林树种的叶片特征有助于理解树种的生存策略。
近年来,国内研究人员从中性理论、生态位分化和密度依赖等方面,对热带雨林物种共存机制和生物多样性维持方面开展了一些研究[12-14]。但是,从植物功能性状方面探讨物种共存机制的研究还较少,关于不同层次的优势种和伴生种叶片特征的比较研究仍然未见报道。本文对海南岛热带雨林演替中期,群落的不同层次优势种和伴生种的幼树在林下的光合作用光响应、暗呼吸和比叶面积进行研究,从生理生态角度探讨热带雨林对林下光照环境的适应能力和不同层次树种幼树的生存策略,为深入研究热带雨林物种共存、演替和高生物多样性的维持提供参考。
1 研究地区自然概况
研究地位于海南岛东南部的吊罗山地区。吊罗山地区气候属于东亚季风区,海拔600 m处的雨林年均温度20.8 ℃,最热月均温度23.9 ℃,最冷月均温度16.3 ℃,全年大于10 ℃的积温7 990 ℃,年降水量2 570 mm。成土母岩为花冈岩和闪长岩,土壤为山地黄壤[15]。样地海拔910~940 m,植被类型属于热带山地雨林,处于演替中期。主要树种有:山杜英(Elaeocarpussylvestris)、琼崖柯(Lithocarpusfenzelianus)、短刺栲(Castanopsisechidnocarpa)、瘤果柯(Lithocarpushandelianus)、阿丁枫(Altingiaobovata)、鸭脚木(Scheffleraoctophylla)、野漆(Toxicodendronsuccedaneum)、细刺栲(CastanopsistonkinensisSeem)、尾叶柯(Lithocarpuscaudatilimbus)、钝齿木荷(Schimacrenata)、黄樟(Cinnamomumparthenoxylon)、海南黄叶树(Xanthophyllumhainanense)、鱼骨木(Canthiumdicoccum)、微毛山矾(Symplocoswikstroemiifolia)、吊罗栎(Quercustiaoloshanica)、子楝树(Decaspermumgracilentum)、海南杨桐(Adinandrahainanensis)、保亭梭罗(Reevsiabotingensis)、洼皮冬青(Ilexnuculicava)、多花五月茶(Antidesmamaclurei)、嘉锡树(Caseariaglomerata)等。优势种有:丛花山矾(Symplocospoilanei)、尾叶柯(Lithocarpuscaudatilimbus)、交让木(Daphniphyllumpaxianum)、楔叶柃(Euryacuneata)、海南大头茶(Gordoniahainanensis)、木荷(Schimasuperba)、海南赤杨叶(Alniphyllumfortunei)、铁山矾(Symplocospseudobarberina)、鸭脚木、短刺栲、海南杨桐、五列木(Pentaphyllaxeuryoides)、广东钩樟(Linderakwangtungensis)、湿地松(Pinuselliottii)、子楝树和长柄鼠李(Rhamnushainanensis)[6,16]。
2 研究方法
物种的选取:设置演替中期的样地5 000 m2,分为50个10 m×10 m的小样方,记录样方内每个物种的种名、胸径、高度、相对坐标[16]。群落优势种按优势度分析法确定[16]。根据计算结果,选择6个优势种与10个在样地中出现频度较高的伴生种(见表1)。每个物种3~5个,选取0.5~3 m高的幼苗幼树进行测量,每株选取3片完全舒展并且成熟的未受损叶片[17]。
光响应曲线的测定:于2006年3—4月份,对所选物种进行光合的测定,选择完全舒展并且成熟的未受损叶片,每株3片;用LI-6400 便携式光合作用系统(LI-COR,Inc,USA)测定叶片的光响应曲线。使用开放气路,空气流速为0.5 L·min-1,大气温度(26±1)℃;空气中相对湿度50%~70%;CO2摩尔分数(380±10)μ mol·mol-1。为了测量的准确和便于比较,测量都在天气晴朗的上午8:00~11:30进行,人工光源使用6400-02B内置式红蓝光源。由于林下不同幼苗幼树的微环境略有差异,在测量前使用人工光源进行5~10 min的光合诱导。光合有效辐射梯度设置为2 500、2 000、1 500、1 000、500、200、100、50、20、0 μmol·m-2·s-1[17]。
比叶面积的测定:从测定光合的每株幼树上采集10~15片完全展开并且健康的叶片,用光电叶面积仪测定叶片的面积,然后带回实验室用烘箱烘干(105 ℃下杀青30 min,然后80 ℃连续烘干48 h),称量烘干质量。比叶面积(SLA)定义为叶面积与烘干质量的比值[18-19]。
数据分析:得到的光强-光合数据,根据Prioul & Chartier[20]提供的模型进行非线性回归拟合。具体模型为:
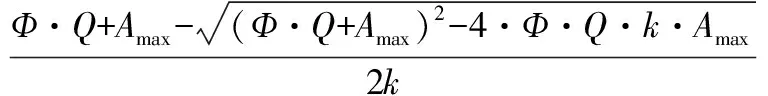
其中:A表示净光合速率,Amax表示最大净光合速率,Ф表示表观量子效率,k表示曲角,Rday表示光下呼吸速率,Q表示光合有效辐射。
试验所得数据采用SPSS13.0软件进行分析,采用最小显著差法(LSD)对植物进行种间多重比较并进行相关分析和T检验。
3 结果与分析
3.1 树种间叶片特征差异
由表1可知,上层伴生种黄樟幼树叶片的比叶面积最大,其次为中层伴生种鱼骨木。中层伴生种吊罗栎的比叶面积最低,其次为下层伴生种洼皮冬青和中层伴生种微毛山矾,三者较为接近。黄樟和鱼骨木的SLA最高,叶片相对其它树种薄,更适应林下光环境;而吊罗栎、洼皮冬青和微毛山矾的适应能力则较低。黄樟的SLA比吊罗栎高出96.6%,SLA在种间变化范围不大。SLA与植物叶片长期生长的光环境密切相关[21],SLA较小的变化范围说明植物对林下低光环境有共同的反应[22-24]。SLA大,则单位干质量叶的面积大,干质量叶的捕光能力增,利于树种在弱光环境中生长。高SLA是植物对弱光环境做出的典型的形态学反应, 这种形态学反应也可以增加叶片同化组织对输导组织和结构组织的相对比例[25-26],导致单位叶面积呼吸速率(Rd-area)降低, 从而利于碳的净积累[27]。各树种间SLA变化幅度不大。而与Quilici et al.[28]研究的热带山地雨林先锋树种幼树的SLA相比,相对较高。因此,不同层次物种以及优势种与伴生种在适应林下低光环境时,在叶片性状上选择了相似的适应策略。 单位面积最大光合速率(A-area)以中层伴生种海南黄叶树最低,中层伴生种鱼骨木次之;短刺栲、鸭脚木、黄樟和保亭梭罗单位面积最大光合速率较高,比海南黄叶树高9倍左右。以单位干质量表示的最大光合速率(A-mass),仍然以海南黄叶树最低,黄樟、鸭脚木、短刺栲和保亭梭罗较高。最大光合速率在种间差异较大,数值变化范围与张明等[17]对150个树种的幼苗幼树研究结果相似。最大光合速率高,有利于干物质的积累,以用于树干和树枝的生长。最大光合速率的差异显示出不同树种的生态位分化。
单位叶面积暗呼吸速率(Rd-area)以鸭脚木的最高;多花五月茶、阿丁枫、洼皮冬青、尾叶柯和鱼骨木最低,为鸭脚木的1.74%~8.70%。单位叶质量暗呼吸速率(Rd-mass)仍然以鸭脚木最高,多花五月茶最低。光合作用补偿点(LCP)以短刺栲和黄樟的最低,最高的是尾叶柯,约为短刺栲的13倍。海南杨桐的光合作用表观量子效率(Ф)最高,其次为多黄五月茶和黄樟;最低为微毛山矾。Rd-area、Rd-mass、LCP与Ф的种间差异较大。
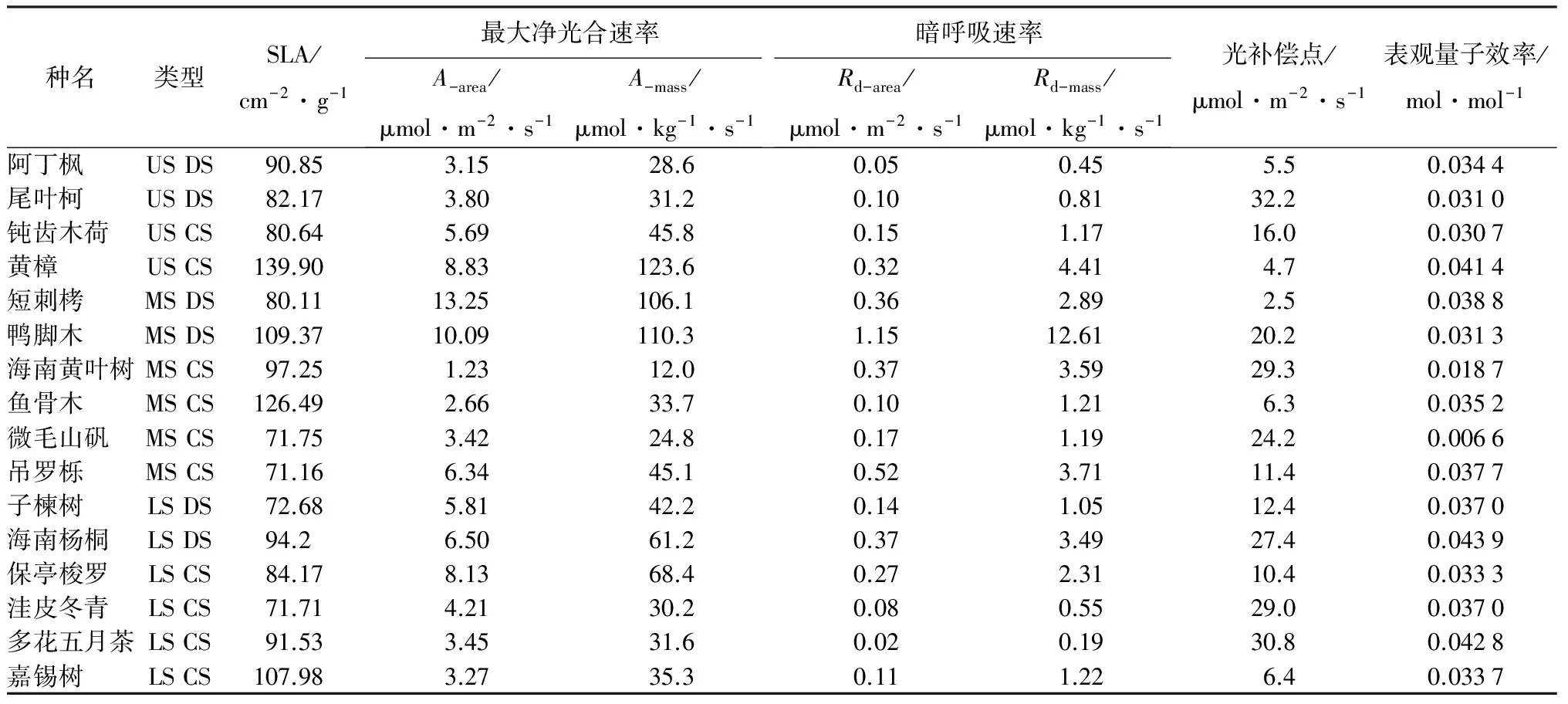
表1 不同树种的比叶面积和光合作用光响应参数
注:US表示上层种,MS表示中层种,LS表示下层种,DS表示优势种,CS表示伴生种。
3.2 不同层次树种间光合特征
由表2可知,从上层种到下层种,SLA和A-mass逐渐减少,但差异不显著(P>0.05);而光补偿点LCP则相反,但差异也不显著(P>0.05)。中层种的单位面积暗呼吸速率(Rd-area)与表观量子效率(Ф)显著大于上层种和下层种(P<0.05);中层种的单位干重暗呼吸速率(Rd-mass)大于下层种,且差异显著(P<0.05);也大于上层种,但差异不显著(P>0.05)。表观量子效率主要反映低光照下,植株利用太阳有效辐射的能力,反映了光化学变化效率。中层种表观量子效率高,在低光照度下,潜在光合作用能力强,有利于其迅速生长进入群落中层。而中层种的暗呼吸速率较高,虽然不利于碳蓄积,但在其极强的低光照利用能力作用下,仍然能够在竞争中占领群落中层。不同层次树种的单位叶质量暗呼吸速率(Rd-mass)存在显著差异,可能是形成不同层次的内在原因。
下层种、中层种和上层种的SLA和A-mass依次升高,而LCP则依次降低,说明3种类型的幼树对林下的低光环境的适应能力和对光斑的利用能力依次增强。Thomas et al.[10]对马来西亚雨林的研究也发现,林下幼树的A-mass随物种的最大高度增加而升高。林下幼苗要达到中上层,较快的生长速率是必需的,这就要求要有较高的最大光合速率[29]。上层种黄樟的比叶面积和单位干质量最大光合速率均最高,同时又具有较低的暗呼吸速率和光补偿点,反应出物种对林下低光环境的高度适应。高层次分布的物种具有较高的光合速率和较低的光补偿点,则与物种的遗传因素有关。中层种有较高的暗呼吸速率,与相对下层种较高的SLA有关;SLA高,将N分配于优化光的捕获,植物以较大的羧化速率表现出相对较高的最大光合速率[30-33]。
各层次间树种的最大光合速率无显著差异,说明在各层次树种之间不存在生存竞争关系,资源互益性利用或互补性利用占主导地位。因此,说明演替中期的群落结构正逐渐趋于稳定。
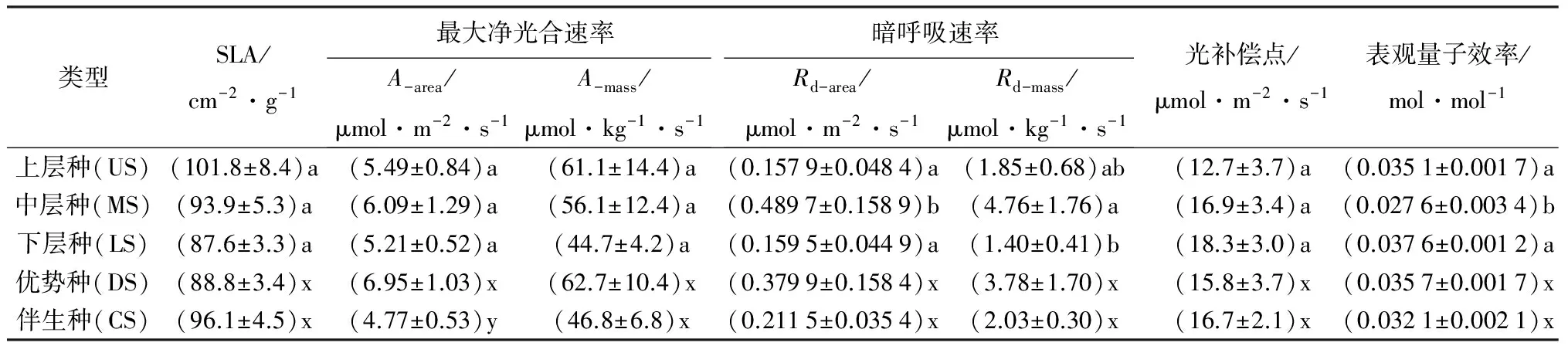
表2 不同层次树种以及优势种、伴生种的比叶面积和光合作用光响应参数
注:表中数值为“平均值±标注差”,同列不同小写字母表示差异显著(P<0.05)。
3.3 优势种与伴生种光合特征
由表2可知,优势种的单位面积最大光合速率(A-area)显著大于伴生种(P<0.05);优势种的单位质量最大光合速率、暗呼吸速率(Rd-area与Rd-mass)和表观量子效率也大于伴生种,但差异不显著(P>0.05);优势种的比叶面积和光补偿点低于伴生种,但差异不显著(P>0.05)。优势种在群落中不仅占有较广泛的生境范围,利用较多资源,具有较高生产力,而且具有较大容量的能量。高生产力则来源于其光合作用能力。该研究中,优势种的最大光合速率和暗呼吸速率都高于伴生种,说明优势种的耐阴性低于伴生种,优势种对林下光斑的利用能力强,同时夜间呼吸损失也较大。优势种相对伴生种具有较低的光补偿点和较高的表观量子效率,说明其光合作用对光斑的利用能力强,且效率高。表明优势种的幼树更能适应林下低光环境。黄樟幼树具有最高的单位质量最大光合速率和较高的适应能力,使其生长成为上层种,但不是优势种,可能与繁殖方式有关。伴生种的比叶面积相对优势种的大,却具有较低的暗呼吸速率,这与其最大光合速率低有关。由于热带雨林物种的多样性和群落结构的复杂性,目前尚无优势种与伴生种的光合特征数据可供比较。在草本植物中,也发现优势种的光合速率高于伴生种这一现象[34-35]。
在上层种中,伴生种的A-area、A-mass、SLA显著大于伴生种(P<0.05);而在中层种中结果恰恰相反,优势种的A-area、A-mass、Rd-area、Rd-mass显著大于伴生种(P<0.05);在下层种中,优势种与伴生种间光合特征差异不显著(P>0.05)。优势种与伴生种的最大光合速率的高低在各个层次中的不同,反映了群落层次的形成与树种的光合作用特征密切相关。各个层次的优势种和伴生种有着不同的适应策略。
3.4优势种与伴生种光合特征与比叶面积之间的关系
由图1可知,无论是单位叶面积暗呼吸速率(Rd-area),还是单位叶质量暗呼吸速率(Rd-mass),均与比叶面积(SLA)之间存在显著相关关系。优势种的暗呼吸速率与比叶面积正相关,而伴生种的暗呼吸速率与比叶面积负相关。其它光合特征参数与比叶面积无相关关系,说明优势种与伴生种的光合特征存在显著差异,而这种不同与叶片结构特征相关。

图1 海南岛热带雨林优势种与伴生种的暗呼吸速率与比叶面积关系
4 结论与讨论
生物多样性的维持通常定义为在同一空间中生态学相似的物种共存[36]。这些生态学相似的物种往往属于同一功能团,对周围的资源与环境具有共同的需求。因此,生物多样性维持的机制其实就是群落中物种共存的机制。
植物群落组成不仅取决于其生长环境因素的作用,而且也受群落内物种间的相互作用的影响。在演替过程中,经过局部环境筛选的植物,都能适应其周围小生境的环境,从而进行繁殖与群落的更新。在此过程的作用下,功能相似的物种则处于相同的生态位,使得群落内各物种的特征趋于相同[37]。该研究中,各树种间SLA变化幅度不大,与郑征等[9]、Santiago et al.[38]研究的热带雨林林下树种结果类似。因此,不同层次物种以及优势种与伴生种在适应林下低光环境时,在叶片性状上选择了相似的适应策略。
群落内物种间存在相互作用,从而使得相似的物种间产生种间竞争,最终导致群落物种的特征趋异发展[39-40]。单位面积最大光合速率(A-area)以短刺栲、鸭脚木、黄樟和保亭梭罗较高,比海南黄叶树高9倍左右。单位叶面积暗呼吸速率(Rd-area)以多花五月茶、阿丁枫、洼皮冬青、尾叶柯和鱼骨木最低,仅为鸭脚木的1.74%~8.70%。光合作用补偿点(LCP)最高的是尾叶柯,约为短刺栲的13倍。各物种间光合特征的差异显示出不同树种的生态位分化。
不同层次树种的单位叶质量暗呼吸速率(Rd-mass)存在显著差异,这可能为群落中不同层次的物种共存机制和群落结构形成提供了解释。优势种的暗呼吸速率与比叶面积正相关,而伴生种的暗呼吸速率与比叶面积负相关。优势种与伴生种在光合特征与叶片结构上的不同策略,可能是群落组成格局的内在机制。因此,无论从群落结构的不同层次的形成,还是优势种与伴生种的群落组成格局来看,群落的构建与物种的叶片特征仍然存在一定相关性,而不是随机的生态漂变。
综上所述,该研究更加支持生态位分化对热带雨林的生物多样性维持和物种共存的作用。不同树种在遗传上的不同,决定了其所能达到分布层次的不同,因此,幼树在生理上也表现不同的光合特征,对林下的低光环境有不同的适应策略。冠层树种的幼树不仅在光合特征上显示优势,在其它方面也表现出生长、形态和繁殖的优越性。但并不是所有的上层种都能成为优势种,优势种只在最大光合速率上表现出显著的优越性,这可能与植物的繁殖策略有关,有待进一步研究。
[1] PIELOU E C. Species-diversity and pattern diversity in the study of ecological succession[J]. Journal of Theoretical Biology,1966,10(2):370-383.
[2] PIANKAE R. Evolutionary ecology[M]. New York: Harper and Row,1974.
[3] CONNELL J H. Dynamics of populations[M]. Wageningen:Center for Agricutural Publishing and Documentation,1971:298-310.
[4] HUSTON M. A General hypothesis of species diversity[J].The American Naturalist,1979,113(1):81-101.
[5] WILSON E O. The diversity of life[M]. Cambridge: The Belknap Press of Harvard University Press,1992.
[6] 安树青,王铮峰,曾繁敬,等.海南吊罗山热带山地雨林植物种类多样性研究[J].中山大学学报(自然科学版),1999,38(6):78-83.
[7] 王铮锋,安树青,DAVID G C,等.海南岛吊罗山山地雨林物种多样性[J].生态学报,1999,19(1):61-67.
[8] CHAZDON R L, PEARCY R W, LEE D W, et al. Photosynthetic responses of tropical forest plants to contrasting light environment[M]//Mulkey S S, Chazdon R L, Smith A P. Tropical Forest Plant Ecophysiology. New York: Chapman and Hall,1996.
[9] 郑征,曹敏.西双版纳热带季节雨林6种树种幼树在林下的光合作用[J].植物生态学报,1998,22(6):499-504.
[10] THOMAS S C, BAZZAZ F A. Asymptotic height as a predictor of photosynthetic characteristics in malaysian rain forest trees[J]. Ecology,1999,80(5):1607-1622.
[11] BROWN N D, WHITMORE T C. Do dipterocarp seedlings really partition tropical rain forest gaps?[J]. Philosophical Transactions of The Royal Society B (Biological Sciences),1992,335:369-378.
[12] LAN G Y, GETZIN S, WIEGAND T, et al. Spatial distribution and interspecific associations of tree species in a tropical seasonal rain forest of China[J]. Plos One,2012,7(9):1-9.
[13] LIN L X, COMITA L S, ZHENG Z, et al. Seasonal differentiation in density-dependent seedling survival in a tropical rain forest[J]. Journal of Ecology,2012,100(4):905-914.
[14] HU Y H, SHENG D Y, XIANG Y Z, et al. The environment, not space, dominantly structures the landscape patterns of the richness and composition of the tropical understory vegetation[J]. Plos One,2013,8(11):1-16.
[15] 鲍士旦.土壤农业化学分析[M].北京:中国农业出版社,2000.
[16] 王文进,张明,刘福德,等.海南岛吊罗山热带山地雨林2个演替阶段的种间联结性[J].生物多样性,2007,15(3):257-263.
[17] 张明,王文进,刘福德,等.海南热带山地雨林幼苗幼树的光合能力与水分利用效率[J].应用生态学报,2007,18(10):2160-2166.
[18] SHIPLEY B, ALMEIDA-CORTEZ J. Interspecific consistency and intraspecific variability of specific leaf area with respect to irradiance and nutrient availability[J]. Ecoscience,2003,10(1):74-79.
[19] 陈飞宇,罗天祥,张林,等.江西九连山常绿阔叶林主要树种叶建成消耗的比较[J].生态学报,2006,26(8):2485-2493.
[20] PRIOUL J L, CHARTIER P. Partitioning of transfer and carboxylation components of ntercellular resistance to photosynthetic CO2fixation: a critical analysis of the method used[J]. Annals of Botany,1977,41:789-800.
[21] ROSATI A, BADECK F W, DEJONG T M. Estimating canopy light interception and absorption using leaf mass per unit leaf area in Solanum melongena[J]. Annals of Botany,2001,88(1):101-109.
[22] SENEVIRATHNA A M, STIRLING C M, RODRIGO V H. Growth, photosynthetic performance and shade adaptation of rubber (Heveabrasiliensis) grown in natural shade[J]. Tree Physiology,2003,23(10):705-712.
[23] LANHAUSSER S M, LIEFFERS V J. Photosynthesis and carbon allocation of six boreal tree species grown in understory and open conditions [J].Tree Physiology, 2001, 21(4): 243-250.
[24] GRONINGER J W, SEILER J R, PETERSON J A, et al. Growth and photosynthetic responses of four Virginia Piedmont tree species to shade[J]. Tree Physiology,1996,16(9):773-778.
[25] WRIGHT I J, REICH P B, WESTOBY M. Strategy shifts in leaf physiology, structure and nutrient content between species of high-and low-rainfall and high-and low-nutrient habitats[J]. Functional Ecology,2001,15(4):423-434.
[26] LAMBERS H, POORTER H. Inherent variation in growth rate between higher plants: a search for physiological causes and ecological consequences[M]//Begon M, Fitter A H eds. Advances in Ecological Research. London: Academic Press,1992.
[27] PEARCY R W, SIMS D A. Photosynthetic acclimation to changing light environments: scaling from the leaf to the whole plant[M]//Caldwell M M, Pearcy R W. Exploitation of environmental heterogeneity by plant: eco-physiological processes above-and-below ground. San Diego: Academic Press,1994.
[28] QUILICI A, MEDINA E. Photosynthesis-nitrogen relationships in pioneer plants of disturbed tropical montane forest sites[J]. Photosynthetica,1998,35(4):525-534.
[29] REICH P B, WALTERS M B, ELLSWORTH D S. From tropics to tundra: global convergence in plant functioning[J]. Proceedings of the National Academy of Sciences (USA),1997,94(25):13730-13734.
[30] REICH P B, WALTERS M B, ELLSWORTH D, et al. Relationships of leaf dark respiration to leaf nitrogen, specific leaf area and leaf life-span: a test across biomes and functional groups[J]. Oecologia,1998,114(4):471-482.
[31] EVANS J R. Photosynthesis and nitrogen relationships in leaves of C3 plants[J]. Oecologia,1989,78(1):9-19.
[32] LUSK C H, REICH P B. Relationships of leaf dark respiration with light environment and tissue nitrogen content in juveniles of 11 cold-temperate tree species[J]. Oecologia,2000,123(3):318-329.
[33] REICH P B, WALTERS M B, TJOELKER M G, et al. Photosynthesis and respiration rates depend on leaf and root morphology and nitrogen concentration in nine boreal tree species differing in relative growth rate[J]. Functional Ecology,1998,12(3):395-405.
[34] 朱慧,马瑞君.入侵植物假臭草及其伴生种的光合特性[J].福建林学院学报,2010,30(2):145-149.
[35] 朱慧,马瑞君.入侵植物马缨丹(Lantanacamara)及其伴生种的光合特性[J].生态学报,2009,29(5):2701-2709.
[36] CHESSON P. Mechanisms of maintenance of species diversity[J]. Annual Review of Ecology and Systematics,2000,31(1):343-366.
[37] LAVOREL S, GARNIER E. Predicting changes in community composition and ecosystem functioning from plant traits: revisiting the Holy Grail[J]. Functional Ecology,2002,16(5):545-556.
[38] SANTIAGO L S, WRIGHT S J. Leaf functional traits of tropical forest plants in relation to growth form[J]. Functional Ecology,2007,21(1):19-27.
[39] ACKERLY D, SCHWILK D, WEBB C. Niche evolution and adaptive radiation: testing the order of trait divergence[J]. Ecology,2006,87(S7):50-61.
[40] GRIME J. Trait convergence and trait divergence in herbaceous plant communities: mechanisms and consequences[J]. Journal of Vegetation Science,2006,17(2):255-260.
ComparisonofLeafTraitsoftheSaplingsofDifferentStructuralandFunctionalSpeciesinTropicalMontaneRainForest//
Zhang Ming
(Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection, Nanjing 210042, P. R. China);
Liu Fude
(Tianjin University of Technology); An Shuqing(Nanjing University);
Ouyang Yan
(Nanjing Institute of Environmental Sciences, Ministry of Environmental Protection)//Journal of Northeast Forestry University,2017,45(9):13-17,23.
Photosynthetic rate; Respiration rate; Dominant species; Companion species; Specific leaf area
Q945;S757
1)中央级公益性科研院所基本科研业务费专项(2016-04)。
张明,男,1982年7月生,环境保护部南京环境科学研究所,助理研究员。E-mail:zhangming@nies.org。
欧阳琰,环境保护部南京环境科学研究所,副研究员。E-mail:oyy0723@163.com。
2017年4月12日。
责任编辑:王广建。
We studied the differences of leaf traits between dominant species and companion species, and differences among three different layers. Based on sample-plot survey, leaf traits of six dominant species and ten companion species from three different layers of tropical montane rain forest were measured in Hainan Island, by using a Li-6400 portable photosynthesis system. Leaves were sampled to measure its specific leaf area (SLA). SLA andA-massof saplings decreased with their mature tree height reducing, and had the descending order of upper layer species, middle layer species and lower layer species, while the order of LCP was opposite, but there were no significant differences among three groups (P>0.05). Middle layer species had a higherRdand Ф than those of the other.A-areaof dominant species was significantly higher than that of companion species (P<0.05). TheirA-mass,Rdand Ф were also higher than those of companion species, while their SLA and LCP were lower than those the latter, but there was no significant difference here (P>0.05).Rdof dominant species was positively correlated with SLA (P<0.05), but for companion species there was no correlation betweenRdand SLA (P>0.05). The ecological niche differentiation of leaf structure and function of different type saplings provides a potential explanation for the high diversity of tropical rainforest.

