镉胁迫下增施氮对白三叶草生长的影响和镉毒害的缓解效应研究
董姬妃,张帆,胡雨寒,李俊承,李维,王娴淑
(四川农业大学风景园林学院,四川 成都 611130)
镉胁迫下增施氮对白三叶草生长的影响和镉毒害的缓解效应研究
董姬妃,张帆*,胡雨寒,李俊承,李维,王娴淑
(四川农业大学风景园林学院,四川 成都 611130)
为了解镉(Cd)胁迫下施加外源氮对植物生长生理的影响及解毒机理, 本研究采用盆栽试验, 以白三叶草为材料, 研究了在重金属镉(CdCl2·2.5H2O)胁迫下施加氮[CO(NH2)2]对其生长、叶绿素含量、抗氧化酶活性、镉含量、谷胱甘肽(GSH)和植物络合素(PCs)含量的影响。结果表明, 单独的Cd处理显著抑制白三叶草生长及叶绿素的合成;而镉胁迫下施加氮显著促进了白三叶草的生长, 其生物量和叶绿素含量显著提高。同时, 镉胁迫下增施氮显著提高了植株过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性及白三叶草植株体内镉含量。单独镉处理显著增加了PCs含量, GSH含量显著降低;而镉胁迫下增施氮使GSH和PCs含量均显著增加。由此说明, 外源氮素在植物对重金属镉的解毒过程起到了重要的作用, 缓解了镉对白三叶草的毒害。
镉胁迫;氮;白三叶草;生长生理;GSH;PCs;解毒作用
随着工业化和城市化进程的快速发展, 土壤重金属污染问题已日益突出[1]。重金属镉(Cd)污染已严重影响着植物的正常生长和人类的健康[2-3]。因此, 重金属镉污染土壤的治理问题亟待解决。已有研究表明, 镉对植物的毒害主要体现在抑制植株生长, 影响植物开花, 降低植株对逆境的抗性[4-6]。
尽管镉对植物有一定的毒性, 但某些植物在长期的生长发育过程中对Cd胁迫产生了一定的耐性。植物耐镉机理主要有:限制镉的吸收, 细胞壁或细胞外碳水化合物对镉的固定, 抗氧化防御系统的作用以及氨基酸或抗逆蛋白的合成, 液泡的区室化作用, 金属硫蛋白(MTs)或者植物络合素(PCs)与Cd2+的结合[7-10]。
虽然植物对重金属镉具有一定的耐性, 但是当土壤中镉浓度过高时, 植物则受到Cd毒害。因此, 随着镉污染日益严重, 找到一种低成本、高效率的土壤修复方法迫在眉睫。植物修复是指植物吸收、转移、富集以及降解等机制来降低土壤中重金属的含量, 使土壤得到修复和治理[11-14]。与传统的物理、化学修复方法相比, 植物修复技术具有以下优点:成本低;不破坏土壤生态环境;通过对植物的集中处理, 不易产生二次污染;易为公众接受。因此, 用对Cd具有高富集效应的植物来修复Cd污染土壤是一种经济、彻底的有效措施。
单纯利用植物进行重金属污染土壤的修复效果不显著, 因此人工干预植物修复以提升修复效果显得极为重要。研究表明, 氮素是植物生长必需营养元素之外[15-17], 还能缓解重金属毒害, 提高植物对重金属的富集能力。因此, 在应用重金属超富集植物进行土壤重金属污染修复时合理施用氮肥会使植物修复土壤的效率得以提高[17-18]。但是氮素在植物解毒过程中的作用机制尚不明确。因此, 研究氮素在植物的解毒过程中的作用具有重要意义。
在重金属镉污染土壤的植物修复中, 东南景天(Sedumalfredii)、滇苦菜(Picrisdivaricata)及圆锥南芥(Arabispaniculata)等超富集植物已得到广泛应用, 但它们大部分植物生长缓慢、生物量较低、镉迁移总量较小且景观价值不高, 不适宜大面积镉污染土壤的修复[19]。而园林地被植物具有个体小、种类多、生长快等特点[20]。生长一段时间后可整株移出, 不会对土壤造成二次污染。白三叶草(Trifoliumrepens)为多年生草本植物, 其适应性广, 观赏价值较高, 主要用于草地建设, 因此具有较好的生态价值和经济价值[21-22]。目前, 对于白三叶草重金属镉胁迫方面的研究, 多集中于镉对白三叶草粗蛋白种类和含量的影响, 以及镉对其养分代谢的影响[21,23], 而关于氮素在白三叶缓解镉毒害过程中的作用机理鲜有报道。因此, 本研究以白三叶草为材料, 采用盆栽试验, 研究镉胁迫下施加氮对其生长生理的影响及对镉毒害的缓解效应, 以期探讨氮素在白三叶草重金属镉解毒过程中的重要作用, 为镉污染土壤的植物修复提供理论参考。
1 材料与方法
1.1材料
供试植物材料为由四川省农业科学院提供的“拉丁诺”白三叶草种子。供试土壤为不含腐根、腐叶的自然土壤。土壤理化性质为:pH 6.3、有机质13.87 g/kg、全氮0.58 g/kg, 全磷0.39 g/kg, 全钾2.95 g/kg, 水解氮36.56 mg/kg, 速效磷19.62 mg/kg, 速效钾48.34 mg/kg, 镉含量0.549 mg/kg。
1.2试验方法
2015年10月至2016年9月, 试验在四川农业大学成都校区温室大棚及五教实验室内进行。供试土壤经自然风干后, 捣碎、剔除杂物、研磨, 过5 mm筛, 装入内径21.5 cm, 深16.5 cm的圆形塑料花盆中, 每盆装土2.5 kg。将白三叶草种子消毒后播种于干净的沙穴盘中。待幼苗长出5片真叶时选取生长良好、生物量一致的白三叶草幼苗移栽至塑料盆, 每盆5株, 种植深度1.5~2.0 cm, 并进行常规养护管理。待白三叶草恢复生长后, 按表1进行处理, 共设置4个处理, 3次重复。每隔7 d, 加入浓度为75 mg/kg的Cd2+(0.3810 g CdCl2·2.5H2O)和0.1001 g CO(NH2)2(N含量0.0467 g), 待单独镉处理的植株叶片出现症状后进行测定。
1.3指标测定及方法
1.3.1生长量与生物量的测定 采用游标卡尺测量主根长及地上部高度。将收获的植株用蒸馏水充分洗净植株上附着的杂质, 根系在20 mmol/L乙二胺四乙酸二钠(EDTA-Na2)溶液中浸泡30 min, 以去除根系表面黏附的金属离子(Cd2+), 再用去离子水冲洗干净, 沥去水分后, 将植株分为根、茎、叶三部分(茎秆与叶片为地上部), 将每部分放置于烘箱中105 ℃杀青30 min, 然后在80 ℃下烘干至恒重, 分别称量每部分干重。3次重复。
1.3.2叶绿素含量测定 采用抽提法测定叶绿素含量。取成熟叶片去主脉, 称取0.200 g 放入具塞试管。加入25 mL 80%丙酮和95%乙醇混合提取液(体积比为1∶1)后放入温度为35 ℃的振荡培养箱中, 暗处浸提12 h, 当叶片呈苍白色时测OD663 nm和OD645 nm, 参照熊庆娥[24]的方法分别测定叶绿素a 和b的含量。3次重复。

表1 白三叶草在重金属镉处理下增施氮的试验方案Table 1 Experimental design of nitrogen supplement on T. repens under Cd stress
1.3.3抗氧化酶活性测定 称取植物材料1.0 g, 加入0.02 mol/L磷酸缓冲液(PBS)5 mL, 研磨成匀浆, 以3000 r/min离心10 min, 上清液即为酶液。1)取1 mL酶液和3 mL反应混合液(取50 mL 0.1 mol/L PBS于烧杯中, 加入28 μL愈创木酚, 加热搅拌至溶解, 待溶液冷却后, 加入19 μL 30%过氧化氢), 测OD470 nm。计算过氧化物酶(POD)活性。2)取0.05 mL酶液和2.95 mL反应混合液(130 mmol/L 甲硫氨酸溶液、750 μmol/L 氮蓝四唑溶液、100 μmol/L EDTA-Na2、20 μmol/L 核黄素溶液各0.3 mL, 0.5 mol/L PBS 1.5 mL及蒸馏水0.25 mL)混合后在4000 lx日光下反应20 min, 避光测OD560 nm。计算超氧化物歧化酶(SOD)活性。3)取0.1 mL酶液和3 mL反应混合液(取200 mL PBS, 加入0.3092 mL H2O2摇匀), 测定OD240 nm(测定40 s)。计算过氧化氢酶(CAT)活性。POD、SOD和CAT活性均参照熊庆娥[24]的方法测得。3次重复。
1.3.4镉含量的测定 称取烘干磨细植物样品0.3000 g于三角瓶中, 加HNO3-HClO4(体积比为4∶1)混合液20 mL, 静置≥5 h。盖上漏斗, 在电热板上加热0.5 h, 直到瓶内有大量白烟, 继续加热, 使白烟慢慢消失, 溶液呈无色透明尚有2 mL时停止加热。冷却后用蒸馏水洗入25 mL容量瓶, 定容。用原子发射光谱仪(ICP)测定植物Cd含量。3次重复。
称取土样1.0000 g于聚四氟乙烯坩埚内, 加几滴蒸馏水润湿, 再加15 mL氢氟酸(HF)与10 mL HClO4-HNO3(体积比为1∶1)混合液消化至干, 再加5 mL HNO3, 消化至干, 加5 mL 2 mol/L盐酸, 溶解摇匀, 定容至25 mL容量瓶。用原子发射光谱仪(ICP)测定土壤Cd含量。3次重复。
根部和地上部镉的生物富集系数(BCF)的计算公式如下:

1.3.5谷胱甘肽(GSH)、植物络合素(PCs)含量测定 1)称取1.0 g材料置于研钵中, 加入5 mL预冷后的50 g/L 三氯醋酸(TCA)(含0.05 mol/L EDTA-Na2),冰浴研磨, 于4 ℃、17600 r/min离心20 min。取上清液根据荧光法测定GSH含量[25]。2)取0.5 g材料, 加少量5%磺基水杨酸(SSA), 冰浴研磨, 于4 ℃、17600 r/min离心30 min。所得上清液参照Rama等[26]的方法测定非蛋白巯基总量(NPT), 参照郝建军等[27]的方法测定总谷胱甘肽含量(还原型谷胱甘肽GSH+氧化型谷胱甘肽GSSG)。PCs的含量=非蛋白巯基总量-总谷胱甘肽含量, 即采用差减法[28]。3次重复。
1.4数据处理与统计分析
采用Microsoft Excel 2003进行相关性分析;采用DPS数据软件进行方差分析和LSD法分析差异显著性。
2 结果与分析

图1 氮素对镉胁迫下白三叶草生长及生物量的影响Fig.1 Effects of nitrogen on growth and biomass of T. repens under Cd stress 图中数值为平均值±标准误。不同小写字母表示处理间差异显著(P<0.05), 不同大写字母表示处理间差异极显著(P<0.01)。下同。Data in the figure are means±SE. Different lowercase letters indicate significant difference among the treatments (P<0.05); Different capital letters indicate extraordinarily significant difference among treatments (P<0.01). The same below.
2.1氮素对镉胁迫下白三叶草生长及生物量的影响
由图1可知, 单独的镉处理(T1)显著抑制了白三叶草的生长, 其地上部高、主根长、生物量分别比对照降低20.46%, 29.30%和31.61%。与对照相比, 单独氮处理(T2)显著增加了地上部高和生物量, 分别增加了30.54%和14.05%, 但主根长与对照相比无显著差异。而镉胁迫下增施氮(T3)显著促进了白三叶草的生长, 与对照相比, 其地上部高、主根长、生物量分别增加了28.75%, 25.99%和14.05%。此外, 镉胁迫下增施氮(T3)处理, 其地上部高和生物量均极显著高于单独镉处理(T1), 主根长极显著高于单独氮处理(T2)(P<0.01)。由此说明高浓度的Cd处理抑制了植物的生长, 但镉胁迫下增施氮能缓解Cd对白三叶草生长的抑制作用。
2.2氮素对镉胁迫下白三叶草叶绿素含量的影响
由图2可知, 单独镉处理严重影响了叶绿素的合成, 尤其是叶绿素a。其叶绿素a、叶绿素b和总叶绿素分别比对照降低了40.98%, 19.80%和33.99%。与对照相比, 单独氮处理(T2)中叶绿素a、叶绿素b和总叶绿素含量显著提高, 分别增加了32.68%, 19.80%和28.43%。而镉胁迫下增施氮处理, 其植株叶绿素a、叶绿素b和总叶绿素分别比对照高26.83%, 28.71%和27.45%, 与单独氮处理均无显著差异。此外, 镉胁迫下增施氮(T3)处理, 其叶绿素a、叶绿素b和总叶绿素均极显著高于单独镉处理(T1)(P<0.01)。说明高浓度的Cd处理影响叶绿素合成, 尤其是叶绿素a, 而镉胁迫下施加氮能增加叶绿素的含量, 缓解重金属镉对白三叶草的毒害作用。2.3氮素对镉胁迫下白三叶草抗氧化酶系统的影响
由图3可知, 单独镉处理的植株, 其POD、SOD及CAT活性分别比对照降低了31.71%, 32.91%和41.59%, 其中POD和CAT活性与对照差异达极显著(P<0.01)。说明高浓度的镉降低了抗氧化酶的活性, 导致活性氧积累, 从而毒害植株。而镉胁迫下增施氮处理, 其POD、SOD及CAT活性与对照相比, 差异不显著(P>0.05), 但与单独镉处理相比, 差异达极显著。说明镉胁迫下增施氮能显著提高白三叶草体内抗氧化酶活性, 以维持体内活性氧的产生与清除的动态平衡, 进而缓解镉对植株的毒害。
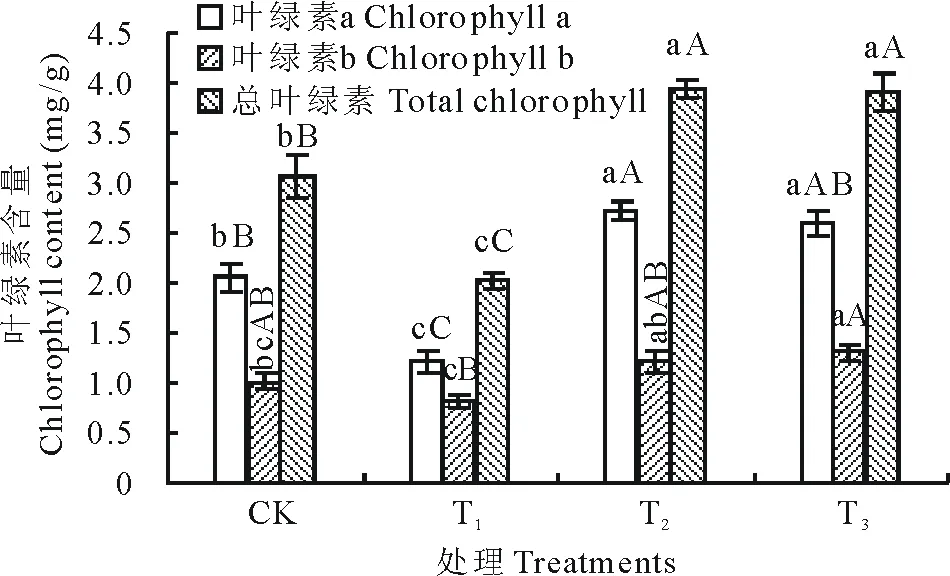
图2 氮素对镉胁迫下白三叶草叶绿素含量的影响Fig.2 Effects of nitrogen on chlorophyll content of T. repens under Cd stress
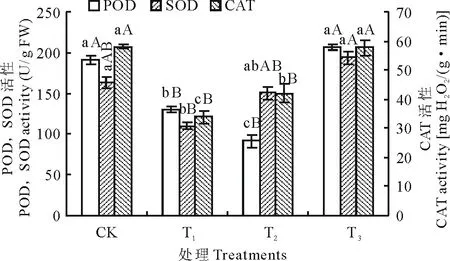
图3 氮素对镉胁迫下白三叶草抗氧化酶系统的影响Fig.3 Effects of nitrogen on the antioxidant enzyme activities of T. repens under Cd stress
2.4氮素对镉胁迫下白三叶草镉积累的影响
由表2可知, 与单独镉处理(T1)相比, 镉胁迫下增施氮处理(T3)植株地上部镉含量和根系镉含量分别增加了53.03%和74.17%, 而土壤镉含量降低了6.17%。说明氮素能提高白三叶草对Cd的吸收。
此外, T3处理白三叶草的地上部转移系数和根系转移系数分别比T1处理植株增加了80.00%和100.00%(表2)。说明氮素能辅助镉在植物体内的迁移, 从而提高白三叶草对Cd的富集能力, 促进植物对重金属污染土壤的修复。

表2 氮素对镉胁迫下白三叶草镉积累的影响Table 2 Effects of nitrogen on cadmium accumulation capacity of T. repens under Cd stress
注:表中数值为平均值±标准误。同列中数值后不同小写字母表示处理间差异显著(P<0.05), 不同大写字母表示处理间差异极显著(P<0.01)。
Note:Data in the table are means±SE. Different lowercase letters in the same column indicate significant difference among the treatments (P<0.05); Different capital letters indicate extraordinarily significant difference among treatments (P<0.01).
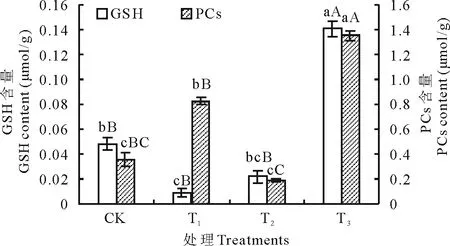
图4 氮素对镉胁迫下白三叶草GSH和PCs含量的影响Fig.4 Effects of nitrogen on GSH and PCs content of T. repens under Cd stress
2.5氮素对镉胁迫下白三叶草GSH和PCs含量的影响
由图4可知, 单独镉处理显著影响白三叶草中谷胱甘肽(GSH)及植物络合素(PCs)含量(P<0.05)。与对照相比, 其GSH降低了81.25%, PCs增加了132.30%。说明高浓度镉胁迫下, 白三叶草以提高自身PCs含量来抵抗镉的毒害, 而作为PCs合成的底物GSH, 其含量极显著降低。此外, 镉胁迫下增施氮处理, 植株的GSH、PCs含量与对照相比均极显著增加, 分别增加了193.75%和279.21%。由此说明, 增施氮能促进白三叶草GSH的合成, 提高PCs含量, 从而增强植株对重金属镉的解毒能力。
3 讨论
土壤中镉含量过多会使植物受到毒害, 造成植物生长缓慢、植株矮小、叶片失绿等[29]。植物吸收过量的镉会诱导植株产生过氧化氢类物质, 破坏抗氧化系统的防御功能, 导致氧化还原失衡, 造成氧化胁迫[30]。本研究表明, 高浓度Cd显著降低了白三叶草的生长量、干重、叶绿素含量、抗氧化酶(POD、SOD、CAT)活性, 这与多数植物受镉胁迫的毒害情况基本一致[31-32]。
重金属镉对植物造成毒害的同时, 植物也会产生相应的解毒机制。植物合成的含巯基化合物, 如谷胱甘肽(GSH)和植物络合素(PCs), 在植物对重金属镉的解毒过程中起到了重要作用[33]。谷胱甘肽通过谷胱甘肽-S-转移酶完成对有害物质的解毒作用, 并将其排出体外[34-37]。植物络合素是由以GSH为底物的酶促反应合成[38-39]。PCs对重金属解毒的机理是重金属离子进入植物体后, 细胞内的PCs与之结合形成复合物, 然后转运到特定的细胞器(主要为液泡), 进行区室化固定, 从而降低重金属对植物的毒害[38,40]。因此, 谷胱甘肽和植物络合素含量在一定程度上可以反映植物对镉的抗性[41]。本研究中, 单独镉处理的PCs含量显著高于对照, 而GSH的含量显著低于对照。这与Jackon等[42]对曼陀罗(Daturastramonium)的研究结果相一致。GSH含量的降低可能是由于大量用于合成PCs造成的。
GSH的生物合成主要通过两步依赖于ATP的酶催化反应完成, 即谷氨酸、半胱氨酸在 γ-谷氨酰半胱氨酸合成酶(γ-GCS)GSH I催化下生成γ-谷氨酰半胱氨酸;γ-谷氨酰半胱氨酸和甘氨酸在谷胱甘肽合成酶(GS)GSH II 的催化下生成GSH[37]。GSH在植物络合素合酶(PCS)的催化下进一步合成植物络合素。而GSH前体物谷氨酸和甘氨酸的合成需要氮的参与, 因此氮素对GSH的合成具有重要作用[43]。然而, 氮素(谷氨酸)不仅用于合成GSH, 也参与叶绿素和核酸、蛋白质的合成[44-45]。正常情况下, GSH、叶绿素以及核酸、蛋白质的合成过程对N的利用处于一种平衡状态。当植物受到镉胁迫时, 氮素不足会造成以下两种情况:1)植株大量合成GSH和PCs用于螯合Cd2+, 导致用于合成叶绿素、蛋白质的氮素减少, 植株生长受抑制, 叶片失绿;2)叶绿素、蛋白质合成消耗N, GSH和PCs合成受阻, 大量Cd2+抑制植株对Ca2+、Fe2+、Zn2+等必需元素的吸收, 使蛋白质变性, 打破细胞内的氧化还原平衡, 对植物造成严重的毒害[46-48]。若此时氮元素供应充足, 植物能够合成足够的谷氨酸使得GSH、叶绿素和核酸、蛋白质的合成均不受影响, 那么植物生长不会出现中毒症状, 植物细胞不会遭受破坏, 即实现了氮素缓解重金属镉对植物的毒害作用。本试验中, 氮素缓解了Cd对白三叶草生长的抑制, 显著提高了白三叶草对Cd的富集能力, 植株生长量、干重、叶绿素含量、抗氧化酶活性基本恢复到对照水平, 甚至优于对照。而且, 镉胁迫下增施氮使植物体内GSH和PCs含量均极显著高于对照和单独镉处理。这与白瑞霞等[49]、翟晶[50]、张圆圆等[18]以及Gutiérrez-Gamboa等[51]的研究结果基本一致。然而氮素以何种形态起作用, 是否能够缓解其他种类重金属对植物造成的毒害, 均有待进一步研究。
4 结论
重金属镉胁迫下, 白三叶草的生长明显受抑制, 植株矮小, 叶片失绿, 新陈代谢速率降低, 无法合成足够的谷胱甘肽, 植株出现中毒症状;而在镉胁迫下增施氮能让植物各生理指标恢复到对照水平, 显著增加谷胱甘肽和植物络合素含量, 提高植株抗氧化能力和对镉的富集能力。说明氮素在白三叶草的重金属镉解毒机制中具有重要作用, 能够缓解镉对植株的毒害, 提高植株对镉的富集能力, 这为白三叶草的生产应用提供了理论参考, 为城市园林绿化及Cd污染土壤的修复提供了理论依据。
References:
[1] Huang Y Z, Hao X W, Lei M,etal. The remediation technology and remediation practice of heavy metals-contaminated soil. Journal of Agro-Environment Science, 2013, 32(3): 409-417. 黄益宗, 郝晓伟, 雷鸣, 等. 重金属污染土壤修复技术及其修复实践. 农业环境科学学报, 2013, 32(3): 409-417.
[2] Xue Y, Wang Y Y, Yao Q H,etal. Research progress of plants resistance to heavy metal Cd in soil. Ecology and Environmental Sciences, 2014, 23(3): 528-534. 薛永, 王苑螈, 姚泉洪, 等. 植物对土壤重金属镉抗性的研究进展. 生态环境学报, 2014, 23(3): 528-534.
[3] Singh A, Prasad S M. Remediation of heavy metal contaminated ecosystem: an overview on technology advancement. International Journal of Environmental Science and Technology, 2015, 12(1): 353-366.
[4] Chen C X, Lu Z Q, Zheng W J. The growth and ecophysiological responses of mangroveAvicenniamarinaseedlings to cadmium. Journal of Xiamen University: Natural Science Edition, 2015, 54(4): 485-492. 陈昌徐, 陆志强, 郑文教. 白骨壤幼苗对镉胁迫的生长及生理生态响应. 厦门大学学报: 自然科学版, 2015, 54(4): 485-492.
[5] Zhang W E, Xue J, Li H. Growth and photosynthetic characteristics ofCannageneralisunder Cd stress. Guizhou Agricultural Sciences, 2015, 43(3): 31-36. 张文娥, 学军, 李慧. 镉胁迫大花美人蕉的生长及光合特性. 贵州农业科学, 2015, 43(3): 31-36.
[6] Wang J, Zhang X, Chen S H,etal. Physiological responses of reed seedlings to NaCl stress and Cd stress. Jiangsu Agricultural Sciences, 2015, 43(3): 327-329. 王静, 张侠, 陈世华, 等. 芦苇幼苗对NaCl胁迫和镉胁迫的生理响应. 江苏农业科学, 2015, 43(3): 327-329.
[7] Zhao X F. Effects and Physiological Mechanisms of Nitric Oxide on Alleviating Cadmium Toxicity in Rice Seedlings[D]. Nanjing: Nanjing Agricultural University, 2012. 赵秀峰. 一氧化氮对水稻幼苗镉毒害的缓解效应及其生理机制[D]. 南京: 南京农业大学, 2012.
[8] Mebarg A A. The role of the plasmalemma in metal tolerance in angiosperms. Physoilogia Plantarum, 1993, 88: 191-198.
[9] Ma J F, Hiradate S, Matsumoto H. High aluminum resistance in buckwheatⅡ.Oxalic acid detoxifies aluminum internally. Plant Physiology, 1998, 117: 753-759.
[10] Sanitadi Toppi L, Gabbrielli R. Response to cadmium in higher plants. Environmental & Experimental Botany, 1999, 41: 105-130.
[11] Barceló J, Poschenrieder C. Phytoremediation: principles and perspectives. Contributions to Science, 2003, 2(3): 333-334.
[12] Zhou Q X, Wei S H, Zhang Q R. Ecological Restoration[M]. Beijing: China Environmental Science Press, 2006. 周启星, 魏树和, 张倩茹. 生态修复[M]. 北京: 中国环境科学出版社, 2006.
[13] Sun T H, Li P J, Zhou Q X. Soil Pollution Formation Mechanism and Remediation Technology[M]. Beijing: Science Press, 2005. 孙铁珩, 李培军, 周启星. 土壤污染形成机理与修复技术[M]. 北京: 科学出版社, 2005.
[14] Zhou Q X, Song Y F. Principles and Methods of Remediation of Contaminated Soils[M]. Beijing: Science Press, 2004. 周启星, 宋玉芳. 污染土壤修复原理与方法[M]. 北京: 科学出版社, 2004.
[15] Wei H D, Li Y, Chen Z L,etal. Effects of nitrogen fertilizer on photosynthesis and chlorophyll fluorescence characteristics ofZoysiajaponicain Cd stress. Soil and Fertilizer in China, 2015, (4): 88-92. 魏花朵, 李悦, 陈忠林, 等. 氮肥对镉胁迫下结缕草光合和叶绿素荧光特性的影响. 中国土壤与肥料, 2015, (4): 88-92.
[16] Xu C. Effects of Nitrogen Application on Growth and Photosynthesis ofZizanialatifolia[D]. Hangzhou: Zhejiang University, 2011. 徐蝉. 氮肥对菱白生长及光合特性的影响[D]. 杭州: 浙江大学, 2011.
[17] Zhao T H, Liu Y L, Cao Y,etal. Effects of nitrogen forms on nitrogen matter of spring wheat plant under cadmium. Journal of Agricultural Science, 2010, 25(5): 177-181. 赵天宏, 刘玉莲, 曹莹, 等. 镉胁迫下不同形态氮肥对春小麦体内含氮物质的影响. 华北农学报, 2010, 25(5): 177-181.
[18] Zhang Y Y, Dou C Y, Yao F,etal. Nitrogen application to enhance zinc and cadmium uptake by the hyper accumulatorSedumalfredii. Journal of Zhejiang Forestry University, 2010, 27(6): 831-838. 张圆圆, 窦春英, 姚芳, 等. 氮素营养对重金属超积累植物东南景天吸收积累锌和镉的影响. 浙江林学院学报, 2010, 27(6): 831-838.
[19] Liu S L, Shi X S, Pan Y Z,etal. Effects of cadmium stress on growth, accumulation and distribution of biomass and nutrient inCatharanthusroseus. Acta Prataculturae Sinica, 2013, 22(3): 154-161. 刘柿良, 石新生, 潘远智, 等. 镉胁迫对长春花生长, 生物量及养分积累与分配的影响. 草业学报, 2013, 22(3): 154-161.
[20] Liu S L, Pan Y Z, Yang R J,etal. Effects of exogenous NO on mineral nutrition absorption, lipid peroxidation and ATPase of plasma membrane inCatharanthusroseustissues under cadmium stress.Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 445-458. 刘柿良, 潘远智, 杨容孑, 等. 外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase 及矿质营养吸收的影响. 植物营养与肥料学报, 2014, 20(2): 445-458.
[21] Lu S L, Yang R J, Ma M D,etal. Effects of cadmium stress on growth, cadmium content and nutrient distribution ofTrifoliumrepensL. Journal of Nuclear Agricultural Science, 2015, 29(3): 595-604. 刘柿良, 杨容孑, 马明东, 等. 镉胁迫对白车轴草生长、镉含量及养分分配的影响. 核农学报, 2015, 29(3): 595-604.
[22] Qi S Y, Chang E Z, Dong J J,etal. Competitive effect between invasive plantGalinsogaparvifloraandTrifoliumrepens. Guangdong Agricultural Sciences, 2014, (1): 141-145. 齐淑艳, 昌恩梓, 董晶晶, 等. 入侵植物牛膝菊与白车轴草的竞争效应. 广东农业科学, 2014, (1): 141-145.
[23] De Lespinay A, Lequeux H, Lambillotte B,etal. Protein synthesis is differentially required for germination inPoapratensisandTrifoliumrepensin the absence or in the presence of cadmium. Journal of Plant Growth Regulation, 2010, 61(2): 205-214.
[24] Xiong Q E. Experimental Course in Plant Physiology[M]. Chengdu: Sichuan Science and Technology Press, 2003. 熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003.
[25] Hissin P J, Hilf R. A fluorometric method for determination of oxidized and reduced glutathione in tissues. Analytical Biochemistry, 1976, 74: 214-226.
[26] Rama D S, Prasad M N V. Copper toxicity inCeratophyllumdemersumL.(Coontail), a free floating macrophyte: Response of antioxidant enzymes and antioxidants. Plant Science, 1998, 138: 157-165.
[27] Hao J J, Kang Z L, Yu Y. Plant Physiology Experiment Technology[M]. Beijing: Chemical Industry Press, 2007. 郝建军, 康宗利, 于洋. 植物生理学实验技术[M]. 北京: 化学工业出版社, 2007.
[28] Bhargava P, Srivastava A K, Urmil S. Phytochelatin plays a role in UV-B tolerance in N2-fixing cyanobacteriumAnabaenadoliolum. Journal of Plant Physiology, 2005, 162: 1220-1225.
[29] Sun Z G. Study on the response to soil cadmium pollution and its remediation effect ofSolanumnigrumL. Jiangsu Agricultural Sciences, 2015, (10): 397-401. 孙正国. 龙葵对镉污染土壤的响应及其修复效应研究. 江苏农业科学, 2015, (10): 397-401.
[30] Cai Y, Cao F, Cheng W. Modulation of exogenous glutathione in phytochelatins and photosynthetic performance against Cd stress in the two rice genotypes differing in Cd tolerance. Biological Trace Element Research, 2011, 143(2): 1159-1173.
[31] Wang J, Shen L B, Li Z,etal. Effects of nitrogen forms on growth and Zn/Cd uptake ofSedumplumbizincicola. Journal of Agro-Environment Science, 2014, 33(11): 2118-2124. 汪洁, 沈丽波, 李柱, 等. 氮肥形态对伴矿景天生长和锌镉吸收性的影响研究. 农业环境科学学报, 2014, 33(11): 2118-2124.
[32] Sun N X, Song G L. Physiological response ofMedicagosativato cadmium stress and accumulation property. Pratacultural Science, 2015, 32(4): 581-585. 孙宁骁, 宋桂龙. 紫花苜蓿对镉胁迫的生理响应及积累特性. 草业科学, 2015, 32(4): 581-585.
[33] Feng Q, Tai P D, Fu S S,etal. The role of thiol pool in cadmium detoxification in marigold plants. Chinese Journal of Environmental Engineering, 2010, 4(1): 214-218. 冯倩, 台培东, 付莎莎, 等. 巯基化合物在万寿菊镉解毒中的作用. 环境工程学报, 2010, 4(1): 214-218.
[34] Zhong H, Zhang H, Xu H P. Progress on determination of glutathione. Amino Acids and Biological Resources, 2014, 36(1): 23-26. 钟华, 张慧, 许海平. 谷胱甘肽的测定方法进展. 氨基酸和生物资源, 2014, 36(1): 23-26.
[35] Song Z T, Jiang N, Zhang A Z. Research progress on biological function of glutathione. Feed Research, 2008, (9): 25-28. 宋增廷, 姜宁, 张爱忠. 谷胱甘肽生物学功能的研究进展. 饲料研究, 2008, (9): 25-28.
[36] Jones D P. Redefining oxidative stress. Antioxidants & Redox Signaling, 2006, 8(9/10): 1865-1879.
[37] Wang W W, Tang L, Zhou W L,etal. Research progress of glutathione biosynthesis and metabolism related enzymes. China Biotechnology, 2014, 34(7): 89-95. 王玮玮, 唐亮, 周文龙, 等. 谷胱甘肽生物合成及代谢相关酶的研究进展. 中国生物工程杂志, 2014, 34(7): 89-95.
[38] Cai B S, Lei M, Chen T B,etal. Phytochelatins and their roles in phyto-tolerance to heavy metals: A review. Acta Ecologica Sinica, 2003, 23(10): 2125-2132. 蔡保松, 雷梅, 陈同斌, 等. 植物螯合肽及其在抗重金属胁迫中的作用. 生态学报, 2003, 23(10): 2125-2132.
[39] Xu Z L, Wu Q T, Yi Y L. Advanced progress of phytochelatins in plant. Agro-environmental Protection, 2001, 20(6): 468-470. 徐照丽, 吴启堂, 依艳丽. 重金属植物螯合肽(PC)的研究进展. 农业环境保护, 2001, 20(6): 468-470.
[40] Li Z Y, Fan X Y, Song Z G,etal. Effects of elevated CO2on Cu uptake, root morphology and phytochelatins synthesis in different rice varieties. Journal of Soil and Water Conservation, 2013, 27(4): 207-216. 李中阳, 樊向阳, 宋正国, 等. CO2浓度升高对2个品种水稻Cu吸收、根形态和植物络合素合成的影响. 水土保持学报, 2013, 27(4): 207-216.
[41] Klapheck, Fliegner W, Zimmer I. Hydroxymethyl-phytochelatins [(γ-glutamylcysteine)n-serine] are metal-induced peptides of the Poaceae. Plant Physiology, 1994, 104: 1302-1325.
[42] Jackon P J, Delhaize E, Kuske C R. Biosynthesis and metabolic roles of cadystins (γ-EC)n G and their precursors inDaturainnoxia. Plant and Soil, 1992, 146: 281-289.
[43] Zhang F, Wan X, Zhong Y. Nitrogen as an important detoxification factor to cadmium stress in poplar plants. Journal of Plant Interactions, 2013, 9(1): 249-258.
[44] Huang C N, Lu X P, Xiao Y M,etal. Effect of nitrogen application on expression of key enzyme genes in pathway of Ponkan leaf nitrogen assimilation and chlorophyll biosynthesis. Journal of Fruit Science, 2014, (1): 7-12. 黄成能, 卢晓鹏, 肖玉明, 等. 施氮对椪柑叶片氮同化叶绿素合成关键酶基因表达的影响. 果树学报, 2014, (1): 7-12.
[45] Wang J S. Basic Biochemistry[M]. Beijing: China Forestry Publishing House, 2006. 王金胜. 基础生物化学[M]. 北京: 中国林业出版社, 2006.
[46] Polle A, Schützendübel A. Heavy Metal Signalling in Plants: Linking Cellular and Organismic Responses[M]. Berlin: Springer-Verlag, 2004: 184-216.
[47] Nathalie V, Christian H, Henk S. Mechanisms to cope with arsenic or cadmium excess in plants. Current Opinion in Plant Biology, 2009, 12: 1-9.
[48] Lu H Y, Liu Z H, Lv G H. Study on the content of MDA, proline and SOD protective enzymes in reed leaves under Cd pollution. Journal of Arid Land Resources and Environment, 2013, 27(8): 171-175. 路海燕, 刘志辉, 吕光辉. 镉污染下芦苇叶片丙二醛、脯氨酸及SOD保护酶反应研究. 干旱区资源与环境, 2013, 27(8): 171-175.
[49] Bai R X, Xu S N, Chen Z L. Effects of nitrogen fertilizer on growth and physiological characteristics ofZoysiajaponicaunder cadmium stress. Jiangsu Agricultural Sciences, 2016, 44(7): 245-247. 白瑞霞, 徐苏男, 陈忠林. 氮肥对镉(Cd)胁迫下结缕草生长和生理特性的影响. 江苏农业科学, 2016, 44(7): 245-247.
[50] Zhai J. The Effects of Nitrogen on Poplar Growth and Chlorophyll Synthesis under Cadmium Stress[D]. Ya’an: Sichuan Agricultural Uniersity, 2013. 翟晶. 镉胁迫下增施氮对杨树生长和叶绿素合成的影响[D]. 雅安: 四川农业大学, 2013.
[51] Gutiérrez-Gamboa G, Garde-Cerdán T, Gonzalo-Diago A,etal. Effect of different foliar nitrogen applications on the must amino acids and glutathione composition in Cabernet Sauvignon vineyard. LWT-Food Science and Technology, 2017, 75: 147-154.
Effectofnitrogensupplementationongrowthofwhitecloverundercadmiumstressandalleviationofcadmiumtoxicity
DONG Ji-Fei, ZHANG Fan*, HU Yu-Han, LI Jun-Cheng, LI Wei, WANG Xian-Shu
CollegeofLandscapeArchitecture,SichuanAgriculturalUniversity,Chengdu611130,China
We investigated the effect of exogenous nitrogen on the growth of white clover (Trifoliumrepens) under cadmium stress and on Cd toxicity. White clover plants grown in pots were treated with N and/or Cd, and their growth, biomass, chlorophyll content, antioxidant enzyme activity, Cd content, glutathione (GSH) content, and phytochelatins content were determined. Treatment with Cd significantly inhibited the growth and decreased the chlorophyll content of white clover. However, applications of both Cd and N to the soil promoted white clover biomass and chlorophyll content, as compared with the control. The addition of N under Cd stress enhanced plant growth and chlorophyll content, and increased the activities of peroxidase, superoxide dismutase, and catalase, as well as increasing the Cd content. Treatment with Cd alone increased the phytochelatins content and significantly reduced the GSH content. Treatment with N increased the GSH and phytochelatins contents under Cd stress. These results indicated that exogenous N can effectively alleviate Cd toxicity to white clover.
cadmium stress; nitrogen,Trifoliumrepens; growth; GSH; PCs; detoxification
10.11686/cyxb2016461
http://cyxb.lzu.edu.cn
董姬妃, 张帆, 胡雨寒, 李俊承, 李维, 王娴淑. 镉胁迫下增施氮对白三叶草生长的影响和镉毒害的缓解效应研究. 草业学报, 2017, 26(9): 83-91.
DONG Ji-Fei, ZHANG Fan, HU Yu-Han, LI Jun-Cheng, LI Wei, WANG Xian-Shu. Effect of nitrogen supplementation on growth of white clover under cadmium stress and alleviation of cadmium toxicity. Acta Prataculturae Sinica, 2017, 26(9): 83-91.
2016-12-08;改回日期:2017-02-11
国家自然科学
基金项目(31300514),四川省“十三五”科技攻关项目林木新品种选育(2016YZGG)和四川农业大学科研兴趣培养计划项目(04054487)资助。
董姬妃(1992-),女,浙江台州人,在读硕士。E-mail:15608037874@163.com*通信作者Corresponding author. E-mail:nolady@163.com

