用密度泛函理论研究汞在CeO2(111)表面的吸附
,,,洪彬,
(1.南京大学南通材料工程技术研究院,江苏 南通 226019; 2.盐城工学院化学与生物工程学院,江苏 盐城 224051)
用密度泛函理论研究汞在CeO2(111)表面的吸附
陆玉1,张秋香1,周小亮1,陆洪彬1,许琦2
(1.南京大学南通材料工程技术研究院,江苏南通226019;2.盐城工学院化学与生物工程学院,江苏盐城224051)
采用密度泛函理论计算了Hg、HgCl、HgCl2在CeO2(111)表面的吸附构型、吸附能和态密度。结果表明,Hg在CeO2(111)表面属于弱化学吸附。HgCl与CeO2(111)表面为强化学吸附,是反应的重要中间体。HgCl2在CeO2(111)表面是物理吸附,易发生解离,脱除。氯对于汞的吸附和氧化产生较强的影响,这与实验结果相一致。基于计算结果,得到汞在CeO2(111)表面的反应机理。
汞; CeO2(111)表面; 密度泛函理论; 吸附
1 前 言
汞是一种有毒的痕量重金属元素,具有易挥发性、持久性、生物积累性,对生物和人体产生毒性作用[1-3],全球对汞污染治理一向十分迫切。汞由自然界及人类活动释放到环境中,其中以人为排放为主,约占总排放量的3/4[4]。 主要排放源是化石燃料的燃烧,特别是煤的燃烧。我国是产煤大国,同时也是燃煤大国,能源消耗以煤炭为主,其中燃煤电厂占重大比例[5-6]。
煤燃烧烟气中,汞主要存在三种基本状态:零价态汞(Hg0)、氧化态汞(Hg2+)、颗粒态汞(Hg(p))[7]。其中Hg0由于其高挥发性及在水中的难溶性,现有的烟气净化设备很难将其去除,是烟气汞污染控制的关键。由于实际烟气系统复杂、汞含量低等原因,实验条件不能完全模拟,测试结果存在误差。近年来为有效控制汞排放,世界各国逐渐从燃煤烟气汞脱除视角转向脱汞机理研究,以期找出有效方法。采用密度泛函理论计算模拟,可更好地探讨理解反应机理,为开发设计新材料提供重要信息和途径[8-10]。通过密度泛函理论,研究物质结构与其性质间的相互作用,与实验结果相比较,从理论方面探讨验证烟气吸附氧化机理,此方法已得到认可。Wenchao Ji等[11]以MnCl2(110)面为模型,利用密度泛函理论对Hg0在其表面的吸附行为进行了研究,得到吸附能为-156.620kJ/mol,属于化学吸附,构型稳定,与实验结果一致。Bingkai Zhang等[12]基于密度泛函理论对MnO2(110)表面Hg0的氧化机理进行了研究,计算结果表明,在HCl条件下MnO2(110)表面Hg0的氧化路径为:Hg→HgCl→HgCl2而不是Hg→HgCl2,其中HgCl→HgCl2是整个过程的决定性步骤。Shujuan Sun等[13]用密度泛函理论计算了Hg、HgCl、HgCl2在CuO(111)表面的吸附结构和电子性质,优化后发现Hg0在CuO(111)表面的吸附能为27.4kJ/mol,为弱物理吸附。在Cl2和HCl条件下,CuO(111)表面Hg0氧化的能量值分别为14.44和2.57kJ/mol。结果表明,HCl对Hg0在CuO(111)表面的氧化反应具有促进作用。
铈为镧系元素,有两种稳定的氧化态(Ce3+和Ce4+),通过两者间的氧化还原反应,具备良好的储氧能力[14],广泛用于材料的制备[15-16]。氧化铈是稀土氧化物系列中活性最高的一种氧化物催化剂[17],萤石结构的CeO2,拥有较好的储释氧能力,较强的氧化还原性,已用于气态Hg0的催化氧化[18-19]。与大量铈基催化剂的Hg0催化氧化实验相比,关于汞在CeO2表面相互作用的理论研究相对较少。
本文依据密度泛函理论,以CeO2为研究对象, 在Cl2体系下,考察Hg、HgCl、HgCl2在CeO2(111)表面不同吸附位:表面顶位氧(Otop)、表面桥位氧(Obridge)、表面顶位铈(Cetop)及氧桥位(Osubridge)的吸附情况,获得优化稳定吸附构型,探讨汞在CeO2(111)表面吸附、氧化反应机理。
2 模型与计算方法
2.1模型
立方萤石结构的CeO2空间群为Fm-3m,晶胞由4个Ce原子和8个O原子组成(图1)。CeO2(111)为热力学最稳定的低指数面[20],其物理化学性质与真实的晶体表面最为接近,因此选取CeO2(111)面作为表面模型(如图2所示)。CeO2晶胞经切割得到(111)表面,截取深度为14.81Å,超胞设为2×2,真空度取10Å。CeO2(111)表面模型其终止面为O,由2层Ce和4层O组成,形成O-Ce-O夹层O终端结构。
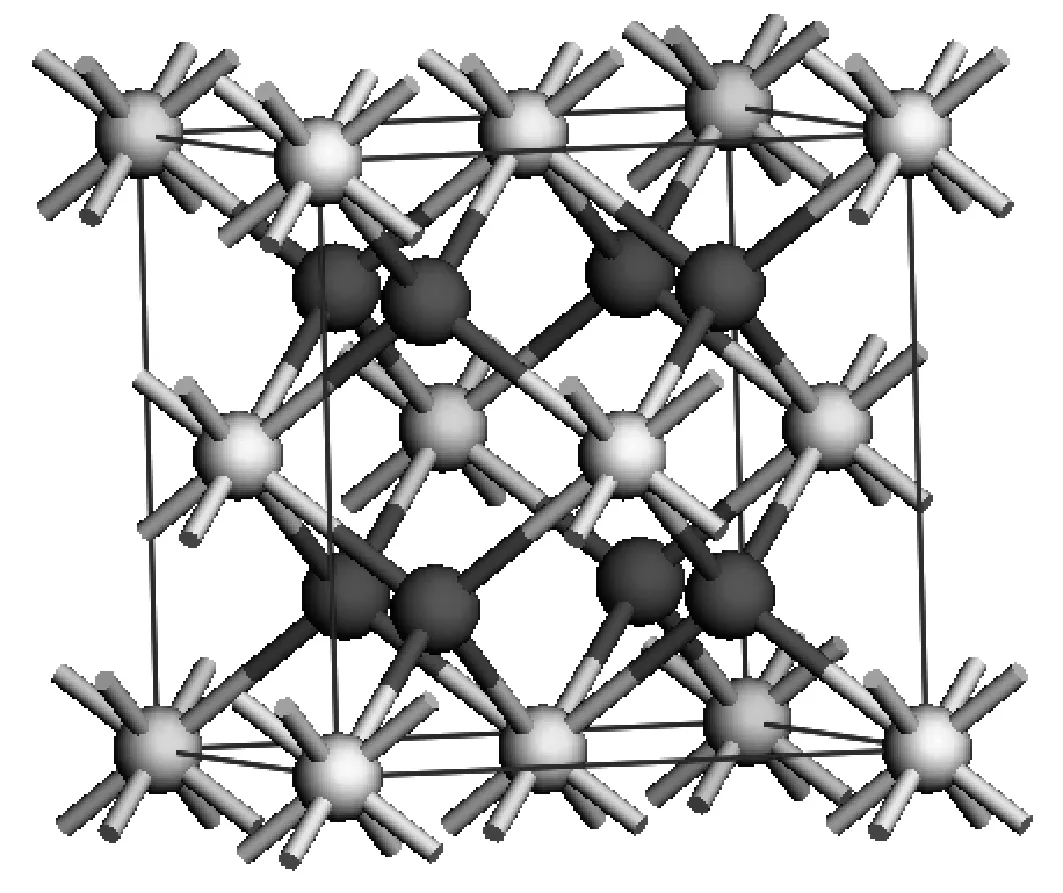
图1 CeO2晶胞模型Fig.1 CeO2 cell model

图2 CeO2(111)面晶体模型Fig.2 Crystal model of CeO2(111)
2.2计算方法
文中所有计算工作都是基于Materials Studio软件中CASTEP模块完成的。电子交换关联势通过广义梯度近似法(GGA)的PBE来描述。CASTEP模块中,K点设置为2×2×1,平面截止能设定为400eV。能量计算和结构优化设定标准为:(1)自洽场精度收敛标准为1.0×10-7eV/atom;(2)最大力收敛标准为0.01eV/Å;(3)能量优化收敛设置为5.0×10-6eV/atom;(4)自洽场最大循环周期为200。本文研究了Hg、HgCl、HgCl2分别在不同吸附位:表面顶位氧(Otop)、表面桥位氧(Obridge)、氧桥位(Osubridge)及表面顶位铈(Cetop)上的吸附氧化情况。
吸附前后各物质的总能量变化被定义为吸附能,在Cl2条件下,汞物质在CeO2(111)表面的吸附能Eads计算如下:
Eads=EHg-species+slab-(EHg-species+Eslab)
(1)
式中EHg-species+slab代表吸附后体系的总能量,EHg-species、Eslab分别代表吸附前含Hg物质和CeO2(111)表面的能量。
3 结果与讨论
3.1不同形态汞在CeO2(111)表面的吸附
3.1.1Hg在CeO2(111)表面的吸附 图3(a、b、c、d)分别为Hg在Otop、Obridge、Osubridge及Cetop上吸附的优化构型。优化后所得吸附能及结构参数如表1所示,各位点吸附能较高,属于弱化学吸附。Otop、Obridge、Osubridge所对应的Hg-O键长分别为:3.605Å、4.672Å、3.699Å或3.744Å;Cetop对应的Hg-Ce键长为3.743Å,Hg-O键键长小于Hg-Ce,表明Hg更易被表面顶位氧(Otop)吸附,吸附过程中以Hg-O键作为主要存在形式。研究证明,当Hg-O键为Hg吸附于表面的主要形式时,其吸附过程存在一定的化学吸附。
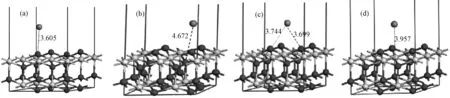
图3 Hg在CeO2(111)表面吸附的优化构型 (a) Otop位; (b) Obridge位; (c) Osubridge位; (d) Cetop位Fig.3 Optimized structures of Hg on CeO2(111) surface (a) Otop; (b) Obridge; (c) Osubridge; (d) Cetop
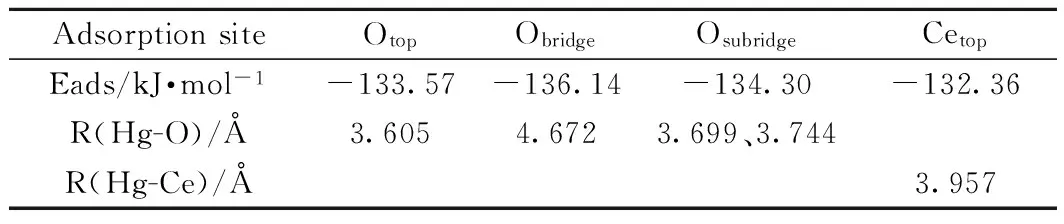
AdsorptionsiteOtopObridgeOsubridgeCetopEads/kJ·mol-1-133.57-136.14-134.30-132.36R(Hg-O)/Å3.6054.6723.699、3.744R(Hg-Ce)/Å3.957
3.1.2HgCl在CeO2(111)表面的吸附 与Hg吸附一致,通过考察HgCl在CeO2(111)表面的四个吸附位 点,发现HgCl在Obridge位的优化未收敛,表明相同条件下,HgCl不能在Obridge位形成稳定构型。相较于Hg吸附,HgCl的吸附能更大(图4),其中Osubridge位上HgCl与两个表面氧原子成键,吸附能远远高于其他位点,吸附作用最强。随着Otop、Osubridge、Cetop位吸附能增加,其对应Hg-O键长(3.126、2.862、3.727)及Hg-Ce键长(3.320)均缩短,这一结果符合吸附强度越强,键长越短的结论。各参数列于表2中。
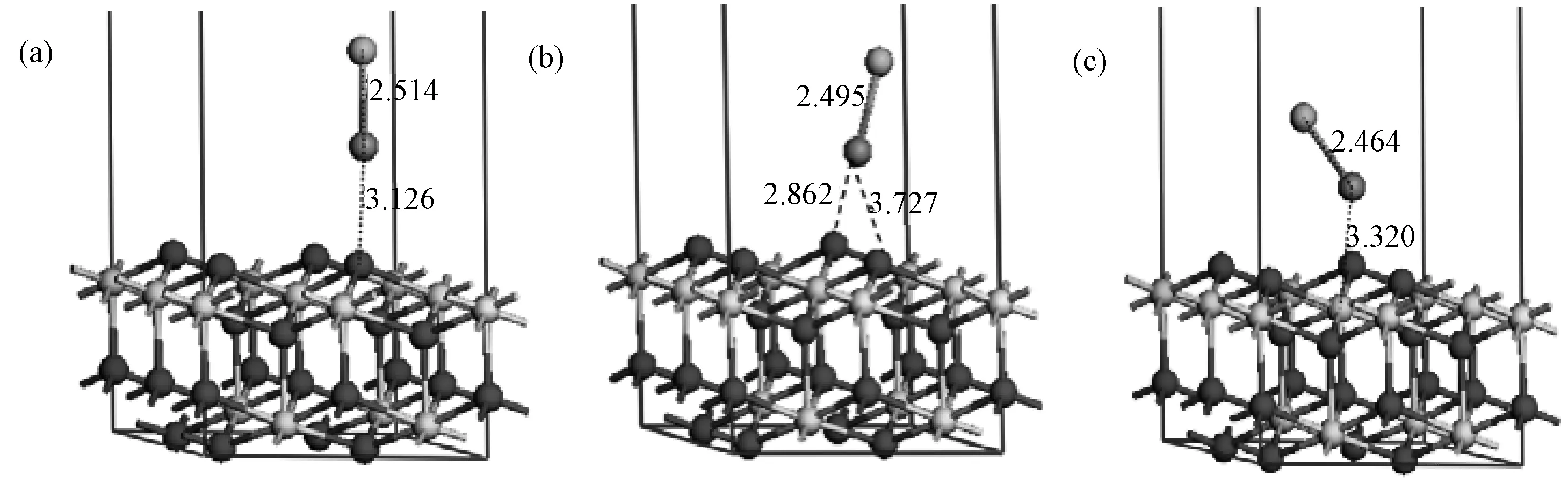
图4 HgCl在CeO2(111)表面吸附的优化构型((a) Otop位; (b) Osubridge位; (c) Cetop位)Fig.4 Optimized structures of HgCl on CeO2(111) surface ((a) Otop; (b) Osubridge; (c) Cetop)

AdsorptionsiteOtopOsubridgeCetopEads/kJ·mol-1-150.60-164.08-153.60R(Hg-O)/Å3.1262.862、3.727R(Hg-Ce)/Å3.320R(Hg-Cl)/Å2.5142.4952.464
3.1.3HgCl2在CeO2(111)表面的吸附 随着Cl2进一步氧化,HgCl转化为HgCl2,Hg2+的生成是Hg0氧化脱除的关键。同Hg、HgCl相比,HgCl2在CeO2(111)表面的吸附能较低(表3),各位点(图5)吸附能均小于40kJ/mol,属于物理吸附。吸附过程中,由于位阻效应,HgCl2不易接近CeO2(111)表面,Hg-O、Hg-Ce键拉长,吸附作用减弱。
依据以上计算结果,Hg在CeO2(111)表面吸附作用较强,因此,在汞与CeO2(111)相互作用的过程中,Hg首先吸附于CeO2(111)表面,形成稳固的Hg-O键,期间存在一定的晶格氧氧化反应。HgCl吸附能为三者最高,在CeO2(111)表面吸附作用也最强,是Hg氧化为HgCl2反应的重要中间体。HgCl2在CeO2(111)表面只是单纯的物理吸附,易从CeO2(111)表面分离脱除。故在Cl2体系下,推测汞在CeO2(111)表面的吸附氧化机理如下:

3.2不同形态汞在CeO2(111)表面吸附的态密度分析
为更加深入地了解不同形态汞与CeO2(111)表面的相互作用机理,研究了Cl2条件下,吸附前后Hg、HgCl、HgCl2和CeO2(111)表面Ce、O原子的态密度变化。根据CeO2(111)表面的吸附计算可知,CeO2(111)表面各位点中,Osubridge上的总能量最低,结构最稳定,因此以Osubridge上Hg、HgCl、HgCl2的吸附为例进行局域态密度(PDOS)分析。
3.2.1Hg在CeO2(111)表面吸附的态密度分析 Hg、Ce、O局域态密度图如图6所示,图6(a)中,吸附前Hg原子的s、d轨道及未充满的p轨道分别在-0.01eV、-3.1eV和5.8eV附近存在特征峰。吸附后态密度图中各轨道特征峰向低能量方向移动,且s、p轨道特征峰显著变宽,能量降低,说明吸附后Hg与CeO2(111)表面存在较强烈的相互作用。从图6(b)和图6(c)可看出, Hg吸附后,CeO2(111)表面的Ce原子和O原子特征峰发生轻微变化。Hg局域态密度d轨道在-3.1eV附近的特征峰与Ce局域态密度d轨道上主峰重叠,说明在CeO2(111)表面,对于Hg而言,Ce展现了更高的活性,Hg与CeO2(111)面相互作用较强。
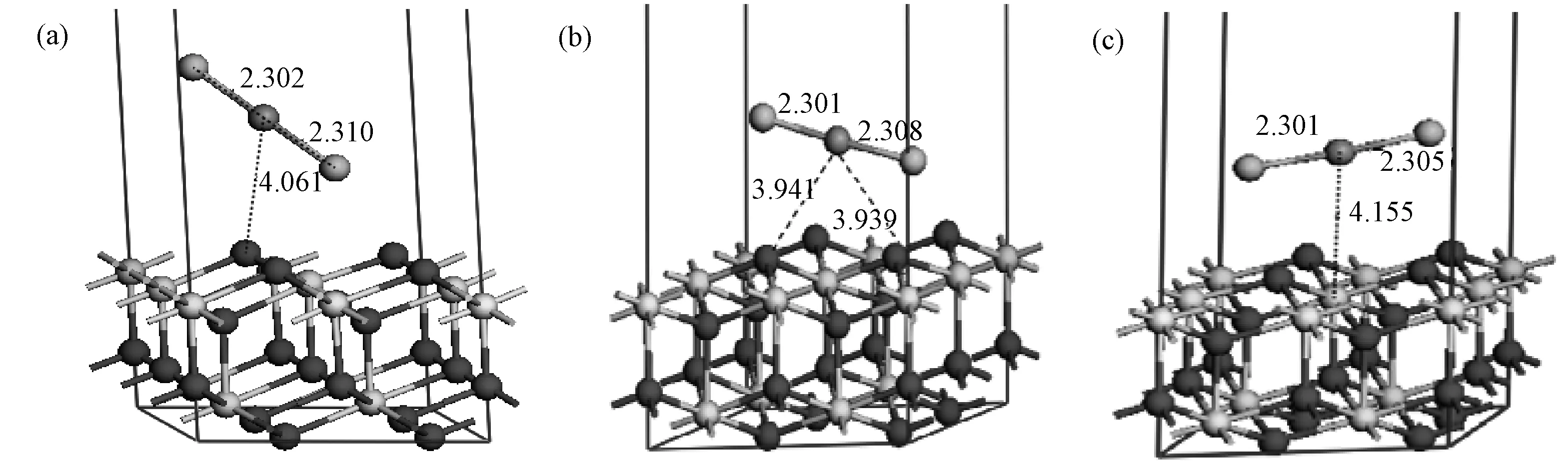
图5 HgCl2在CeO2(111) 表面吸附的优化构型((a) Otop位; (b) Osubridge位; (c) Cetop位)Fig.5 Optimized structures of HgCl2 on CeO2(111) surface ((a) Otop; (b) Osubridge; (c)Cetop)
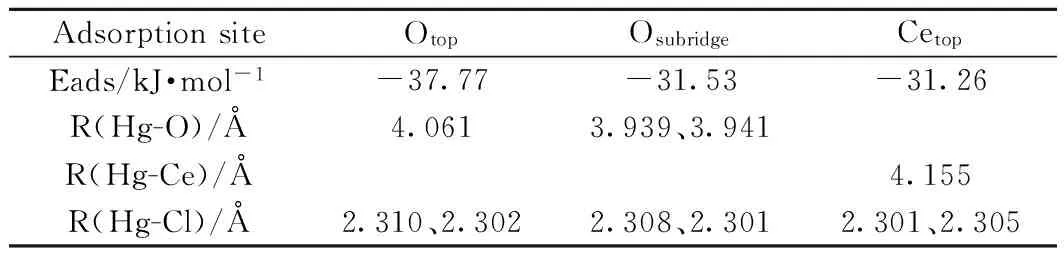
AdsorptionsiteOtopOsubridgeCetopEads/kJ·mol-1-37.77-31.53-31.26R(Hg-O)/Å4.0613.939、3.941R(Hg-Ce)/Å4.155R(Hg-Cl)/Å2.310、2.3022.308、2.3012.301、2.305
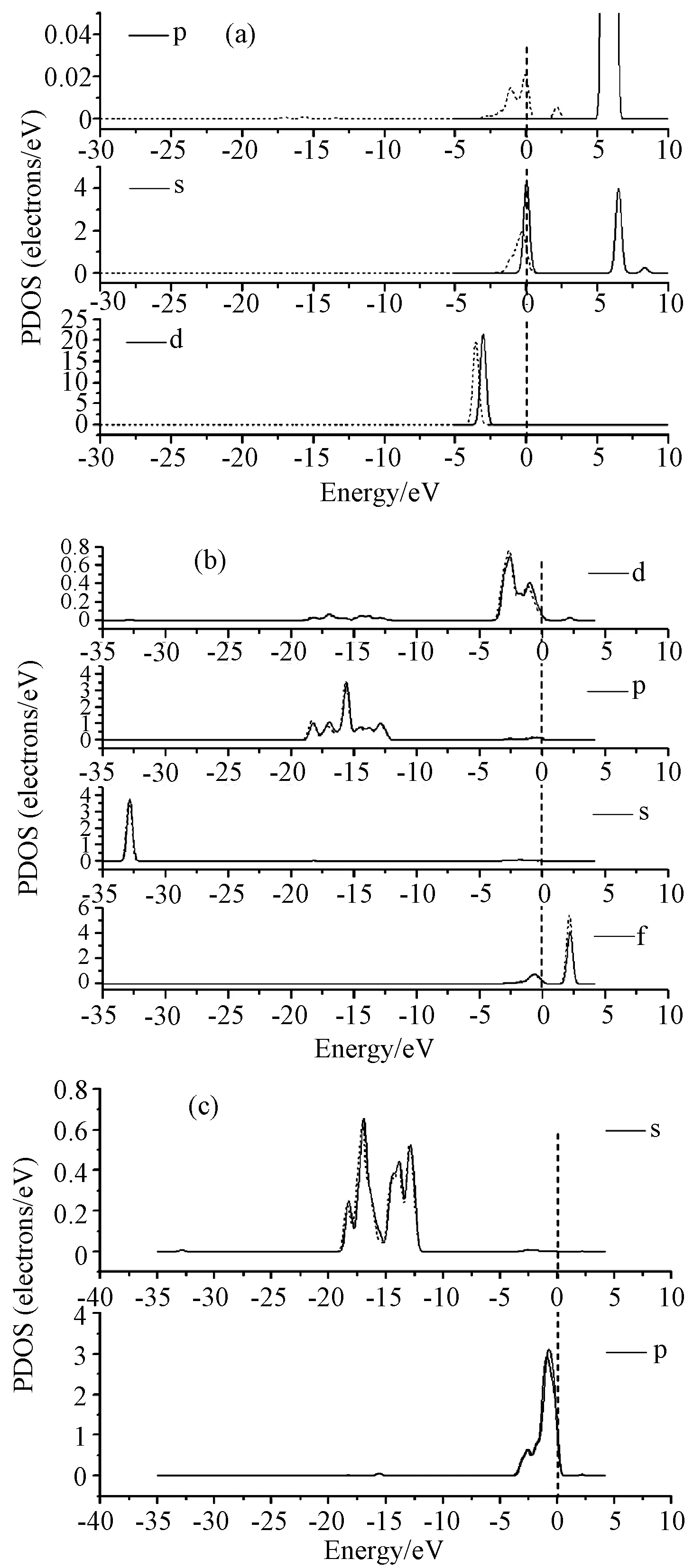
图6 Hg在CeO2(111)表面分局域态密度图((a)、(b)、(c) 图分别为Hg、Ce、O原子的局域态密度,实线为吸附前,虚线为吸附后)Fig.6 Partial density of states(PDOS) of Hg on CeO2(111) ((a),(b),(c) are the PDOS of Hg, Ce, O respectively. The solid line is before adsorption, the dotted line is after adsorption)
3.2.2HgCl在CeO2(111)表面吸附的态密度分析 图7为HgCl、Ce和O的局域态密度,由图7(a)可知,吸附后HgCl各轨道峰位向低能量方向偏移,并且局域态密度s轨道-13.8eV和p轨道-3.2eV 附近分别与Ce的p、d轨道出现重叠,表明以上轨道有效成键。当CeO2(111)表面吸附HgCl后,CeO2(111)表面Ce原子和O原子的局域态密度发生明显变化,各特征峰向低能量方向大幅度偏移,说明吸附HgCl使体系总能量大大降低,提高了体系的稳定性。此结果与文中吸附能计算一致,HgCl为反应重要的中间体。
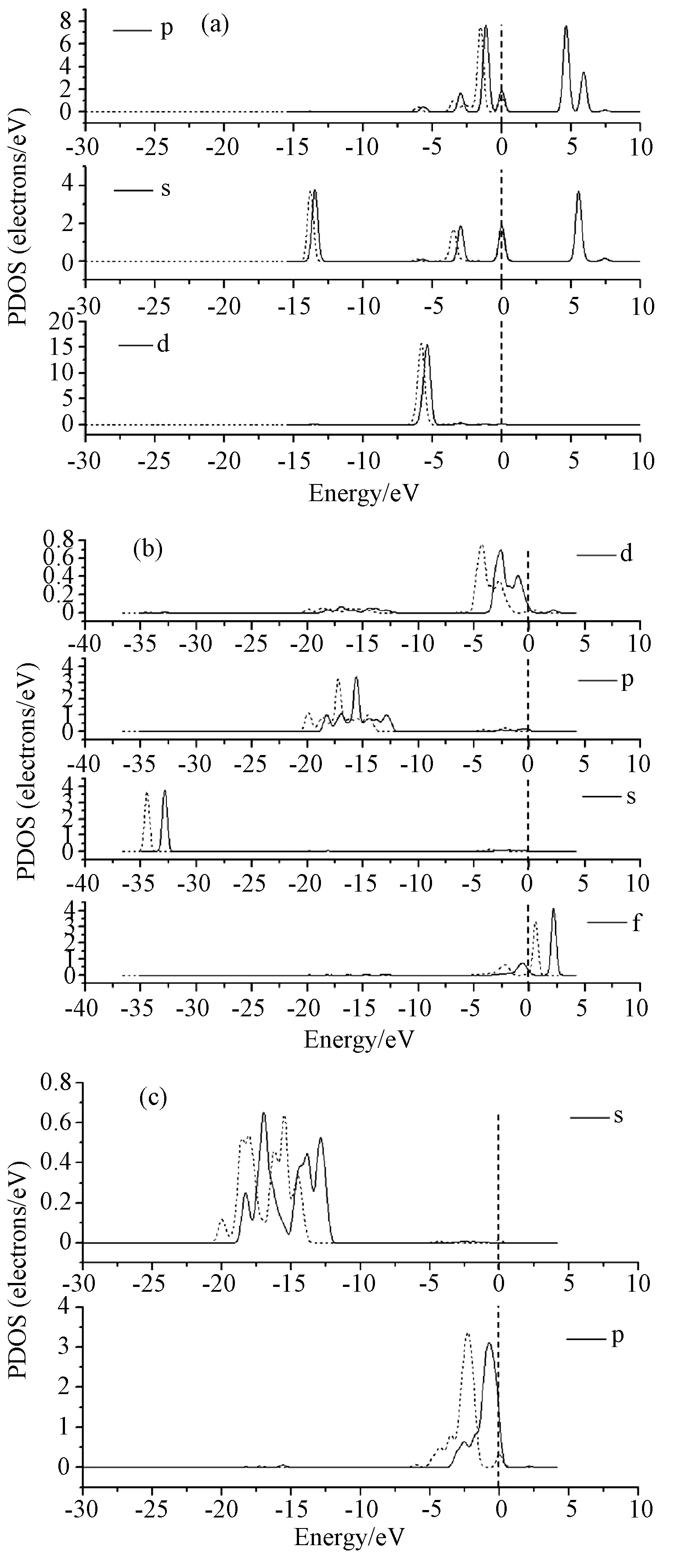
图7 HgCl在CeO2(111)表面局域态密度图((a)、(b)、(c) 图分别为HgCl、Ce、O原子的局域态密度,实线为吸附前,虚线为吸附后)Fig.7 Partial density of states(PDOS) of HgCl on CeO2(111) ((a),(b),(c) are the PDOS of HgCl, Ce, O respectively. The solid line is before adsorption, the dotted line is after adsorption)
3.2.3HgCl2在CeO2(111)表面吸附的态密度分析
如图8(a)、(b)、(c)所示,与HgCl2分子的局域态密度相比,吸附HgCl2后的CeO2(111)局域态密度图中s、p、d轨道的特征峰位置发生了较大变化,向低能级方向偏移,电子峰强度减弱,以p轨道最为显著。从图8(b)和图8(c)可看出,HgCl2吸附后,Ce原子和O原子各轨道的局域态密度未有明显变化,说明CeO2(111)表面的Ce原子、O原子与HgCl2间相互作用较弱,为物理吸附,易从CeO2(111)表面脱附,从而可实现重复利用,有效降低成本。
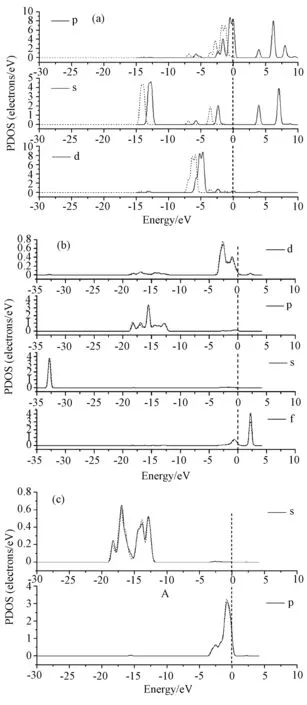
图8 HgCl2在CeO2(111)表面局域态密度图((a)、(b)、(c) 图分别为HgCl2、Ce、O原子的局域态密度,实线为吸附前,虚线为吸附后)Fig.8 Partial density of states(PDOS) of HgCl2 on CeO2(111) ((a),(b),(c) are the PDOS of HgCl2, Ce, O respectively. The solid line is before adsorption, the dotted line is after adsorption
4 结 论
Hg在CeO2(111)表面四个位点为化学吸附,结合的局域态密度图进一步验证了Hg与CeO2(111)表
面存在强相互作用。HgCl在CeO2(111)表面的吸附能高于150kJ/mol,属于强化学吸附,其中氧桥位(Osubirdge)的吸附能最大,达到-164.08kJ/mol。吸附HgCl后, HgCl、Ce、O的局域态密度图整体向低能量方向偏移,构型稳定,是汞吸附氧化反应的重要中间体。HgCl2在CeO2(111)表面各位点的吸附能较低,属于物理吸附,易与CeO2(111)表面发生解离、脱除。依据计算结果得到Cl2条件下, 汞在CeO2(111)表面的吸附氧化机理。
[1] Lingkui Zhao,Caiting Li,Jie Zhang,et al. Promotional Effect of CeO2Modified Support on V2O5-WO3/TiO2Catalyst for Elemental Mercury Oxidation in Simulated Coal-fired Flue Gas[J]. Fuel, 2015, 153(1):361~369.
[2] R. Stolle,H. Koeser,H. Gutberlet. Oxidation and Reduction of Mercury by SCR DeNOx Catalysts under Flue Gas Conditions in Coal Fired Power Plants[J]. Appl. Catal. B: Environ, 2014, 144(1):486~497.
[3] Xu W, Wang H, Zhu T, Kuang J,Jing P. Mercury Removal from Coal Combustion Flue Gas by Modified Fly Ash[J]. J Environ Sci., 2013, 25(2):393~398.
[4] 黄永健,周蓉生,张成江,汪云亮. 大气环境中汞污染的研究进展[J]. 物探与化探, 2002, 26(4): 296~298.
[5] Ye Wu,Shuxiao Wang,David G. Streets, et al. Trends in Anthropogenic Mercury Emissions in China from 1995 to 2003[J]. Environmental Science & Technology, 2006, 40(17): 5312~5318.
[6] Xiaoyu Wen,Caiting Li,Xiaopeng Fan,et al. Experimental Study of Gaseous Elemental Mercury Removal with CeO2/gamma-Al2O3[J]. Energy & Fuels, 2011, 25(7): 2939~2944.
[7] Jianrong Li,Jinsheng Chen,et al. Fe-Mn-Ce/ceramic Powder Composite Catalyst for Highly Volatile Elemental Mercury Removal in Simulated Coal-fired Flue Gas[J]. Journal of Industrial and Engineering Chemistry, 2015, 25(25):352~358.
[8] 雷艳丽,黄华伟,等. 第一原理研究Zr元素对UO2结构与力学性能的影响[J]. 材料科学与工程学报, 2014, 32(1):126~129.
[9] 李文明,吴一,刘晨吉,郑树凯,闫小兵. Cd-O共掺杂ZnTe第一性原理计算[J]. 材料科学与工程学报, 2015, 33(3):405~409.
[10] 陈佰树,胡飞,吴坤,高智勇. 基于第一性原理研究Heusler合金Fe2CuCa的结构和性能[J]. 材料科学与工程学报, 2015, 33(2):168~172.
[11] Wenchao Ji,Zhemin Shen,Maohong Fan,et al. Adsorption Mechanism of Elemental Mercury (Hg0) on the Surface of MnCl2(110) Studied by Density Functional Theory[J]. Chemical Engineering Journal, 2016, 283(1):58~64.
[12] Bingkai Zhang, Jing Liu, Yingju Yang, Ming Chang. Oxidation Mechanism of Elemental Mercury by HCl over MnO2Catalyst: Insights from First Principles[J]. Chemical Engineering Journal, 2015, 280:354~362.
[13] Shujuan Sun, Dongsheng Zhang, Chunyu Li, et al. Density Functional Theory Study of Mercury Adsorption and Oxidation on CuO(111) Surface[J]. Chemical Engineering Journal, 2014, 258(15):128~135.
[14] Wenpo Shan, Fudong Liu, Hhong He,XiaoyanShi, Changbin Zhang. An Environmentally-benign CeO2-TiO2Catalyst for the Selective Catalytic Reduction of NOx with NH3in Simulated Diesel Exhaust[J]. Catal Today, 2012, 184(1):160~165.
[15] 王钲源,张红艳,潘飞,等. PANI/CeO2/WC复合材料的制备及性能[J]. 材料科学与工程学报, 2015, 33(4):564~569.
[16] 张红艳,黄惠,郭忠诚,赖耀斌,付仁春. 水热法制备杂化型CeO2/WC复合材料的电化学性能及表面结[J]. 材料科学与工程学报, 2015, 33(2):197~202.
[17] 闫志国,周小渊,徐艳萍,宣爱国,吴元欣. CeO2掺杂Mn的密度泛函理论[J]. 武汉工程大学学报, 2011, 33(4):7~12.
[18] Yine Xie,Caiting Li,et al. Experimental Study on Hg0Removal from Flue Gas over Columnar MnOx-CeO2/ activated Coke[J]. Applied Surface Science, 2015, 333(1):59~67.
[19] Xunan Zhang,Caiting Li,et al. Simultaneous Removal of Elemental Mercury and NO from Flue Gas by V2O5-CeO2/TiO2Catalysts[J]. Applied Surface Science, 2015, 347:392~400.
[20] Nolan Michael,Grigoleit Sonja,Sayl Dean C., et al. Density Functional Theory Studies of the Structure and Electronic Structure of Pure and Defective Low Index Surfaces of Ceria[J]. Surface Science, 2005, 576(1/3):217~229.
DensityFunctionalTheoryStudyofMercuryAdsorptionontheCeO2(111)Surface
LUYu1,ZHANGQiuxiang1,ZHOUXiaoliang1,LUHongbin1,XUQi2
(1.InstituteofMaterialsEngineering,NanjingUniversity,Nantong226019,China;2.CollegeofChemicalEngineeringandBiological,YanchengInstituteofThechnology,Yancheng224051,China)
Using density functional theory(DFT), the adsorption configuration, adsorption energies and density of states for Hg, HgCl, HgCl2on CeO2(111) surface were calculated. The calculated results show that the adsorption of Hg and HgCl on CeO2(111) surface are mainly chemisorption. The adsorption energy of HgCl on CeO2(111) surface is stronger than that of Hg, which indicates that the HgCl-surface is an important reaction intermediate. HgCl2adsorption on CeO2(111) surface is physisorption, such that it is easy to remove from the CeO2(111) surface. The chlorine species has a strong effect on the mercury adsorption and oxidation, which is consistent with the available experimental results. Based on the calculation results, the reaction mechanism of mercury on CeO2(111) surface is proposed.
mercury; CeO2(111)surface; density functional theory; adsorption
TQ424
:ADOI:10.14136/j.cnki.issn1673-2812.2017.04.009
2016-03-16;
:2016-05-17
南通市应用研究计划资助项目(BK2014026),中央高校基本科研业务费专项资金资助项目(021314380019),国家自然科学基金资助项目(51501088)
陆 玉(1988-),女,助理工程师,主要研究:燃煤烟气汞脱除催化剂的制备和机理研究。E-mail: nantongluyu@126.com。
1673-2812(2017)04-0559-06

