HER2肿瘤靶向亲合体重组蛋白的构建、表达纯化及功能验证
池小琴
福建省厦门市厦门大学附属中山医院肝胆实验室,福建厦门 361004
HER2肿瘤靶向亲合体重组蛋白的构建、表达纯化及功能验证
池小琴
福建省厦门市厦门大学附属中山医院肝胆实验室,福建厦门 361004
目的 实现重组亲合体的高效表达和纯化,并验证其活性。 方法 选择2016年1—12月该院收治的56例卵巢癌患者为研究对象,对HER2亲合体编码序列进行优化,增加其与纳米载体的连接位点,提高表达和纯化效率。重组表达产物ZHER2:342经过凝胶亲和层析纯化和质谱检测分子量,并将纯化产物作为靶向分子连接纳米药物,检测其对HER2高表达细胞的靶向能力。结果 ZHER2:342重组亲合体产物纯度约为97.8%,回收效率1.0 mg/mL。纯化产物分子量为7.648 kDa,与理论值7.631 kDa误差0.2%,表明构建的Cys-ZHER2:342-6His重组亲合体正确。细胞实验表明其可显著提高纳米药物对乳腺癌细胞的细胞毒性(P<0.01),对HER2高表达的肿瘤细胞具有特定的靶向性。结论 重组表达产物ZHER2:342构建正确,可实现高效表达纯化并对HER2高表达的肿瘤细胞具有特定的靶向性。
肿瘤;靶向分子;重组亲合体;表达纯化;靶向能力分析
亲合体是通过定向分子进化技术筛选获得的一类新型的独特的蛋白结合配体,亲合体的结合位点与抗体相似且亲和力强;分子量小,不易在体内诱发免疫应答,组织穿透性好;性质十分稳定[1]。
亲合体的这些独特优势引起了科研工作者的关注,研究人员利用HER2亲合体ZHER2作为HER2高表达肿瘤疾病(宫颈癌、卵巢癌、乳腺癌、头颈部鳞状细胞癌(鳞癌)的特定靶向配体[2-5]。目前,将亲合体ZHER2:342作为靶向分子进行靶向肿瘤能力的研究中,亲合体主要是通过化学合成获得的[6-7]。但化学合成亲合体的方法成本较高,且杂质多,不易纯化。
该文对重组亲合体的编码序列按照大肠杆菌的密码子偏好性进行碱基优化,并在序列中添加肠激酶酶切位点、半胱氨酸密码子、6His-Tag纯化标签等序列,增加重组亲合体与纳米载体的连接位点,并保证表达产物的准确性,提高了表达和纯化效率,降低了生产成本;该文还通过细胞实验验证了表达产物对卵巢癌细胞的特定靶向能力。对2016年1—12月该院收治的56例卵巢癌患者进行了细胞学验证,现将内容总结如下。
1 材料与方法
1.1 实验材料
ATO购于北京华奉联博科技有限公司,氨苄青霉素、IPTG、肠激酶rEK、透析袋、FITC等购于上海生工。交联剂MAL-NHS、NAP-10凝胶柱、Superdex 75 10/300 GL凝胶柱、HisTrap HP预装柱购于GE公司。所有细胞系购于中国科学院上海细胞库。
1.2 重组靶向亲合体的构建
1.2.1 重组亲合体表达质粒的构建 将HER2亲合体的核苷酸序列进行了重组优化设计,在序列前端加上BamHⅠ酶切位点、肠激酶酶切位点和半胱氨酸残基,后端加上6His-Tag纯化标签和XhoⅠ酶切位点,方便表达产物的分离纯化及与纳米颗粒的连接(图1)。并将重组亲合体Cys-ZHER2:342-6His(以下简写为 ZHER2:342)的核苷酸序列按照大肠杆菌的密码子偏好性进行碱基优化,优化后的序列


CATCATTAATAGCTCGAG下划线部分为HER2亲合体的编码序列)送上海生工合成,由于后续实验。

图1 重组亲合体ZHER2:342的核苷酸序列示意图
重组亲合体ZHER2:342基因片段与pET32a(+)表达型质粒分别进行酶切连接,构建重组亲合体表达质粒pET32a (+)-ZHER2:342,重组质粒经酶切结果验证。
1.2.2 利用大肠杆菌表达重组亲合体ZHER2:342制备大肠杆菌BL21(DE3)感受态细胞,将重组表达质粒转化到感受态细胞中,并用IPTG诱导表达6 h。收集菌体,超声破碎细胞,获得胞内可溶性表达产物,用Tricine SDS-PAGE电泳验证表达产物。
1.2.3 重组亲合体ZHER2:342的纯化方法 超声破碎后的上清液经快速蛋白液相色谱 (Fast protein liquid chromat ography,FPLC)纯化,纯化柱用HisTrap HP预装柱(GE),得到融合蛋白Trx-ZHER2:342。
将融合蛋白于4℃下透析;再用肠激酶rEK酶切12~24 h;最后用Superdex 75 10/300 GL凝胶柱(GE)层析分离得到目标产物:重组亲合体ZHER2:342。蛋白含量采用BCA方法测定。最终纯化产物用低温真空冷冻干燥获得重组亲合体ZHER2:342的冻干粉,-20℃储存备用。
1.3 重组亲合体ZHER2:342的鉴定及靶向能力分析
取少量重组亲合体ZHER2:342纯化产物置于透析袋中,用蒸馏水透析;基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)测定纯化产物的精确分子量。
将1 nM HSNs(介孔空心SiO2纳米颗粒)先与1 μM MAL-NHS在pH 8.5的硼酸盐缓冲液中均匀混合,并于室温下缓慢搅拌2 h,凝胶柱(NAP-10,GE)除去未结合的小分子;再加入0.1 μM ZHER2:342继续搅拌使亲合体与纳米药物连接,用NAP-10凝胶柱纯化,获得HSNs-ZHER2:342纳米颗粒。将荧光分子FITC与HSNs表面的氨基反应,获得HSNs-FITC、HSNs-FITC&ZHER2并将它们分别与两种不同的细胞株 SKOV3(HER2高表达细胞株)、SMMC7721(HER2低表达细胞株)孵育24 h,流式细胞分析比较纳米颗粒进入不同细胞的数量差异。

图2 重组亲合体ZHER2:342的构建及表达纯化
1.4 Ni,As@SiO2-ZHER2:342靶向纳米药物的合成
通过斯托伯格法制备Ni,As@SiO2纳米颗粒[9]。并采用交联剂MAL-NHS将靶向亲合体与纳米药物Ni,As@SiO2偶联,形成表面带有靶向亲合体的纳米药物:Ni,As@ SiO2-ZHER2:342。具体方法同1.3。通过反应前后纳米药物表面zeta电位的改变判定靶向分子是否已经连接到了 Ni, As@SiO2纳米药物的表面。将制备好的靶向纳米药物重悬于PBS缓冲液便于后续体内外生物实验。
1.5 纳米药物的细胞毒性检测
SKOV3细胞用含10%胎牛血清(FBS,Hyclone)的Mc-Coy's 5A培养基培养,SMMC7721细胞用含10%胎牛血清(FBS,Hyclone)的RPMI1640培养基培养,细胞置于37℃,5%CO2培养箱中孵育。MTT法研究新型纳米药物与卵巢癌细胞的特异靶向能力。测定不同药物对癌细胞的IC50,分析不同药物对癌细胞的毒性差异,验证纳米药物的选择性杀伤力。
1.6 统计方法
数据统计分析采用Student’s t-test,P<0.05为差异有统计学意义。
2 结果
2.1 HER2重组亲合体ZHER2:342的构建及表达纯化
HER2重组亲合体ZHER2:342基因片段由经人工合成后连接到pET32a(+)表达型质粒上,经酶切检测大小正确(图2A、2B)。将重组质粒pET32a-ZHER2:342导入大肠杆菌BL21 (DE3)中,得到可高效表达 ZHER2:342的重组菌BL21(DE3)-pET32a-ZHER2:342。重组菌经IPTG诱导后可溶性表达融合蛋白Trx-ZHER2:342。
重组大肠杆菌BL21(DE3)-pET32a-ZHER2:342的表达产物含有6His-tag纯化标签,因此用快速蛋白质液相层析系统(FPLC,GE)结合镍柱亲和层析可初步纯化融合蛋白Trx-ZHER2:342,纯化后的融合蛋白用肠激酶切除前端Trx蛋白,再经凝胶分离得到最终产物:重组亲合体 ZHER2:342(图2C)。取少量ZHER2:342纯化产物置于透析袋中,用蒸馏水透析;基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)测定产物的精确分子量。得出结果ZHER2:342重组亲合体产物纯度均为97.8%,回收效率1.0 mg/mL。取2 μL透析后样品与1 μL基质混匀后上样,测得纯化产物的分子量为7.648 kDa(图2D),与ZHER2:342的理论值7.631 kDa,误差0.2%,表明构建的Cys-ZHER2:342-6His重组亲合体正确。
2.2 重组亲合体ZHER2:342靶向卵巢癌细胞的特异性分析
通过荧光分子FITC验证合成的重组亲合体 ZHER2:342是否具有特异的靶向能力。选择 HER2低表达的SMMC7721细胞和HER2高表达的SKOV3细胞做对比,将这3种细胞分别与HSNs-FITC、HSNs-FITC&ZHER2纳米粒子孵育24 h,结果显示相同纳米颗粒浓度和相同孵育时间下,与HSNs-FITC&ZHER2共同孵育的SKOV3细胞其荧光信号比SMMC7721的强,证明ZHER2:342对HER2高表达的癌细胞具有特异靶向能力(图3)。
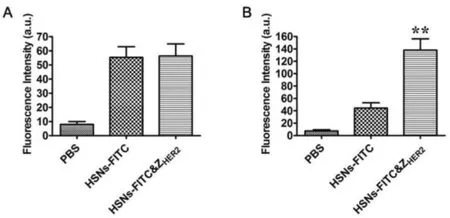
图3 重组亲合体ZHER2:342对HER2高表达的癌细胞有靶向能力。A:SMMC7721;B:SKOV3。
2.3 靶向纳米药物Ni,As@SiO2-ZHER2:342对卵巢癌细胞的毒性更强
将自主合成的Ni,As@SiO2纳米药物与ZHER2:342重组亲合体分子通过交联剂MAL-NHS偶联(图4A),用凝胶柱(NAP-10)纯化,获得靶向纳米药物Ni,As@SiO2-ZHER2:342,用动态光散射仪测定靶向修饰前后纳米药物的表面电位。实验结果显示:Ni,As@SiO2表面电位为30.2 mV,连接靶向分子后Ni,As@SiO2-ZHER2:342的表面电位降为5.2 mV。这是由于重组亲合体的等电点PI为6.17,在水溶液中显负电,因此将其连接到纳米药物上后,降低了其表面电位。靶向前后表面电位的差异证明重组亲合体已经成功连接到了纳米颗粒上。
对合成的靶向纳米药物Ni,As@SiO2-ZHER2:342进行细胞毒性和特异靶向能力的分析。MTT法测定不同药物对肝癌细胞SMMC7721和卵巢癌细胞SKOV3的细胞毒性 (24 h,图4B、4C)。纳米药物Ni,As@SiO2和ZHER2:342靶向纳米药物Ni,As@SiO2-ZHER2:342对SKOV3的IC50分别为(10.42±1.85)、(6.25±1.21)μM,二者差异有统计学意义;而这两种纳米药物对SMMC7721的IC50分别为(8.33±0.81)、(7.5±0.73)μM。重组亲合体靶向修饰后的纳米药物比未修饰纳米药物对HER2高表达的卵巢癌细胞SKOV3具有更强的细胞毒性,而在HER2低表达的肝癌细胞SMMC7721中差异无统计学意义,说明ZHER2:342重组亲合体对HER2过表达的肿瘤细胞具有特定的靶向效果,提高了药物对其抗癌活性。
3 讨论
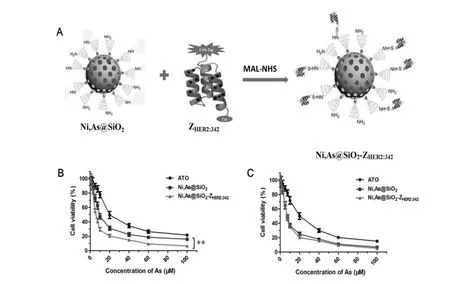
图4 靶向分子增强了纳米药物Ni,As@SiO2-ZHER2:342对卵巢癌SKOV3的细胞毒性
随着现代纳米生物医学技术的发展,基于纳米技术的靶向性输送体系有望实现传统肿瘤诊断和治疗方法所无法企及的高效、低毒的效果,成为肿瘤诊断和治疗的有效手段之一。靶向分子是构建靶向性输送体系的重要因素,亲合体的独特优势决定了其可作为高亲和力靶向分子连接到纳米载体上,实现主动靶向[9-10]。
Rosik D等[7]采用微波辅助的固相肽合成方法(microwaveassisted solid-phase peptidesynthesis)合成HER2亲合体,回收效率仅70%,而该研究对HER2亲合体ZHER2:342的编码序列进行重组优化设计,在大肠杆菌中实现了其高效表达和纯化,降低了生产成本,提高了产量;并增加了其与纳米载体的连接位点,使其易于实现纳米载体的靶向功能化,便于探索其各种潜在应用,包括肿瘤靶向成像和靶向治疗,为后续的开发研究奠定了重要基础。该研究还表明将ZHER2:342重组亲合体与砷纳米药物连接,在卵巢癌中可实现高的特定靶向能力。实验结果与目前已有的研究相同,有报道将ZHER2:342亲合体与不同SPECT显影剂,在卵巢癌中均能实现肿瘤部位的特定显影能力[9-11]。该研究所构建的靶向纳米药物Ni,As@SiO2-ZHER2:342对卵巢癌细胞的毒性更强,这可能是由于ZHER2:342重组亲合体与卵巢癌SKOV3表面的HER2具有高度亲和力,靶向纳米药物富集在SMMC7721细胞表面,更易被细胞摄取进入胞内溶酶体中,再缓慢释放出As离子,进而有效杀死肿瘤细胞。以上研究结果表明构建的重组亲合体ZHER2:342可作为高亲和力的靶向分子与目标分子、纳米药物或探针连接,实现对卵巢癌细胞的靶向功能化,后续将对所构建的靶向纳米药物对HER2高表达的不同癌细胞都进行研究比较,以验证重组亲合体ZHER2:342的特定靶向性。
该文建立了重组亲合体ZHER2:342的高效表达和纯化方法,并证实了它的有效生物活性,节约了实验成本,为其进一步的应用开发和临床转化研究提供了保障。
(
)
[1]Eigenbrot C,Ultsch M,Dubnovitsky A,et al.Structural basis for high-affinity HER2 receptor binding by an engineered protein[J].Proceedings of the National Academy of Sciences of the United States of America,2010(107):15039-15044.
[2]Sandberg D,Tolmachev V,Velikyan I,et al.Intra-image referencing for simplified assessment of HER2-expression in breast cancer metastases using the Affibody molecule ABY-025 with PET and SPECT[M].European Journal of Nuclear Medicine and Molecular Imaging,2017:1-10.
[3]Zhang Y,Jiang S,Zhang D,et al.DNA-affibody nanoparticles for inhibiting breast cancer cells overexpressing HER2[J]. Chemical Communications,2017(53):573-576.
[4]Marzieh G,Aminollah P,Mohammad Ali G,et al.Specific targeting of HER2-positive head and neck squamous cell carcinoma line HN5 by Idarubicin-ZHER2 affibody conjugate[J].Current Cancer Drug Targets,2017(17):1.
[5]Honarvar H,Müller C,Cohrs S,.Evaluation of the first 44Sc-labeled Affibody molecule for imaging of HER2-expressing tumors[J].Nuclear Medicine and Biology,2017(45): 15-21.
[6]Akhtari J,Rezayat SM,Teymouri M,et al.Targeting,bio distributive and tumor growth inhibiting characterization of anti-HER2 affibody coupling to liposomal doxorubicin using BALB/c mice bearing TUBO tumors[J].International Journal of Pharmaceutics,2016(505):89-95.
[7]Rosik D,Thibblin A,Antoni G,et al.Incorporation of a Triglutamyl Spacer Improves the Biodistribution of Synthetic Affibody Molecules Radiofluorinated at the N-Terminus via Oxime Formation with 18F-4-Fluorobenzaldehyde[J].Bioconjugate Chemistry,2014(25):82-92.
[8]Zhao Z,Zhang H,Chi X,et al.Silica nanovehicles endow arsenic trioxide with an ability to effectively treat cancer cells and solid tumors.Journal of Materials Chemistry B,2014(2): 6313-6323.
[9]Altai M,Wallberg H,Honarvar H,et al.Re-188-Z(HER2: V2),a Promising Affibody-Based Targeting Agent Against HER2-Expressing Tumors:Preclinical Assessment.Journal of Nuclear Medicine,2014(55):1842-1848.
[10]Mohamed Suffian IFB,Wang JT-W,Hodgins NO,et al. Engineering hepatitis B virus core particles for targeting HER2 receptors in vitro and in vivo[J].Biomaterials,2017 (120):126-138.
[11]Zhang J,Zhao X,Wang S,et al.Monitoring therapeutic response of human ovarian cancer to trastuzumab by SPECT imaging withTc-peptide-Z[J].Nuclear Medicine and Biology,2015,42(6): 541-546.
《科技资讯》期刊投稿要求及说明
稿件要求:
1、稿件应具有科学性、先进性和实用性,论点明确、论据可靠、数据准确、逻辑严谨、文字通顺。
2、计量单位以国家法定计量单位为准;统计学符号按国家标准《统计学名词及符号》的规定书写。
3、所有文章标题字数在20字以内。
4、参考文献应引自正式出版物,在稿件的正文中依其出现的先后顺序用阿拉伯数字加方括号在段末上角标出。
5、参考文献按引用的先后顺序列于文末。
6、正确使用标点符号,表格设计要合理,推荐使用三线表。
7、图片要清晰,注明图号。
投稿说明:
1、稿件须以电子文档形式发送。如为打印稿,请附软盘,软盘采用Word格式。请勿一稿多投。来稿一律不退,请作者自留底稿。
2、本刊已加入《中国学术期刊(光盘版)》、《中文科技期刊数据库》、《万方数据数字化期刊群》等网络媒体,本刊发表的文章将在网络媒体上全文发布。
3、本刊编辑部对来稿有修改权,不愿改动者请事先说明。自收稿之日起1个月内未收到用稿通知,作者可自行处理。
4、来稿请注明作者姓名、单位、通讯地址、邮编、联系电话及电子信箱。
5、如有一稿多投、剽窃或抄袭行为者,一切后果由作者本人负责。
Construction,Expression and Purification and Functional Verification of HER2 Tumor Target Affinity Recombinant Protein
CHI Xiao-qin
Hepatobiliary Laboratory,Zhongshan Hospital Affiliated to Xiamen University,Xiamen,Fujian Province,361004 China
Objective To realize the high efficient expression and purification of recombinant affinity and test its activity.Methods 56 cases of patients with oophoroma admitted and treated in our hospital from January to December 2016 were selected and the HER2 affinity coding sequence was optimized and the connection site with nanocarrier was enhanced,and the expression and purification efficacies were improved and the recombinant expression product ZHER2:342was purified by the gel affinity chromatography and molecular weight was tested by the mass spectrum,and the purification products were used as the targeting molecules to connect the nanodrugs,and the targeting ability of it to the HER2 high-expression cells was tested.Results The pure of ZHER2:342recombinant affinity product was about 97.8%and the recycle efficacy was 1.0 mg/mL,and the molecular weight of purification products was 7.648 kDa, and the error was 0.2%compared with the theoretical value 7.631 kDa,which shows that the construction of Cys-ZHER2:342-6His recombinant affinity was correct,and the cell test showed that it could obviously improve the cytotoxicity of nano-drugs to breast cancer cells(P<0.01),and it had a specific target to the tumor cells with high HER2 high-expression.Conclusion The construction of recombinant expression product of ZHER2:342is correct,which can realize the high-efficiency expression and purification and has a certain target to the tumor cells with high HER2 high-expression.
Tumor;Targeting molecule;Recombinant affinity;Expression and purification;Targeting ability analysis
R14
A doi 10.11966/j.issn.2095-994X.2017.03.03.06
2017-06-02;
2017-06-20
本论文受厦门市科技计划项目(3502Z20164024,3502Z20144019);福建省自然科学基金青年科技人才创新项目(2013D014)。作者简介:池小琴(1983-),福建三明人,硕士,助理研究员,研究方向:纳米医学。

