不同品种蓝莓酚类物质组成特征及抗氧化能力比较分析
唐柯,王梓萱,张伟宏,徐岩*
1(工业生物技术教育部重点实验室、食品科学与技术国家重点实验室、江南大学 生物工程学院酿酒微生物与酶技术研究室,江苏 无锡,214122) 2(苏州禾木田蓝莓果园,江苏 苏州,215131)
不同品种蓝莓酚类物质组成特征及抗氧化能力比较分析
唐柯1,王梓萱1,张伟宏2,徐岩1*
1(工业生物技术教育部重点实验室、食品科学与技术国家重点实验室、江南大学 生物工程学院酿酒微生物与酶技术研究室,江苏 无锡,214122) 2(苏州禾木田蓝莓果园,江苏 苏州,215131)
以高丛、矮丛、兔眼蓝莓为研究对象,比较了其总酚、花色苷、原花色素、单体酚以及抗氧化力差异。超高效液相色谱检测结果表明,绿原酸为3种蓝莓中含量最多的酚酸;表没食子儿茶素是高丛蓝莓和兔眼蓝莓含量最丰富的黄烷醇,表儿茶素没食酸酯则是矮丛蓝莓含量最高的黄烷醇;在3种蓝莓中含量最高的黄酮醇均为芦丁;矮丛蓝莓单体酚总量显著高于高丛蓝莓和兔眼蓝莓。抗氧化分析结果则表明,无论从DPPH、ABTS还是FRAP测定结果来看,矮丛蓝莓均具有最强的抗氧化能力。相关性分析结果表明,3种蓝莓总酚、总花色苷和原花色素含量均与抗氧化能力存在明显的正相关性。
蓝莓;花色苷;原花色素;单体酚;抗氧化力
蓝莓(blueberry)为杜鹃花科越橘属植物,学名越橘。蓝莓风味独特、色泽诱人、酸甜适口,而且营养丰富,深受人们的喜爱。如今世界上栽培种蓝莓主要包括高丛蓝莓、矮丛蓝莓、兔眼蓝莓三大类[1]。
蓝莓果实中除了含有蛋白质、脂肪、碳水化合物、维生素、微量元素等常见营养物质之外,还有花色苷、多糖、黄酮等多种生理活性成分。在具备营养保健功能的同时,还具有防止脑神经老化、抗癌、软化血管和增强人体免疫能力等功能。特别是它的强抗氧化功能,被誉为“浆果之王”[2-3]。近年来,国内外研究人员也陆续对蓝莓抗氧化活性展开研究。WANG等[4]以42种蓝莓为实验材料,证实蓝莓具有较强的抗氧化能力,能够有效清除O2-·、·OH、ROO·以及H2O2。李颖畅等[5]研究了“圣云”蓝莓花色苷不同组分的体外抗氧化性和稳定性,结果表明,“圣云”蓝莓花色苷3个组分都具备抗脂质体过氧化能力,可以有效的还原和清除·OH、DPPH·。蓝莓除花色苷具有清除自由基的能力外,多糖、黄酮和总酚等也具有抗氧化能力。孟宪军等[6]对蓝莓多糖的抗氧化性进行研究,结果表明蓝莓对·OH、DPPH·具有较强的清除作用。刘玮等[7]对蓝莓黄酮抗氧化能力进行了初步研究,结果表明蓝莓黄酮具有较强的抗氧化能力,尤其是经纯化的黄酮类物质,其抗氧化性显著增加。高畅等[8]利用蓝莓果渣提取总酚,结果表明总酚对DPPH·及O2-·均具有很好的清除能力。
蓝莓作为一种具有高营养价值的水果越来越受到人们的关注,我国蓝莓的种植面积也是逐年扩大[9],但是系统的关于不同品种蓝莓果实抗氧化物质的差异,特别是单体酚的研究仍较少见。本研究以3种主栽蓝莓高丛、矮丛、兔眼蓝莓为研究对象,通过对其总酚、花色苷、原花色素、单体酚以及抗氧化力进行对比分析,明确不同品种蓝莓主要功能成分的差异。
1 材料与方法
1.1材料与试剂
材料:矮丛蓝莓(长白山,美登,Blomidon),高丛蓝莓(安吉,奥尼尔,O’Neal),兔眼蓝莓(安吉,顶峰,Climax)。所有蓝莓样品均由苏州禾木田蓝莓果园提供。
试剂:12种黄酮醇标准品(桑黄素、山奈酚、杨梅酮、鼠李素、异鼠李素、高良姜、非瑟酮、芹菜素、木犀草素、芦丁、槲皮素、槲皮苷)购自Sigma(St. Louis, MO)公司,纯度95%以上;11种酚酸标准品(没食子酸、原儿茶酸、龙胆酸、p-羟基苯甲酸、绿原酸、咖啡酸、香草酸、丁香酸、p-香豆酸、阿魏酸、芥子酸)购自Sigma(St. Louis, MO)公司,纯度95%以上;5种黄烷醇标准品(EGC 表没食子儿茶素、CAT 儿茶素、EGCG 表没食子儿茶素没食子酸酯、EC 表儿茶素、ECG 表儿茶素没食酸酯)购自Sigma(St. Louis, MO)公司,纯度98%以上;ABTS试剂盒、FRAP试剂盒、DPPH购自上海哈灵生物有限公司;实验用水为自制超纯水(电导度18M);甲醇、乙腈,CNW公司,色谱纯(纯度≥98%)。
1.2仪器与设备
Waters Acquity H-Class 超高效液相色谱仪(配置二极管阵列检测器、样品管理器、溶剂管理器、柱温箱、Empower色谱工作站),美国Waters公司;WFZ UV-2802H型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;超低温冰箱Forma-86C Thermo Electron Corporation;循环水式真空泵SHZ-D(Ⅲ) 巩义市子华仪器有限责任公司;纯水仪Millipore Simplicity UV Bedford,MA,USA;恒温烘箱,上海实验仪器厂有限公司。
1.3实验方法
1.3.1 蓝莓样品处理
取冰冻蓝莓果实,去籽,加液氮冷冻,用打浆机粉碎,准确称取2.5 g研磨好的粉末于离心管中,加入30 mL体积分数60%的乙醇溶液,40 ℃水浴浸提2 h,离心,取上清液,提取3次,合并上清液,35 ℃下,减压旋蒸,去除乙醇。避光低温保存,待用。
1.3.2 总酚、花色苷、原花色素含量测定
总酚测定:福林肖卡法测定蓝莓果实中的总酚含量。酶标仪测定765 nm下的吸光值,以没食子酸计。
总花色苷测定:采用pH示差法,配制pH=1.5 [V(0.2 mol/L KCl)∶V(0.2 mol/L HCl)=25∶67]和pH=4.5[V(0.2 mol/L NaAc·H2O)∶V(0.2 mol/L HAc)=1∶1]的缓冲液。取0.4 mL提取液,分别用2种缓冲液定容至10 mL容量瓶在520 nm下测吸光度。花色苷计算公式如下:
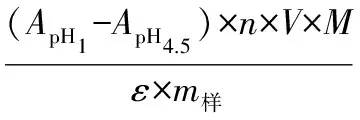
(1)
式中:A为吸光度;n为用缓冲液稀释倍数(25倍);V提取液总体积;M为矢车菊素-3-葡萄糖苷相对分子质量(449 g/mol);ε为矢车菊素-3-葡萄糖苷消光系数(26 900 L/(mol·cm)-1);m样为样品质量。
原花色素测定:取5 mL 提取液经乙醚除脂,用乙酸乙酯萃取,收集乙酸乙酯上相,取0.5 mL样液加入试管中加4%香草醛甲醇液3 mL混合,再加入1.5 mL浓HCl,混匀。室温下显色15 min左右,在500 nm下测吸光度。用4%香草醛甲醇液做空白,避光操作。原花色素含量计算公式如下:
原花色素/(×103mg)=A500÷0.55×100×样液稀释倍数
(2)
式中:A为吸光度;0.55为0.1 g的原花色素波长为0.55。
1.3.3 酚类物质超高效液相色谱分析
ACQUITY UPLC BEH C18(i.d 2.1×150 mm,1.7 μm)色谱柱,流速0.3 mL/min,进样量为1 μL,以峰面积外标法定量。
酚酸、黄烷醇、黄酮醇洗脱程序参照课题组前期已建立的方法进行[10]。
蓝莓提取液测定前经 0.22 μm水相微孔滤膜过滤。
1.3.4 DPPH分析
12.5 mg DPPH溶解到甲醇溶液中,定容到100 mL,使用时再稀释5倍到25 mg/L。取0.1 mL提取液或酒样加到3.9 mL DPPH甲醇溶液中,在黑暗中反应20 min后在515 nm处测定吸光值,对照以相同体积15%乙醇代替待测液。Trolox作为标准品进行DPPH抗氧化能力检测,样品的抗氧化能力用Trolox-Equivalent Antioxidant Capacity (TE)来表示。
1.3.5 ABTS分析
将提取液适当稀释后,按照ABTS试剂盒说明书提供方法进行检测。Trolox作为标准品进行ABTS抗氧化能力检测,样品的抗氧化能力用Trolox-Equivalent Antioxidant Capacity (TE)来表示。
1.3.6 FRAP分析
将提取液适当稀释后,按照FRAP试剂盒说明书提供方法进行检测。对于FRAP方法,总抗氧化能力用FeSO4标准溶液的浓度来表示。
1.4数据处理
所有样品检测均重复3次,单因素方差分析和相关性分析由SPSS 19.0统计分析软件实现(SPSS Inc., Chicago, Illinois, USA),所有统计分析的显著性水平为0.05(p<0.05)。
2 结果与分析
2.1总酚、总花色苷、原花色素含量及抗氧化力比较分析
表1为3种蓝莓果实的总酚、花色苷、原花色素及抗氧化力的分析。从结果可以看出,不同蓝莓品种之间总酚含量和花色苷含量差异比较大,其中矮丛蓝莓(美登)的总酚和花色苷含量最为丰富,分别为649.1 mg/100 g FW和301.8 mg/100 g FW。含量最低为兔眼蓝莓,只有266.4 mg/100 g FW和88.8 mg/100 g FW。3种蓝莓的原花色素含量最高仍是矮丛蓝莓(美登)为43.5 mg/100 g FW,高丛蓝莓(奥尼尔)和兔眼蓝莓(顶峰)则差异不大,分别为25.7 mg/100 g FW和29.7 mg/100 g FW。

表1 不同地区蓝莓果实花色苷、原花色素含量及抗氧化活性分析
此外,高丛蓝莓(奥尼尔)和矮丛蓝莓(美登)在抗氧化能力方面明显强于兔眼蓝莓(顶峰),矮丛蓝莓(美登)在抗氧化能力较高丛蓝莓(奥尼尔)则更强。结合图1~图3相关性分析结果可以看出,总酚和总花色苷含量跟蓝莓果实的抗氧化能力存在明显的正相关性。总酚含量和DPPH、ABTS、FRAP三种抗氧化能力测定结果的相关性分别为0.854 7、0.980 6、0.604 3;总花色苷含量和DPPH、ABTS、FRAP三种抗氧化能力测定结果的相关性分别为0.527 9、0.786 1、0.899 0。充分验证了总酚含量和总花色苷含量与抗氧化活性之间的相关性。而原花色素含量与3种抗氧化能力测定结果的相关系数相对较低,分别为0.853 8、0.624 5、0.430 2。姜爱丽等以4 个北高丛蓝莓品种为试验,比较了总花色苷、可溶性多糖、Vc 以及还原型谷胱甘肽含量4 种抗氧化物质与DPPH 自由基清除能力之间的相关性,结果表明总花色苷含量、Vc 含量以及还原型谷胱甘肽含量与DPPH 自由基清除能力间存在显著的正相关[11]。本文研究结果也与GRACE等的研究结果基本一致[12]。
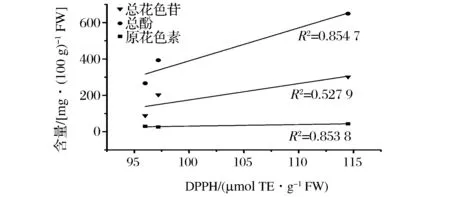
图1 蓝莓中总花色苷、总酚和原花色素含量与DPPH法测定抗氧化能力的相关性Fig.1 Correlation between totalanthocyanins and proanthocyanidins total phenol content of blueberry and DPPH assay correlation between antioxidant capacity
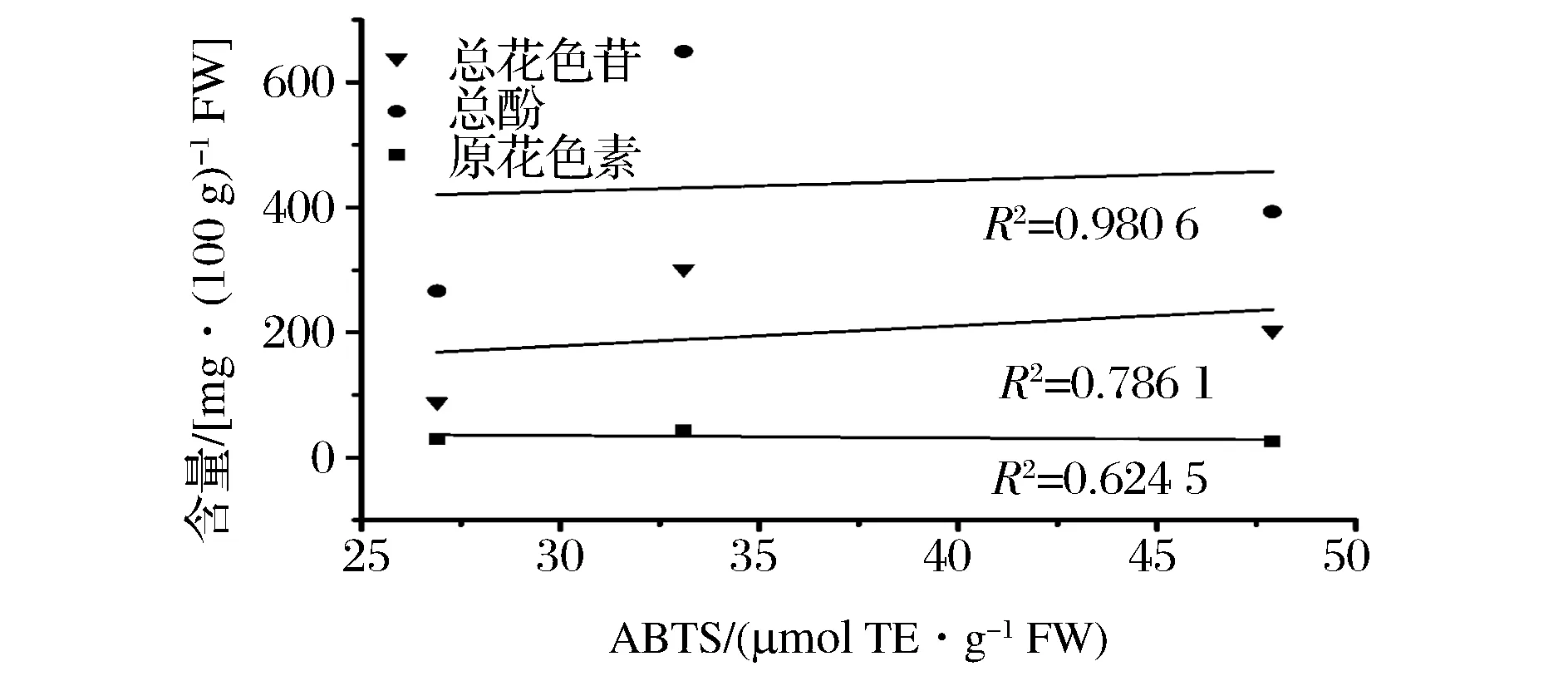
图2 蓝莓中总花色苷、总酚和原花色素含量与ABTS法测定抗氧化能力的相关性Fig.2 Correlation between totalanthocyanins and proanthocyanidins total phenol content of blueberry and ABTS assay correlation between antioxidant capacity
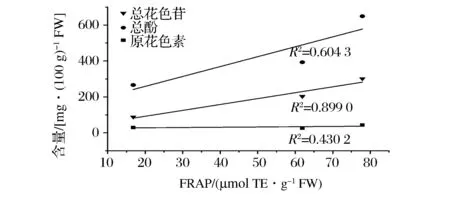
图3 蓝莓中总花色苷、总酚和原花色素含量与FRAP法测定抗氧化能力的相关性Fig.3 Correlation between totalanthocyanins and proanthocyanidins total phenol content of blueberry and FRAP assay correlation between antioxidant capacity
2.2酚类物质组成及含量比较分析
酚酸分析结果表明,3种蓝莓均未检测到对羟基苯甲酸,此外,矮丛蓝莓未检测到丁香酸,兔眼蓝莓未检测到丁香酸和龙胆酸。绿原酸为3种蓝莓中含量最多的酚酸,其中矮丛蓝莓含量最高,为9.54 mg/100g FW;除绿原酸外其他酚酸含量均较低,大多低于1 mg/100g FW。此外,3个不同蓝莓品种的总酚酸含量在9.19~20.92 mg/100g FW之间,与ZHANG等[13]对蓝莓果实酚类物质含量测定结果基本一致。矮丛蓝莓的酚酸含量高于高丛蓝莓,高于兔眼蓝莓。
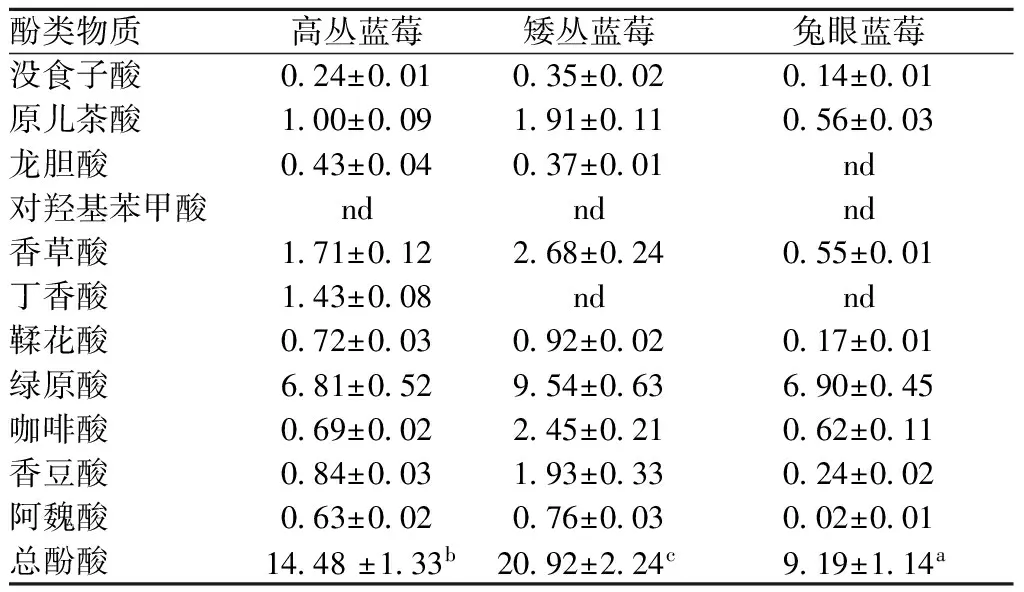
表2 不同品种蓝莓酚酸含量 单位:mg/100 g FW
注:表中不同字母代表差异显著(p<0.05)。
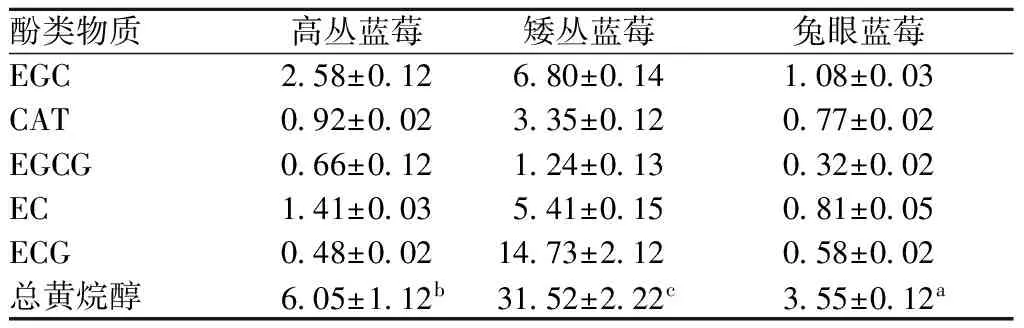
表3 不同品种蓝莓黄烷醇含量 单位:mg/100 g FWTable 3 Flavanols content of different kinds of
注:表中不同字母代表差异显著(p<0.05)。
表3可以看出,3种蓝莓黄烷醇含量差别较大,其中矮丛蓝莓黄烷醇总含量达到31.52 mg/100 g FW,显著高于高丛蓝莓(6.05 mg/100 g FW)和兔眼蓝莓(3.55 mg/100 g FW)。单体黄烷醇方面,EGC是高丛蓝莓和兔眼蓝莓含量最丰富的黄烷醇,ECG则是矮丛蓝莓含量最高的黄烷醇。
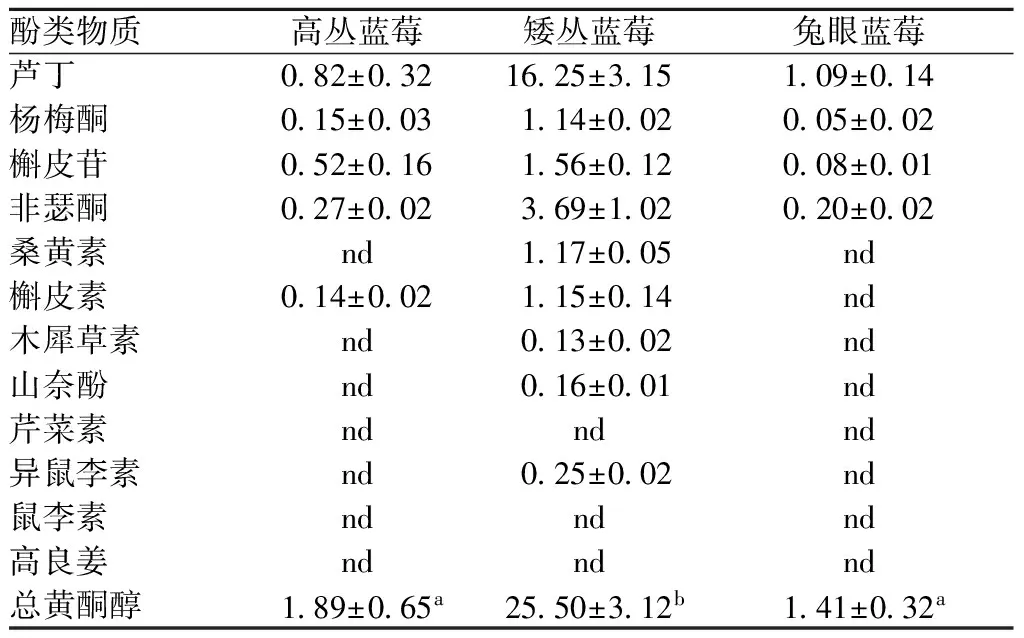
表4 不同品种蓝莓黄酮醇含量 单位:mg/100g FW
注:表中不同字母代表差异显著(p<0.05)。
表4为不同品种蓝莓黄酮醇的UPLC测定结果。从表4可以看出,在3种蓝莓中芦丁均为含量最高的黄酮醇。而矮丛蓝莓的总黄酮醇含量最丰富,达到25.50 mg/100 g FW,高丛蓝莓和兔眼蓝莓的总黄酮醇含量较低,均不足2 mg/100 g FW。除矮丛蓝莓外,高丛蓝莓和兔眼蓝莓的总黄酮醇含量与CHUN等研究结果基本一致[14]。
3 结论
本实验以高丛蓝莓(奥尼尔)、矮丛蓝莓(美登)、兔眼蓝莓(顶峰)为研究对象,通过UPLC技术对其主要单体酚进行了定性定量分析。结果表明,绿原酸为3种蓝莓中含量最多的酚酸;EGC是高丛蓝莓(奥尼尔)和兔眼蓝莓(顶峰)含量最丰富的黄烷醇,ECG则是矮丛蓝莓(美登)含量最高的黄烷醇;在3种蓝莓中含量最高的黄酮醇均为芦丁;矮丛蓝莓单体酚总量显著高于高丛蓝莓(奥尼尔)和兔眼蓝莓(顶峰)。
不同蓝莓品种之间总酚含量和花色苷含量差异比较大,其中矮丛蓝莓(美登)的总酚和花色苷含量最为丰富,兔眼蓝莓(顶峰)含量最低。3种蓝莓的原花色素的含量最高仍是矮丛蓝莓(美登),高丛蓝莓(奥尼尔)和兔眼蓝莓(顶峰)则无显著性差异。抗氧化分析结果则表明,无论从DPPH、ABTS、FRAP还是总酚含量测定来看,矮丛蓝莓(美登)均具有最强的抗氧化能力。相关性分析结果表明,3种蓝莓总酚、总花色苷和原花色素含量均跟蓝莓果实的抗氧化能力存在明显的正相关性。
[1] MOORE N.The blueberry industry of North America[J]. Hort Technology, 1994, 346(4): 96-102.
[2] 王秀菊,杜金华,马磊. 蓝莓酒渣中花色苷提取工艺的优化及稳定性的研究[J]. 分离与提取,2009,35(9):151-156.
[3] 贺强,吴立人. 蓝莓果实中营养成分的生物学功能[J]. 北方园艺,2010. 24:222-224.
[4] WANG S Y, CHEN H J, EHLENFELDT M K. Antioxidant capacities vary substantially among cultivars of rabbiteye blueberry (VacciniumasheiReade)[J]. International Journal of Food Science and Technology, 2012, 46(12):2 482-2 490.
[5] 李颖畅,李冰心,孟良玉,等. 圣云蓝莓花色苷不同组分的体外抗氧化性和稳定性[J]. 食品科学,2012,33(9):105-109.
[6] 孟宪军,刘晓晶,孙希云,等. 蓝莓多糖的抗氧化性与抑菌作用[J]. 食品科学,2010,31(7): 110-114.
[7] 刘玮,钱慧碧,辛秀兰,等. 蓝莓果渣中总黄酮的提取纯化及抗氧化性能的研究[J]. 食品科技,2011,36(2):216-219.
[8] 高畅,程大海,高欣,等. 蓝莓提取物总酚含量及抗氧化活性研究[J]. 植物研究,2010,30(2):253-256.
[9] 戴桂芝. 浅谈我国目前果酒行业现状及发展对策[J].中国酿造,2002,2(6):3-5.
[10] 马磊. 基于不挥发风味物质对葡萄酒产地, 品种特征性及收敛性的研究[D]. 无锡:江南大学, 2013.
[11] 姜爱丽,孟宪军,胡文忠等.不同北高丛蓝莓品种的抗氧化成分及其抗氧化活性[J]. 食品与发酵工业, 2011,37(9): 161-165.
[12] GRACE M H, ESPOSITO D, DUNLAP K L,et al. Comparative analysis of phenolic content and profile, antioxidant capacity, and anti-inflammatory bioactivity in wild alaskan and commercial vaccinium berries[J]. Journal of Agricultural and Food Chemistry, 2014,62(18):4 007-4 017.
[13] ZHANG W, WANG S Y. Oxygen radical absorbing capacity of phenolics in blueberries, cranberries, chokeberries, and Lingonberries[J]. Journal of Agricultural and Food Chemistry, 2003,51(2):502-509.
[14] CHUN O, CHUNG S, SONG W. Estimated dietary flavonoid intakes and major food sources of U.S. adults[J]. Journal of Nutrition, 2007,137(5):1 244-1 252.
Comparativeanalysisofphenoliccontentandprofile,andantioxidantcapacityindifferentblueberryvarieties
TANG Ke1, WANG Zi-xuan1, ZHANG Wei-hong2, XU Yan1*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education; State Key Laboratory of Food Science & Technology;Centre for Brewing Science and Enzyme Biotechnology, School of BiotechnologyJiangnan University, Wuxi 214122, China) 2 (Hemutian Blueberry orchard, Suzhou 215131, China)
The total phenols, anthocyanins, proanthocyanidin, monomer polyphenol and antioxidant activities of three varieties of blueberry were compared. The results of UPLC showed that chlorogenic acid was the highest in phenolic in three blueberries; EGC was the highest flavanols in highbush blueberries and rabbiteye blueberries; ECG was the highest flavanol in lowbush blueberry. The highest flavonol in three blueberries was rutin, the total phenolic compounds in lowbush blueberry were more than highbush blueberries and rabbiteye blueberries. The antioxidant activities results showed that lowbush blueberry have the strongest antioxidant capacity in DPPH, ABTS and FRAP. Correlation analysis showed that total phenolics, total anthocyanin and proanthocyanidin content in blueberries were all significantly positive correlated with antioxidant capacity.
blueberry; anthocyanins; proanthocyanidin; monomer polyphenol; antioxidant activities
10.13995/j.cnki.11-1802/ts.013342
博士,副教授(徐岩教授为通讯作者,E-mail:yxu@jiang ̄nan.edu.cn)。
2016-11-04,改回日期:2017-01-18

