长链非编码RNA AL049452在结直肠癌组织中的表达及临床意义
孙祥威,胡盈盈,徐剑峰,张良,毛晨晨,郭刚强,黄关立,沈贤,薛向阳
长链非编码RNA AL049452在结直肠癌组织中的表达及临床意义
孙祥威1,胡盈盈2,徐剑峰1,张良1,毛晨晨1,郭刚强3,黄关立4,沈贤5,薛向阳3
(1.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;2.温州医科大学附属第二医院 妇产科,浙江 温州 325027;3.温州医科大学 基础医学院 微生物学与免疫学教研室,浙江 温州 325035;4.温州医科大学附属第一医院 肿瘤科,浙江 温州 325015;5.温州医科大学附属第二医院 胃肠外科,浙江 温州 325027)
目的:探索长链非编码RNA(lncRNA)AL049452在结直肠癌组织中的表达及临床意义。方法:收集84例手术切除的结直肠癌及相应的癌旁正常组织,qRT-PCR检测lncRNA-AL049452的表达水平,用Mann-Whitney U检验分析lncRNA-AL049452表达水平和结直肠癌患者临床病理特征的关系,同时分析其对结直肠癌患者的总生存时间及无病生存时间的影响。绘制ROC曲线评价lncRNA-AL049452诊断结直肠癌的效能。结果:结直肠癌患者肿瘤组织lncRNA-AL049452的表达水平明显高于癌旁正常组织(P=0.0035),肿瘤更大的结直肠癌患者其lncRNA-AL049452的表达量更高(P=0.024)。生存曲线分析显示,高表达lncRNA-AL049452的结直肠癌患者的无病生存时间较低表达组更短(log-rank=4.208,P=0.034)。ROC曲线分析显示,lncRNAAL049452诊断结直肠癌的曲线下面积为0.723(95%CI=0.613~0.832,P<0.001),敏感性和特异性分别为86.0%和51.2%。结论:肿瘤组织中高表达的lncRNA-AL049452可能参与了结直肠癌发生发展进程,是结直肠癌诊断和预后判断的新生物标记物。
长链非编码RNA;AL049452;结直肠肿瘤;生物学标记
结直肠癌是全球发病率第三的恶性肿瘤,全球每年超过693 900例患者死于结直肠癌[1]。发病率位于中国恶性肿瘤第四位,并逐年上升,严重威胁公众生命健康[2]。随着基因组学的进展,人们发现结直肠癌的发生发展与原癌基因和抑癌基因的改变密切相关[3]。人类基因组中有98%的转录产物不编码蛋白质,即非编码RNA,其中长度大于200 nt的转录本被称为长链非编码RNA(long non-coding RNA,lncRNA)[4]。研究表明lncRNA通过表观遗传学调控、转录水平及转录后水平调控影响靶基因的表达,从而参与糖尿病、肿瘤等多种疾病的发生发展[5-6]。AL049452是G蛋白偶联受体180基因(G protein
coupled receptor 180,GPR180)3’端长约577 bp的转录本,并不编码任何蛋白质,是新的lncRNA。GPR180是近年来新发现的G蛋白偶联受体家族的成员[7],参与血管重建并与肿瘤预后相关[8-9], 但lncRNA-AL049452在肿瘤中的表达及效应迄今尚未阐明。本研究旨在探索lncRNA-AL049452在结直肠癌中的表达及临床意义。
1 资料和方法
1.1 一般资料 组织标本来源于2004年2月至2006年12月在温州医科大学附属第一医院进行手术并经病理确认的84例结直肠癌患者。其中男46例,女38例;年龄为37~81岁,中位年龄65岁。所有患者的肿瘤分化程度、浸润深度、淋巴结转移、脉管侵犯等均由温州医科大学附属第一医院病理科确认,其中肿瘤浸润深度、淋巴结转移、TNM分期、Duke分期根据2012美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)结直肠癌临床实践指南划分。切取结直肠癌组织及癌旁正常黏膜组织(距离肿瘤>10 cm),保存于液氮中。术后前2年每3个月随访1次,术后第3年以后每半年随访1次。总生存时间和无病生存时间均从术后第1天开始计算,总生存时间统计至患者死亡,无病生存时间统计至患者肿瘤复发或至死亡。本研究经医院伦理委员会批准,所有患者均已签署知情同意书。
1.2 方法
1.2.1 试剂及仪器:Trizol购自美国Invitrogen公司;ReverTra Ace qPCR RT Kit、SYBR®Green Realtime PCR Master Mix购自日本TOYOBO公司;realtime-PCR采用Step One PlusTM实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)系统;lncRNA-AL049452及GAPDH的引物由上海吉玛制药技术有限公司合成,序列见表1。
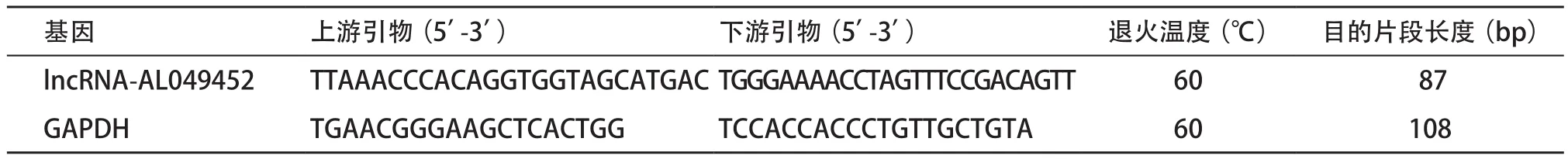
表1 LncRNA-AL049452及GAPDH的qRT-PCR引物
1.2.2 生物信息学:GSE37364表达谱芯片信息来自NCBI GEO数据库。该芯片含有38例结直肠正常组织,29例结直肠腺瘤,27例结直肠癌的表达谱数据。编辑R语言代码从中提取AL049452的表达数据,进行统计分析。
1.2.3 RNA提取及反转录:切取30 mg的冰冻组织进行研磨,按照说明书用Trizol提取RNA,并用紫外分光光度计(NanoDrop ND-1000)检测RNA的纯度及浓度。取1 μg RNA,按照ReverTra Ace qPCR RT Kit说明书进行反转录,合成的cDNA在-20 ℃保存。
1.2.4 qRT-PCR:按照20 μL qRT-PCR体系:将1 μL cDNA,上下游引物各1 μL,10 μL SYBR Mix,7 μL DEPC水依次加入八连管并混匀,按3 000 r/min离心1 min。采用Step One PlusTMqRT-PCR系统,反应条件:95 ℃ 5 min,95 ℃ 15 s、60 ℃ 32 s、72 ℃ 32 s循环40次。设置3个复孔,lncRNAAL049452及GAPDH的PCR产物琼脂糖凝胶电泳结果见图1。结果以GAPDH为内参进行校正,并按照结直肠癌组织/癌旁正常组织处理成2-△△CT的形式。
1.3 统计学处理方法 采用SPSS21.0统计学软件进行统计学分析。lncRNA-AL049452的表达量以M(P25,P75)表示。结直肠癌、结直肠腺瘤及癌旁正常组织lncRNA-AL049452表达量的比较以及不同临床病理学特征lncRNA-AL049452表达量的比较采用Mann-Whitney U检验。采用ROC曲线分析lncRNAAL049452诊断结直肠癌的敏感性和特异性。生存曲线采用Kaplan-Meier分析,采用log-rank test进行统计检验。P<0.05为差异有统计学意义。
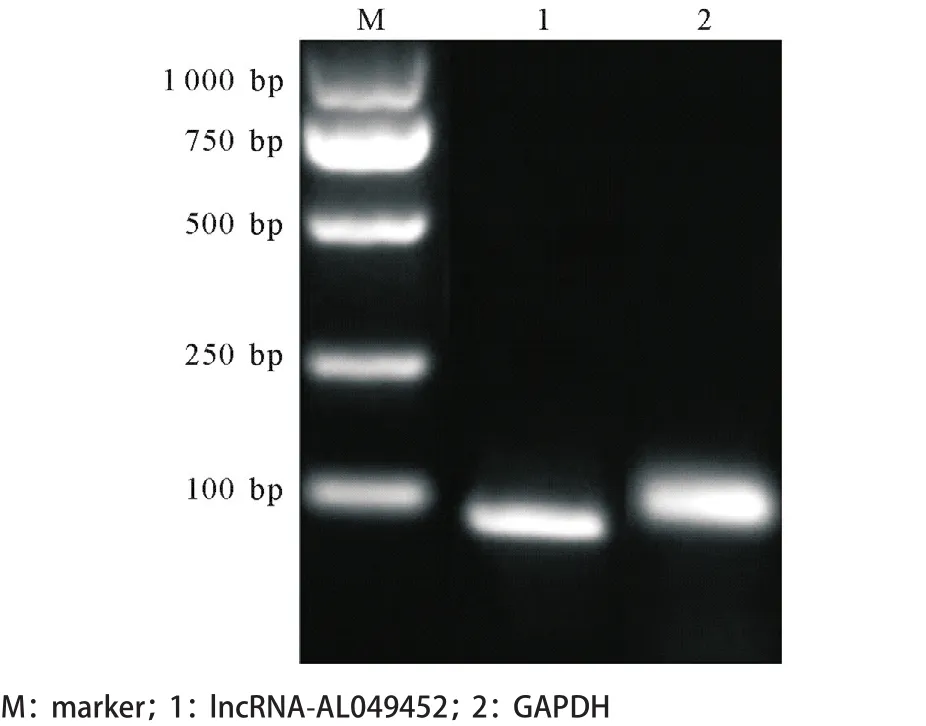
图1 lncRNA-AL049452及GAPDH的qRT-PCR扩增产物的琼脂糖凝胶电泳结果
2 结果
2.1 LncRNA-AL049452在结直肠癌组织中的表达情况 GSE37364表达谱芯片分析显示,lncRNA-AL049452 在癌旁正常组织[99.85(85.03,113.15)]、结直肠腺瘤[133.01(98.55,183.55)]及结直肠癌[204.45(167.12,284.35)]中的表达量逐渐升高(P<0.001),见图2。qRT-PCR结果显示lncRNA-AL049452在肿瘤组织中的表达量[2.50(1.13,7.35)]明显高于癌旁正常组织(P=0.0035)。
2.2 LncRNA-AL049452诊断结直肠癌的价值 ROC曲线分析结果显示lncRNA-AL049452诊断结直肠癌的曲线下面积(area underthe curve,AUC)为0.723(95%CI=0.613~0.832,P<0.001),诊断结直肠癌的敏感性和特异性分别为86.0%和51.2%,约登指数为0.372,有较高的诊断价值(见图3)。
2.3 LncRNA-AL049452表达水平与结直肠癌患者临床病理学特征的关系 如表2所示,lncRNA-AL049452 的过表达与结直肠癌的大小有关(P=0.024),而lncRNA-AL049452的表达量与患者的性别、年龄、肿瘤分化、浸润、淋巴结转移、TNM分期、Duke分期、脉管侵犯及血清癌胚抗原(carcinoembryonic antigen,CEA)水平无关(P>0.05)。
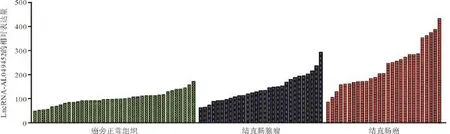
图2 LncRNA-AL049452在结直肠癌表达谱芯片GSE37364中的表达情况
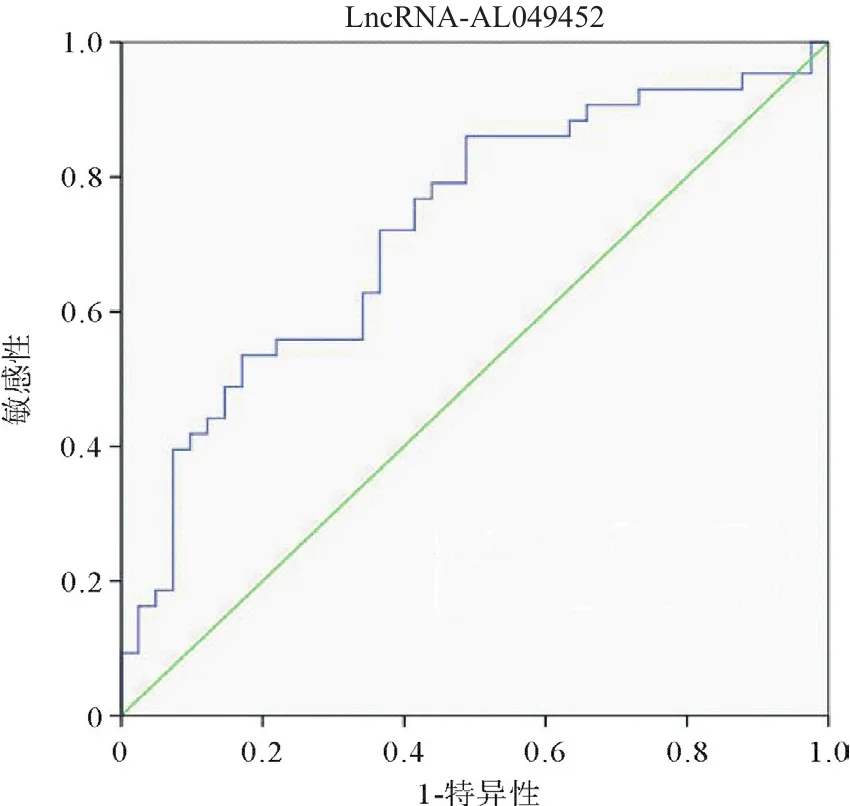
图3 LncRNA-AL049452诊断结直肠癌的ROC曲线
2.4 LncRNA-AL049452表达水平与结直肠癌患者预后的关系 以结直肠癌患者lncRNA-AL049452表达量的平均值为界,将结直肠癌患者划分为lncRNAAL049452高表达组(38例)和低表达组(46例)进行生存分析。结果显示lncRNA-AL049452不同表达组结直肠癌患者总生存率差异无统计学意义(logrank=0.099,P=0.753),但是lncRNA-AL049452低表达组的中位无病生存时间(disease-free survival, DFS)为43个月,明显高于lncRNA-AL049452高表达组的30个月(log-rank=4.208,P=0.034),见图4。
3 讨论
lncRNA是长度大于200 nt的非编码RNA,缺乏开放阅读框,不编码任何蛋白[10]。按lncRNA在基因组的位置,分为正义lncRNA、反义lncRNA、双向 lncRNA、基因内lncRNA及基因间lncRNA[11]。lncRNA 起初被认为是“基因组噪音”,而后研究证实lncRNA通过表观遗传学、转录水平及转录后水平调控靶基因的表达,参与各种疾病的发生发展[12]。
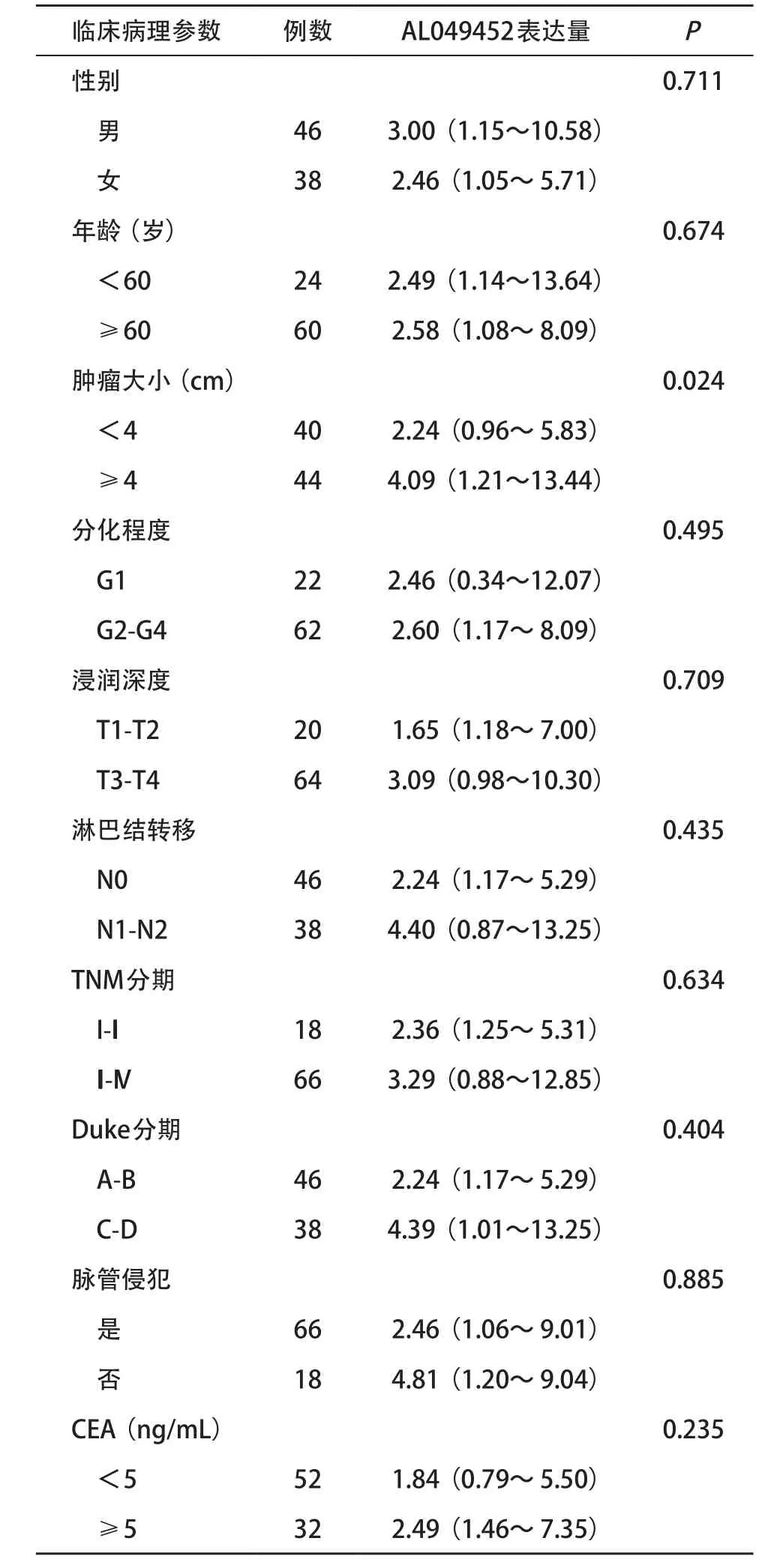
表2 LncRNA-AL049452表达水平和结直肠癌临床病理参数的关系[M(P25,P75)]
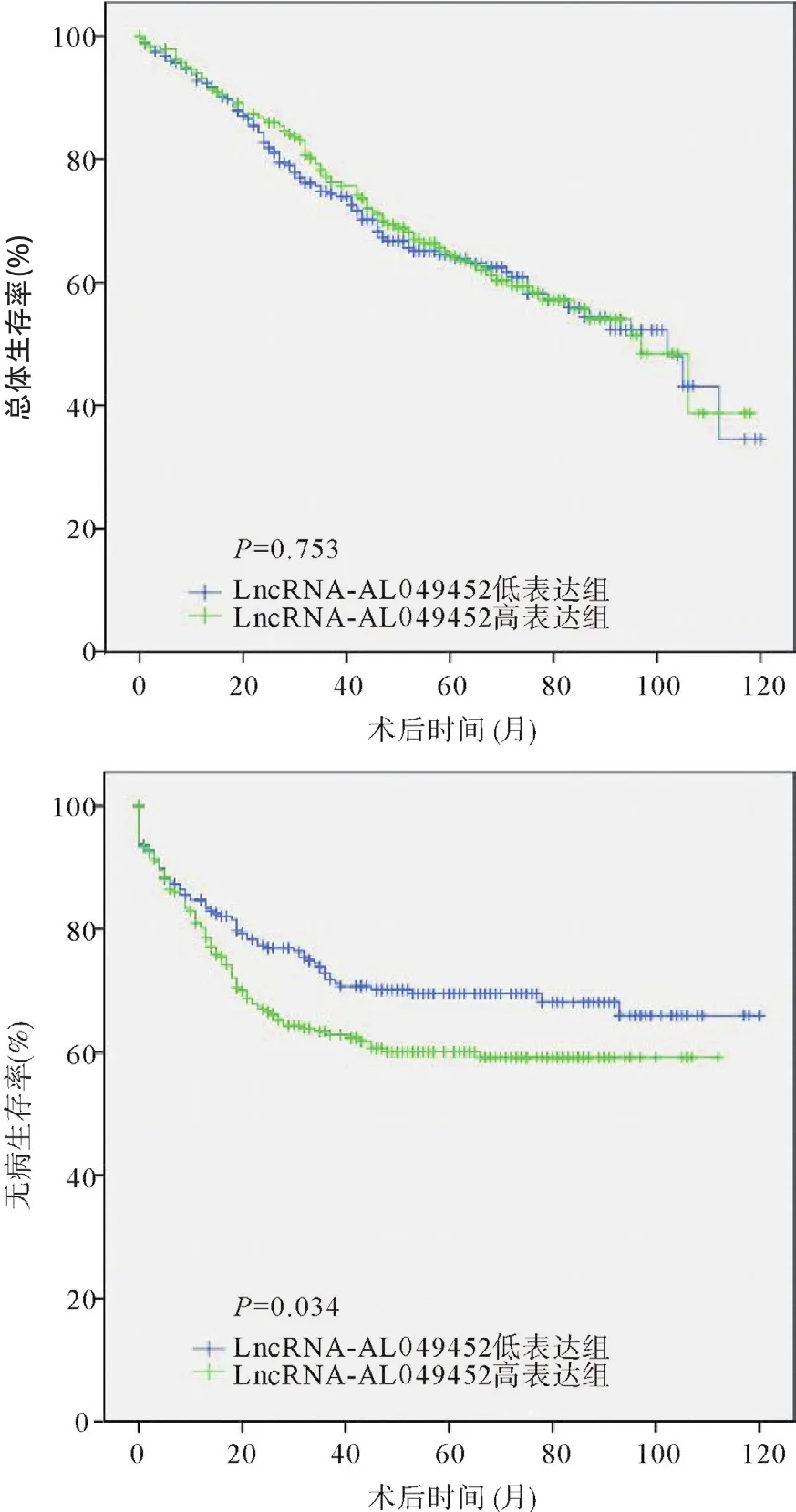
图4 不同lncRNA-AL049452表达水平结直肠癌患者的生存曲线分析
遗传物质改变是肿瘤发生发展的重要因素,原癌基因的激活及抑癌基因的失活都会最终促成肿瘤的发生[13]。研究证明,lncRNA与结直肠癌发生和发展密切相关。如lncRNA-CCAT2在结直肠癌中过表达,并且促进肿瘤细胞的增殖和转移[14],lncRNA loc285194作为p53的靶基因,可以抑制结直肠癌细胞的增殖[15]。同时lncRNA可以作为结直肠癌诊断和预后的潜在指标[16]。AL049452作为一个新的 lncRNA,位于GPR180的3’端;而GPR家族能够调节肿瘤的血管重建,GRP180对肿瘤的发展有抑制作用。为分析lncRNA-AL049452在结直肠癌的表达,我们首先分析GEO数据库中lncRNA-AL049452的表达,结果发现,lncRNA-AL049452在结直肠正常组织向腺瘤及癌的演进过程中表达量逐渐上升。进一步qRT-PCR检测发现,与癌旁正常组织相比,lncRNA
AL049452在结直肠癌中表达明显上调。已发现一些lncRNA可以作为结直肠癌诊断的潜在生物学指标,如HOTAIRM1作为肿瘤抑制因子对结直肠癌具有和CEA类似的诊断价值,其诊断效能优于CA19-9和CA125[17]。循环中的lncRNA-BCAR4、lncRNA-MAGEA、lncRNA-KRTP5可以联合作为结直肠癌诊断的良好指标,其AUC可达0.857[18]。我们应用ROC曲线分析lncRNA-AL049452表达量对结直肠癌早期诊断的价值,发现AUC为0.723,敏感性和特异性分别为86.0% 和51.2%,约登指数为0.372,有较高的诊断价值。
研究证实lncRNA与结直肠癌的临床特征及预后密切相关,如lncRNA-GAPLINC在结直肠癌中高表达,并与肿瘤大小、T分级、N分级有关,是结直肠癌不良预后的独立危险因素[19];过表达lncRNA-H19的结直肠癌患者,其肿瘤的分化程度更低,TNM分期更晚,总生存时间和无病生存时间更短[20]。临床病理学分析发现,结直肠癌组织的AL049452表达量与结直肠癌的肿瘤大小有关。生存分析发现lncRNAAL049452低表达的结直肠癌患者,其无病生存时间长于高表达lncRNA-AL049452的患者。以上结果提示结直肠癌恶性程度越高,其lncRNA-AL049452表达量越高,同时患者的预后情况也越差,因此AL049452 在结直肠癌的发生发展中起着重要的作用。
综上所述,lncRNA-AL049452在结直肠癌组织中高表达与肿瘤大小有关,而且对于结直肠癌的诊断及预后判断均有提示作用。深入研究lncRNAAL049452参与结直肠癌发生发展的机制,对于结直肠癌的早期诊断、完善治疗、改善预后均有一定价值。
[1] TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
[2] CHEN W, ZHENG R, ZENG H, et al. Annual report on status of cancer in China, 2011[J]. Chin J Cancer Res, 2015, 27(1): 2-12.
[3] Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer[J]. Nature, 2012, 487(7407): 330-337.
[4] COSTA F F. Non-coding RNAs: lost in translation?[J]. Gene, 2007, 386(1-2): 1-10.
[5] JAÉ N, DIMMELER S. Long noncoding RNAs in diabetic retinopathy[J]. Circ Res, 2015, 116(7): 1104-1106.
[6] MARTENS-UZUNOVA E S, BÖTTCHER R, CROCE C M, et al. Long noncoding RNA in prostate, bladder, and kidney cancer[J]. Eur Urol, 2014, 65(6): 1140-1151.
[7] DUNHAM A, MATTHEWS L H, BURTON J, et al. The DNA sequence and analysis of human chromosome 13[J]. Nature, 2004, 428(6982): 522-528.
[8] IIDA A, TANAKA T, NAKAMURA Y. High-density SNP map of human ITR, a gene associated with vascular remodeling[J]. J Hum Genet, 2003, 48(4): 170-172.
[9] HONDA S, MINATO M, SUZUKI H, et al. Clinical prognostic value of DNA methylation in hepatoblastoma: Four novel tumor suppressor candidates[J]. Cancer Sci, 2016, 107(6): 812-819.
[10] ST LAURENT G, WAHLESTEDT C, KAPRANOV P. The Landscape of long noncoding RNA classification[J]. Trends Genet, 2015, 31(5): 239-251.
[11] CLARK M B, JOHNSTON R L, INOSTROZA-PONTA M, et al. Genome-wide analysis of long noncoding RNA stability[J]. Genome Res, 2012, 22(5): 885-898.
[12] ZENG S, XIAO Y F, TANG B, et al. Long noncoding RNA in digestive tract cancers: function, mechanism, and potential biomarker[J]. Oncologist, 2015, 20(8): 898-906.
[13] WANG Y, VELHO S, VAKIANI E, et al. Mutant N-RAS protects colorectal cancer cells from stress-induced apoptosis and contributes to cancer development and progression[J]. Cancer Discov, 2013, 3(3): 294-307.
[14] LING H, SPIZZO R, ATLASI Y, et al. CCAT2, a novel noncoding RNA mapping to 8q24, underlies metastatic progression and chromosomal instability in colon cancer[J]. Genome Res, 2013, 23(9): 1446-1461.
[15] LIU Q, HUANG J, ZHOU N, et al. LncRNA loc285194 is a p53-regulated tumor suppressor[J]. Nucleic Acids Res, 2013, 41(9): 4976-4987.
[16] SVOBODA M, SLYSKOVA J, SCHNEIDEROVA M, et al. HOTAIR long non-coding RNA is a negative prognostic factor not only in primary tumors, but also in the blood of colorectal cancer patients[J]. Carcinogenesis, 2014, 35(7): 1510-1515.
[17] WAN L, KONG J, TANG J, et al. HOTAIRM1 as a potential biomarker for diagnosis of colorectal cancer functions the role in the tumour suppressor[J]. J Cell Mol Med, 2016, 20(11): 2036-2044.
[18] DONG L, LIN W, QI P, et al. Circulating long RNAs in serum extracellular vesicles: Their characterization and potential application as biomarkers for diagnosis of colorectal cancer[J]. Cancer Epidemiol Biomarkers Prev, 2016, 25(7): 1158-1166.
[19] YANG P, CHEN T, XU Z, et al. Long noncoding RNA GAPLINC promotes invasion in colorectal cancer by targeting SNAI2 through binding with PSF and NONO[J]. Oncotarget, 2016, 7(27): 42183-42194.
[20] HAN D, GAO X, WANG M, et al. Long noncoding RNA H19 indicates a poor prognosis of colorectal cancer and promotes tumor growth by recruiting and binding to eIF4A3[J]. Oncotarget, 2016, 7(16): 22159-22173.
(本文编辑:贾建敏)
Expression of lncRNA-AL049452 in the tissue of colorectal cancer and its clinical significance
SUN Xiangwei1, HU Yingying2, XU Jianfeng1, ZHANG Liang1, MAO Chenchen1, GUO Gangqiang3, HUANG Guanli4, SHEN Xian5, XUE Xiangyang3.
1.Department of General Surgery, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Obstetrics and Gynecology, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 3.Department of Microbiology and Immunology, School of Basic Medical Sciences, Wenzhou Medical University, Wenzhou, 325035; 4.Department of Oncology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 5.Department of General Surgery, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective: To explore the expression and clinical significance of lncRNA-AL049452 in colorectal cancer (CRC). Mothods: Eighty-four cases of CRC tissues and corresponding paracancerous tissues were collected. Quantitative real-time PCR (qRT-PCR) was used to detect the expression level of lncRNA-AL049452 in these tissue specimens. Correlation between the expression of lncRNA-AL049452 and clinicopathological features was analysed by Mann-Whitney U test. Kaplan-Meier survival curves was used to analysed overall survival time and disease-free survival time between different lncRNA-AL049452 levels. Receiver operating characteristic (ROC) curve was performed to observe the diagnostic value of lncRNA-AL049452 for colorectal cancer. Results: lncRNA-AL049452 expression level in CRC tissues was obviously higher than that in corresponding paracancerous tissues (P=0.0035). High expression of lncRNA-AL049452 indicated larger tumor size (P=0.024). The lncRNA-AL049452 high-expression group presented significantly lower disease-free survival rates than the low-expression group (log-rank=4.208, P=0.034). In addition, ROC curves analyse showed that the AUC of ROC curve was 0.723 (95%CI=0.613-0.832, P<0.001) with 86.0% sensitivity, 51.2% specificity. Conclusion: The highexpression of lncRNA-AL049452 in tumor tissues may play an important role in the progression in CRC, and can serve as novel biomarker for the diagnosis and prognosis of CRC.
long non-coding RNA; AL049452; colorectal neoplasms; biological markers
R735.3
A
10.3969/j.issn.2095-9400.2017.08.004
2016-07-31
国家自然科学基金资助项目(81472308,31470891);温州市科技计划项目(20150050)。
孙祥威(1992-),男,浙江温州人,硕士生。
薛向阳,副教授,Email:wzxxy001@163.com。

