斜纹夜蛾嗅觉反应昼夜节律及其调控机制
林慧玥,钱凯,白家秀,张道根,鲁瑞,万新龙
斜纹夜蛾嗅觉反应昼夜节律及其调控机制
林慧玥,钱凯,白家秀,张道根,鲁瑞,万新龙
(温州医科大学 健康与环境生态研究所,浙江 温州 325035)
目的:研究斜纹夜蛾嗅觉反应的昼夜节律和调控机制,为更有效的防治提供新的思路和方法。方法:通过测定多种寄主植物气味化合物和性信息素在昼夜8个不同时间点下的斜纹夜蛾触角电位(EAG)反应,发现斜纹夜蛾的EAG反应昼夜节律并筛选出斜纹夜蛾EAG反应最为强烈的化合物,进一步通过风洞技术测定黑暗期5个不同时间点斜纹夜蛾对这些化合物的行为反应,验证其行为昼夜节律;同时通过RT-qPCR技术检测多个调控昼夜节律的时钟基因和嗅觉受体基因在昼夜各个不同时间点的表达水平差异。结果:斜纹夜蛾雄虫对所有测试植物气味化合物和性信息素的EAG反应都表现出双峰模式,即都在黑暗之后3 h和9 h的反应最为强烈,并筛选出斜纹夜蛾最为敏感的5种化合物:Z9E12-14:OAc、Z9E11-14:OAc、石竹烯、芳樟醇和苯乙醛。斜纹夜蛾在黑暗期5个时间点对这5种化合物行为反应也表现出与EAG反应相类似的夜间节律。从 基因表达水平来看,大部分嗅觉受体基因和时钟基因都在黑暗之后3 h和(或)9 h表达水平达到最高峰值。结论:斜纹夜蛾的嗅觉反应昼夜节律与嗅觉基因和时钟基因表达的昼夜节律大体上是一致的,表明斜纹夜蛾的嗅觉反应节律可能都是由这些时钟基因和嗅觉基因在其体内进行表达调控的。
斜纹夜蛾;昼夜节律;触角电位;风洞;RT-qPCR
昆虫经过长期的演化,它们的许多生命活动和行为形成了昼夜节律性。昆虫的许多行为如取食、交配以及寻找栖息地等都是依靠嗅觉来完成的。因此,昆虫的嗅觉反应也一定具有节律性的。目前对昆虫嗅觉反应昼夜节律及其分子机制的研究报道较少。对隐花色素基因的研究表明,其在生物体内具有很高的同源性[1],通过分子系统进化分析可以探索出各个物种间的亲缘关系,因而该基因成为分子进化的又一个研究热点。由于昆虫生理活动与生物钟现象密切相关,通过研究其节律机制能够更深人了解虫害的发生与发展规律[2-4]。
近年来昼夜节律的分子机制这个暗箱逐渐被打开。目前转录/翻译反馈环被认为是主要的生物节律产生的分子基础,并通过该环中产生的蛋白反馈抑制它们自身的转录。现研究最多、最深入的是果蝇的昼夜节律分子机制[5]。在果蝇,有五种被认为是昼夜节律反馈调节的必需基因:period(per)、 timeless(tim)、clock(clk)、cycle(cyc)和cryptochromes(cry)[6]。目前,昆虫昼夜节律的研究主要聚焦在生物钟水平。生物钟是基于一组 “时钟基因”的转录/翻译反馈循环而产生的内源性昼夜节律性的周期变化[7],研究发现2个时钟基因per和cry1在甘草夜蛾和灰翅夜蛾的触角中表达量呈昼夜周期性变化规律,表明这2种夜蛾的昼夜节律与其时钟基因的时间表达水平有关[8]。生物钟调节嗅觉反应已经在黑腹果蝇的触角中发现[16]。触角电位(electroantennogram,EAG)反应实验表明,黑腹果蝇和蟑螂对其寄主植物气味和性信息素的嗅觉反应也都表现出明显的昼夜周期性变化[9-10], 而敲除cry基因之后它们的触角神经元则表现出了异常的嗅觉反应昼夜节律[9]。另外,研究发现敲除黑腹果蝇的中心振荡器细胞对其EAG反应的昼夜节律没有影响,而破坏其触角神经元之后发现其EAG反应的昼夜节律消失[11],表明触角神经元足以调控嗅觉反应的昼夜节律。尽管触角时钟调节EAG反应节律的机制还不明确,但是基于微阵列的研究方法已经表明那些与气味识别相关的基因,如嗅觉受体基因(olfactory receptors,OR)、气味结合蛋白基因(odorant binding proteins,OBP)也起着时钟调节作用[12]。除此之外,性信息素合成激活神经肽(pheromone biosynthesis activating neuropeptide,PBAN)、黑化诱导激素(corazonin,Crz)以及色素扩散因子(pigment dispersing factor,PDF)被认为参与和调节动物的昼夜节律行为,不同的时间点在昆虫脑部结构中分布的位置和表达的水平不一样[13]。
斜纹夜蛾(Spodoptera litura)是我国长江以南蔬菜、烟草、棉花、茶叶、葡萄等农业和林特作物的重要害虫,繁殖力强,且栖息地隐蔽,对农药抗性强,药剂防治非常困难,已到了无药可用的地步[14]。 目前防治斜纹夜蛾主要依靠化学药剂进行防治,但大量使用化学农药导致斜纹夜蛾对多种杀虫剂产生了不同程度的抗药性,防治效果减低[15]。近几年关于植物气味引诱雌成虫产卵或增强性信息对雄虫引诱效果的研究已经应运而生,并取得了相当不错的成果。因此,利用植物气味和性信息结合其行为节律,或许能为探索新型防治害虫的方法提供理论基础和思路。目前关于斜纹夜蛾嗅觉反应昼夜节律及其分子机制几乎还没有进行过系统地研究报道。为此,本研究选取斜纹夜蛾为研究对象,通过EAG反应、风洞以及RT-qPCR技术共同探索其嗅觉反应的昼夜节律及分子调控机制。
1 材料和方法
1.1 供试虫源 斜纹夜蛾蛹购买于河南济源白云实业有限公司,并放置于温州医科大学健康与环境生态研究所人工智能气候室内进行羽化,室内光照时间12 h:12 h,其中黑暗时间从人为授时时间(zeitgeber time,ZT)3到ZT15,光照时间从ZT15到ZT3;温度(27±1)℃,湿度70%±10%。羽化成虫饲以10%葡萄糖水作为补充营养。
1.2 植物气味化合物和性信息素及其配制 供试挥发性气味化合物的名称、纯度和来源见表1。用石蜡油作溶剂,分别将每种挥发性化合物配成浓度为0.01 μg/mL的溶液。
1.3 EAG反应的测定 为了研究斜纹夜蛾对上述供试化合物EAG反应的昼夜节律,我们分别在ZT3、ZT6、ZT9、ZT12、ZT15、ZT18、ZT21、ZT24共8个时间点测定了斜纹夜蛾对每种化合物的EAG反应。每次测定前先将斜纹夜蛾触角切除顶端,然后将触角基部和顶端分别套在参考电极和记录电极上。实验采用Syntech EAG记录系统记录、分析其电位的变化。测定参照杜永均等[16]和方宇凌等[17]的方法,实验中每次吸取20 μL配好的溶液均匀滴于6 cm× 0.5 cm的滤纸上,并移入滴管中,滴管末端连接气体刺激控制装置,顶端插入具有连续气流的巴斯德管小孔中。经活性碳处理的干净、湿润的连续气流的流量为1 200 mL/min,刺激气流流量为40 mL/min, 对准斜纹夜蛾触角刺激,每次刺激时间为0.1 s。以 液体石蜡油为对照。各种测定每根触角只用1次,用完之后再用另一只斜纹夜蛾的触角进行测定。每个时间段在刺激间隔为60 s的实验条件下,分别重复5次,取其均值作为最终的EAG反应值。
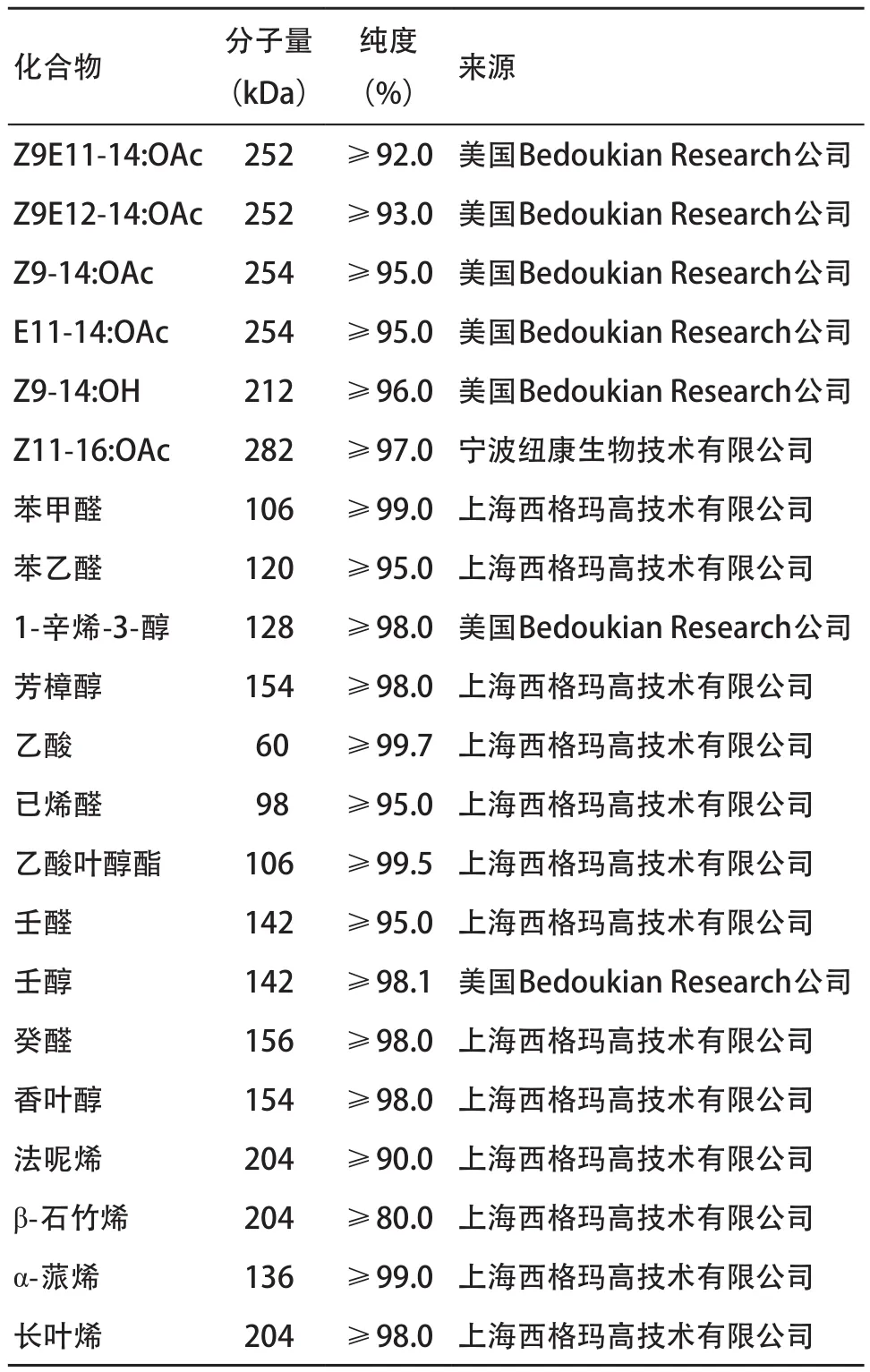
表1 EAG反应中使用的气味化合物名称、分子量、纯度及来源
1.4 风洞实验 斜纹夜蛾对植物气味和性信息素的行为反应的昼夜节律研究在风洞中进行。风洞装置长200 cm,宽和高均为70 cm。风洞内设置温度26 ℃,相对湿度为60%~75%。在实验开始前,将孵化3 d的雄虫单独装入玻璃管(10 cm×2.5 cm)中,并用纱布封住开口处。在距上风端20 cm、高35 cm的支架上放置滴有20 μL植物气味化合物或性信息素化合物的滤纸条作为气味源,滤纸每15 min换1次。同时在气味源周边设置1个直径为10 cm左右的球形钢丝网罩以保护诱芯不受雄蛾的污染和为雄蛾在诱芯附近降落提供场所。在距下风端120 cm处设置1个高30 cm的昆虫释放支架。实验开始时,将装有斜纹夜蛾雄虫的玻璃管放置昆虫支架上,拿掉纱布,开始观察并记录雄蛾在ZT3、ZT6、ZT9、ZT12和ZT15这5个不同的时间点对气味化合物的行为反应。每头昆虫任其反应3 min,如无行为反应则换下,引入另1头雄蛾继续实验;实验中每个处理重复3 次,每次重复测试20头雄蛾。记录下列行为反应的斜纹夜蛾数量:飞行、定向飞行和着陆。
1.5 斜纹夜蛾触角基因表达量测定
1.5.1 总RNA提取:分别在ZT3、ZT6、ZT9、ZT12、ZT15、ZT18、ZT21、ZT24时间剪取并收集斜纹夜蛾触角,每组取20对触角作为1个重复,每个时间点设置3个重复。每个重复的触角收集完毕后立即用液氮研磨,采用Trizol法提取总RNA。提取的RNA溶于DEPC处理水后经琼脂糖凝胶电泳及紫外-可见分光光度计测其260/280比值检测RNA纯度和浓度。
1.5.2 cDNA模板的合成:按照反转录实验手册使用FastQuant cDNA第一链合成试剂盒合成cDNA。反应体系包括10 μL反应体系一:2 μL 5×gDNA Buffer、 1 μg RNA、RNase-Free ddH2O补足到10 μL;10 μL反应体系二:2 μL 10×Fast RT Buffer、1 μL RT Enzyme Mix、2 μL FQ-RT Primer Mix、5 μL RNase-Free ddH2O。先将体系一于42 ℃孵育3 min后立即放置在冰上,然后将反应体系二全部加入反应体系一中;最后将混合反应体系42 ℃孵育15 min, 95 ℃孵育3 min,并4 ℃保存。合成的cDNA置于-20 ℃保存备用。以上所有样品均设置3个生物学重复。
1.5.3 RT-qPCR:为探索斜纹夜蛾嗅觉反应昼夜节律的分子调控机制,本研究共测定了9个嗅觉受体基因(OR01、OR03、OR06、OR11、OR13、OR14、OR26、 OR27和OR83)和10个时钟基因(clk1、clk2、cry1、cry2、cyc1、cyc2、per1、tim1、tim2和crz)在ZT3、ZT6、ZT9、ZT12、ZT15、ZT18、ZT21、ZT24时间点的表达水平。用GAPDH作为参照基因。用做RT-qPCR的基因引物见表2。RT-qPCR在实时荧光定量PCR仪(Bio-Rad)上完成,每个PCR反应体系为20 μL,包括10 μL Su-permix,1 μL正向引物(10 μmol/L), 1 μL反向引物(10 μmol/L),1 μL cDNA,7 μL灭菌蒸馏水。采用的qPCR扩增程序为:预变性95 ℃ 3 min;然后95 ℃ 10 s,60 ℃ 10 s,和70 ℃ 10 s 扩增40个循环。每个基因的相对表达水平采用CT值 法的相对定量法计算,以2-△△Ct计算基因的相对表达量,△△Ct=△Ct目的基因-△Ct参照基因;△Ct=Ct目的基因- Ct持家基因。
1.6 统计学处理方法 所有数据都利用Excel软件制作成平滑曲线图,分析比较斜纹夜蛾在不同时间点对不同植物气味和性信息素化合物的EAG反应和行为反应,以及多个嗅觉受体基因和时钟基因的表达水平差异。

表2 RT-qPCR引物序列
2 结果
2.1 斜纹夜蛾对植物气味和性信息素化合物的EAG反应的昼夜节律 斜纹夜蛾的EAG反应表现出双峰的昼夜节律模式,即斜纹夜蛾触角对所有植物气味和性信息素化合物的EAG反应都在黑暗后3 h和9 h表现最为强烈,且在黑暗期所有时间点的触角EAG反应值要高于光照期所有时间点的EAG反应值(见图1)。这个结果表明,斜纹夜蛾的生物活性在黑暗期要明显强于光照期,这与绝大多数蛾类昆虫所表现出的昼伏夜出的生活习性一致。另外,根据斜纹夜蛾对不同化合物的EAG反应值大小可以将这些化合物分为4组。第1组化合物包括斜纹夜蛾的性信息素主要成分Z9E12-14:OAc、Z9E11-14:OAc及斜纹夜蛾寄主植物成分石竹烯、芳樟醇和苯乙醛,斜纹夜蛾对这5种化合物的EAG反应最为强烈(见图1A);第2组化合物包括植物气味化合物苯甲醛、己烯醛、1-辛烯-3-醇和乙酸,斜纹夜蛾对它们的EAG反应也较为强烈,但较第1组化合物稍弱(见图1B);第3组化合物包括植物气味化合物α蒎烯、乙酸叶醇酯、壬醛和壬醇,斜纹夜蛾对这4种化合物的EAG反应又比第2组化合物更弱一些(见图1C);第4组化合物则包括斜纹夜蛾性信息素化合物的一些衍生化合物Z9-14:OAc、Z9-12:OAc、E11-14:OAc、Z11-16:OAc和Z9-14:OH,斜纹夜蛾对这些化合物的EAG反应最弱(见图1D)。
2.2 斜纹夜蛾行为反应的昼夜节律 本研究通过风洞装置测定了黑暗期所有时间点(光照期斜纹夜蛾活动较弱,根本不起飞,因此无法测定其行为反应)斜纹夜蛾对其EAG反应最为强烈的5种化合物(Z9E12-14:OAc、Z9E11-14:OAc、石竹烯、芳樟醇和苯乙醛)的行为反应。结果表明,斜纹夜蛾对这5种化合物的起飞、定向飞行(芳樟醇除外)以及着陆(芳樟醇和石竹烯除外)行为反应都表现出与EAG反应一致的双峰模式,即在黑暗后3 h和9 h其3种行为反应最为强烈(见图2)。从斜纹夜蛾对这5种化合物的飞行反应来看,表现最弱的时间点为刚进入黑暗期的时候(ZT3),产生飞行反应的斜纹夜蛾百分比只有10%(Z9E12-14:OAc)到20%(苯乙醛);表现最为强烈的时间点为ZT6和ZT12,在这2个时间点,斜纹夜蛾的飞行比例最高分别达到50%(ZT6)和55%(ZT12)(见图2)。定向飞行反应的斜纹夜蛾百分比总体要比飞行反应的低,在0到20%之间。除芳樟醇外,所有的化合物吸引斜纹夜蛾定向飞行的高峰期都在黑暗之后3 h和9 h这2个时间点(ZT6和ZT12),最高百分比分别达到20%(苯乙醛)和15%(苯乙醛);而斜纹夜蛾对这4种化合物的定向飞行反应最弱的时间点都在黑暗之后6 h(ZT9),在这个时间点,斜纹夜蛾定向飞行的比例只有0(石竹烯)和7.5%(Z9E11-14:OAc)。与这4种化合物不同,斜纹夜蛾对芳樟醇的定向飞行反应+只有在黑暗后9 h(ZT12)表现最为强烈(为7.5%),而在刚进入黑暗期时(ZT3) 表现最弱(为0)(见图2)。从着陆反应来看,斜纹夜蛾对所有化合物的着陆反应偏弱,最高的着陆斜纹夜蛾百分比仅为5%。其中斜纹夜蛾对Z9E12-14:OAc、 Z9E11-14:OAc和苯乙醛的着陆率高峰期都在黑暗之后3 h和9 h这2个时间点(ZT6和ZT12),最高百分比均达到5%(Z9E11-14:OAc和苯乙醛);而斜纹夜蛾对芳樟醇和石竹烯的着陆率高峰期只出现在黑暗之后9 h(ZT12),最高百分比均为2.5%(见图2)。
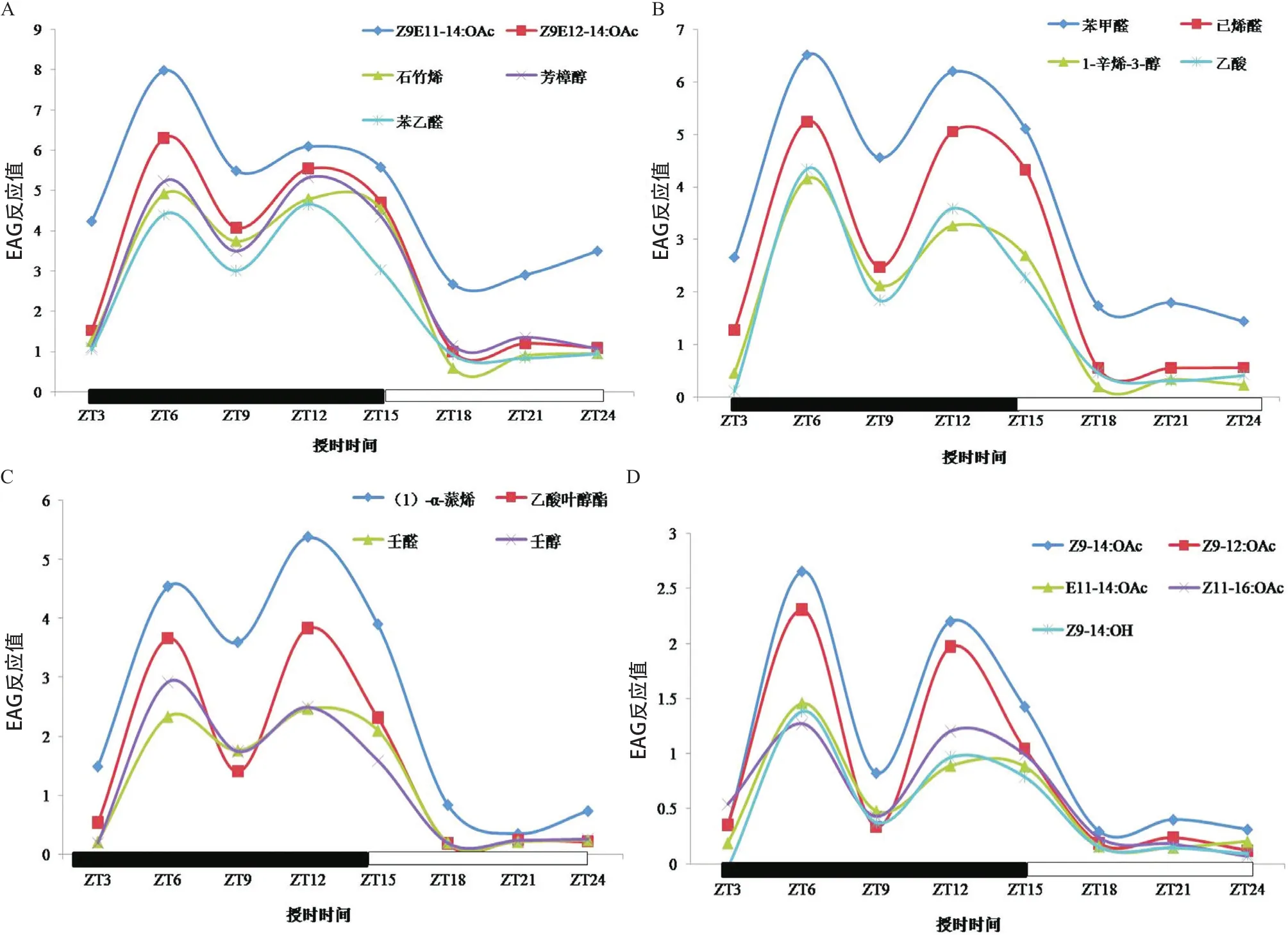
图1 不同时间点斜纹夜蛾对植物气味和性信息素化合物的EAG反应
总体而言,5种化合物对斜纹夜蛾引导的飞行、定向飞行及着陆等行为具有一定的节律性,均在黑暗后3 h(ZT6)和(或)9 h(ZT12)出现高峰期,而在刚进入黑暗期(ZT3)或者黑暗6 h(ZT9)表现最弱,这规律与EAG反应的实验结果一致。
2.3 斜纹夜蛾基因表达水平的昼夜节律 为了进一步探讨斜纹夜蛾在EAG反应和风洞实验中所表现出来的嗅觉反应昼夜节律的调控机制,本研究在不同时间点检测了斜纹夜蛾多个嗅觉受体基因和时钟基因的表达水平,结果发现所有嗅觉受体基因(OR01、OR03、OR06、OR11、OR13、OR14、OR26、OR27和OR83)表达水平规律与斜纹夜蛾嗅觉反应的昼夜节律一致,均在黑暗后3 h(ZT6)和9 h(ZT12)表达达到最高水平,而且这些基因在黑暗期的表达水平整体上要高于光照期的表达水平(见图3A-B)。光照期除OR14在光照3 h后又出现了1个表达小高峰之外,其他嗅觉受体基因表达水平都很低,而且波动不大(见图3A)。与嗅觉受体基因不一样,时钟基因的表达水平规律不一致,但总的来说,所有基因表达水平在黑暗期要比在光照期高(见图3C-D)。其中per1、crz、cry1和cry2这4个时钟基因的表达水平规律与嗅觉受体基因一样,都在黑暗后3 h (ZT6)和9 h(ZT12)表达水平达到最高值;cyc2则在黑暗后3 h(ZT6)和12 h(ZT15)这2个时间点表达水平达到最高值;其他所有时钟基因(tim1、tim2、cyc1、clk1和clk2)都只在黑暗后3 h(ZT6)这1个时间点表现出表达高峰,其他时间点表达水平差异不大(图3C-D)。
3 讨论
动物的昼夜节律是一种复杂的生物学现象,是动物对各种环境条件变化(如光照、温度、湿度等非生物条件和食物条件、种内社群关系和种间关系等生物因素)的综合适应[18]。对于地球上的绝大多数生命有机体来说,光线是它们调整生物钟的主要因素,通过对光线的感受从而调整它们的生理时钟与自然界光照变化保持一致[19]。本研究通过EAG反应和行为反应(风洞实验)发现斜纹夜蛾的嗅觉反应是具有一定的昼夜节律性,这与其嗅觉基因和时钟基因表达水平的昼夜节律基本上一致。
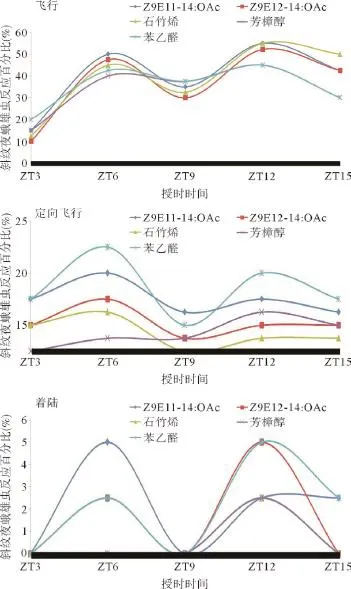
图2 黑暗期不同时间点斜纹夜蛾对3种植物气味化合物和2种性信息素化合物的行为反应
昆虫主要是靠触角上的嗅感器来感受气味的,有气味的化学刺激物质在嗅感器内转变成电信号,通过触角上的神经传向中枢[20]。在快速检测触角对气味的反应活性和敏感性方面,EAG反应是一种非常重要的生物测定方法。它具有很高的敏感性和选择性,因此被广泛地应用于昆虫嗅觉研究中[21],成为昆虫信息素及其它挥发性信息化合物生物测定非常得力的方法之一[22]。风洞实验国内运用的不多,与嗅觉仪相比,风洞实验能更好地模拟田间条件,可观察的指标较多,而且灵敏度也很高,其研究的对象为飞行的成虫。风洞实验从斜纹夜蛾的行为上有力地验证了嗅觉反应是具有一定的昼夜规律的。风洞实验选取的化学刺激物均为从EAG反应中筛选出的,斜纹夜蛾敏感的化合物,因此实验结果更直观强烈地证明嗅觉反应具有较强的昼夜规律。不同化合物在不同时间对斜纹夜蛾引导的行为也是不一样的,从侧面可以求证出嗅觉反应最强的时间段,从而为化学信息素诱捕斜纹夜蛾打下了基础。目前国内研究嗅觉行为大多是以嗅觉仪为主,通过风洞实验来研究斜纹夜蛾的昼夜节律较少。本研究则运用EAG反应和风洞实验来检测斜纹夜蛾在不同时间段受到气味刺激后所产生的电生理和行为反应变化,并通过荧光定量PCR检测其嗅觉受体和时钟基因表达水平的昼夜节律以揭示其嗅觉反应昼夜节律的调控机制,进一步了解斜纹夜蛾的生物学特性,从而为该昆虫的防治提供重要的理论依据。
本研究中EAG反应和风洞实验表明,斜纹夜蛾在黑暗后3 h和9 h的嗅觉最为活跃,而且在黑暗期的嗅觉反应总体上要比在光照期的嗅觉反应更为灵敏,这与绝大多数的蛾类昆虫的生物行为昼夜节律一致。除此之外,蛾类生物行为昼夜节律还表现在其化蛹、羽化、交配、产卵、孵化等方面[23]。 蛾类昆虫大多数产卵是在交尾后第2天的夜间,如棉 大卷叶夜蛾(S.derogate)、沙棘木蠹蛾(H.hippophaecolus)和甜菜夜蛾(S.exigua)的产卵时间都是在交尾后第2天晚上,其产卵时间分别为夜间20:00- 22:00,20:30-22:00和00:00-5:00[24-26]。在其他 昆虫中,其生物行为也是有一定昼夜节律的。如井上蛀果斑螟虫羽化、产卵、交配、化蛹等行为的高峰期都分别在18:00-4:00、2:00-10:00、4:00- 8:00、10:00-14:00和18:00-22:00,表现出较明显的昼夜节律[27]。
昆虫行为节律被认为是一种由生物钟基因控制的内源性节律[28]。这种行为节律在其他夜行性动物中也充分存在,并被指出与嗅觉传入有一定关联,认为嗅觉传入会影响昼夜节律,这两者的关联性已被证明[29]。目前关于斜纹夜蛾的昼夜节律分子机制的研究较少,我们猜测斜纹夜蛾嗅觉反应的昼夜节律也是通过时钟基因来控制的,故我们检测了不同时间点的斜纹夜蛾的时钟基因以及编码嗅觉反应的嗅觉受体基因的表达水平。从时钟基因和嗅觉基因表达水平的实验结果来看,这两种基因的表达随时间变化均具有较强的节律性,但各个基因的节律性并不相同,这也许是它们功能的侧重点不同。有研究表明在果蝇中有100多个基因有较强的昼夜节律,分别参与了嗅觉、视觉、摄食等反应[30]。本研究中,斜纹夜蛾的时钟基因表达水平出现一定的节律性,其基因整体的表达水平在黑暗期较光照期高,这与斜纹夜蛾活动习性相一致。时钟基因在黑暗期的高水平表达有利于增加活动相关酶的量及活性,为斜纹夜蛾夜间活动本身条件提供便利。cyc1和clk2不管在黑暗期还是光照期,其基因表达水平起伏不大,但仍不排除它辅助或负反馈其他基因表达的作用。嗅觉基因表达规律性更强,各基因高表达水平均时间段位于黑暗后3 h和9 h,在光照期的基因表达水平均较低,与斜纹夜蛾活动习性相一致。斜纹夜蛾主要在夜间活动及觅食,嗅觉基因在此时间段高水平表达进而合成嗅觉相关蛋白为夜间觅食做准备。OR14在光照期3 h出现了峰值,我们推测OR14基因在白昼交替的时间段作用较大,而光照对其表达影响不显著。
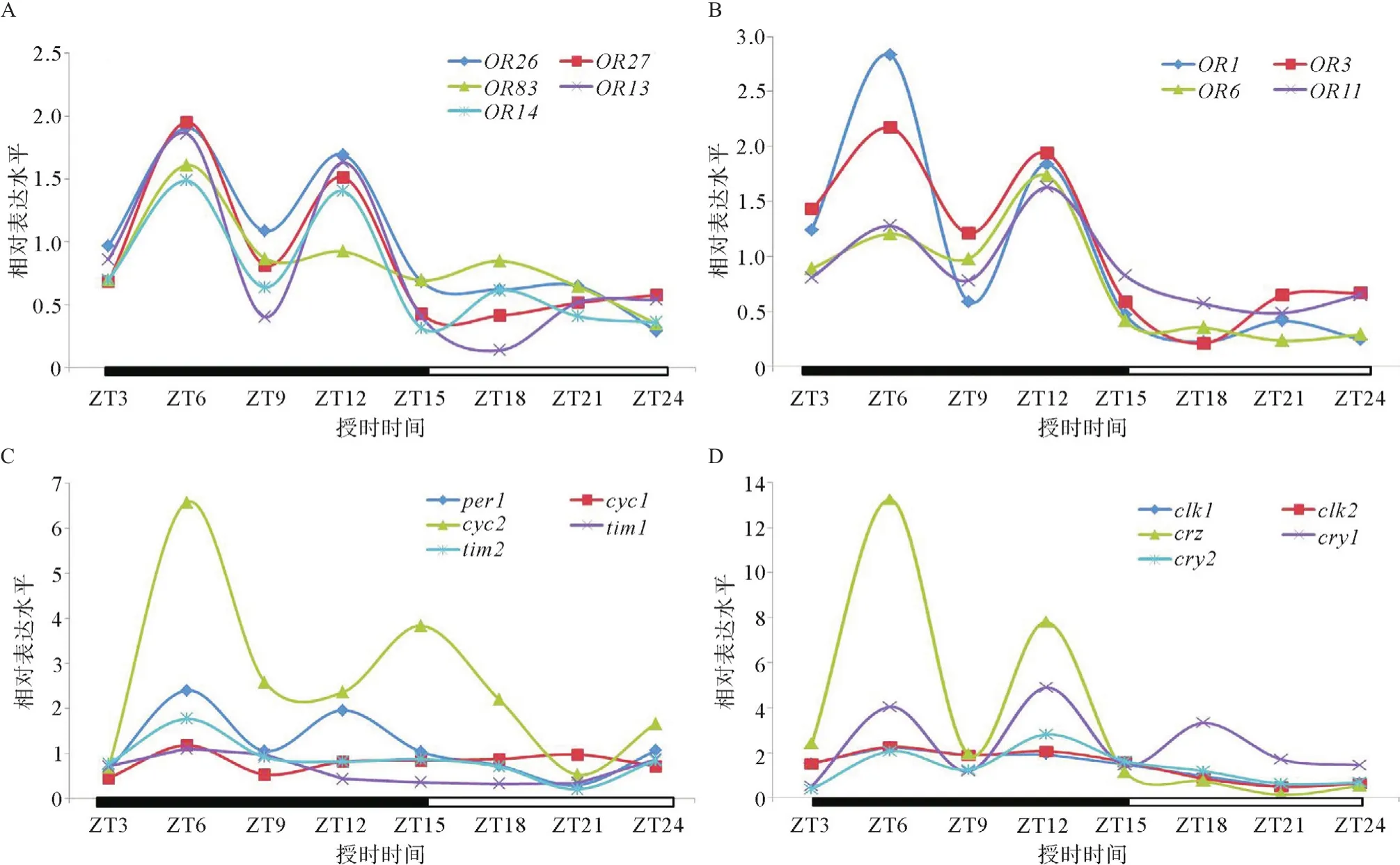
图3 不同时间点斜纹夜蛾几个嗅觉受体基因和时钟基因的表达水平
本研究运用EAG反应和风洞实验,运用植物挥发物及性信息素在1 d内的不同时间段对斜纹夜蛾的嗅觉反应活性进行检测,了解植物挥发物及性信息素对斜纹夜蛾雄虫的电生理反应及行为反应,找出斜纹夜蛾对这些刺激气味的昼夜节律性,为进一步提高斜纹夜蛾诱集效率提供科学依据。通过研究斜纹夜蛾时钟基因和嗅觉受体基因表达水平的昼夜节律,为进一步深入探索斜纹夜蛾以及其他蛾类昆虫昼夜节律的调控打下坚实的理论基础,后期可以结合更多行为学观察进而为害虫的防治提供更宽广的思路。当然,斜纹夜蛾触角嗅觉反应的昼夜节律还可能和光强度[31]、温度[32]、地理性[33]等因素有关,有待进一步研究。
[1] 王文栋, 梁辉, 朱晓苏, 等. 家蚕生物钟基因Bmcryl与Bmcry2的克隆及生物信息学分析[J]. 昆虫学报, 2011, 54(1): 9-19.
[2] EBAN-ROTHSCHILD A, SHEMESH Y, BLOCH G. The colony environment, but not direct contact with conspecifics, influences the development of circadian rhythms in honey bees[J]. J Biol Rhythm, 2012, 27(3): 217-225.
[3] LONE S R, SHARMA V K. Or47b receptor neurons mediate sociosexual interactions in the fruit fly Drosophila melanogaster[J]. J Biol Rhythms, 2012, 27: 107-116.
[4] ZÁVODSKÁ R, FEXOVÁ S, VON WOWERN G, et al. Is the sex communication of two pyralid moths Plodia interpunctella and Ephestia kuehniella, under circadian clock regulation?[J]. J Biol Rhythm, 2012, 27(2): 206-216.
[5] 杜玉珍,童建. 生物钟的基因调控[J]. 生理科学进展, 2002, 33(4): 343-345.
[6] ALLADA R, WHITE N E, SO W V, et al. A mutant Drosophila homolog of mammalian clock disrupts circadian rhythms and transcription of period and timeless[J]. Cell, 1998, 93(5): 791-804.
[7] SHIRASU N, SHIMOHIGASHI Y, TOMINAGA Y, et al. Molecular cogs of the insect circadian clock[J]. Zool Sci, 2003, 20(8): 947-955.
[8] MERLIN C, LUCAS P, ROCHAT D, et al. An antennal circadian clock and circadian rhythms in peripheral pheromonereception in the moth, Spodoptera littoralis[J]. J Biol Rhythm, 2007, 22: 502-514.
[9] KRISHNAN B, DRYER S E, HARDIN P E. Circadian rhythms in olfactory responses of Drosophila melanogaster [J]. Nature, 1999, 400(6742): 375-378.
[10] RYMER J, BAUERNFEIND A L, BROWN S, et al. Circadian rhythms in the mating behavior of the cockroach Leucophea maderae[J]. J Biol Rhythm, 2007, 22(6): 43-57.
[11] TANOUE S, KRISHNAN P, KRISHNAN B, et al. Circadian clocks in antennal neurons are necessary and sufficient for olfaction rhythms in Drosophila[J]. Curr Biol, 2004, 14(8): 638-649.
[12] MCDONALD M J, ROSBASH M. Microarray analysis and organization of circadian gene expression in Drosophila[J]. Cell, 2001, 107(5): 567-578.
[13] TAGHERT P H, SHAFER O T. Mechanisms of clock output in the Drosophila circadian pacemaker system[J]. J Biol Rhythm, 2006, 21(6): 445-457.
[14] 沈幼莲, 高扬, 杜永均. 植物气味化合物与斜纹夜蛾性信息素的协同作用[J]. 昆虫学报, 2009, 52(12): 1290-1297.
[15] SALEEMA M, HUSSAINA D, GHOUSEB G, et al. Monitoring of insecticide resistance in Spodoptera litura (Lepidoptera Noctuidae) from four districts of Punjab, Pakistan to conventional and new chemistry insecticides[J]. Crop Prot, 2016, 79: 177-184.
[16] 杜永均, 严福顺, 韩心丽, 等. 大豆蚜嗅觉在选择寄主植物中的作用[J]. 昆虫学报, 1994, 37(4): 385-392.
[17] 方宇凌, 张钟宁. 植物气味化合物对棉铃虫产卵及田间诱蛾的影响[J]. 昆虫学报, 2002, 45(1): 63-67.
[18] LETSOU A, BOHMANN D. Small flies-big discoveries: nearly a century of Drosophila genetics and development[J]. Dev Dynam, 2005, 232(3): 526-528.
[19] 王英, 司马杨虎, 宋艳, 等. 昆虫生物钟基因及其分子作用机制研究进展[J]. 江苏蚕业, 2008, 30(1): 9-14.
[20] 陈展册, 苏丽, 戈峰, 等. 绿盲蝽对性信息素类似物和植物挥发物的触角电位反应[J]. 昆虫学报, 2010, 53(1): 47-54.
[21] 王桂花, 易克贤, 吕宝乾, 等. 斜纹夜蛾对植物挥发物及其与性信息素组合的触角电位反应[J]. 热带作物学报, 2013, 34(3): 524-528.
[22] DENG J Y, HUANG Y P, WEI H Y, et al. EAG and behavioral responses of Helicoverpa armigera males to volatiles from poplar leaves and their combinations with sex pheromone[J]. J Zhejiang Univ Sci, 2004, 5(12): 1577-1582.
[23] 涂小云, 陈元生. 蛾类昆虫行为节律[J]. 生物灾害科学, 2013, 36(1): 18-21.
[24] 宗世祥, 骆有庆, 路常宽, 等. 沙棘木蠹蛾生物学特性的初步研究[J]. 林业科学, 2006, 42(1): 79-84.
[25] 李建勋, 李娟, 程伟霞, 等. 甜菜夜蛾成虫生物学特性研究 [J]. 中国农学通报, 2008, 24(5): 318-322.
[26] 李志军. 美国白蛾成虫行为节律研究[J]. 科技信息, 2008 (7): 155, 176.
[27] 何超, 沈登荣, 尹立红, 等. 井上蛀果斑螟虫昼夜行为节律研究[J]. 植物保护, 2016, 42(3): 137-140.
[28] 吴少会, 向群, 薛芳森. 昆虫的行为节律[J]. 江西植保, 2006, 29(4): 147-157.
[29] PERRET M, AUJARD F, SEGUY M, et al. Olfactory bulbectomy modifies photic entrainment and circadian rhythms of body temperature and locomotor activity in a noctural primate[J]. J Biol Rhythm, 2003, 18(5): 392-401.
[30] 周先举, 袁春燕, 杨旭科, 等. 果蝇昼夜节律的分子机制研究进展[J]. 生物化学与生物物理进展, 2005, 32(1): 3-8.
[31] SHIMIZU I, MIURA K. Circadian clock controlling the eclosion rhythm of silkworm Bombyx mori: its characteristics and dynamics[J]. Mem Fac Sci Kyoto Univ, 1987, 12: 135-156.
[32] PITTENDRIGH C S. On temperature independence in the clock controlling emergence time in Drosophlia[J]. Proc Nat Acad Sci U S A, 1954, 40: 1018-1029.
[33] LANKINEN P, FORSMAN P. Independence of genetic geographical variation between photoperiodic diapauses circadian eclosion rhythm and Thr-Gly repeat region of the period gene in Drosophila littoralis[J]. J Biol Rhythm, 2006, 21 (1): 3-12.
(本文编辑:赵翠翠)
Study on circadian rhythms of olfactory response and its regulatory mechanisms in Spodoptera litura
LIN Huiyue, QIAN Kai, BAI Jiaxiu, ZHANG Daogen, LU Rui, WAN Xinlong.
Institute of Health and Environmental Ecology, Wenzhou Medical University, Wenzhou, 325035
Objective: To study circadian rhythms of olfactory response and its regulatory mechanisms in Spodoptera litura, providing new insight in controlling this pest. Methods: Electroantennogram (EAG) was used to determine the electrophysiological responses of S. litura to chemicals originated from sex pheromones and host plants at eight different time points during day, finding the circadian rhythms of EAG responses in S. litura and selecting out the compounds to which the moths strongly responded. Then the wind tunnel was used to measure the behavioral responses of S. litura to these compounds at the same five time points during the scotophase. In addition, the expression levels of genes regulating circadian rhythms and olfaction at the same time points were detected by the real-time fluorescence quantitative PCR (RT-qPCR) technique to reveal the molecular regulatory mechanism of olfactory circadian rhythms in S. litura. Results: The results showed that the strongest EAG responses of male S. litura to all tested plant odor compounds and sex pheromone components occurred after 3 hours and 9 hours in the dark, showing a bimodal pattern. A total of five compounds: Z9E12-14:OAc, Z9E11-14:OAc, caryophyllene, linalool and phenylacetaldehyde were selected and tested in behavioral responses (wind tunnel). The behavioral responses of S. litura to the five chemicals at five time points during scotophase showed similar patterns to that obtained from the EAG tests. The expression levels of the most olfactory receptor and clock genes reached the peak after 3 and 9 hours in the dark, which is largely consistent with the circadian rhythms of olfactory responses in S. litura. Conclusion: The circadian rhythms of olfactory responses were consistent with those of expression levels of olfactory and clock genes in S. litura, suggesting that the circadian rhythms are probably essentially regulated by clock and olfactory genes.
Spodoptera litura; circadian rhythms; electroantennogram; wind tunnel; RT-qPCR
Q965
A
10.3969/j.issn.2095-9400.2017.08.002
2016-11-02
浙江省自然科学基金资助项目(LY15C030003);温州医科大学科研启动基金(89213002)。
林慧玥(1991-),女,浙江瑞安人,硕士生。
万新龙,副研究员,Email:smartw@wmu.edu.cn。

