新型靶向纳米探针在早期上尿路上皮癌动物模型中的 成像研究
廖国栋,王丽江,俞蔚文,张建设
·论 著·
新型靶向纳米探针在早期上尿路上皮癌动物模型中的 成像研究
廖国栋1,王丽江2,俞蔚文1,张建设3
(1.浙江省人民医院 泌尿外科,浙江 杭州 310014;2.浙江大学 浙江大学加州国际纳米技术研究院, 浙江 杭州 310027;3.温州医科大学 基础医学院,浙江 温州 325035)
目的:探讨上转换荧光材料(UCP)纳米探针的荧光特征及其对早期上尿路上皮癌移植瘤的靶向性。方法:采用高温裂解法先合成水溶性UCP,再制备靶向酸性组织插入多肽(pHLIP)偶联的UCP纳米探针,利用Maestro小动物活体多光谱影像系统(CRI)观察pHLIP-UCP探针对荷瘤动物模型上尿路上皮肿瘤的成像。结果:合成了分散性好、粒径小、溶液通透性高的NaYF4:Yb3+,Er3+上转换纳米晶体;UCP纳米探针对荷瘤动物模型成像的上转换发光信号在黑暗环境下发光稳定、灵敏度高。结论:体内UCP纳米粒子能明显富集在肿瘤组织,在早期上尿路上皮癌活体成像中有较大的应用潜力。
上尿路上皮癌;纳米探针;上转换成像;动物模型
上尿路上皮癌来源于肾盂、输尿管的尿路上皮,大多数在诊断时已为浸润性癌,导致手术效果不佳、总体预后较差[1],术后有64.6%出现肿瘤进展,35.6%出现肿瘤转移[2]。因此,上尿路上皮癌的早期诊断意义重大。目前,纳米科技为肿瘤的早期探测提供了新的思路,基于纳米粒子的早期肿瘤标志物检测技术[3]、基于纳米粒子光热转换效应基础上的显像治疗一体化技术[4]、纳米缓释药物与纳米药物递送器件[5]等基于纳米粒子的早期肿瘤标志物 检测技术已取得了重大进展。本研究合成基于上转 换荧光材料(up-converting phosphor,UCP)的纳米 分子影像探针,对早期上尿路上皮癌进行了成像。
1 材料和方法
1.1 材料
1.1.1 主要试剂:三氯化铒(ErCl3)购自上海阿拉丁生化科技股份有限公司,三辛基氧化膦(trioctylphosphine oxide,TOPO,90%)、三氟乙酸(trifluoroacetic acid,CF3COOH)购自美国Sigma-Aldrich公司。正硅酸乙酯(tetraethyl orthosilicate,TEOS)购自天津阿法埃莎化学有限公司,其他试剂购自上海生工生物工程有限公司。所有化学试剂均为分析纯级别。
1.1.2 实验动物:BALB/c小鼠,6~8周龄,SPF级,来源于上海斯莱克实验动物有限公司,动物许可证号:SYXK(浙)2012-0178,由浙江大学实验动物中心饲养。
1.2 方法
1.2.1 聚醚酰亚胺(polyetherimide,PEI)高分子包裹的水溶性UCP纳米晶体制备:利用文献[6]记录的高温裂解法制备PEI高分子包裹的水溶性UCP。所有稀土试剂均为5N(99.999%)纯度。(CF3COO)3Er的制备需要提前将相应的稀土氧化物溶解在CF3COOH中,并在回流温度下加热。当溶解完全后,在真空条件下除去溶剂。所得的固体真空下室温过夜,不需要进一步净化。向已加入10 g TOPO的50 mL三口烧瓶中同时再加入1.25 mmoL CF3COONa、0.48 mmoL (CF3COO)3Y、0.12 mmoL(CF3COO)3Yb以及制备好的0.00024 mmoL(CF3COO)3Er前体。再将得到的反应混合物在100 ℃、真空下放置30 min,完成脱气过程。再将该溶液在氩气下迅速加热到360 ℃,并保持在这个温度1 h,同时大力磁力搅拌(1 000 r/min)。 接着溶液冷却至室温后,加入氯仿和甲醇沉淀纳米 粒子。通过离心(转速12 000 r/min,时间为15 min) 收集纳米粒子,用乙醇洗涤3次。纯化的纳米粒子颗粒再分散在环己烷和储存纯化的纳米颗粒再加入环己烷中分散和储存(室温)。通过动态光散射和透射电子显微镜(transmission electron microscope, TEM)(JEOL/JEM-2010F)分析所制备UCP的粒径,利用荧光光谱仪在外接980 nm光源下测定所制备粒子的发光光谱。
1.2.2 将靶向插入微酸组织多肽(pH low insertion peptide,pHLIP)与UCP连接:采用固相合成法合成的pHLIP序列如下:Ala-Cys-Glu-Gln-Asn-Pro-Ile-Tyr-Trp-Ala-Arg-Tyr-Ala-Asp-Trp-Leu-Phe-Thr-Thr-Pro-Leu-Leu-Leu-Leu-Asp-Leu-Ala-Leu-Leu-Val-Asp-Ala-Asp-Glu-Gly-Thr-Gly。多肽与粒子间偶联采用的linker是4-(N-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(SMCC)(美国Pierce 公司),用于连接多肽N末端的Cys巯基与粒子表面氨基。利用SMCC linker连接蛋白与纳米粒子的方法是:将50 mg SMCC溶于5 mL N,N-二甲基甲酰胺(DMF)中配成10 mg/mL SMCC溶液,取纯化好的高亮度UCP约0.015 mmol,分散于5 mL磷酸缓冲盐溶液PBS中,将两者迅速混合,37 ℃振荡反应30 min,用PBS透析除去多余的SMCC,取1 mL 0.15 moL/L pHLIP多肽溶液与透析好的溶液混合,继续37 ℃振荡反应30 min。反应结束后,离心沉淀纳米粒子并反复洗涤,于4 ℃保存。
1.2.3 利用pHLIP-UCP纳米探针对早期上尿路上皮癌肿瘤模型进行高灵敏成像:建立裸鼠上尿路上皮 癌皮下荷瘤动物模型,在接种后第1天进行观察,研 究pHLIP-UCP探针对早期肿瘤的显像灵敏度和特异度。移植瘤模型的建立方法:在体外培养上尿路上皮癌细胞株T24,细胞计数,制备肿瘤细胞悬液,将制 备好的肿瘤细胞悬液吹打均匀,固定好动物,乙醇棉球消毒注射部位(下肢)的皮肤,按每只动物每个部位0.1 mL(约0.5×106个细胞),将连接完毕的pHLIP-UCP纳米探针溶液按每只动物1 mL注射入腹腔,1 d后进行光学检测。采用Maestro小动物活体多光谱影像系统,其光谱检测范围为400~950 nm。激发源是运行在980 nm和安全功率为0.2 W的红外激光二极管[14]。使用电荷耦合元件(charge-coupled device,CCD)相机捕获图像,使用MaestroTMver 2.4软件包分析所得到的影像,通过荧光强度判定探针对上尿路上皮癌肿瘤细胞的富集程度和灵敏度。
2 结果
2.1 TEM分析所制备的UCP粒子 当温度从200 ℃开始逐渐升高时,前体开始发生高温裂解反应,从细小的晶体逐渐团聚成较大的晶体团簇,在特定温度(360 ℃),这些小的晶体簇不断生长、熟化,最终成为规则的纳米粒子,见图1。
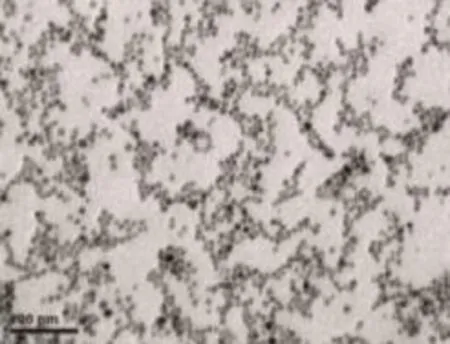
图1 在TOPO溶剂相360 ℃下的纳米晶体TEM图
2.2 荧光光谱仪测定所制备粒子的发光光谱 Er3+掺杂的UCP发光纳米晶体,Er3+在不同掺杂浓度下可以发射绿光和红光2种光谱。分别通过绿色和红色滤光片捕获相应光谱,激发通道上的发光均匀通透、强度较高;通过其光谱测定Er3+粒子掺杂的UCP晶体最大发射波长在550 nm左右,红光发射区域在660 nm左右。在激活粒子掺杂浓度为2%,绿色发射占主要位置;当增大激活离子掺杂比例时,红光发射所占的比例也相应提高,见图2。
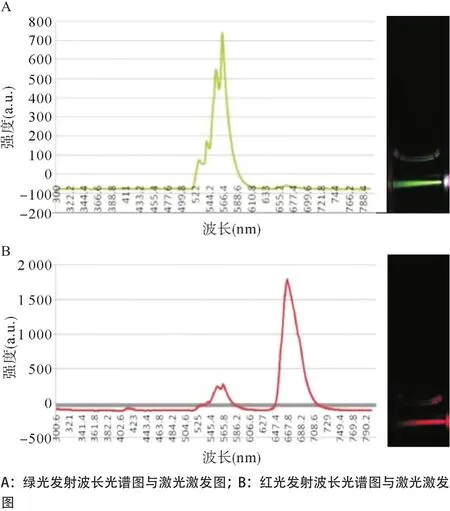
图2 Er3+掺杂的UCP晶体(NaYF4:Yb3+,Er3+)光谱图(白底)和激光激发图(黑底)
2.3 UCP纳米探针对荷瘤动物模型的成像 CCD器件对处于近红外区的光线依然敏感,利用普通CCD器件拍摄了荷瘤动物的荧光图像,CCD未进行光谱过滤下的实验动物和CCD未进行光谱过滤下的肿瘤,见图3A。CCD前进行光谱过滤下的实验动物和CCD前进行光谱过滤下的肿瘤,见图3B。

图3 上转换活体实验动物和肿瘤CCD成像图
2.4 利用Maestro系统的光谱分析技术对上转换活体动物的光谱分析 自然光下裸鼠的形态,注射上转换纳米粒子后分别扫描650~660 nm和540~550 nm所显示的肿瘤荧光图,见图4。利用光谱分析系统分离540~550 nm激发区域的荧光光谱,非肿瘤所在区域为红色激发光,肿瘤所在区域为绿色激发光,540~550 nm光谱峰值为上转换荧光发光区域,并进行荧光强度测量,取得光子信号计数平均值(average counts signal,acs),根据2种测量信号强度与相应区域作图比较,见图5。利用光谱分析系统分离650~660 nm激发区域的荧光光谱,肿瘤所在区域为红色激发光,非肿瘤所在区域为黄色激发光,650~660 nm光谱峰值为上转换荧光发光区域,并进行荧光强度测量,取得光子信号计数acs值,根据2种测量信号强度与相应区域作图比较,见图6。左后肢部位650~660 nm上转换发光荧光与自然光叠加后的图像,用Maestro系统将两者转换为强度模式下荧光的强度分布情况,见图7。右后肢部位540~550 nm上转换发光荧光与自然光叠加后的图像,用Maestro系统将两者转换为强度模式下荧光的强度分布情况,见图8。650~660 nm和540~550 nm上转换发光荧光与自然光叠加后的图像,用Maestro系统将3者转换为强度模式下荧光的强度分布情况,见图9。

图4 荷瘤动物在自然光及不同波长下的荧光图
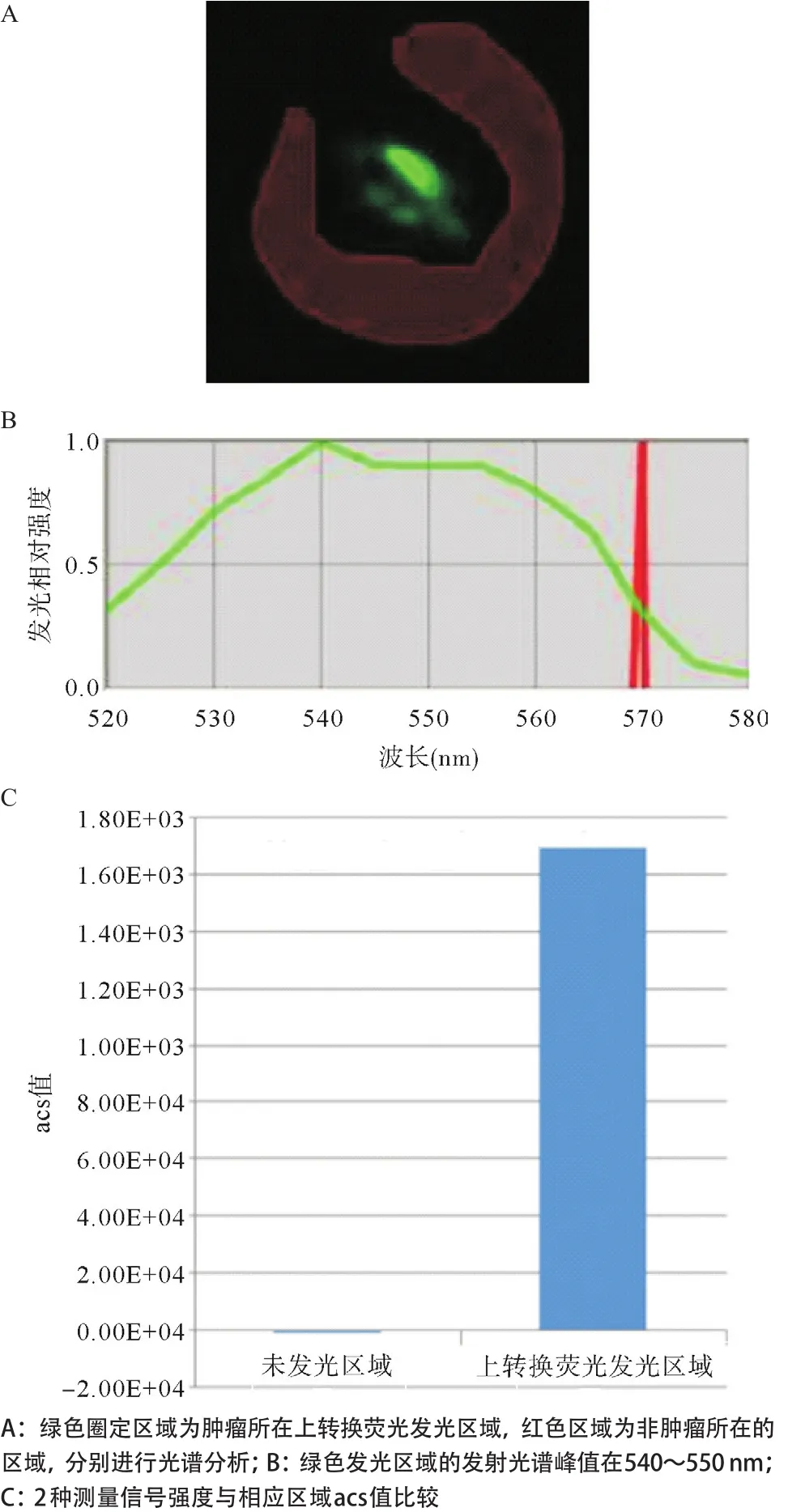
图5 活体实验动物肿瘤区域在540~550 nm波长激发光下光谱特征及强度
3 讨论
上尿路上皮肿瘤的常规诊断手术目前有CT尿路成像(computed tomography urography,CTU)、输尿管镜检查、尿细胞学检查等。CTU对于5~10 mm的病灶具有超过95%的敏感性和特异性,但在疾病发生的早期,即镜下血尿阶段的早期上尿路上皮癌的敏感性低下。输尿管镜检查尤其是纤维软输尿管镜可以观察上尿路的大体形态并可以到达肾盂,可以评估肿瘤的形态,获取病理活检标本,但属于有创操作,且依赖于手术医师的技术熟练性和肿瘤的大小能否被肉眼可见。尿细胞学检查阳性对于诊断上尿路上皮癌有很强的提示作用,但尿细胞学阴性并不能排除恶性肿瘤。因此,发展新的诊断手段成为提高上尿路上皮癌治疗效果的前提条件。
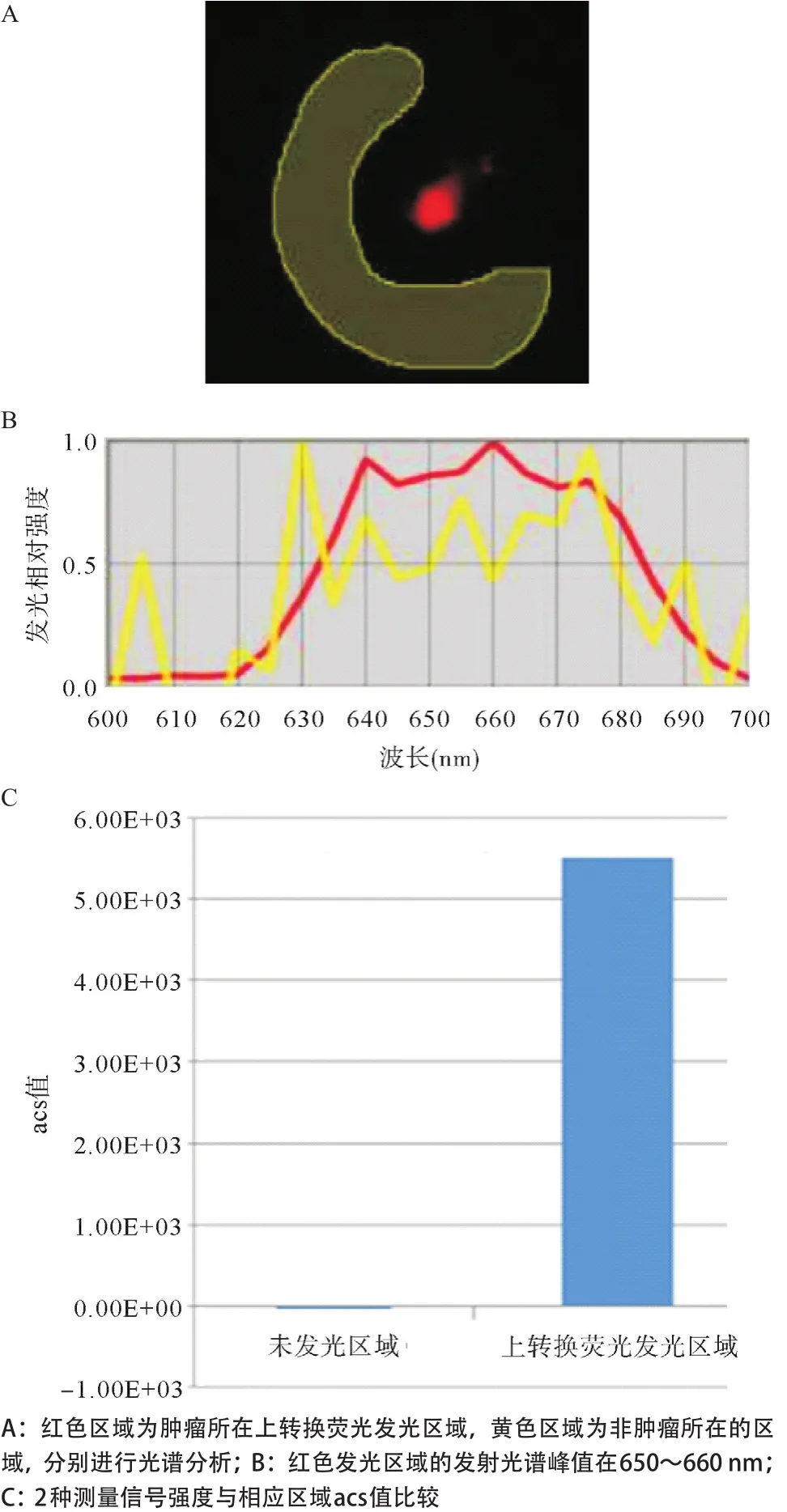
图6 活体实验动物肿瘤区域在650~660 nm波长激发光下光谱特征及强度
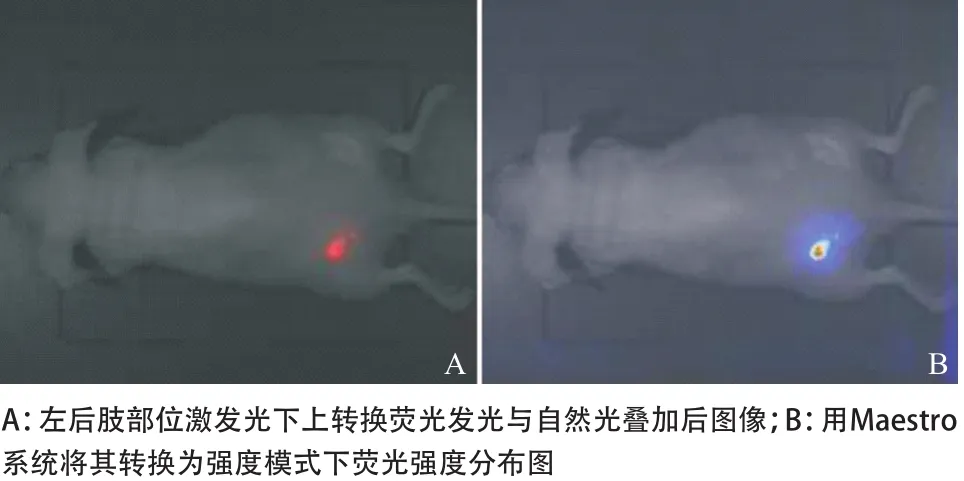
图7 活体实验动物肿瘤区域在650~660 nm上转换荧光与自然光叠加图及其强度分布示意图
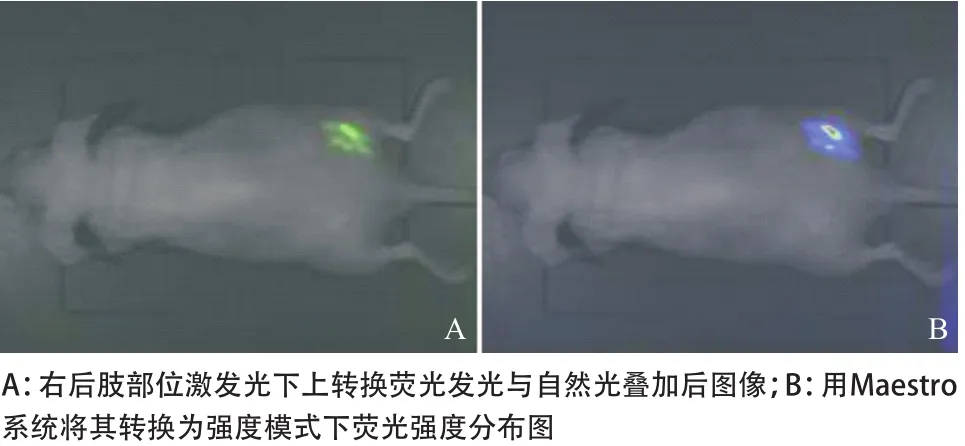
图8 活体实验动物肿瘤区域在540~550 nm上转换荧光与自然光叠加图及其强度分布示意图

图9 活体实验动物肿瘤区域在650~660 nm和540~550 nm上转换荧光与自然光叠加图及其强度分布示意图
光动力诊断(photodynamic therapy,PDT)因为生物安全性好,且不影响化疗和放疗,成为近几年研究的热点[7]。目前,常见的光敏剂有5-氨基乙酰丙酸(5-ALA)、金丝桃素类化合物、酞菁类化合物。5-ALA在泌尿系统首先被用于早期膀胱癌及转移癌的诊断,但5-ALA的荧光显示不但可在膀胱移行细胞癌上,而且增生的膀胱黏膜、鳞状上皮化生、炎症或肉芽组织也可出现阳性[8],且生物利用率低,不利于临床大规模的推广[9]。金丝桃素在诊断膀胱癌有较好的特异性和灵敏性[10],然而,金丝桃素纯净物价格昂贵,并且目前缺乏合适的溶剂保证其在溶液内的溶解度和稳定性。
在光学成像领域中新兴的近红外荧光(nearinfrared fluorescence,NIRF)成像已逐渐受到研究人员的重视[11]。NIRF成像技术能够通过不同的方式降低背景以提高分辨率,但背景自发荧光依然存在。上转换发光是一种在红外光激发下发出可见光的发光现象,研究发现[12],基于UCP的分子影像探针具有成像的高灵敏度、产生荧光的高度稳定性及生物组织不产生破坏效应,因此非常适用于NIRF成像,此外,UCP纳米粒子还是一种非常合适的光敏剂输送载体,它可以连接特异肿瘤靶向分子,在目标肿瘤部位结合富集。CHATTERJEE等[13]首次报道将聚乙烯亚胺包裹的NaYF4:Yb3+,Er3+纳米粒子用于肿瘤细胞和小动物正常组织显像,结果表明该纳米粒子生物相容性好,对骨髓干细胞不产生毒性,肿瘤细胞成像背景自发荧光极低;与量子点比较,UCP纳米颗粒能穿透更深的组织发出荧光。本研究以NaYF4为基质材料,掺杂20% Yb3+为敏化离子,掺杂2% Er3+作为激活离子。其中敏化离子的作用是吸收激发光能量,并将其转移给激活离子,作为激活离子的这些稀土元素具有丰富的能级,在激发光下产生较强的发射光谱。对于上转换发光成像,由于其原理在于近红外光源激发,但对于CCD器件,其对处于近红外区的光线仍然敏感,因此普通的CCD成像对于发射光谱的影响主要在于所照射部位的近红外反射光,这种反射光在CCD上成像呈现粉白色,见图3A。通常的错误认识是认为激发光源不纯,出现了其他发射波长的光谱,因而影响了CCD的成像,但我们可通过在CCD前进行光谱过滤,去除激发光干扰,见图3B。
先前的光学成像的靶点大多聚焦在特异性的肿瘤细胞上,将特异性的生物探针与纳米粒子耦合,然后输入动物体内,通过被动吸收和主动吸收途径与肿瘤细胞靶向结合成像。遗憾的是,这种模式在诊断早期上尿路上皮癌上有着巨大的局限性,可能与肿瘤缺乏足够的特异性分子标记以及分子探针与纳米粒子耦合后,改变了探针的生物活性等因素有关。研究发现:肿瘤细胞与邻近宿主各成分之间相互作用后可形成肿瘤-宿主界面微环境[14],肿瘤细胞的生长速度快,组织代谢活性高,从而导致微环境低氧和酸性增高[15]。肿瘤的微环境选择诱导能在恶性环境下生存的肿瘤细胞,并促使其继续恶变,尤其是酸性微环境与肿瘤的发生、增殖、转移都有着密切关系。“生物纳米针筒”技术[16]合成了一种能靶向聚集在酸性组织,并能够嵌入到细胞膜内pHLIP的小片段蛋白质,应用近红外荧光染料Cy5.5 与pHLIP结合构建靶向探针,对鼠乳腺癌模型进行近红外荧光成像。结果表明,pHLIP插入细胞膜不会造成膜损伤,且自身非常稳定,在肿瘤酸性微环境组织中明显富集。直接插入质膜比其他抗体类靶向探针在肿瘤部位富集程度要高得多,所以弥补了肿瘤缺乏足够的特异性分子标记的缺点。我们同样利用了生物针筒技术这个特点,将pHLIP与UCP纳米粒子链接后,利用上转换发光检测结合Maestro光谱分析系统可以清晰地识别富集在表皮不同部位的 UCP纳米粒子,并且可以通过分析得到相关部位的光谱及强度等数据。以此作为模型,验证了上转换发光的低背景发射以及高的信噪比等特征。发现pHLIP-UCP纳米粒子在成像时的背景荧光S/N为107,而荧光区域的S/N为1346,背景荧光几乎不存下,这说明背景荧光几乎没有存在,在注射较强发光的上转换纳米粒子情况下,肿瘤细胞富集的区域可以得到极强的荧光信号。由于没有背景荧光,所以在近红外激光激发下几乎看不到小鼠的形态,见图7和图8。将荧光图片与自然光图片进行叠加后可清晰地进行荧光定位;而转换为强度模式下荧光的强度分布情况,显示探针在肿瘤接种部位较高的富集程度,见图7和图9。因此,提示pHLIP-UCP纳米探针对于诊断早期上尿路上皮癌具有高敏感性与特异性。
利用上转换发光不会产生背景荧光的特性,建立上尿路上皮癌上转换活体动物成像的纳米探针,通过研究表明此探针具有极高的信噪比,由于UCP纳米粒子发光强度高、不淬灭、组织背景荧光低,因此很适合临床早期尿路上皮肿瘤的显像应用。
[1] ROUPRÊT M, ZIGEUNER R, PALOU J, et al. European guidelines for the diagnosis and management of upper urinary tract urothelial cell carcinomas: 2011 update[J]. Eur Urol, 2011, 59(4): 584-594.
[2] PICOZZI S, RICCI C, GAETA M, et al. Upper urinary tract recurrence following radical cystectomy for bladder cancer: a meta-analysis on 13,185 patients[J]. J Urol, 2012, 188(6): 2046-2054.
[3] POON C Y, WEI L, XU Y, et al. Quantification of cancer biomarkers in serum using scattering-based quantitative single particle intensity measurement with a dark-field microscope[J]. Anal Chem, 2016, 88(17): 8849-8856.
[4] GARCIA K E, BABANOVA S, SCHEFFLER W, et al. Designed protein aggregates entrapping carbon nanotubes for bioelectrochemical oxygen reduction[J]. Biotechnol Bioeng, 2016, 113(11): 2321-2327.
[5] AINBINDER D, TOUITOU E. Testosterone ethosomes for enhanced transdermal delivery[J]. Drug Deliv, 2005, 12(5): 297-303.
[6] SHAN J, QIN X, YAO N, et al. Synthesis of monodisperse hexagonal NaYF4:Yb, Ln (Ln=Er, Ho and Tm) upconversion nanocrystals in TOPO[J]. Nanotechnology, 2007, 18(44): 445607.
[7] BUS M T, DE BRUIN D M, FABER D J, et al. Optical diagnostics for upper urinary tract urothelial cancer: technology, thresholds, and clinical applications[J]. J Endourol, 2015, 29 (2): 113-123.
[8] DE DOMINICIS C, LIBERTI M, PERUGIA G, et al. Role of 5-aminolevulinic acid in the diagnosis and treatment of superficial bladder cancer: improvement in diagnostic sensitivity[J]. Urology, 2001, 57(6): 1059-1062.
[9] FOTINOS N, CAMPO M A, POPOWYCZ F, et al. 5-Aminolevulinic acid derivatives in photomedicine: Characteristics, application and perspectives[J]. Photoehem Photobiol, 2006, 82(4): 994-1015.
[10] OLIVO M, LAU W, MANIVASAGER V, et al. Novel photodynamic diagnosis of bladder cancer: ex vivo fluorescence cytology using hypericin[J]. Int J Oncol, 2003, 23(6): 1501-1504.
[11] HUCK C W, OZAKI Y, HUCK-PEZZEI V A. Critical review upon the role and potential of fluorescence and near-Infrared imaging and absorption spectroscopy in cancer related cells, serum, saliva, urine and tissue analysis[J]. Curr Med Chem, 2016, 23(27): 3052-3077.
[12] CHATTERJEE D K, ZHANG Y. Upconverting nanoparticles as nanotransducers for photodynamic therapy in cancer cells[J]. Nanomedicine, 2008, 3(1): 73-82.
[13] CHATTERJEE D K, RUFAIHAH A J, ZHANG Y. Upconversion fluorescence imaging of cells and small animals using lanthanide doped nanocrystals[J]. Biomaterials, 2008, 29 (7): 937-943.
[14] LIOTTA L A, KOHN E C. The microenvironment of the tumour-host interface[J]. Nature, 2001, 411(17): 375-379.
[15] RAGHUNAND N, GATENBY R A, GILIES R J. Microenvironmental and cellular consequences of altered blood flow in tumours[J]. Br J Radiol, 2003, 76(1): s11-s22.
[16] ANDREEV O A, DUPUY A D, SEGALA M, et al. Mechanism and uses of a membrane peptide that targets tumors and other acidic tissues in vivo[J]. Proc Natl Acad Sci U S A, 2007, 104(19): 7893-7898.
(本文编辑:吴彬)
Imagination of novel targeted molecular imaging probes in the early diagnosis of upper urinary tract epi-thelial carcinoma model
LIAO Guodong1, WANG Lijiang2, YU Weiwen1, ZHANG Jianshe3.
1.Department of Urology, Zhejiang Provincial People’s Hospital, Hangzhou, 310014; 2.Zhejiang University California International Nanosystems Institute, Zhejiang University, Hangzhou, 310027; 3.School of Basic Medical Science, Wenzhou Medical University, Wenzhou, 325035
Objective: To investigate the characteristic and tumor targeting of up-converting phosphor (UCP) nano-probe in labeling orthotopic transplantation tumor of early upper urinary tract urothelial carcinoma in vivo. Methods: Water soluble UCP was synthesized by high temperature pyrolysis. Then, UCP was link to the pH (low) insertion peptide (pHLIP). Imaging of urothelial tumors in a tumor bearing animal model by pHLIPUCP probe was proceeded using a small animal in vivo multispectral Maestro imaging system (CRI). Results: NaYF4:Yb3+, Er3+upconversion nanocrystals were synthesized with good dispersibility, small particle size and high solution permeability. The upconversion luminescence signal of the UCP nanoprobe had stable luminescence and high sensitivity in the dark environment. Conclusion: The UCP nanoprobe can specifically bound to orthotopic transplanted tumor of upper urinary tract urothelial cancer in vivo, which shows the potential for in vivo imaging of early upper urinary tract epithelial carcinoma.
upper urinary tract epithelial carcinoma; nanoprobe; upconversion imaging; animal model
R604
A
10.3969/j.issn.2095-9400.2017.08.001
2017-01-16
国家自然科学基金青年基金资助项目(30900346);浙 江省自然科学基金资助项目(Y2101402);浙江省公益性技术应 用研究计划项目(2014C33129)。
廖国栋(1977-),男,湖南衡阳人,主治医师,博士。

