芍药甘草附子汤对类风湿关节炎大鼠下丘脑室旁核nN OS、IL-1β及TNF-α表达的影响
谢传美,袁国华
(川北医学院附属医院 风湿科,四川 南充 637000)
芍药甘草附子汤对类风湿关节炎大鼠下丘脑室旁核nN OS、IL-1β及TNF-α表达的影响
谢传美,袁国华
(川北医学院附属医院 风湿科,四川 南充 637000)
目的探讨芍药甘草附子汤(PGAD)对类风湿关节炎(RA)大鼠下丘脑室旁核神经元型一氧化氮合酶(nNOS)、白介素1β(IL-1β)及肿瘤坏死因子α(TNF-α)表达的影响。方法选取48只健康Wistar大鼠,随机分3组,每组16只,分别为对照组、模型组及药物干预组。由Ⅱ型胶原酶诱导关节炎大鼠,采用大鼠关节炎评分法和足爪肿胀评分法评价其模型是否复制成功;30mg/kg PGAD灌胃;免疫荧光和Western blot检测下丘脑室旁核nNOS、IL-1β及TNF-α的表达。结果3组大鼠关节炎评分、足爪肿胀评分、下丘脑室旁核nNOS、IL-1β及TNF-α表达比较,模型组和药物干预组较对照组升高(P<0.05),药物干预组较模型组下降(P<0.05)。结论PGAD对RA大鼠有治疗、保护作用,其机制可能与抑制下丘脑室旁核nNOS、IL-1β及TNF-α表达有关。
芍药甘草附子汤;类风湿关节炎;下丘脑室旁核;一氧化氮合酶;白介素1β;肿瘤坏死因子α
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性对称性多关节炎表现为主要特征的全身性自身免疫性疾病[1]。最新研究发现,RA患者糖皮质激素严重缺乏,已经证实糖皮质激素严重缺乏是RA的一个重要发病机制[2-3]。近年来,RA在神经内分泌免疫学方面的发病机制研究越来越受到关注,下丘脑-垂体 -肾上腺轴(hypothalamic-pituitary-adrenal axis,HPAA)功能在RA发病中发挥重要作用[4]。下丘脑的室旁核(paraventricular nucleus of hypothalamus,PVN)是调节HPAA的主要核团[5]。研究发现,芍药甘草附子汤(paeoniae andglycyrrhizae and a coniti decoction,PGAD)能有效缓解RA的症状,控制病情的快速发展,临床疗效较好,是一种治疗RA的手段[6]。但是PGAD预防与治疗RA的具体机制尚未报道。本研究通过观察PGAD是否通过血脑屏障,进而影响下丘脑室旁核内神经元型一氧化氮合酶(neuronal nitricoxi'desynthase,nNOS)、白介素 1β(Interleukin-1β,IL-1β)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)表达,探讨PGAD是否通过影响PVN区nNOS、IL-1β及TNF-α的表达对RA起治疗、保护的作用。
1 材料与方法
1.1 动物
选取健康雌性Wistar大鼠48只,体重220~260g(川北医学院实验动物中心提供),动物饲养室温(20±2)℃,湿度43%~45%,常规自由摄食、饮水,将动物适应性喂养1周后开始进行实验。
1.2 药品与试剂
PGAD购自广州广修堂医药科技有限公司,含量≥30%。完全弗氏佐剂购自美国Sigma公司,nNOS、IL-1β及TNF-α一抗购自美国Abcam公司,兔抗大鼠抗体购自Abcam公司,山羊抗兔购自Santa Cruz生物技术公司。
1.3 实验动物分组
SD大鼠随机分为对照组、模型组及药物干预组(PGAD 30 mg/kg),每组16只。
1.4 方法
1.4.1 模型的复制 药物干预组大鼠按照30 mg/kg剂量给药[7]。模型组和药物干预组每只实验大鼠注射完全弗氏佐剂诱导关节炎模型[8-9]。药物干预组在模型复制过程中即可开始给药,每天灌胃给药,直至取材。模型组和对照组给予等剂量的生理盐水灌胃。
1.4.2 关节观察及评分 关节炎评分规定[10]:每只RA模型大鼠的关节炎最高评分为8分。以下情况计为1分:①有1只耳朵出现结节和红肿;②1只鼻子出现结节和红肿;③1只尾巴出现结节和红肿;④1只足爪出现结节和红肿。
足爪肿胀评分规定[11]:每只RA模型大鼠的足爪肿胀最高评分为24分。以下情况计为1分:①1只腕关节或踝关节出现结节和红肿;②每个小关节出现结节和红肿(每只足爪包括5只指关节或趾关节)。
1.4.3 取材 在药物干预后第21天进行灌注。30%水合氯醛麻醉,500 ml生理盐水冲洗,40g/L多聚甲醛 +0.1 mol/L磷酸盐缓冲溶液(phosphate buffer saline,PBS)pH值7.2灌注固定。灌注完在冰块上小心取下丘脑组织,包埋切片,厚14μm。
1.4.4 免疫荧光法染色 采用免疫荧光法染色检测nNOS,IL-1β及TNF-α阳性神经元。将切片从-80℃冰箱取出,复温10min,0.01mol PBS冲洗3次;30%Triton打孔1h;5%牛血清37℃封闭孵育1h;加nNOS1、IL-1β及TNF-α一抗(1∶200),4℃过夜,加二抗1∶200,放入37℃恒温箱温育1 h,PBS冲洗。滴加荧光封片剂,封片。荧光显微镜进行观察拍摄,利用图像分析系统进行分析。
1.4.5 Western blot检测 实验结束30 min后迅速断头处死大鼠,取出脑组织。游离下丘脑室旁核,放置于-80℃冰箱冷冻保存。4℃下将PVN区切片,裂解分离PVN区组织,然后经匀浆液离心,提取PVN区总蛋白,离心总蛋白,超声波裂解,从裂解液中分离提取生物化蛋白。组织匀浆后提取蛋白成分变性,蛋白样品通过聚丙烯酰胺凝胶(积层胶浓度6%,分离胶浓度10%)电泳2 h,将分离的蛋白转移到聚偏二氟乙烯膜上(湿转300 mA,1.5 h或110 V,1 h)。转膜后置于3%牛血清蛋白溶液中孵育;加一抗(1∶1 000),4℃孵育过夜,三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20,TBST)洗一抗;加二抗(1∶1 000)室温孵育40 min,TBST洗二抗,发光。采用NIH Image J和Imagine软件进行图像分析。
1.5 统计学方法
数据分析采用SPSS 22.0统计软件理,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,方差齐则两两比较用SNK-q检验,P<0.05为差异有统计意义。
2 结果
2.1 PG AD治疗R A大鼠的疗效分析
RA模型大鼠第17天出现RA症状:四肢、耳朵、鼻子、尾巴出现红肿或结节。对照组、模型组及药物干预组关节炎评分比较,经方差分析,差异有统计学意义(F=56.341,P=0.000),进一步两两比较经SNK-q检验,模型组和药物干预组关节炎评分高于对照组(q=23.649和18.219,均P=0.000);与模型组比较,药物干预组大鼠关节炎评分降低(q=20.401,P= 0.000)(见图1A)。第17天各组大鼠足爪肿胀评分比较,经方差分析,差异有统计学意义(F=65.612,P= 0.000),进一步两两比较经SNK-q检验,模型组和药物干预组大鼠足爪肿胀评分高于对照组(q=46.469和21.655,均P=0.000);与模型组比较,药物干预组大鼠的足爪肿胀评分降低(q=36.129,P=0.000)(见图1B)。
2.2 PG AD对 R A大鼠下丘脑室旁核 nNOS、IL-1β及TNF-α阳性神经元表达的影响
对照组、模型组及药物干预组的大鼠下丘脑室旁核nNOS阳性神经元量分别为34.000、42.000和19.000 pg/ml,IL-1β阳性神经元量分别为0.183、0.610和0.376 pg/ml,TNF-α阳性神经元量分别为0.890、2.343和1.776 pg/ml(见图2)。各组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α阳性神经元量比较,经方差分析,差异有统计学意义(F=51.712、55.626和71.916,均P=0.000)。进一步两两比较经SNK-q检验,模型组和药物干预组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α阳性神经元数量高于对照组(P<0.05);与模型组比较,药物干预组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α阳性神经元数量降低(P<0.05)(见图3)。
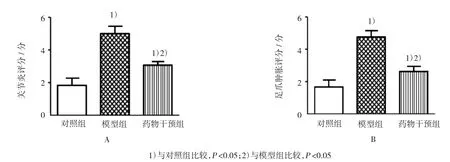
图1 PD AG治疗R A大鼠的疗效分析 (n=16,±s)
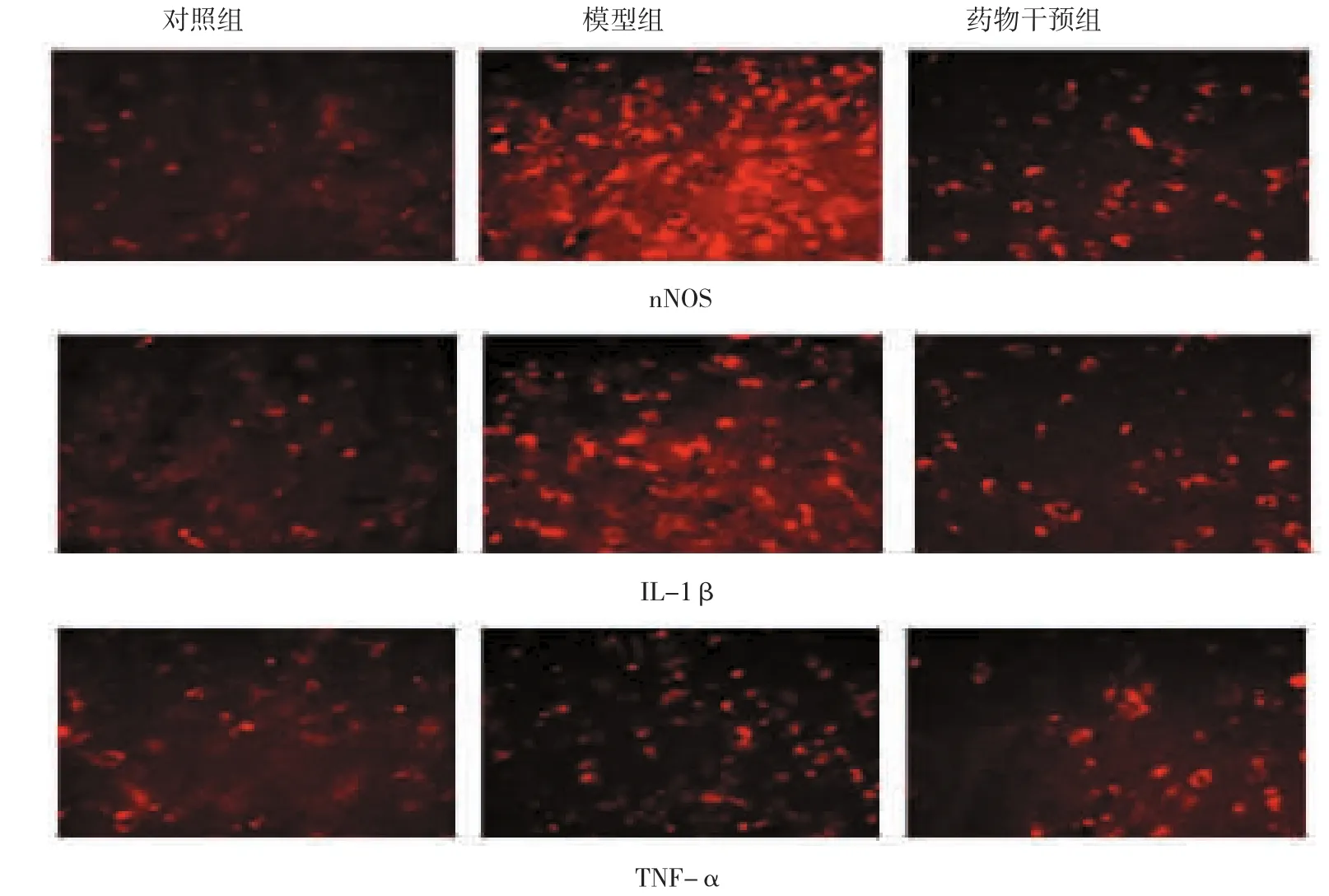
图2 各组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α阳性神经元的表达 (免疫荧光法×40)

图3 各组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α阳性神经元表达比较 (n=16,±s)
2.3 PG AD对R A大鼠下丘脑室旁核蛋白表达的影响
对照组、模型组及药物干预组的大鼠下丘脑室旁核 nNOS的表达量分别为 19.7%、54.3%和3.41%,IL-1β的表达量分别为 1.75%、28.9%和2.06%,TNF-α的表达量分别为12.4%、26.7%和22.6%(见图4)。各组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α的表达量比较,经方差分析,差异有统计学意义(F=31.188、38.912和61.523,均P= 0.000)。进一步两两比较经SNK-q检验,模型组和药物干预组大鼠下丘脑室旁核nNOS、IL-1β及 TNF-α的表达量高于对照组(P<0.05);与模型组比较,药物干预组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α表达量降低(P<0.05)(见图5)。

图4 各组大鼠下丘脑室旁核nNOS、IL-1β及TNF-α蛋白的表达

图5 各组R A大鼠下丘脑室旁核nNOS、IL-1β及TNF-α蛋白表达的比较 (n=16,±s)
3 讨论
RA属于“痹证”范畴,中医认为风、寒、湿、热诸邪是RA发生、发展的外部条件,而诸虚内存,芷气不足是其发病的内因。现代医学主要以药物治疗为主,如非甾体抗炎药、改变病情的抗风湿药、糖皮质激素等,目的在于减轻疼痛、控制病情进展。由于服药时间长,毒副作用大,患者往往难以接受。芍药甘草附子汤出自《伤寒论》,见于68条。发汗,病不解,反恶寒者,虚故也,芍药甘草附子汤主之。由自芍、炙甘草、炮附子3味药组成。该中药可以改善RA症状,毒副作用较小,易长期坚持服用,但其具体机制尚不明确。
下丘脑室旁核具有中枢调控与整合作用,是机体神经-内分泌-免疫系统联系的枢纽。研究发现,nNOS是一种同工酶,存在于内皮细胞、巨噬细胞、神经吞噬细胞及神经细胞中。nNOS存在于神经元中,在不同脑区呈选择性分布。在PVN中存在较多的神经元型nNOS阳性神经元,大鼠脑室内注人nNOS的抑制剂后,能促进室旁核释放因子的合成及促肾上腺皮质激素的释放,因此nNOS可能对HPAA起抑制调节作用[12]。本研究发现复制模型后第21天,模型组大鼠RA症状较对照组明显;与对照组比较,模型组PVN区nNOS阳性神经元水平与蛋白的表达增多,因此RA大鼠PVN区nNOS功能处于活跃状态。经PGAD治疗后,与模型组比较,药物干预组组足肿胀度低于模型组,具有治疗、保护作用,同时PVN区nNOS阳性神经元水平与蛋白的表达降低。因此,本研究推测PGAD对RA具有治疗、保护作用与PVN区nNOS水平变化有关。
RA是一种伴有炎症细胞浸润和骨质侵蚀的滑膜组织增生性疾病。滑膜组织的增生、炎症反应及自身免疫反应相互作用、相互联系,共同推动病情进展[13-14]。在炎症部位、关节积液及滑膜组织中,可检测到多种细胞因子。许多细胞因子被公认为是RA炎症及关节损伤的重要分子,该细胞因子参与RA的整个病理过程[15]。根据细胞来源不同,将细胞因子分为2大类,一类包括IL-2、IL-4、IL-10等主要由T细胞产生的淋巴因子;另一类包括IL-1、IL-6、TNF-α等主要由单核/巨噬细胞产生的单核因子。PGAD治疗RA大鼠后,TNF-α、IL-6及IL-1β水平降低,表明PGAD对RA的作用机制与抑制TNF-α和IL-1β水平密切相关。
本研究发现,RA大鼠PVN区nNOS、TNF-α及IL-1β含量较对照组升高。PGAD灌胃治疗后,大鼠PVN区nNOS、TNF-α及IL-1β含量降低,提示降低PVN区nNOS、TNF-α及IL-1β水平能影响PGAD治疗RA的疗效。
[1]TAKESHITA M,KUNO A,SUZUKI K,et al.Alteration of matrix metalloproteinase-3 O-glycan structure as a biomarker for disease activity of rheumatoid arthritis[J].Arthritis Res Ther, 2016,18(1):112.
[2]RAZAVI H,RIETHER D,HARCKEN C,et al.Discovery of a potent and dissociated non-steroidalglucocorticoid receptor agonist containing an alkyl carbinol pharmacophore[J].Bioorganic Medicinal Chemistry Letters,2014,24(8):1934-1940.
[3]JUHÁSZ P,ÁDÁM MESTER,BIRÓ A J,et al.Clinical and radiological dissociation of anti-TNF plus methotrexate treatment in early rheumatoid arthritis in routine care:Methodsfrom the ABRAB study[J].Molecular Biochemical Parasitology,2014,15(2):169-178.
[4]高骏,刘旭光,黄迪君,等.HPAA在艾灸调控类风湿性关节炎大鼠滑膜组织NF-κB信号通路中的作用[J].针刺研究,2010,35(3):198-203.
[5]VALENTINO R,SAVASTANO S,TOMMASELLI A P,et al. Hormonal pattern in women affected by rheumatoid arthritis[J].J Endocrinol Invest,1993,16(8):619-624.
[6]SECA S,KIRCH S,CABRITA A S,et al.Evaluation of the effect of acupuncture on hand pain,functional deficits and healthrelated quality of life in patients with rheumatoid arthritis-a study protocol for a multicenter,double-blind,randomized clinical trial[J].J Integr Med,2016,14(3):219-227.
[7]FENG Z,XU J,HEg,et al.The efficacy and safety of the combination of totalglucosides of peony and leflunomide for the treatment of rheumatoid arthritis:a systemic review and metaanalysis[J].Evidence Based Complementary and Alternative Medicine, 2016,2016(2):1-8.
[8]SAHU R P,REZANIA S,OCANA J A,et al.Topical application of a platelet activating factor receptor agonist suppresses phorbol ester-induced acute and chronic inflammation and has cancer chemopreventive activity in mouse skin[J].PLoS One,2014,9(11):DOI:10.1371/journal.pone.0111608.
[9]BHALEKAR M R,UPADHAYA Pg,NALAWADE S D,et al. Anti-rheumatic activity of chloroquine-SLNgel on wistar rats using complete freund's adjuvant(CFA)model[J].Indian Journal of Rheumatology,2015,10(2):58-64.
[10]KOTHAVADE P S,BULANI V D,NAGMOTI D M,et al.Therapeutic effect of saponin rich fraction of achyranthes aspera linn.on adjuvant-induced arthritis in sprague-dawley rats[J]. Oral Surgery Oral Medicine Oral Pathology,2014,2015(8):844-853.
[11]TATEISHI N,KANEDA Y,KAKUTANI S,et al.Dietary supplementation with arachidonic acid increases arachidonic acid contentin paw,butdoes notaffectarthritis severity or prostaglandin E2,content in rat adjuvant-induced arthritis model[J].Lipids in Health Disease,2015,14(1):1-10.
[12]VASCONCELOS A S,OLIVEIRA I C M,VIDAL L T M,et al. Subchronic administration of riparinⅢ induces antidepressivelike effects and increases BDNF levels in the mouse hippocampus[J].Fundamental Clinical Pharmacology,2015,29(4):394-403.
[13]BRENNAN-BOURDON L M,de LA CRUZ-MOSSO U,REYESCASTILLO Z,etal.MIF and TNF-α serum levelsin rheumatoid arthritis patients treated with disease-modifying antirheumatic drugs:a cross-sectional study[J].Immunopharmacology Immunotoxicology,2015,37(2):1-7.
[14]WANG M,WANG B,MA Z,et al.Detection of the novel IL-1 family cytokines by QAH-IL1F-1 assay in rheumatoid arthritis[J]. Cell Mol Biol(Noisy-le-grand),2016,62(4):31-34.
[15]YASUKAWA K,KASAHARA Y.Effects of flavonoids from french marigold(florets of tagetes patula L).on acute inflammation model[J].International Journal of Inflammation,2013,DOI:org/10.1155/2013/309493.
(童颖丹 编辑)
Effect of PGAD on nNOS,IL-1βand TNF-αexpressions in hypothalamic paraventricular nuclei of rats with rheumatoid arthtis
Chuan-mei Xie,Guo-hua Yuan
(Department of Rheumatology,the Affiliated Hospital of North Sichuan Medical College, Nanchong,Sichuan 637000,China)
ObjectiveTo investigate the effect of Peony andglycyrrhiza and Aconite Decoction(PGAD) on the expressions of neuronal nitric oxide synthase (nNOS),IL-1β and TNF-α in the hypothalamic paraventricular nuclei of the rats with rheumatoid arthritis.MethodsForty-eight healthy Wistar rats were randomly divided into controlgroup,modelgroup and PGAD-interventiongroup with 16 in eachgroup.The arthritis rat model was induced by typeⅡ collagenase and evaluated by arthritis score and paw swelling score.The arthritis rats in the PGAD intervention group were given 30 mg/kg PGAD by gavage. Immunofluorescence and Western blot were used to detect the nNOS,IL-1β and TNF-α expressions in the hypothalamic paraventricular nuclei.MethodsThe arthritis score,the paw swelling score,and the expressions of nNOS,IL-1β and TNF-α in the hypothalamic paraventricular nuclei were significantly higher in the model and PGAD-interventiongroups than in the controlgroup (P<0.05).but significantly lower in the PGAD interventiongroup than in the modelgroup(P<0.05).ConclusionsPGAD has therapeutic and protective effect on the rats with rheumatoid arthritis,which may be related to the inhibition of nNOS,IL-1β and TNF-α expressions in the hypothalamic paraventricular nuclei.
Peony and Glycyrrhiza and Aconite Decoction;rheumatoid arthritis;hypothalamic paraventricular nucleus;nNOS;IL-1β;TNF-α
R392
A
2016-05-26
袁国华,E-mail:ghuayuan1996@yahoo.com;Tel:13990799112
10.3969/j.issn.1005-8982.2017.20.002
1005-8982(2017)20-0006-05

