D M T1在人胎盘绒毛膜癌细胞中表达的实验研究*
曹晓晓,李燕琴
(1.陕西省西安市健康教育所,陕西 西安 710004;2.西安交通大学医学部公共卫生学院,陕西 西安 710061)
D M T1在人胎盘绒毛膜癌细胞中表达的实验研究*
曹晓晓1,李燕琴2
(1.陕西省西安市健康教育所,陕西 西安 710004;2.西安交通大学医学部公共卫生学院,陕西 西安 710061)
目的进一步确定二价金属离子转运体1(DMT1)在人胎盘绒毛膜癌细胞(BeWo)中的表达定位,以及缺铁状态下mRNA的表达变化。方法采用免疫细胞化学技术观察DMT1在BeWo细胞中的表达定位,采用实时荧光定量聚合酶链反应检测DMT1在BeWo细胞缺铁状态下mRNA的表达变化。结果DMT1在BeWo细胞中呈阳性表达,其弥漫性表达定位于细胞质和细胞膜上;DMT1+IRE mRNA和DMT1-IRE mRNA的相对表达量随缺铁干预浓度和时间的增加而上调。DMT1+IRE mRNA的相对表达量高于DMT1-IRE mRNA。结论DMT1大量表达在BeWo细胞质和细胞膜上,且表达受机体不同铁水平的调节,说明其在胎盘铁转运过程中发挥重要作用,为进一步探讨胎盘铁转运分子机制提供实验基础。
铁缺乏;铁转运;BeWo细胞;DMT1
胎儿所有铁来自母体供给,母体通过胎盘向胎儿进行单向的、主动的铁转运。铁转运过程分为铁吸收、铁转运及铁输出3个阶段。细胞内铁转运过程即被还原酶还原的Fe2+从内吞小体内转运入胞浆,以及Fe2+在细胞内储存利用的过程。二价金属离子转运体1(divalent metal transporter 1,DMT1)是一种广泛表达的膜铁转运蛋白,其在细胞内铁转运过程中具有重要作用。目前其在胎盘的表达仍未定义清楚。本实验通过检测DMT1在BeWo细胞中的表达定位,以及不同缺铁状态下mRNA的表达变化,来阐明胎盘铁转运分子机制。
1 材料与方法
1.1 主要试剂与器材
人胎盘绒毛膜癌BeWo细胞(武汉大学细胞库),去铁胺(Desferoxamine,DFO)(美国Sigma公司),DMT1兔多克隆抗体(英国Abcam公司),山羊抗兔二抗试剂盒(美国Zymed公司SP系列),Revert AidTMFirst Strand cDNA Synthesis Kit反转录试剂盒、MaximaTMSYBRgreen Realtime PCR Master Mix购自美国Fermentas Life Sciences公司。图像采集系统Q550CW型(德国Leica公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪ABI Prism 7000 Seqμence Detection System(美国ABI公司)。引物设计与合成由北京三博远志技术有限责任公司完成。
1.2 免疫细胞化学染色
细胞在24孔板中爬片,用80%酒精固定和脱水,加0.1~0.3%Triton-100通透细胞膜,孵育封闭后逐滴加入浓度为1∶50的一抗试剂,过夜浸泡后逐滴加入二抗试剂。孵育、浸泡后用已二酸二丁酯染色。苏木素复染后,采用80%、90%和95%及无水酒精逐级脱水,并用二甲苯透明3次。封片采集图像。
1.3 DFO缺铁干预
BeWo细胞分为基线对照组、48h对照组、48h30μmol/L缺铁组、48h60μmol/L缺铁组、72 h对照组、72h30μmol/L缺铁组、72 h 60μmol/L缺铁组7组,进行不同浓度的DFO缺铁干预,并于0、48和72 h后收获细胞。
1.4 qRT-PCR
提取总RNA,每组进行总RNA纯度测定,检测每组总RNA的OD260/OD280nm吸光度比值(Ratio,R)。使用逆转录试剂盒逆转录反应合成cDNA。使用Lifeson Medical Tech Co,Ltd Two-Step qRT-PCR试剂盒构建PCR反应体系,进行熔解曲线和定量结果分析,所得Ct值进行函数运算得出2-△△Ct值。见表1。

表1 基因引物序列表
1.5 统计学方法
数据分析采用SPSS 13.0统计软件,计量资料以均数±标准差(±s)表示,组间比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 D M T1在BeW o细胞的表达定位
BeWo细胞系为贴壁细胞,生长周期为1周,呈团块状聚集生长。细胞形态呈不规则的多角形,细胞核大而圆,呈卵圆形,位于细胞质中央,状况良好的细胞质呈透明状。
本实验分为磷酸盐缓冲溶液(phosphate buffer saline,PBS)对照组、1∶100和1∶50抗体浓度组。PBS对照组细胞核经苏木素染色呈紫红色,细胞浆呈透明状,并无非特异性染色,阴性反应。1∶100与1∶50抗体浓度组相比,黄色阳性反应物染色较浅,两组阳性反应物染色均匀,在细胞上呈弥漫着色。从1∶100抗体浓度组可看出DMT1在BeWo细胞中呈阳性表达,大量表达于细胞质,并且推测在细胞膜上也有表达。见图1。
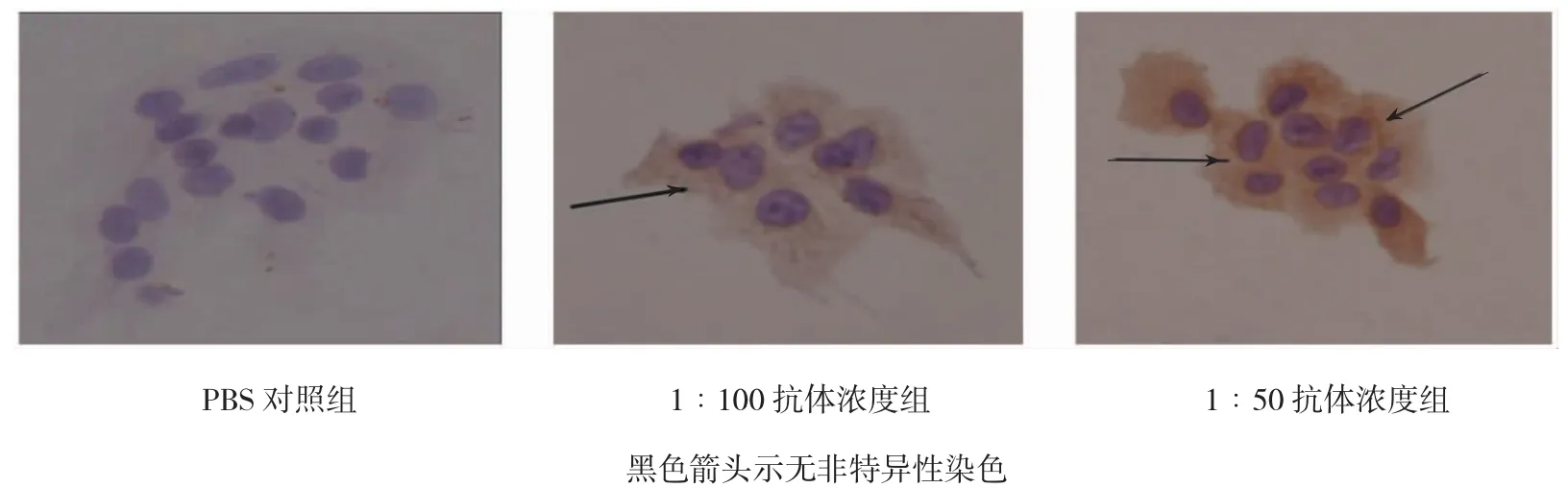
图1 DMT1蛋白的细胞表达定位(×400)
2.2 缺铁状态下BeWo细胞D MT1mRNA的表达变化
每组R值在1.8~2.0,总RNA纯度较好。48h30μmol/L缺铁组、48h60μmol/L缺铁组及72 h 60μmol/L缺铁组浓度高于其他组。总RNA浓度与各组细胞生长量及生长时间相关,整体上说BeWo细胞生长均匀一致。各组总RNA浓度整体较均匀,根据样品浓度计算使用体积。由于SYBRgreen I能与任意双链DNA结合后非特异地发出荧光,以及每个产物的解链温度不同,qRT-PCR结果显示,每个基因的扩增曲线平滑,以及熔解曲线为单峰型,说明胎盘DMT1基因的反应体系中无非特异性扩增,没有引物二聚体产生。见表2。
表2 各组细胞总R N A的R值和浓度比较 (±s)

表2 各组细胞总R N A的R值和浓度比较 (±s)
组别浓度/(ng /μ l)基线对照组 1 . 9 3 ± 0 . 1 3 5 4 6 . 0 ± 9 . 3 4 8 h对照组 1 . 9 1 ± 0 . 0 6 5 5 1 . 1 ± 4 . 6 4 8 h 3 0μ m o l / L缺铁组 1 . 9 3 ± 0 . 0 6 6 3 0 . 3 ± 1 5 . 0 4 8 h 6 0μ m o l / L缺铁组 1 . 9 4 ± 0 . 4 5 6 9 0 . 0 ± 1 2 . 0 7 2 h对照组 1 . 8 9 ± 0 . 0 5 4 9 7 . 0 ± 6 . 2 7 2 h 3 0μ m o l / L缺铁组 1 . 8 7 ± 0 . 0 2 6 2 7 . 7 ± 9 . 0 7 2 h 6 0μ m o l / L缺铁组 1 . 9 5 ± 0 . 0 2 5 2 7 . 8 ± 6 . 0 R值
BeWo细胞经过不同浓度DFO和不同时间的缺铁干预后,各组DMT1+IRE mRNA的相对表达量比较,经方差分析,差异有统计学意义(F=184.347,P= 0.001)。3个对照组相对表达量比较,经方差分析,差异无统计学意义(F=4.662,P=0.060),说明培养时间不会影响相对表达量的变化。48 h 3组相对表达量比较,经方差分析,差异无统计学意义(F=3.588,P=0.094)。72 h 3组比较,差异有统计学意义(F= 231.021,P=0.001);72 h两两比较经LSD-t检验,30μmol/L组与对照组相对表达量比较,差异有统计学意义(t=13.703,P=0.001),30μmol/L组相对表达量是对照组2.03倍;60μmol/L组与对照组相对表达量比较,差异比较有统计学意义(t=11.969,P= 0.001),60μmol/L组相对表达量是对照组5.05倍;60μmol/L组与30μmol/L组相对表达量比较,差异有统计学意义(t=9.104,P=0.001),60μmol/L组相对表达量是30μmol/L组的2.49倍。不同时间相同浓度相比,72 h 30μmol/L组与48 h 30μmol/L相对表达量比较,差异有统计学意义(t=10.203,P= 0.001),72 h组相对表达量是48 h组的1.52倍;72 h 60μmol/L组与48 h 60μmol/L组相对表达量比较,差异有统计学意义(t=14.817,P=0.001),72 h组相对表达量是48 h组的3.65倍。结果表明,DFO干预浓度和时间可以影响DMT1+IRE mRNA的相对表达量,DFO的干预浓度越高、时间越长,其DMT1+ IRE mRNA的相对表达量越高。见表3和图2。
表3 各组细胞D MT1+IRE和D MT1-IREmRNA表达的比较 (±s)

表3 各组细胞D MT1+IRE和D MT1-IREmRNA表达的比较 (±s)
组别D M T 1 -I R E m R N A基线对照组 1 . 0 0 0 ± 0 . 0 2 0 1 . 0 0 0 ± 0 . 0 2 1 4 8 h对照组 1 . 4 3 0 ± 0 . 2 9 8 0 . 7 2 7 ± 0 . 1 5 0 4 8 h 3 0μ m o l / L缺铁组 1 . 8 1 5 ± 0 . 1 5 4 1 . 5 0 7 ± 0 . 1 5 1 4 8 h 6 0μ m o l / L缺铁组 1 . 8 8 1 ± 0 . 1 9 0 1 . 3 6 7 ± 0 . 1 2 3 7 2 h对照组 1 . 3 6 0 ± 0 . 1 1 7 0 . 9 1 5 ± 0 . 2 5 0 7 2 h 3 0μ m o l / L缺铁组 2 . 7 5 8 ± 0 . 0 4 4 2 . 6 7 1 ± 0 . 0 8 4 7 2 h 6 0μ m o l / L缺铁组 6 . 8 6 7 ± 0 . 5 5 1 3 . 7 0 3 ± 0 . 2 4 4 D M T 1 + I R E m R N A

图2 各组D M T1+I R E m R N A的表达比较 (±s)
BeWo细胞经过不同浓度DFO和不同时间的缺铁干预后,各组DMT1-IRE mRNA的相对表达量比较,经方差分析,差异有统计学意义(F=131.854,P= 0.001)。3个对照组相对表达量比较,经方差分析,差异无统计学意义(F=2.061,P=0.209)。48 h 3组相对表达量比较,经方差分析,差异有统计学意义(F= 25.759,P=0.001);48 h两两比较经 LSD-t检验,30μmol/L组与对照组相对表达量比较,差异有统计学意义(t=4.490,P=0.011),30μmol/L组相对表达量是对照组的2.07倍;60μmol/L组与对照组相对表达量比较,差异有统计学意义(t=4.042,P=0.016),60μmol/L组相对表达量是对照组的 1.88倍;60μmol/L组与30μmol/L组相对表达量比较,差异无统计学意义(t=0.882,P=0.4284)。72 h 3组相对表达量比较,经方差分析,差异有统计学意义(F= 138.519,P=0.001);72 h两两比较经LSD-t检验,30μmol/L组与对照组相对表达量比较,差异有统计学意义(t=8.154,P=0.002),30μmol/L组相对表达量是对照组的2.92倍;60μmol/L组与对照组相对表达量比较,差异有统计学意义(t=9.766,P=0.001),60μmol/L组相对表达量是对照组的4.05倍;60μmol/L组与30μmol/L组相对表达量比较,差异有统计学意义(t=4.890,P=0.008),60μmol/L组相对表达量是30μmol/L组的1.39倍。不同时间相同浓度比较,72 h 30μmol/L组与48 h 30μmol/L组相对表达量比较,差异有统计学意义(t=11.673,P=0.001),72 h组相对表达量是48 h组的1.77倍。72 h 60μmol/L组与48 h 60μmol/L组相对表达量比较,差异有统计学意义(t=14.812,P=0.001),72 h组相对表达量是48 h组的2.71倍。证明DFO的干预浓度越高和时间越长,其DMT1-IRE mRNA的相对表达量越高。见表3和图3、4。

图3 各组D M T1-I R E m R N A的表达比较 (±s)
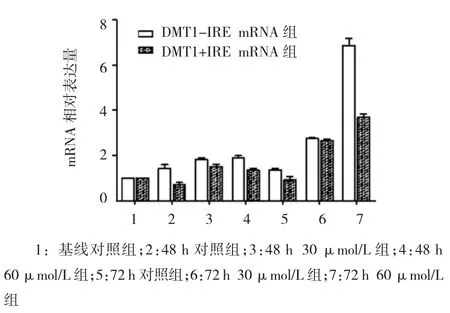
图4 各组D M T1-I R E和D M T1+I R E m R N A的表达比较(±s)
3 讨论
妊娠期孕妇铁缺乏和缺铁性贫血患病率分别为46.44%和19.94%,并随孕周增加而升高[1]。孕期缺铁时,母体血液透过胎盘屏障向胎儿血液最大限度地转运铁,防止胎儿患缺铁性贫血及贫血导致的相关疾病[2-4]。合体滋养层细胞(syncytiotrophoblast,STB)基底膜与胎儿血循环紧挨,顶部STB细胞膜与母体血循环接触,在物质交换中具非常重要作用,BeWo细胞在形态及分泌等特性上与STB细胞相似,性质均一并易于传代。
胎盘铁转运包括3个过程:①铁吸收,即铁从母体血浆转运入胎盘屏障最外层STB母体面顶端的过程;②铁细胞内转运,即被还原酶还原的Fe2+从内吞小体内转运入胞浆,以及Fe2+在细胞内的储存利用的过程;③铁输出,即Fe2+穿过STB细胞的基底膜并转运入胎儿血循环的过程。DMT1目前是Fe2+从STB细胞内吞小体内转入胞浆最好的假说。DMT1基因定位于第12条染色体,含43 999 kb,长4 142 bp,能编码2种mRNA:+IRE和-IRE。DMT1+IRE mRNA在3'端非翻译区有1个铁调节元件IRE(含有30个核苷酸,呈氢环状结构),DMT1-IRE则不含有[5]。DMT1蛋白的第4跨膜结构域具有维持DMT1转运Fe2+等金属离子活性的重要作用。
本实验观察到DMT1弥漫性地表达于BeWo细胞,阳性反应物在BeWo细胞均匀着色,表明DMT1表达于BeWo细胞质和细胞膜上,揭示胎盘DMT1在母体向胎儿铁转运机制中的作用。DMT1广泛表达在哺乳类动物的各个组织,2种亚型具有组织细胞分布特异性及亚细胞特异性。有研究表明,DMT1表达在细胞质[6-7];还有研究表明,DMT1表达在STB细胞的细胞浆内和基底膜上[8-9],在铁释放和透过细胞膜转入细胞质中起重要的作用。但BASTIN等[10]研究结果显示,其在STB细胞不间断、连续地表达,并且在基质细胞中也有表达,与本实验结果相同。由此推断,一方面表达DMT1的部分母体面STB细胞顶部膜凹陷为内吞小体,在内吞小体内Fe3+由还原酶还原为Fe2+后,Fe2+可通过DMT1穿过细胞膜进入细胞质,Fe2+在STB细胞胞浆中主要以铁蛋白形式贮存,进入胞浆后,铁或以铁蛋白的形式贮存、或参与生物合成或被转出细胞;另一方面,受细胞外铁浓度的影响,当细胞外铁吸收增多时,30%左右与Fe2+结合的DMT1出现内化后以囊泡的形式游离在细胞质中,含铁的囊泡在细胞质中从STB细胞顶部膜上,向基底膜转运铁,随后在基底膜附近Fe2+从囊泡中释放出去,最后DMT1内化的囊泡再重新返回母体面STB细胞顶部膜,参与细胞质中铁的转运。
本实验对BeWo细胞进行DFO干预使细胞处于缺铁状态时,DMT1+IRE mRNA相对表达量升高。DMT1的表达受多种影响因素调控,包括酸碱度值、炎症介质、铁调素、蛋白激酶C、生长发育等,主要受机体不同铁水平的调节。机体缺铁时小肠组织DMT1+ IRE mRNA表达升高[11],肝脏组织和宫颈癌细胞等表达是否受机体铁水平调控研究结果不一致[12]。本实验结果揭示,DMT1+IRE型受铁反应元件——铁调控蛋白机制(iron regulatory element-iron regulatory proteins,IRE/IRPs)的调节,属于转录后水平上的调控,与CORNOCK等[13]动物实验缺铁时,DMT1+ IRE mRNA相对表达量提高结果一致。由此可推断当BeWo细胞处于缺铁状态时,IRPs与IRE结构域紧密结合在一起,从而增强DMT1+IRE mRNA编码蛋白的稳定表达,防止翻译过程中内切酶的降解作用,最终增加DMT1蛋白的表达。目前关于DMT1-IRE mRNA的研究还很少,一般认为其不含有IRE结构,因此不受IRE-IRPs机制的调节。本实验结果显示,DMT1-IRE mRNA的相对表达量随DFO干预的时间和浓度上调,可能存在未知的调节机制,但是其调控能力不及IRPs/IRE调控机制。
胎盘DMT1除受转录水平的调控外,还受翻译水平的调控,应进一步采用Western blot检测蛋白的表达变化,对胎盘DMT1的调节机制进行更为深入的研究。
[1]宁书芬.妊娠期铁缺乏和缺铁性贫血发病情况的临床调查及预防性补铁时机的研究[D].石家庄:河北医科大学,2015:1-2.
[2]GAOg,LIU S Y,WANG H J,et al.Effects of pregnancy and lactation on iron metabolism in rats[J].Biomed Research Int ernational,2015,12(16):105325-105334.
[3]丽丽.妊娠期缺铁性贫血与新生儿体重、早产的关系[D].南宁:广西医科大学,2015:15-21.
[4]郝文静.中国大陆妊娠期贫血发病因素与围产结局的调查与分析[D].北京:首都医科大学,2016:30-34.
[5]STEVEN L Y T,PHILIPPEg.Distinct targeting and recycling properties of two isoforms of the iron transporter DMT1 (NRAMP2,Slc11A2)[J].Biochemistry,2006,45(7):2294-2301.
[6]KARI A D,JAMES R C.Iron uptake and transport across physiological barriers[J].Biometals,2016,29:573-591.
[7]WANGg,SHAO A,HU W,et al.Changes of ferrous iron and its transporters after intracerebral hemorrhage in rats[J].Interna tional Journal of Experimental Pathology,2015,8(9):10671-10679.
[8]GEORGIEFF M K,WOBKEN J K,WELLE J,et al.Identification and localization of divalent metal transporter-1 (DMT-1)in term human placenta[J].Placenta,2000,21(8):799-804.
[9]SHIMONO A,IMOTO A,SAKAMOTO H,et al.An immunohistochemicalstudy ofplacentalsyncytiotrophoblasts in neonatal hemochromatosis[J].Placenta,2016,12(48):49-55.
[10]BASTIN J,DRAKESMITH H,REES M,et al.Localisation of proteins of iron metabolism in the human placenta and liver[J]. British Journal of Haematology,2006,134(5):532-543.
[11]SHAWKI A,ANTHONY S R,NOSE Y,et al.Intestinal DMT1 is critical for iron absorption in the mouse but is not required for the absorption of copper or manganese[J].American Journal of Physiologygastrointest Liver Physiol,2015,309(8):635-647.
[12]HUBERT N,HENTZE M W.Previously uncharacterized isoforms of divalent metal transporter (DMT)-1:implications for regulation and cellular function[J].Proceedings of the National Academy of Sciences of the United States of America,2002,99(19):12345-12350.
[13]CORNOCK R,GAMBLING L,LANGLEY-EVANS S C,et al. The effect of feeding a low iron diet prior to and duringgesta tion on fetal and maternal iron homeostasis in two strains of rat[J].Reproductive Biology and Endocrinology,2013,5(1):2-9.
(童颖丹 编辑)
Expression of divalent metal transporter 1 in BeWo cells*
Xiao-xiao Cao1,Yan-qin Li2
(1.Xi'an Institute for Health Education,Xi'an,Shaanxi 710004,China;2.Department of Public Health,Medical School of Xi'an Jiaotong University,Xi'an,Shaanxi 710061,China)
ObjectiveTo further determine the positioning and the mRNA expression changes of divalent metal transporter 1 (DMT1)under iron deficiency conditions in human placental choriocarcinoma BeWo cells.MethodsAdopting immunocytochemical technique,the localization of DMT1 in BeWo cells was detected.RNA of the cells was extracted,and detected the changes of DMT1+IRE mRNA and DMT1-IRE mRNA using qRT-PCR.MethodsDMT1 waspositivelyexpressed in BeWocells,and distributed in cytoplasm and membrane.TheexpressionsofDMT1+IRE andDMT1-IRE mRNAsraisedwiththeincreaseofdrug concentration and time of iron deficiency treatment.The relative expression level of DMT1+IRE mRNA was significantly higher than that of DMT1-IRE mRNA.ConclusionsDMT1 is abundantly expressed in the cytoplasm and cell membrane of BeWo cells and regulated by the body's iron levels,suggesting that DMT1 plays an important role during the iron transfer process in the placenta,which provides an experimental basis for the study of molecular mechanism of placental iron transport.
iron deficiency;iron transport;BeWo cell;divalent metal transporter 1
R181.24
A
2016-10-24
国家自然科学基金(No:30800909)
李燕琴,E-mail:741213252@qq.com;Tel:15353556592
10.3969/j.issn.1005-8982.2017.20.005
1005-8982(2017)20-0021-05

