不同比例激活剂对富血小板凝胶的生物学影响*
戴静,陈建苏,招志毅
[1.广西省柳州市工人医院 眼科,广西 柳州 545005;2.暨南大学医学院 眼科研究室(再生医学教育部重点实验室),广东 广州 510632]
不同比例激活剂对富血小板凝胶的生物学影响*
戴静1,陈建苏2,招志毅1
[1.广西省柳州市工人医院 眼科,广西 柳州 545005;2.暨南大学医学院 眼科研究室(再生医学教育部重点实验室),广东 广州 510632]
目的比较不同比例激活剂对富血小板凝胶的生物学影响,研究其用于角膜基质再生的可行性。方法抽取兔全血,经二次离心法制备富血小板血浆(PRP),将PRP与激活剂按不同比例激活,制备PRP凝胶。实验分为3个实验组,分别为9∶1组(PRP∶激活剂=9∶1)、11∶1组(PRP∶激活剂=11∶1)及5∶1组(PRP∶激活剂=5∶1)。将兔角膜基质细胞与PRP凝胶共同培养,进行组织形态学观察,用细胞增殖-毒性检测试剂盒法,分别检测3个实验组PRP凝胶释放的复合生长因子促角膜基质细胞的增殖作用。对不同实验组制备的PRP凝胶与双层猪角膜基质进行黏附性观察。结果9∶1组制备的PRP凝胶促进兔角膜基质细胞的增殖和活化作用强于其他实验组。3个实验组中,只有9∶1组制备的PRP凝胶苏木精-伊红染色法染色结果显示,呈有序的网状支架结构,能紧密黏附并固定双层猪角膜基质。结论PRP与激活剂以9∶1比例制备的PRP凝胶促角膜基质细胞增殖作用最强,同时具有有序网状结构和良好的组织黏附性及相容性,是一种可以用于角膜基质再生的良好支架。
激活剂;富血小板凝胶;角膜基质;
富血小板血浆(platelet-rich plasma,PRP)是一种全血提取后获得的血小板浓缩物,PRP与激活剂按一定比例激活后,就可得到PRP凝胶。PRP凝胶制备方法中,多种因素都可能影响其生物效应的发挥,而不同激活剂及其比例的选择对PRP凝胶促组织再生有非常重要的作用[1-2]。本文通过PRP与凝血酶激活剂按不同比例激活,制备PRP凝胶,比较不同比例的激活剂对富血小板凝胶生物学影响的差异,得出促进角膜基质再生所需激活剂的最佳比例,为临床治疗提供理论依据。
1 材料与方法
1.1 试剂及仪器
Ⅱ型胶原蛋白酶、胰蛋白酶、凝血酶购自美国Sigma公司,胎牛血清(fetal bovine serum,FBS)、细胞培养基 (dulbecco'smodified eaglemedium,DMEM)购自美国Gibico公司,活细胞计数法试剂盒(cell counting kit-8,CCK-8)(日本同仁化学研究所),多功能酶标仪(奥地利Tzcan公司),倒置显微镜(德国Leica公司),3111型二氧化碳CO2培养箱、置入-80℃冰箱冷冻保存备用,购自美国Forma公司,Universal 32R型低温离心机(德国Hettich公司)。
1.2 方法
1.2.1 激活剂的配制 分别取1 000 u凝血酶,0.25g 10%氯化钙溶于2.5 ml磷酸盐缓冲溶液(phosphate buffer saline,PBS)中制成100g/L氯化钙与400 u/ml凝血酶的血小板血浆激活剂,0.22μm滤器过滤后离心管(eppendorf,EP)分装,置入-20℃冰箱冷冻保存备用。
1.2.2 分组及不同组别PRP复合生长因子、兔富血小板凝胶的制备 采用改良Curasan法二次离心制备富血小板血浆[3]。取100μl制备好的PRP与血小板血浆激活剂分别按9∶1、11∶1及5∶1的比例混合,从而分为3个不同实验组,分别为9∶1组(PRP∶激活剂=9∶1)、11∶1组(PRP∶激活剂=11∶1)及5∶1组(PRP∶激活剂=11∶1)。混合激活后可形成胶冻状物,得到3个不同实验组的兔PRP凝胶。分别将上述3个实验组制备的兔PRP凝胶放置于4℃冰箱24 h,4℃、5 000 r/min离心20 min。分别吸取析出的上清液,经0.22μm滤膜过滤后分装,得到3个不同实验组的兔PRP凝胶释放的复合生长因子萃取液。
1.2.3 CCK-8法 CCK-8法检测不同比例激活剂制备的PRP复合生长因子对兔角膜基质细胞增殖的影响。采用胶原蛋白酶消化法获取第3代兔角膜基质细胞,以胰蛋白酶消化后,用含10%FBS的DMEM培养液制成10×103个/ml密度的兔角膜基质细胞悬液,以100μl/孔接种在96孔板中,在5% CO2、37℃恒温培养箱内孵育过夜后,弃原培养液,用无血清DMEM液洗涤2次,加入新的培养液[4]。根据加入新细胞培养液的不同分为4组:将3个不同实验组的PRP复合因子萃取液用无血清DMEM配制成含5.0%兔PRP复合因子培养液的9∶1实验组、11∶1实验组及5∶1实验组,对照组培养液为未加入任何PRP复合因子的无血清DMEM液。每组制备25孔,分别加入100μl/孔各自组的培养液,分别在培养第2、3、5、7和8天后,每组选取5孔加入10μl CCK-8,5%CO2、37℃恒温培养箱内培养2 h。用酶标仪测定 450 nm波长处的吸光度(optical density,OD),求出各组吸光度的平均值。
1.2.4 生物角膜基质支架 采用胶原蛋白酶消化法培养获得的第3代兔角膜基质细胞,以胰蛋白酶消化后,用含10%FBS的DMEM培养液制成5×105个/ml密度的兔角膜基质细胞悬液40μl,分别接种于3个不同实验组的富血小板凝胶上,于5%CO2、37℃恒温培养箱内培养24 h后,弃去培养基,分别在已贴壁细胞表面覆盖前步制备的3个不同实验组的富血小板凝胶,于5%CO2、37℃恒温培养箱内培养24 h,倒置显微镜下观察细胞的生长状况和形态变化,并拍照记录。取培养48 h后的标本,4%多聚甲醛固定,石蜡包埋、切片,苏木精-伊红(hematoxylin-eosin,HE)染色。
1.2.5 双层猪角膜基质的黏附 从屠宰场猪尸体上获取新鲜猪眼球,用剪刀水平剪出全厚角膜片,解剖显微镜下撕去上皮层和后弹力层,环钻钻取并分离中央直径约7 mm大小的角膜板层基质片,深度约为角膜基质厚度的1/2,在基质片上加入120μl兔PRP,分别以不同比例加入激活剂激活得到兔富血小板凝胶,根据实验组中制备凝胶的激活剂比例不同,分为9∶1组、11∶1组及5∶1组;在不同实验组凝胶表面覆盖一层直径约7 mm大小的猪角膜基质片,于5%CO2、37℃恒温培养箱内静置过夜。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,不同培养时间各组细胞增生率的比较用重复测量设计的方差分析,4组总体比较用两因素方差分析,两两比较用Bonferronit检验,P<0.05为差异有统计学意义。
2 结果
2.1 兔PR P凝胶释放的复合生长因子对细胞增殖的影响
5∶1组、11∶1组及9∶1组与对照组在培养2、3、5、6和8 d后OD值比较,采用重复测量设计的方差分析,结果:①不同时间OD值比较,差异有统计学意义(F=819.016,P=0.000);②各实验组与对照组的OD值比较,差异有统计学意义(F=268.002,P=0.000),4组间两两比较,9∶1组与对照组、5∶1组、11∶1组比较,经Bonferronit检验,差异有统计学意义(P<0.05);与对照组比较,各实验组吸光度增加速度较快,而9∶1组吸光度增加速度高于其他各组,相对促角膜基质细胞增殖作用最强;③各实验组与对照组的OD值变化趋势比较,差异有统计学意义(F=103.599,P=0.000)。见图1和附表。
2.2 富血小板凝胶作为生物角膜基质支架
PRP与血小板血浆激活剂分别按9∶1、11∶1及5∶1的比例混合后都可以迅速形成透明胶冻状的富血小板凝胶。倒置显微镜下观察发现,兔角膜基质细胞在这3个实验组制备的富血小板凝胶上附着良好,培养24 h后即可见细胞呈梭形及多角形长入凝胶内。但9∶1组培养24 h的角膜基质细胞即可达50%融合,而5∶1组和11∶1组细胞数目少于9∶1实验组(见图2)。石蜡切片HE染色结果发现,只有9∶1组制备的富血小板凝胶内见大量的纤维素,纤维素之间交织形成多孔有序的网状支架结构,与正常角膜基质胶原纤维排列结构极为相似,可作为组织工程角膜基质支架。9∶1组的富血小板凝胶内培养48 h后,兔角膜基质细胞可在凝胶形成纤维网状支架结构中黏附并生长良好,在两层凝胶之间形成典型复层细胞(见图3A)。而5∶1组和11∶1组制备的PRP凝胶不能形成多孔有序的网状支架结构,而且角膜基质细胞接种在5∶1组和11∶1组的富血小板凝胶内培养48 h后,呈单层细胞生长,不能长入凝胶内(见图3B)。
2.3 富血浆凝胶作为角膜黏附剂
大体观察时,9∶1组制备富血小板凝胶作为黏附剂进行双层猪角膜基质黏附时,呈透明果冻状,能起到很好的固定黏附效果,形成稳定规则的猪角膜基质/兔富血小板凝胶/猪角膜基质复合体的形状(见图4)。而11∶1组、5∶1组的富血小板凝胶虽然透明,但不能形成规则的固体的果冻形状,而且与猪角膜基质未能紧密黏附,不能形成猪角膜基质/兔富血小板凝胶/猪角膜基质复合体。
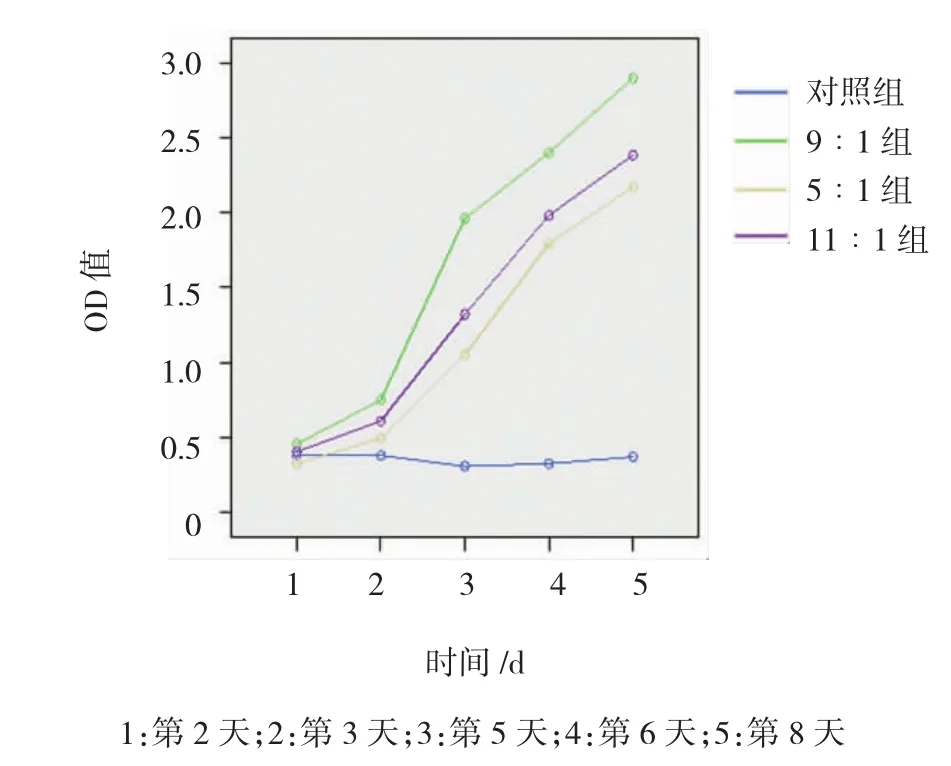
图1 各组培养兔角膜基质细胞O D值的变化趋势
附表 PR P复合生长因子培养兔角膜基质细胞不同时间的O D值比较 (±s)
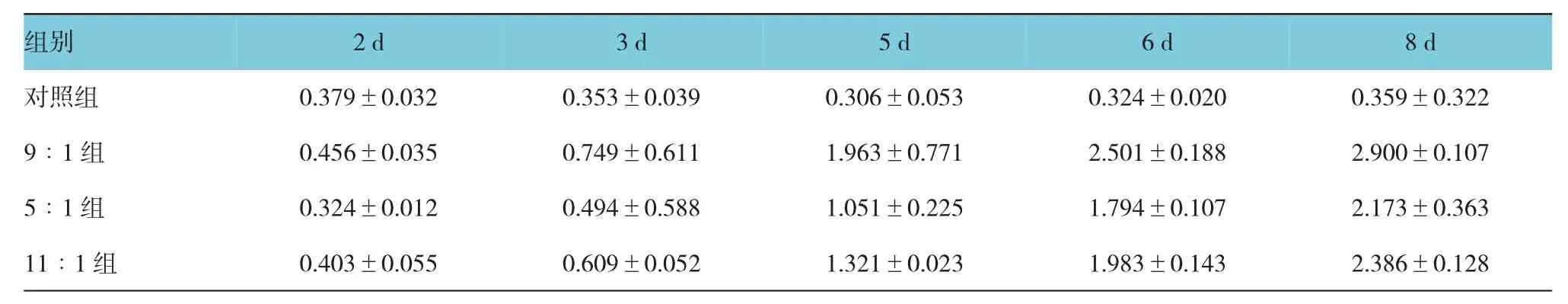
附表 PR P复合生长因子培养兔角膜基质细胞不同时间的O D值比较 (±s)
组别8 d对照组 0.379±0.032 0.353±0.039 0.306±0.053 0.324±0.020 0.359±0.322 9∶1组 0.456±0.035 0.749±0.611 1.963±0.771 2.501±0.188 2.900±0.107 5∶1组 0.324±0.012 0.494±0.588 1.051±0.225 1.794±0.107 2.173±0.363 11∶1组 0.403±0.055 0.609±0.052 1.321±0.023 1.983±0.143 2.386±0.1282 d3 d5 d6 d
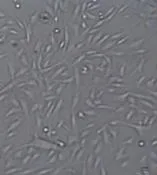
图2 9∶1组富血小板凝胶培养24 h后的细胞形态(倒置显微镜×100)
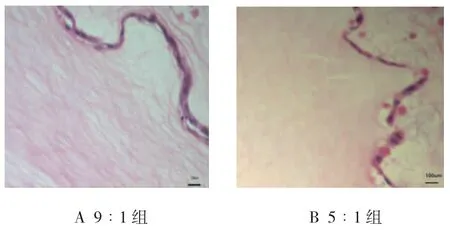
图3 两组富血小板凝胶 (HE×200)
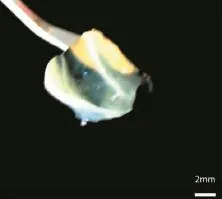
图4 富血浆凝胶作为角膜黏附剂
3 讨论
PRP是一种全血经离心提取后获得的血小板浓缩物,富血小板血浆与凝血酶等激活剂混匀激活后形成透明胶冻状物质,即富血小板凝胶。在其激活过程中,分泌多种高浓度细胞生长因子,如血小板衍生因子、转化生长因子-β、乙烯基酯树脂鳞片胶泥、胰岛素样生长因子及表皮细胞生长因子等,为PRP复合生长因子,该生长因子能有效地促进细胞及组织修复[5]。此外,富血小板凝胶内纤维素之间交织形成多孔有序的网状支架结构,为细胞及组织修复提供良好的支架。目前,PRP凝胶被广泛的应用到组织工程领域。大量研究证实,PRP凝胶在临床上的应用取得良好的效果[6-8]。研究发现,PRP和PRP凝胶在眼科方面也得到一定程度的应用,在治疗角膜病、眼烧伤及干眼症等眼部疾病方面有良好的临床效果,并广泛用于角膜组织工程再生的研究[9-10]。
随着PRP和PRP凝胶在各领域的广泛应用,富血小板血浆凝胶的制备方法逐渐多元化,并无统一标准。而PRP凝胶制备方法中多种因素都可能影响其生物效应的发挥,所以针对不同的实验和临床用途需根据自身的需求不同,而确定其最佳的制备方法。研究发现,制备方法中激活剂比例的选择对PRP凝胶促组织修复再生有非常重要的作用。目前多数研究者常用的激活剂为牛凝血酶和氯化钙的混合物(100g/L氯化钙与400 u/ml凝血酶)[11]。制备PRP凝胶时,如果激活剂与血小板血浆选择的比例不同,激活后制备的富血小板血浆凝胶释放的各种生长因子的浓度、速度、比例及生长因子随时间变化规律也大不相同。此外,制备的富血小板血浆凝胶各种成分比例不同,必然影响其组织结构及功能,从而影响其生物学效应的发挥。因此针对富血小板血浆凝胶用于角膜基质修复再生的可行性研究,需要比较选择不同比例的激活剂制备的PRP凝胶对角膜基质生物学效应的影响的差异,得出促进角膜基质再生所需激活剂与血小板血浆的最佳配比,为临床治疗提供理论依据。
笔者参考国内外学者的研究成果,采用改良Curasan法二次离心制备富血小板血浆,1 100g/L氯化钙与400 u/ml凝血酶的混合物作为激活剂。使用PRP与凝血酶激活剂分别按9∶1、11∶1、5∶1的比例混合,分成3个组,激活制备的PRP复合生长因子及PRP凝胶,比较不同比例激活剂制备的PRP凝胶用于角膜基质修复再生的可行性。
笔者先研究各组兔PRP凝胶释放的PRP复合生长因子对兔角膜基质细胞增殖的影响。结果显示,与对照组相比,3组制备的PRP复合生长因子均能促进细胞增殖,但9∶1组促角膜基质细胞增殖作用高于其他组。可见血小板血浆与激活剂配比为9∶1时,激活后所得的富血小板血浆凝胶中,各种生长因子的浓度为对角膜基质细胞的增殖作用最强,为最适刺激比例。本实验采用不同比例激活剂制备各组的PRP凝胶,并作为载体与角膜基质细胞联合培养重建角膜基质层,观察细胞生长情况及构建的效果。HE染色结果发现,只有9∶1组制备的富血小板凝胶内见大量的纤维素交织形成多孔有序的网状支架结构,兔角膜基质细胞可在凝胶形成纤维网状支架结构中黏附并生长良好,在两层凝胶间形成典型复层细胞。而5∶1组和11∶1组制备的PRP凝胶不能形成多孔有序的网状支架结构,而且角膜基质细胞接种在5∶1组和11∶1组的富血小板凝胶内培养48 h后不呈复层细胞生长,不能长入凝胶内,说明9∶1组制备的PRP凝胶与其他组制备的PRP凝胶比较,既能形成与正常角膜基质结构相似有序的纤维网状支架结构,作为生物细胞支架又能更有效地促角膜基质细胞增殖分化,具有良好生物相容性。提示血小板血浆与激活剂配比为9∶1时,激活后所得的富血小板血浆凝胶未来能够运用于角膜基质组织工程再生的研究。本实验对不同比例激活剂制备的兔富血小板凝胶作为黏附剂,进行双层猪角膜基质黏附实验时发现,9∶1组制备的富血小板凝胶呈透明果冻状,能形成稳定规则的猪角膜基质/兔富血小板凝胶/猪角膜基质复合体的形状。而11∶1组和5∶1组的富血小板凝胶虽然透明,但是未能与猪角膜基质紧密黏附形成复合体,说明PRP与激活剂以合适的比例(9∶1)激活制备的富血小板凝胶具有良好的透明性,与异体角膜间具有良好的组织黏附性及相容性。
本实验结果提示,与其他组比较,9∶1组制备的PRP凝胶释放的复合生长因子能最有效地促进角膜基质细胞增殖,而且制备的凝胶能够作为生物细胞支架构建角膜基质层,并具有良好的生物相容性及黏附性。从而说明血小板血浆与激活剂配比为9∶1时制备的PRP凝胶是一种既能黏附又能促进角膜损伤快速修复,而且还是一种接近生理状态的天然生物材料,适合用于组织工程角膜基质层的制备,具有良好的应用前景。因此,制备PRP凝胶时,血小板血浆与激活剂配比为9∶1是治疗眼表疾病及角膜基质组织工程再生的最佳比例。
[1]LACOSTE E,MARTINEAU I,GAGNONg.Platelet concentrates:effects of calcium and thrombin on endothelial cell proliferation andgrowth factor release[J].J Periodontol,2003,74(10):1498-1507.
[2]HARRISON S,VAVKEN P,KEVY S,et al.Platelet activation by collagen provides sustained release of anabolic cytokines[J]. Am J Sports Med,2011,39(4):729-734.
[3]戴静,陈建苏,招志毅,等.富血小板凝胶对角膜基质生物学功能的影响[J].眼科新进展,2013,33(8):705-708.
[4]戴静,陈建苏,李晓霞,等.自体血小板血浆对角膜基质细胞生物学功能的影响[J].眼科新进展,2010,30(8):705-708.
[5]SCHAR M O,DIAZ-ROMERO J,KOHL S,et al.Platelet-rich concentrates differentially releasegrowth factors and induce cell migration in vitro[J].Clin Orthop Relat Res,2015,473(5):1635-1643.
[6]GRIFFIN J W,HADEED M M,WERNER B C,et al.Plateletrich plasma in meniscal repair:does augmentation improve surgical outcomes[J].Clin Orthop Relat Res,2015,473(5):1665-1672.
[7]ANDIA I,RUBIO-AZPEITIA E,MAFFULLI N.Platelet-rich plasma modulates the secretion of inflammatory/angiogenic proteins by inflamed tenocytes[J].Clin Orthop Relat Res,2015,473(5):1624-1634.
[8]SAKATA R,MCNARY S M,MIYATAKE K,et al.Stimulation of the superficial zone protein and lubrication in the articular cartilage by human platelet-rich plasma[J].Am J Sports Med,2015, 43(6):1467-1473.
[9]ALIO J L,ABAD M,ARTOLA A,et al.Use of autologous platelet-rich plasma in the treatment of dormant corneal ulcers[J]. Ophthalmology,2007,114(7):1286-1293.
[10]LUENGOg F,GATTO S C,CROXATTO J O,et al.In vivo lamellar keratoplasty using platelet-rich plasma as a bioadhesive[J]. Eye(Lond),2010,24(2):368-375.
[11]JAKSE N,TANGL S,GILLI R,et al.Influence of PRP on autogenous sinusgrafts.An experimental study on sheep[J].Clin Oral Implants Res,2003,14(5):578-583.
(童颖丹 编辑)
Effect of different proportions of activators on biological functions of platelet-richgel*
Jing Dai1,Jian-su Chen2,Zhi-yi Zhao1
(1.Department of Ophthalmology,Liuzhou Worker's Hospital,Liuzhou,Guangxi 545005,China; 2.Research Room of Ophthalmology,Key Laboratory of Regenerative Medicine of Ministry of Education,Jinan University,Guangzhou,Guangdong 510632,China)
ObjectiveTo compare the effect of different proportions of activators on the biological function of platelet-richgel and to reaserch the feasibility for the reconstruction of corneal stroma.MethodsRabbit blood was extracted and platelet-rich plasma(PRP)was prepared by two-step centrifugation.Platelet-richgels were prepared by activation of PRP with thrombin activators in different proportions and divided into threegroups.There weregroup 9:1 (PRP:activators=9:1),group 11:1 (PRP:activators=11:1)andgroup 5:1 (PRP:activators=5:1).The rabbit keratocytes were seperately co-cultured with the three platelet-richgels and the morphological features were observed.CCK-8 assay was used to analyze the influences of compositegrowth factors released from the platelet-richgel on the proliferation of rabbit keratocytes in the threegroups. The adhesive properties of the three platelet-richgels were evaluated after adhesion to the double-layer porcine corneal stroma.MethodsThe platelet-richgel of thegroup 9:1 had better effect on promoting cell proliferation than those of other twogroups.HE staining displayed that only the platelet-richgel prepared in thegroup 9:1 formed an orderly network scaffold that could closely attach to the double-layer porcine corneal stroma.ConclusionsThe platelet-richgel,prepared by combining PRP with activators in 9:1 proportion,caneffectively promote the proliferation of keratocytes,and has the nature of orderly network structure,effective adhesiveness and favorable biocompatibility.These properties indicate that the platelet-richgel prepared by combining PRP with activators in 9:1 proportion is an excellent scaffold for the reconstruction of corneal stroma.
activator;platelet-richgel;corneal stroma
R318.08
A
2016-09-26
国家自然科学基金(No:30973244)
陈建苏,E-mail:chenjiansu2000@163.com
10.3969/j.issn.1005-8982.2017.20.004
1005-8982(2017)20-0016-05

