缺氧预处理携带肝细胞生长因子的骨髓干细胞对急性心梗大鼠心功能的影响
江金锋 林修 蔡文钦 苏津自 王芬珍
基础研究
缺氧预处理携带肝细胞生长因子的骨髓干细胞对急性心梗大鼠心功能的影响
江金锋 林修 蔡文钦 苏津自 王芬珍
目的 探讨缺氧预处理携带肝细胞生长因子(HGF)基因的骨髓间充质干细胞(MSCs)对急性心梗大鼠心功能及心肌胶原合成的影响。方法 通过结扎冠状动脉左前降支制作SD大鼠急性心肌梗死模型。随机分为5组:对照组、假手术组、心梗组、MSCs组和MSCs-HGF组。移植后4周心彩超测定大鼠心功能;HE染色观察心肌组织结构;天狼星红染色测心肌组织胶原;PCR法测心肌HGFmRNA表达;免疫印迹检测心肌HGF蛋白表达;ELISA法测心肌组织胶原Ⅰ、Ⅲ含量。结果 与心梗组相比,MSCs-HGF组左室射血分数(LVEF)明显好转[(75.42±7.82)%比(66.36±8.55)%,P<0.01]。PCR 与 Western-bloting结果示,MSCs-HGF组心肌组织HGF mRNA及蛋白表达显著增加,其他各组均未见到表达;HE染色显示心梗组心肌细胞减少,可见大量增生组织;MSCs-HGF组心肌细胞较为完整,间隙仅见少量增生组织。天狼星红染色显示心梗组有大量红染纤维,MSCs-HGF组仅可见细束状红染纤维。ELISA结果显示,与心梗组相比,MSCs-HGF组心肌组织胶原Ⅰ含量[(450±12)pg/ml比(523±13)pg/ml,P<0.05]、组织胶原Ⅲ含量[(870±14)pg/ml比(1080±25)pg/ml,P<0.05]均明显著降低。结论 缺氧预处理携带HGF基因的MSCs改善心梗大鼠心功能可能与其抑制心梗后心肌纤维化有关。
骨髓间充质干细胞; 肝细胞生长因子; 心功能; 胶原Ⅰ、Ⅲ
心肌梗死是心血管常见病、多发病,严重威胁患者的身心健康。心肌梗死发生后容易引起严重的心力衰竭及死亡。目前主要通过急诊介入及溶栓来治疗急性心肌梗死,然而介入治疗有创伤,药物治疗不能促进大部分心肌的修复。干细胞在细胞修复和再生方面极具潜力,因此干细胞治疗成为目前研究的热点。骨髓间充质干细胞(mesenchymal stem cells,MSCs)来源广泛,具有多能分化及自我更新的能力,因此成为心肌组织工程的种子细胞[1,2]。然而研究[3,4]发现,MSCs移植到急性心肌梗死的大鼠,大部分细胞因环境不适而死亡,治疗效果不佳,因此提高MSCs在移植区的成活率成为目前研究的热点。肝细胞生长因子(hepatocyte growth factor,HGF)与其受体c-met结合后,激活细胞内多个信号通路,参与调节机体的发育、分化、代谢和组织修复[5-7],因此HGF基因转染MSCs能提高细胞在心梗区域的再生能力。本课题组前期细胞体外实验[8]已证实,携带HGF基因MSCs能减少在缺血、缺氧情况下凋亡及提高细胞迁移力。本研究通过观察缺氧预处理携带HGF基因的MSCs对急性心梗大鼠心功能及心肌胶原合成作用,探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 10周龄雄性SD大鼠40只,体重(250±10)g。饲养条件:4 只/笼,室温(22±2)℃,湿度(55±5)%,人工光照明暗各 12 h/d,24 h自由取食和饮水,饲料由上海斯莱克公司提供。本次动物试验经福建医科大学实验动物伦理委员会批准。
1.1.2 试剂 Ad-HGF-EGFP质粒载体(福建省高血压研究所制备),Trizol(Invitrogen公司),逆转录试剂盒(Takara公司),real-timePCR试剂盒(Takara公司),β-actin单克隆抗体、胎牛血清、DMEM培养基、胰蛋白酶(Gibco),HRP标记二抗(北京中杉公司),丙烯酰胺、Tris-base(Ameresco),PVDF 膜(millipore公司),免疫印迹化学发光试剂(Santa Cruz公司),引物设计、合成由大连宝生物公司完成。ELISA 试剂盒(BioSource International,Inc.)。
1.2.3 仪器 低温冰箱(海尔,中国青岛),超速低温离心机(Allegra TM64R,Beckman),超净台(苏州苏净集团)垂直电泳槽(BIO-RAD公司),DYY-Ⅲ-6B型稳压稳流电泳仪(北京六一仪器厂),荧光倒置相差显微镜(Ⅸ-70型,Olympus公司),蛋白转移设备(北京六一仪器厂),混合气体(福州林德气体公司提供)。
1.2 实验方法
1.2.1 MSCs的原代及传代培养、HGF基因转染梯度离心法收集SD大鼠股骨骨髓MSCs,进行分离及传代培养。取3~5代且生长良好的MSCs进行基因转染等实验。本课题组保存有含HGF目的基因的腺病毒。转染步骤参照本课题组既往发表文章,详细方法见参考文献[4,8]。
1.2.2 缺氧条件的构建及MSCs缺氧培养 采用缺氧小室持续通入5%二氧化碳、95%氮气进行细胞缺氧培养。取3~4代生长状态好的MSCs。MSCs分为转染组(转染HGF目的基因)和未转染组,移植前转入缺氧培养小室内培养6 h。缺氧培养前无血清培养72 h,使细胞同步化生长。
1.2.3 心梗大鼠模型的建立及分组 大鼠麻醉后固定于小动物操作台,记录术前心电图;切开左胸第4与5肋间隙皮肤,暴露心脏;于肺动脉与左心耳之间,距左心耳下缘2~3 mm沿室间左前壁处结扎并记录心电图。梗死区域为苍白的缺血区,并有相应导联ST改变即造模成功。心梗大鼠模型成功15 min后进行随机分组。动物分组(n=8):①A组对照组;②B组假手术组,大鼠仅在相同部位穿线但不结扎;③C组心梗组;④D组MSCs组,注射单纯未转染空载的 MSCs(100 μl,约 1×106个细胞);⑤E组MSCs-HGF组,注射转染HGF基因的MSCs(100 μl,约 1×106个细胞),直视下分 5 点在心肌梗死区及其心梗交界区注射。
1.2.4 大鼠心脏结构与功能测定 术后4周采用GE VIVID7多普勒心脏彩色超声仪,10S探头(频率5.4~11.8 MHz),测量及计算左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDd)、左心室收缩末期内径(left ventricular end systolic diameter,LVESd)和左室射血分数(LVEF)。所有数据均测量5个心动周期,取平均值。
1.2.5 心导管法测定大鼠血液流变学指标 术后4周大鼠麻醉后剃除颈部毛,正中切开皮肤,暴露右侧颈总动脉;结扎右颈总动脉远心端,眼科剪将颈动脉剪一楔形小口,插入自制的硅胶心导管,另一端与多道生理记录仪配套的压力换能器相连接;将导管缓慢送入左心室;观察电脑屏幕上压力波变化,如窄小的动脉波变为宽大的心室波;固定心导管,推注约0.5 ml生理盐水,稳定5 min,记录左室收缩末压(left ventricular end systolic pressure,LVESP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)及左室压力最大上升或下降速率(LV+dp/dtmax,LV-dp/dtmax)。
1.2.6 心肌组织HE染色及天狼星红染色观察组织胶原分布及含量 术后4周取出大鼠心脏于生理盐水中漂洗,10%甲醛固定24 h,脱水,石蜡包埋,切片,常规脱蜡至水,加苏木素或苦味酸天狼猩红染色液,脱水,凉干,中性树脂封片。心肌胶原分析:苦味酸天狼猩红染色后,高倍镜下(×200)观察并利用图文分析系统进行图像处理,每张切片随机选取5个视野,计算每个视野心肌外膜胶原容积分数(collagen volume fraction,CVF)(CVF=胶原面积/全视野面积×100%),取平均值。
1.2.7 ELISA测定心肌组织胶原Ⅰ、Ⅲ水平 根据ELISA试剂盒说明进行操作,450 nm波长测量OD值;根据标准浓度和OD值算出标准曲线的回归方程,并计算被测样品浓度。
1.2.8 Western-blotting检测心肌组织HGF蛋白表达 取大鼠左室前壁心梗区心肌组织50 mg,加入1 ml RIPA组织裂解液提取蛋白,10%SDS-PAGE电泳,半干转膜45 min,3%脱脂奶粉室温封闭30 min,加一抗4℃过夜,TBS-T洗膜5 min×3次;加二抗(1∶5000)37 ℃ 1.5 h,TBS-T 洗膜 5 min×3次;曝光,显影,定影,光密度分析。HGF/β-actin比值(OD)表示HGF蛋白水平。
1.2.9 Real-time PCR检测心肌组织HGF基因的表达 取大鼠左室前壁心梗区心肌组织50 mg,加1 ml Trizol匀浆,根据Trizol说明书取总RNA,紫外分光光度计测定总RNA的浓度与纯度,A260 nm/A280 nm OD比值为1.8~2.0可进行逆转录实验。RNA逆转录过程参照Takara PrimeScript RT Reagent Kit产品说明进行操作,反应条件37℃20 min,85 ℃ 10 s,-20 ℃保存备用。Real-time PCR过程参照Takara PrimeScript PCR Reagent Kit产品说明进行操作,引物设计与合成由TaKaRa公司完成。引物序列如下:HGF引物序列:正义链:5′-AGCATGAGCCGTATGCACTAGA-3′;反义链:5′-GCACTAACTACACAGAGACGTA-3′;GADPH 引物序列:正义链:5′-CTCATGACCACAGTCCATGCCA-3′;反义链:5′-GCCTTGGCAGCACCAGTGGATG-3′;实验结果的分析,目的基因与内参照GAPDH相对量表示。
1.3 统计学方法 所有数据均采用SPSS 13.0统计软件系统分析。计量资料以±s表示,多组间的均数比较采用单因素方差分析(One-Way ANOVA),组内的两两均数比较采用最小显著性差异(least significant difference,LSD)法检验。P<0.05为差异有统计学意义。
2 结果
2.1 缺氧预处理携带HGF基因MSCs细胞对心梗大鼠左心血流动力学影响 与假手术组相比,心梗组心功能明显下降(P<0.01);与心梗组及MSCs组相比,MSCs-HGF组心功能明显好转(P<0.05)。见表1。
2.2 MSCs-HGF移植心梗大鼠左室前壁心肌组织HGF mRNA及HGF蛋白表达水平 PCR及Western-Blotting检测结果显示,对照组、假手术组、心梗组、MSCs组均未见HGF mRNA及HGF蛋白表达。与MSCs组相比,MSCs-HGF组HGF mRNA及HGF蛋白表达水平明显增高(P<0.01)。
表1 各组缺氧预处理携带HGF基因的MSCs细胞对心梗大鼠左心血流动力学影响(±s)
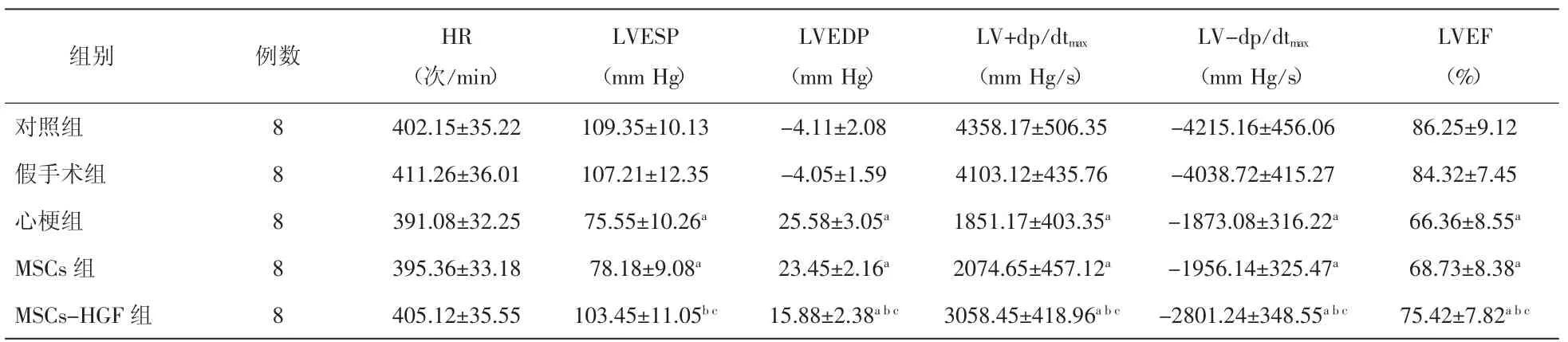
表1 各组缺氧预处理携带HGF基因的MSCs细胞对心梗大鼠左心血流动力学影响(±s)
注:HR:心率;LVESP:左室收缩末压;LVEDP:左室舒张末压;LV+dp/dtmax:左室压力最大上升速率;LV-dp/dtmax:左室压力最大下降速率;LVEF:左室射血分数。与假手术组比较,aP<0.01;与心梗组比较,bP<0.01;与 MSCs组比较,cP<0.05
LVEF(%)对照组 8 402.15±35.22 109.35±10.13 -4.11±2.08 4358.17±506.35 -4215.16±456.06 86.25±9.12假手术组 8 411.26±36.01 107.21±12.35 -4.05±1.59 4103.12±435.76 -4038.72±415.27 84.32±7.45心梗组 8 391.08±32.25 75.55±10.26a 25.58±3.05a 1851.17±403.35a -1873.08±316.22a 66.36±8.55aMSCs组 8 395.36±33.18 78.18±9.08a 23.45±2.16a 2074.65±457.12a -1956.14±325.47a 68.73±8.38aMSCs-HGF 组 8 405.12±35.55 103.45±11.05bc 15.88±2.38abc 3058.45±418.96abc -2801.24±348.55abc 75.42±7.82abc组别 例数 HR(次/min)LVESP(mm Hg)LVEDP(mm Hg)LV+dp/dtmax(mm Hg/s)LV-dp/dtmax(mm Hg/s)
2.3 缺氧预处理携带HGF基因的MSCs对心梗大鼠左室前壁梗死区心肌组织结构和胶原容积分数影响 HE染色显示,对照组及假手术组心肌细胞排列整齐,未见到增生组织;心梗组心肌细胞减少,结构紊乱,可见大量增生组织;MSCs-HGF组心肌细胞形态结构较为完整,心肌组织间隙仅见少量增生组织(见图1A)。天狼星红染色可见对照组和假手术组心肌组织有少量丝状红染纤维,心梗组有大量红染纤维,呈束状或片状,MSCs-HGF组可见细束状红染纤维(见图1B)。心肌胶原分析显示,与假手术组相比,心梗组心梗区心肌胶原容积分数显著增加(P<0.01);与心梗组相比,MSCs-HGF 组心肌胶原容积分数明显降低(P<0.05)(见图1C)。
2.4 缺氧预处理携带HGF基因的MSCs对心梗大鼠左室前壁梗死区心肌组织胶原Ⅰ、Ⅲ的影响ELISA检测结果显示,与假手术组相比,心梗组左室前壁梗死区心肌组织胶原Ⅰ、Ⅲ含量均显著增加(P<0.01);与心梗组相比,MSCs-HGF 组胶原Ⅰ、Ⅲ水平均明显降低(P<0.01);心梗组与MSCs组之间未见统计学差异(P>0.05)。见图2。
3 讨论
MSCs是一种多能分化的干细胞,具有多向分化潜能、自我复制和更新能力,能分泌大量细胞因子,参与心肌梗死组织的修复,减少心肌梗死后纤维组织的增生并降低心力衰竭的发生。MSCs移植疗效被基础实验及临床试验所证实,已成为治疗心肌梗死组织工程的工具之一。但动物实验[3,9,10]表明,单纯MSCs移植到急性心梗的大鼠,其心功能及血流动力学改善不明显,这与本实验结果一致。究其原因,由于在急性大鼠梗死早期大量心肌细胞死亡,局部炎症反应及缺血缺氧的环境导致MSCs无法正常转化为心肌细胞,严重影响其疗效。因此提高MSCs的存活率是目前医学界研究的热点。HGF又名扩散因子,c-met受体是HGF受体,属于酪氨酸激酶受体,HGF和c-met受体结合后激活细胞内多个信号通路,发挥包括抗细胞凋亡、促进细胞增殖、促进组织血管再生、促进细胞定向归巢等作用。HGF的分泌主要靠微环境的调节,但在心肌梗死的区域分泌量极少。本课题组通过对外源性基因HGF转染MSCs后再移植到心梗的大鼠,4周后可见大鼠心肌梗死组织内HGF mRNA及蛋白表达显著增加,从而发挥其生物学效应[11-16]:①促进毛细血管大量新生,改善心肌梗死周围区域心肌细胞的血供,心肌组织实质成分得到修复,从而改善心脏收缩功能,心脏功能显著提升。②直接刺激梗死区域血管扩张,为MSCs迁移、增殖、分化等提供最佳的生长环境,最终提高MSCs的迁移力及存活率,使MSCs能转化为心肌细胞,改善心功能。③HGF显著抑制转化生长因子β的产生,转化生长因子β是与瘢痕形成紧密相关的细胞因子,可以减轻血管周围胶原沉积,减少瘢痕组织的形成,减轻室壁僵硬度,限制心室重构。④HGF具有抗凋亡的能力,能减少心肌细胞的死亡,保护心肌,改善心功能。而这些作用可能是HGF基因修饰后MSCs对心梗大鼠心脏功能改善的效果优于单纯应用MSCs的原因。本实验证实,移植后4周行心脏彩超或血流动力学检测,MSCs-HGF组反映左室收缩功能的指标(LVESP、LV+dp/dtmax、EF)较心梗组、MSCs组明显提高,而反映心脏舒张功能指标(LVEDP)较心梗组、MSCs组明显恢复。
缺氧预处理是指对细胞进行短暂的非致命的缺氧适应,使MSCs移植到急性心梗大鼠能够适应局部缺氧、缺血的恶劣环境,延迟细胞的程序性死亡。近来研究[17]发现,缺氧预处理可以提高细胞内缺氧诱导因子1α的表达。缺氧诱导因子1α是具有转录活性的核蛋白,能够控制下游多种基因的表达,这些基因参与血管生成、能量代谢及细胞存活、凋亡,以维持细胞在缺氧条件下内环境的稳定。刘容容等[18]和王耀晟等[19]的研究发现,缺氧预处理的MSCs通过旁分泌细胞因子SDF-1、VEGF促进血管内皮细胞的增殖及血管的形成能力。本课题组前期细胞实验证实,无血清缺氧培养条件下HGF基因转染MSCs,能提高Bcl-2的表达而降低Bax的表达[20-22]。Bcl-2、Bax家族是调节细胞凋亡的重要分子,Bcl-2基因抑制细胞凋亡,而Bax基因促进细胞凋亡,Bcl-2和Bax可以形成二聚体,两者相互拮抗,通过控制Bcl-2/Bax来调控细胞的凋亡,比值升高可抑制凋亡,比值降低则促进凋亡。因此HGF基因转染MSCs能提高其在缺氧缺血条件下的抗凋亡的能力,从而提高MSCs的存活,增加MSCs转化为心肌样细胞的数量,并与宿主细胞建立电-机械耦合,参与心脏收缩与舒张,进而改善心功能。
心梗后心肌缺血缺氧,镜下HE染色可见大量心肌细胞坏死,心肌间质成分异常增生。细胞外基质增生主要是胶原纤维化,主要包括Ⅰ、Ⅲ型胶原蛋白,首先在血管周围增生,进而进展到心肌细胞,导致心肌僵硬、心室增厚、冠状动脉血流储备减少和心功能异常,加速心力衰竭的过程。所以,减少Ⅰ、Ⅲ型胶原蛋白在心梗心肌的过量表达,可能是影响心肌纤维化程度的最根本因素。减少心肌纤维化可提高心脏的舒张与收缩功能,改善心功能。本实验证实,移植后4周MSCs-HGF组心梗区域心肌组织Ⅰ、Ⅲ型胶原蛋白的表达较心梗组及MSCs组明显减少,差异有统计学意义,从而减少胶原增生,改善大鼠的心功能。
综上所述,HGF基因转染可通过增加缺氧、无血清培养MSCs在心梗大鼠局部表达HGF,以提高细胞存活率和迁移力,减少细胞的凋亡,并减少局部胶原蛋白的表达,从而改善心功能。
(本文图片见后插五)
[1]高青,李树仁.基因修饰干细胞治疗心肌梗死:临床前和临床应用中的相关问题.中国组织工程研究,2014,18:5220-5224.
[2]陈婷,陈光辉.间充质干细胞移植治疗心血管疾病的应用与进展.中国组织工程研究,2013,17:142-149.
[3]朱颖之,方五旺.骨髓间充质干细胞治疗心肌梗死的研究进展.中国医药指南,2013,11:468-469.
[4]林美萍,胡雨,张文文,等.人肝细胞生长因子基因修饰的骨髓间充质干细胞对大鼠心肌纤维化的影响.中华高血压杂志,2011,19:65-70.
[5]Wen Q,Jin D,Zhou CY,et al.HGF-transgenic MSCs can improve the effects of tissue self-repair in a rabbit model of traumatic osteonecrosis of the femoral head.PLoS One,2012,7:e37503.
[6]Ohno S,Hirano S,Kanemaru S,et al.Role of circulating MSCs in vocal fold wound healing.Laryngoscope,2012,122:2503-2510.
[7]Lu F,Zhao X,Wu J,et al.MSCs transfected with hepatocyte growth factor or vascular endothelial growth factor improve cardiac function in the infarcted porcine heart by increasing angiogenesis and reducing fibrosis.Int J Cardiol,2013,167:2524-2532.
[8]蔡文钦,王隽苼,苏津自,等.肝细胞生长因子基因转染缺氧培养骨髓间充质干细胞凋亡相关蛋白的影响.中国组织工程研究,2015,19:5746-5752.
[9]黄榕翀,葛均波.骨髓干细胞移植治疗急性心肌梗死研究现状.中华心血管病杂志,2007,35:497-499.
[10]金元哲,李占全.干细胞移植治疗心肌梗死的研究进展.介入放射学杂志,2004,12:218-221.
[11]孙津津,刘朝中,张海涛,等.体外心肌梗死微环境下大鼠骨髓间充质干细胞向内皮样细胞的分化.中国组织工程研究与临床康复,2011,15:2471-2476.
[12]Tseliou E, Pollan S, Malliaras K, etal.Allogeneic cardiospheres safely boost cardiac function and attenuate adverse remodeling after myocardial infarction in immunologically mismatched rat strains.J Am Coll Cardiol,2013,61:1108-1119.
[13]Xu Z,Tao Z,Xu Z,et al.Cardiac-specific expression of the hepatocyte growth factor(HGF) under the control of a TnIc promoterconfersaheartprotectiveeffectaftermyocardial infarction(MI).Curr Gene Ther,2014,14:63-73.
[14]Kang HJ,Kang WS,Hong MH,et al.Involvement of miR-34c in high glucose-insulted mesenchymal stem cells leads to inefficienttherapeutic effecton myocardialinfarction.Cell Signal,2015,27:2241-2251.
[15]Savi M,Bocchi L,Fiumana E,et al.Enhanced engraftment and repairing ability of human adipose-derived stem cells,conveyed by pharmacologically active microcarriers continuously releasing HGF and IGF-1,in healing myocardial infarction in rats.J Biomed Mater Res A,2015,103:3012-3025.
[16]朱德星,宋莉.肝细胞生长因子基因修饰骨髓间充质干细胞的研究进展.南昌大学学报(医学版),2012,52:91-94,
[17]戚金威,程景林,周姝,等.低氧诱导因子1α高表达对急性心肌梗死大鼠骨髓间充质干细胞的动员.中国组织工程研究,2014,18:1579-1584.
[18]刘容容,王晔,李士勇,等.缺氧环境下MSCs促进血管内皮细胞增殖和血管形成.中国组织化学与细胞化学杂志,2012,21:84-88.
[19]王耀晟,程晓曙,王伶,等.骨髓间充质干细胞在缺氧条件下VEGF的表达规律.中国应用生理学杂志,2009,25:475-477.
[20]张优,严卫亚,沈振亚,等.低氧预处理诱导骨髓间充质干细胞Pim-1激酶高表达抑制细胞凋亡.中国组织工程研究,2016,20:1989-1998.
[21]周美玲,王爱玲,徐凤,等.低氧增强骨髓间充质干细胞对缺氧诱导心肌细胞凋亡的可能性.中国组织工程研究与临床康复,2011,15:955-958.
[22]蔡文钦,苏津自,俞登及.肾上腺髓质素基因转染改善缺氧培养骨髓间充质干细胞的抗凋亡能力.中国组织工程研究与临床康复,2010,14:5913-5917.
The effect of hypoxia preconditioning MSC cells with HGF gene on the change of the heart function in AMI rats
JIANG Jin-feng*,LIN Xiu,CAI Wen-qin,et al.*Emergency Department,the Fuzhou First Hospital of Fujian Medical University,Fuzhou 350009,China
Objective To observe the effect of hypoxia preconditioning MSC cells with hepatocyte growth factor(HGF)gene on the change of the heart structure and function and collagen synthesis in AMI rats.Methods Acute myocardial infarction (AMI)model was established by ligating left anterior descending coronary artery.40 Rats were randomly divived into 5 groups(8 rats per group):control group,sham-operated group,AMI group,MSCs group,MSCs-HGF group.Echocardiography was performed to measure left ventricular ejection fractions(EF).Cardiac hemodynamics was evaluated with left cardiac catherization.Hematoxylin-eosin(HE)and Sirus red staining were used to determine myocardial structure and collagen deposition.RT-PCR was performed to determine the expression of HGF mRNA.The level of HGF protein was estimated by Western-blotting.Enzyme Linked Immunosorbent Assay(ELISA)was used to assay the levels of collagenⅠ、Ⅲ.Results Compared with AMI groups:the left ventricular ejection fraction(EF)were significantly increased in MSCs-HGF group[(75.42±7.82)%vs AMI groups(66.36±8.55)%,P<0.01];Real-time PCR and Western-bloting shown:the levels of HGF mRNA and protein were remarkable elevated in MSCs-HGF group compared with those in MSCs group(P<0.01).There were no the expression of HGF mRNA and protein in control,sham,AMI and MSCs group.HE staining shown that in AMI rats myocardial cells lowed,disordered,A large number of fibrous tissue deposition,in MSCs HGF group only A small amount of fibrous tissue deposition.Myocardial tissue Sirius red staining,in AMI group a large number of beam and plate red dye of myocardial tissue,in MSCs-HGF group wispy bouquet of red dye of myocardial tissue.ELISA analysis shown the level of collagenⅠ、Ⅲ in heart tissue were greatly increased in AMI group while those were significantly decreased in MSCs-HGF group[collagenⅠ(450±12)pg/ml vs AMI groups(523±13)pg/ml,P<0.05;collagenⅢ(870±14)pg/ml vs AMI groups(1080±25)pg/ml,P<0.05].Conclusion Hypoxia pretreated MSC cells with HGF gene improves cardiac function possibly through inhibiting myocardial fibrosis in AIM rats.
MSCs; Hepatocyte growth factor; Heart function; CollagenⅠ,Ⅲ
福建省自然科学基金(项目编号:2014J1433)
作者单位:350009 福建省福州市,福建医科大学附属福州市第一医院急诊科(江金锋、林修、王芬珍);福建医科大学附属第一医院心血管内科,高血压研究所(蔡文钦、苏津自)
10.3969/j.issn.1672-5301.2017.09.021
Q95-33;R542.2+2
A
1672-5301(2017)09-0849-05
2017-01-16)