β-catenin在食管癌侵袭转移过程中的作用
秦燕子,王晓丽,刘明俊,王乐乐,单利娜,李卓然,陶仪声
β-catenin在食管癌侵袭转移过程中的作用
秦燕子1,王晓丽2,刘明俊3,王乐乐3,单利娜3,李卓然3,陶仪声1
目的 探讨β-catenin在食管癌侵袭转移过程中的作用。方法 转染有效的β-catenin基因siRNA干扰片段于食管癌Eca-109细胞中,下调β-catenin表达:CCK-8增殖实验检测沉默该基因对食管癌细胞增殖能力的影响;Transwell小室实验检测对其侵袭、迁移能力的影响;Western blot法检测β-catenin表达下调后WISP2、TCF4及E-cadherin蛋白表达。结果 CCK-8增殖实验结果显示,干扰组(siRNA干扰片段有效转染的下调β-catenin组)细胞增殖能力明显低于空白对照组(未处理组)及阴性对照组(转染无意义片段组)(P<0.05),而空白对照组与阴性对照组之间差异无统计学意义(P>0.05)。Transwell小室实验结果显示,干扰组迁移、侵袭能力均低于空白对照组及阴性对照组(P<0.05)。Western blot结果显示,WISP2、E-cadherin蛋白在干扰组中的表达量高于空白对照组及阴性对照组(P<0.05);TCF4蛋白在干扰组中的表达量低于空白对照组及阴性对照组(P<0.05)。结论 在食管癌细胞中,下调β-catenin后,Wnt信号通路的相关因子也出现明显改变,推测沉默食管癌中Wnt信号通路β-catenin因子,E-cadherin表达增加,抑制上皮-间质转化(epithelial mesenchymal transition, EMT),阻碍食管癌细胞增殖,通过减少TCF4表达,促进下游靶基因WISP2表达,从而抑制肿瘤细胞侵袭、转移;β-catenin基因有望成为靶向治疗食管癌的候选基因。
食管肿瘤;侵袭;转移;增殖;β-catenin
食管癌的发生严重威胁着人类健康,其复发和转移很难得到有效控制。研究证明,食管癌的增殖、侵袭和转移是多基因参与的多步骤复杂过程[1-2]。Wnt信号通路的异常激活在食管癌的发生、发展过程中起到一定的作用。β-catenin在细胞内的异常聚集是此信号通路异常激活的标志性体现。Wnt-1信号蛋白与细胞膜上的受体蛋白Frizled结合后,引起细胞内游离的β-catenin过度集聚,而后β-catenin进入细胞核内与转录因子相互作用,调节下游基因转录,影响细胞增殖、分化等行为[3]。研究证实β-catenin在食管癌中高表达,本次实验通过下调β-catenin表达,探究其对食管癌细胞增殖、侵袭及迁移能力的影响。
1 材料与方法
1.1 细胞系 人食管癌细胞系Eca-109购自上海复祥生物公司细胞库。
1.2 主要试剂、抗体 DMSO、Lipofectamine 2000脂质体转染试剂购自美国Invitrogen公司,质粒提取试剂盒、反转录试剂盒,蛋白试剂盒、β-catenin引物(上游序列5′-ATGGACAGTATGCAATGACTCG-3′,下游序列5′-TAGCAGACACCATCTGAGGAGA-3′,357 bp)及β-actin引物(上游序列5′-CACCCAGCACAATGAAGATCAAGAT-3′,下游序列5′-CCAGTTTTTAAATCCTGAGTCAAGC-3′,317 bp)购自武汉谷歌生物公司,β-catenin siRNA干扰片段(有义链5′-GGAUGUGGAUACCUCCCAATT-3′,反义链5′-UUGG GAGGUAUCCACAUCCTT-3′)、β-catenin siRNA阴性对照片段(有义链5′-GGAUGUGGAUACCUCCCAAT T-3′,反义链5′-UUGGGAGGUAUCCACAUCCTT-3′)由上海吉玛生物公司设计,β-catenin抗体(鼠抗人)、E-cadherin抗体(兔抗人)、TCF4抗体(鼠抗人)购自美国Affbiotech公司,WISP2抗体(兔抗人)购自美国Abcam公司。
1.3 方法 细胞转染:复苏细胞,更换培养液,细胞转染,将Lipofectamine 2000和β-catenin siRNA按照6 ∶4比例稀释于500 μL的不含抗生素的opti-MEM培养液中,放置在超净台上,避光孵育20 min,接种到六孔板内,收集细胞。Western blot实验:提取细胞蛋白,测定蛋白浓度并制备检测样品,电泳,转膜,封抗,一抗浓度β-catenin(1 ∶2 000)、WISP2(1 ∶1 000)、TCF4(1 ∶1 000)、E-cadherin(1 ∶5 000)、β-catin(1 ∶10 000),化学发光、显影。qRT-PCR凝胶图像分析:提取Total RNA,按照实验说明操作,反应体系20 uL,40个循环(50 ℃ cDNA 15 min,95 ℃ 10 min,95 ℃ 10 min预变性,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s)。Transwell侵袭实验:每孔随机选取8个视野进行观察拍照,计算平均穿过基膜的细胞数。细胞迁移实验:小室内不需要铺Matril基质胶,步骤、结果处理同侵袭实验。CCK-8增殖实验:终止细胞培养,移除培养液,加入新鲜培养基,每孔加入10 μL CCK-8试剂(保持总体积每孔100 uL),置于CO2培养箱4 h,450 nm滤光片下测OD值。各组实验均重复3次。
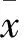
2 结果
2.1 Western blot法检测β-catenin蛋白表达 本实验在细胞水平通过Lipofectamine 2000和β-catenin siRNA形成的复合物成功瞬时转染Eca-109细胞株,干扰β-catenin表达后,应用Western blot法测得β-catenin与β-actin灰度值比值,空白对照组、阴性对照组、干扰组分别为1.749±0.012、1.735±0.004、0,分析得出β-catenin蛋白表达量在干扰组中显著低于空白对照组、阴性对照组(P<0.05,图1)。
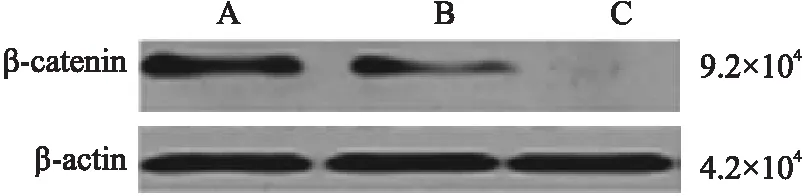
图1 各实验细胞β-catenin和β-actin蛋白的表达 A.空白对照组;B.阴性对照组;C.干扰组
2.2 qRT-PCR检测各组食管癌细胞中β-catenin mRNA的表达 siRNA沉默β-catenin后,提取各组细胞的总RNA,应用核酸蛋白分析仪测定总RNA浓度,得出各组细胞中β-catenin mRNA的相对表达量,结果显示空白对照组、阴性对照组、干扰组中的β-catenin mRNA的相对表达量分别为1.542±0.046、1.377±0.046、0.292±0.05。干扰组与其它两组相比,β-catenin mRNA的相对表达水平显著下调(P<0.05,图2),而阴性对照组与空白对照组之间差异无显著性(P>0.05)。
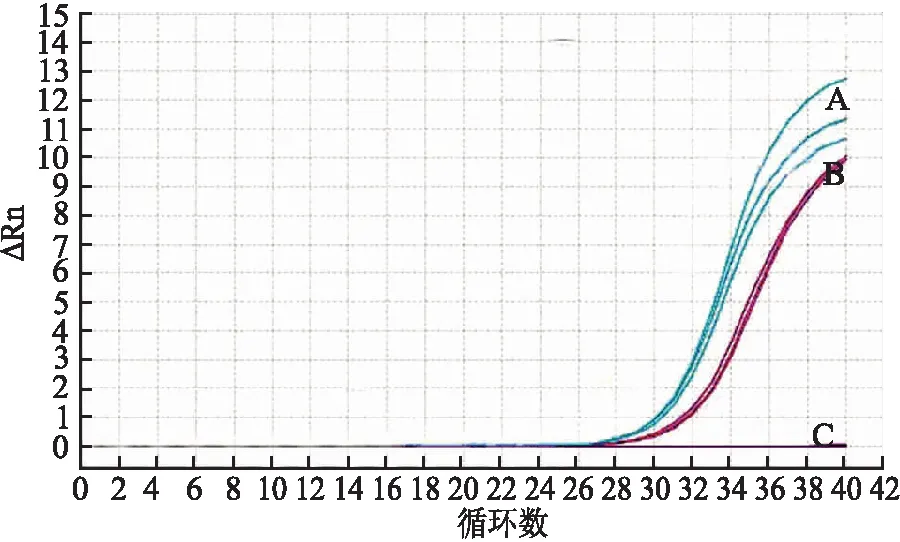
图2 各实验组细胞β-catenin基因的扩增曲线: A.空白对照组;B.阴性对照组;C.干扰组
2.3 沉默β-catenin对各组食管癌细胞侵袭能力的影响 倒置显微镜下计数穿过Matrigel基质胶的细胞数,反应细胞侵袭能力,结果显示空白对照组、阴性对照组、干扰组穿透Matrigel基质胶的细胞数分别为129.67±8.50、124.67±11.01、47.33±4.16。干扰组细胞数显著低于空白对照组、阴性对照组(P<0.05),而与空白对照组、阴性对照组之间差异无显著性(P>0.05,图3)。
2.4 沉默β-catenin对各组食管癌细胞迁移能力的影响 倒置显微镜下计数穿过微孔滤膜的细胞数,反应细胞迁移能力,结果显示空白对照组、阴性对照组、干扰组穿透聚碳酸微孔滤膜的细胞数分别为95.5±4.69、102.1±4.33、47.8±5.21。干扰组细胞数显著低于空白对照组、阴性对照组(P<0.05),而与空白对照组、阴性对照组之间差异无显著性(P>0.05,图4)。
2.5 CCK-8增殖实验 种板24、48、72、96 h后在酶标仪下分别测定OD值,实验重复3次以上,得不同时间点各实验组数据(表1),统计分析得出,干扰组的增殖能力显著低于空白对照组及阴性对照组(P<0.05)。
2.6 下调β-catenin后WISP2、E-cadherin、TCF4蛋白的表达 提取各实验组蛋白,应用Western blot法检测各实验组因子与β-actin灰度值比值,在空白对照组、阴性对照组、干扰组中:WISP2分别为0.12±0.02、0.38±0.01、0.53±0.02;E-cadherin分别为0.123±0.015、0.19±0.06、0.53±0.02;TCF4分别为0.643±0.035、0.74±0.04、0.16±0.03。SPSS 20.0统计软件分析:干扰组的WISP2、E-cadherin蛋白表达量均高于空白对照组及阴性对照组(P<0.05),而空白对照组与阴性对照组之间差异无显著性(P>0.05);干扰组的TCF4蛋白表达量低于空白对照组及阴性对照组(P<0.05),而空白对照组及阴性对照组之间差异无显著性(P>0.05,图5)。
③A③B③C④A④B④C
图3 Transwell细胞侵袭试验中穿过Matrigel基质胶的细胞:A.空白对照组;B.阴性对照组;C.干扰组 图4 Transwell细胞迁移试验中穿过基膜的细胞:A.空白对照组;B.阴性对照组;C.干扰组
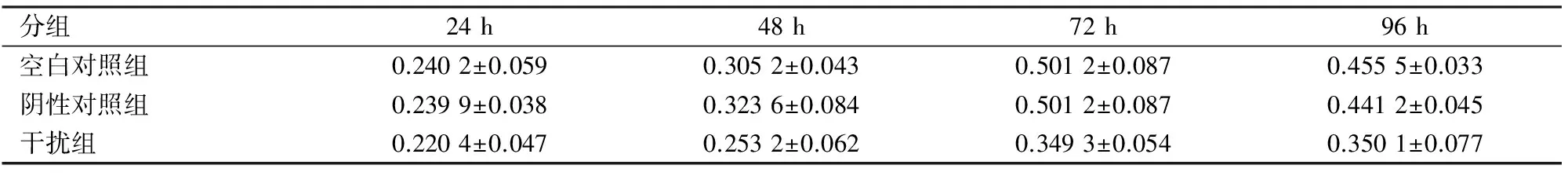
表1 各实验组在不同时间点的OD值
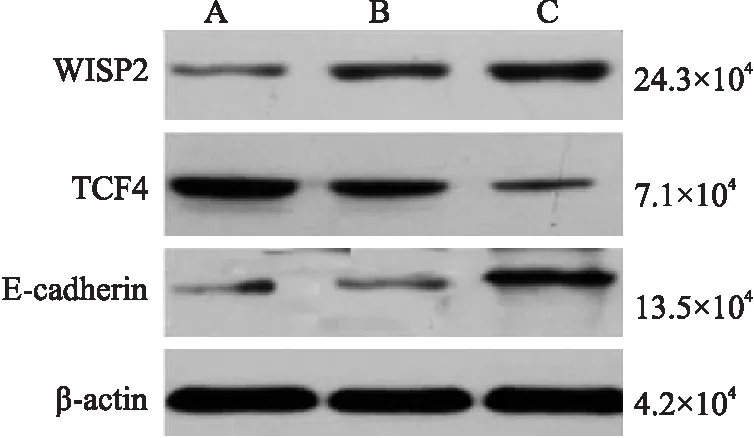
图5 WISP2、E-cadherin、TCF4与β-actin在各实验组中的表达 A. 空白对照组;B.阴性对照组;C.干扰组
3 讨论
侵袭、迁移能力作为恶性肿瘤的重要生物学行为是目前热点研究领域,以此可以探索肿瘤的发生、发展机制。随着对连环蛋白与恶性肿瘤关系认识的加深,细胞黏附分子与恶性肿瘤生物学行为的关系被推向新的阶段[4]。β-catenin具有介导细胞黏附及参与Wnt信号传导的双重功能[5],是Wnt信号通路的关键调控因子,在多种肿瘤细胞如黑色素瘤、乳腺癌、卵巢癌等中高表达[6],参与肿瘤发生、发展多个环节[7]。本实验利用siRNA干扰技术,合成靶向沉默β-catenin的双链siRNA[8]干扰片段,qRT-PCR和Western blot实验证明在食管癌细胞株中转染siRNA载体后,β-catenin mRNA和蛋白表达被显著抑制;Transwell小室及CCK-8实验发现,干扰组细胞的增殖、迁移及侵袭能力均低于空白对照组及阴性对照组(P<0.05),而空白对照组与阴性对照组之间差异无显著性(P>0.05)。本次实验提示,在食管癌中有效沉默β-catenin因子可以抑制食管癌细胞的增殖、侵袭及转移,β-catenin可能作为食管癌分子生物治疗的新候选基因。
WISP2是生长因子CNN家族成员之一,其在促进细胞增殖、介导细胞黏附、参与细胞迁移及肿瘤形成等方面发挥作用[9]。本课题组前期实验证明在食管癌中WISP2低表达,并且与β-catenin存在相关性,提示WISP2可能作为一种保护因子抑制其发生、发展[10]。本组实验利用siRNA干扰技术,在食管癌细胞Eca-109中沉默β-catenin因子,发现WISP2在干扰组中蛋白表达量明显高于空白组和阴性对照组(P<0.05),与前期研究结果相吻和[10]。有研究显示,WISP2与Wnt信号通路有关,WISP2被证实为Wnt-1信号通路的下游靶基因[11]。在乳腺癌细胞株中敲除WISP2基因可以诱导上皮-间质转化(epithelial mesenchymal transition, EMT)[12]发生,从而促进癌细胞侵袭和迁移[13]。Haque等[14]发现在三阴型乳腺癌中WISP2能够激活诱导并促进细胞停滞在G0/G1期,降低细胞增殖。推测可能在食管癌细胞中Wnt信号通路异常激活后,通过沉默β-catenin而作用于该信号通路的其它因子,促使下游靶基因WISP2的表达,进而抑制Eca-109细胞的增殖、侵袭、迁移。
肿瘤细胞从原发部位脱落,并迁移至其他组织或器官是肿瘤播散最为关键的环节[15],也是肿瘤发生侵袭、迁移的主要原因之一。Wnt信号通路的异常活化参与肿瘤的发生、发展以及转移过程,E-cadherin是其相关因子之一。当细胞胞膜上的β-catenin减少时,E-cadherin依赖性的细胞黏附功能就会下降,进而使得肿瘤细胞容易从原发部位发生脱离。E-cadherin 被认为是EMT过程中的基础,而EMT是指上皮细胞失去黏合性和极性,从而获得转移和侵袭能力的可逆过程。TCF4是Wnt信号通路中的信号分子,在肿瘤的发生、发展过程中起到重要作用。异常情况下Wnt通路被激活时,β-catenin由细胞质转移到细胞核内,竞争性结合TCF4,抑制TCF4转录激活功能[16-18],并且同TCF4共同作用促使其下游转录因子也被激活,进而诱导细胞癌变[19]。Peng等[20]发现β-catenin/TCF在肝细胞癌中通过激活下游靶基因来促进肝癌细胞的侵袭和迁移。E-cadherin/β-catenin/TCF通路在胃癌与幽门螺杆菌感染关系[21]中有所研究,在肿瘤的侵袭、转移方面三者之间的关系尚未见报道。差异性基因表达路径分析显示,TCF4依赖人神经母细胞瘤,如果敲除TCF4基因,EMT相关的多信号通路和基因会因此而发生不同程度的变异[22]。本组实验结果显示,沉默β-catenin表达之后,食管癌细胞Eca-109的侵袭、迁移能力均显著下降,干扰组中TCF4表达较阴性对照组及空白组均显著下降(P<0.05),而E-cadherin的表达量较阴性对照组及空白组均显著升高(P<0.05)。说明β-catenin蛋白沉默可能通过下调TCF4的表达进而调节E-cadherin的表达使其表达增强进而抑制肿瘤的EMT,阻碍食管癌细胞的侵袭及迁移。
由于基因靶向治疗的针对性强,目前在许多肿瘤治疗中已成为治疗的一种趋势,食管癌靶向治疗也是目前的研究热点。结合前期研究结果及本组实验结果,通过沉默β-catenin基因后,TCF4表达下降,两者结合能力减弱,直接或间接抑制E-cadherin的表达,同时对Wnt信号通路下游靶基因WISP2的抑制作用减弱,导致食管癌细胞增殖、侵袭、迁移能力减弱。但是信号的传导是多因子参与的多步骤过程,该调控的具体机制还需进一步研究。阐明这些机制,对食管癌的治疗和改善预后将提供更多的参考价值,因此我们期待对Wnt/β-catenin信号通路进行深入探讨,为食管癌的治疗提供更多的有效思路。
[1] Lordick F. Current standard and trends in oesophageal cancer[J]. Eur J Cancer, 2011,47(3):S353-S354.
[2] Moyes L H, Going J J. Still waiting for predictive biomarkers in Barrett's oesophagus[J]. J Clin Pathol, 2011,64(9):742-750.
[3] Umawat K, Koopmans T, Gosens R. β-catenin as a regulator and therapeutic target for asthmatic airway remodeling[J]. Expert Opin Ther Targets, 2014,18(9):1023-1034.
[4] Tan C W, Gardiner B S, Hirokawa Y,etal. Wnt signalling pathway parameters for mammalian cells[J]. PLoS One, 2012,7(2):e31882.
[5] Voronkov A, Krauss S. Wnt/β-catenin signaling and small molecule inhibitors[J]. Curr Pharm Des, 2013,19(4):19634-19664.
[6] Schmeel L C, Schmeel F C, Kim Y,etal. Targeting the Wnt/beta-catenin pathway in multiple myeloma[J]. Anticancer Res, 2013,33(11):4719-4726.
[7] Flemr M, Malik R, Franke V,etal. A retrotransposon-driven dicer isoform directs endogenous small interfering RNA production in mouse oocytes[J]. Cell, 2013,155(4):807-816.
[8] Fellmann C, Lowe S W. Stable RNA interference rules for silencing[J]. Nat Cell Biol, 2014,16(1):10-18.
[9] Brigstock D R. The CCN family: a new stimulus package[J]. J Endocrinol, 2003,178(2):169-175.
[10] 秦燕子, 陶仪声. Sox4, β-cateninhe和WISP2在食管鳞癌中的表达及临床意义[D]. 蚌埠: 蚌埠医学院, 2013.
[11] Pennica D, Swanson T A, Welsh J W,etal. WISP genesare members of the connective tissue growth factor family that are up-regulated in Wnt-1-transformed cells and aberrantly expressed in human colon tumors[J]. Proc Natl Sci USA, 1998,95(25):14717-14722.
[12] Fritah A, Saucier C, De Wever O,etal. Role of WISP-2/CCN5 in the maintenance of a differentiated and noninvasive phenotype in human breast cancer cells[J]. Mol Cell Biol, 2008,28(3):1114-1123.
[13] Sabbah M, Emami S, Redeuilh G,etal. Molecular signature and therapeutic perspective of the epithelial-to-mesenchymal transitions in epithelial cancers[J]. Rug Resist Updat, 2008,11(4-5):123-151.
[14] Haque I, Banerjee S, De A,etal. CCN5/WISP-2 promotes growth arrest of triple-negative breast cancer cells through accumulation and trafficking of p27(Kip1) via Skp2 and FOXO3a regulation [J]. Oncogene, 2015,34(24):3152-3163.
[15] Klucky B, Mueller R, Vogt I,etal. Kallikrein 6 induces E-cadherin shedding and promotes cell proliferation, migration, and invasion[J]. Cancer Res, 2007,67(17):8198-8206.
[16] Xu Z, Chen Y, Yu J,etal. TCF4 mediates the maintenance of neuropathic pain through Wnt/β-catenin signaling following peripheral nerve injury in rats[J]. Mol Neurosci, 2015,56(2):397-408.
[17] Guturi K K, Sarkar M, Bhowmik A,etal. DEAD-box protein p68 is regulated by β-catenin/transcription factor 4 to maintain a positive feedback loop in control of breast cancer progression[J]. Breast Cancer Res, 2014,16(6):496.
[18] Valenta T, Hausmann G, Basler K. The many faces and functions of beta-catenin[J]. EMBO J, 2012,31(12):2714-2736.
[19] Schuijers J, Mokry M, Hatzis P,etal. Wnt induced transcriptional activation is exclusively mediated by TCF/LEF[J]. EMBO J, 2014,33(2):146-156.
[20] Peng Y Y, He Y H, Chen C,etal. NLRC5 regulates cell proliferation, migration and invasion in hepatocellular carcinoma by targeting the Wnt/β-catenin signaling pathway[J]. Cancer Lett, 2016,376(1):10-21.
[21] Yu X W, Xu Q, Xu Y,etal. Expression of the E-cadherin/β-catenin/tcf-4 pathway in gastric diseases with relation to Helicobacter pylori infection: clinical and pathological implications[J]. Asian Pac J Cancer Prev, 2014,15(1):215-220.
[22] Forrest M P, Waite A J, Rendon E M,etal. Knockdown of human TCF4 affects multiple signaling pathways involved in cell survival, epithelial to mesenchymal transition and neuronal differentiation[J]. PLoS One, 2013,8(8):e73169.
Effect of β-catenin in invasion and metastasis of esophageal squamous cell carcinoma
QIN Yan-zi1, WANG Xiao-li2, LIU Ming-jun3, WANG Le-le3, SHAN Li-na3, LI Zhuo-ran3, TAO Yi-sheng1
(1DepartmentofPathology,theFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China;2DepartmentofPathology,RenminHospitalofWeifang,Weifang261000,China;3DepartmentofGeneralMedicine,Grade2012,BengbuMedicalCollege,Bengbu233004,China)
Purpose To explore the β-catenin role in the process of invasion and metastasis of esophageal cancer. Methods Transfection-effective β-catenin gene segments of siRNA interference in human esophageal Eca-109 cells was used to downregulate β-catenin expression: CCK-8 multiplication experiment was carried out to observe the esophageal cancer cell proliferation. Transwell chambers experiment was used to observe its invasion, migration ability. Western blot was used to detect the expression of WISP2 and TCF4, E-cadherin protein. Results CCK-8 multiplication experiment showed that in the interference group (the efficient transfection of β-catenin down-regulation group by siRNA) cell proliferation ability significantly decreased as compared with the blank control group (the untreated group) and the negative control group (the transfection group meaningless fragments) (P<0.05), and there was no statistical significance between the blank and negative control groups (P>0.05). The invasion and migration ability of the interference group was lower than that in the blank control group and the negative control group (P<0.05) by the transwell chambers experiment. Western blot showed that the protein lever of WISP2 and E-cadherin in interference group was higher than those in the blank control group and the negative control group (P<0.05). TCF4 protein expression in the interference group was lower than that of the blank control group and the negative control group (P<0.05). Conclusions After the β-catenin expression is down-regulated, Wnt signaling pathway-related factors are significantly changed. It can be speculated that the silencing of β-catenin in Wnt signaling pathway may hinder the esophageal cancer cell proliferation by up-regulating E-cadherin expression to obstruct epithelial mesenchymal transition (EMT) and to inhibit tumor cell proliferation. Invasion and metastasis of the tumor are also inhibited by reducing TCF4 expression and promoting WISP2 downstream target genes expression. Therefore, β-catenin gene is expected to be a target for the treatment of esophageal cancer.
esophageal neoplasms; invasion; metastasis; proliferation; β-catenin
国家级大学生创新创业项目(201410367036)、蚌埠医学院自然科学基金(BYKY1437)
1蚌埠医学院第一附属医院病理科/蚌埠医学院病理学教研室,蚌埠 2330042山东省潍坊市人民医院病理科,潍坊 2610003蚌埠医学院2012级全科医学系,蚌埠 233004
秦燕子,女,硕士,讲师。E-mail: qyz18725525611@163.com 陶仪声,女,教授,硕士生导师,通讯作者。Tel:(0552)3070209,E-mail: tys101041@126.com
时间:2017-8-20 15:27 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170820.1527.002.html
R 735.1
A
1001-7399(2017)08-0832-05
10.13315/j.cnki.cjcep.2017.08.002
接受日期:2017-04-16

