松香淀粉酯对苯并芘的吸附研究
巫 佳, 陆有达, 杨 慧, 赖熙晨, 林日辉*, 陈其勇
(1.广西民族大学 海洋与生物技术学院;广西高校微生物与植物资源利用重点实验室,广西 南宁530006; 2.广西民族大学 化学化工学院;化学与生物转化过程新技术重点实验室,广西南宁 530006; 3.南宁天亮精细化工有限公司,广西 南宁 530007)
松香淀粉酯对苯并芘的吸附研究

WU Jia
巫 佳1, 陆有达2, 杨 慧2, 赖熙晨2, 林日辉2*, 陈其勇3
(1.广西民族大学 海洋与生物技术学院;广西高校微生物与植物资源利用重点实验室,广西 南宁530006; 2.广西民族大学 化学化工学院;化学与生物转化过程新技术重点实验室,广西南宁 530006; 3.南宁天亮精细化工有限公司,广西 南宁 530007)
以松香淀粉酯为吸附剂对正辛烷溶液中的苯并芘进行吸附研究,分析了吸附时间、温度、苯并芘的初始浓度以及松香淀粉酯的取代度对吸附量的影响,并对吸附过程的热力学、动力学进行了分析。结果显示:提高吸附温度、苯并芘的浓度以及吸附剂的取代度均可提高吸附量;以取代度0.12的松香淀粉酯为吸附剂,在吸附时间120 min、吸附温度50 ℃、苯并芘的质量浓度10 mg/L条件下,对苯并芘的吸附量达20.76 μg/g;该吸附过程符合Langmuir等温线模型,热力学参数ΔG,ΔH和ΔS表明:吸附是一个自发和吸热的过程;动力学数据分析表明松香淀粉酯对苯并芘的吸附过程符合准二级动力学模型。
松香淀粉酯;苯并芘;吸附过程
多环芳香烃属于有机化合物中的一大类,由煤炭、石油、木柴等不完全燃烧或工业中利用这些燃料进行热加工处理时产生的一类化合物,广泛存在于大气烟尘、空气、水、土壤以及烟熏食物中[1]。这类化合物有一些具有强致癌性和致基因变导毒性,苯并芘是其中之一,由于其高毒性和强污染性,常将它作为多环芳香烃污染物的代表[2-3]。苯并芘是由一个苯环和一个芘分子结合而成的多环芳烃类化合物,在自然环境中广泛分布。苯并芘有致癌性、致畸和致突变性,对人体健康存在巨大的危害[4],因此,采取经济、安全、有效的方法去除苯并芘等多环芳烃污染受到广泛的关注,目前有效方法主要有溶剂萃取法、吸附法、化学氧化法和生物降解法等[5]。吸附法可对苯并芘的脱除起到良好的效果,且与其他方法相比,吸附法除去苯并芘具有操作简单,成本相对较低的优势[5-7]。淀粉具有较强的亲水性,松香主要成分为二萜树脂酸,其三环菲骨架具有良好的亲油性[8]。经松香酯化改性的淀粉酯具有潜在的生物降解性和生物相容性,广泛地应用于食品,药品等行业[9-10]。为了充分利用松香改性后获得淀粉酯的优良性能,拓展松香淀粉酯的应用领域,作者在前期研究的基础上[11-13]开展了松香淀粉酯对苯并芘吸附(情况)的研究,探讨了吸附时间、吸附温度、苯并芘初始浓度以及松香淀粉酯取代度对吸附的影响,并分析吸附过程中热力学及动力学,探索淀粉酯吸附苯并芘的特征和机制,以期为未来松香淀粉酯去除苯并芘在生产和生活中的广泛应用提供理论依据。
1 材料与方法
1.1 材料与试剂
苯并芘(纯度95%),Sigma公司;木薯淀粉(食品级),广西岑溪市三角淀粉有限责任公司;松香,广西梧州松脂股份有限公司;固定化脂肪酶 Novozym435,诺维信公司;甲醇为色谱纯;正辛烷、二甲基亚砜(DMSO)、无水乙醇、丙酮、氢氧化钠和尿素,均为分析纯。
1.2 仪器与设备
Agilent 1260高效液相色谱仪,美国安捷伦公司;HPS-250生化培养箱,哈尔滨市东明医疗仪器厂;高速离心机,日本日立公司;HJ-6A多头磁力搅拌器;DHG-9146A电热鼓风干燥箱;KJMR-IV血液混匀器,上海天呈医流科技股份有限公司。
1.3 方法
1.3.1 松香淀粉酯的合成 参照文献[13]的合成方法,在150 mL三角瓶中,分别加入一定质量的原木薯淀粉和预处理木薯淀粉,然后加入一定量的松香和DMSO溶液,摇匀,溶解后,再加入一定量的Novozym435脂肪酶,恒温反应一定时间。设置4个不同的反应时间2、3、4和5 h,得到4种不同取代度的样品。参照文献[13]测定样品的取代度(Ds),分别为0.068、 0.089、 0.101和0.120。
1.3.2 吸附苯并芘 将一定量的苯并芘固体溶于正辛烷中配制成质量浓度为 10 mg/L 的苯并芘储备液,根据实验需要,用正辛烷稀释为不同质量浓度(2、4、6、8和10 mg/L)的苯并芘工作液。
在5 mL离心管中,分别加入3 mL的苯并芘工作液和1 g不同取代度的松香淀粉酯。将离心管放到血液混匀器上,置于恒温培养箱中于一定温度混匀吸附。吸附完成后,溶液通过离心机在12 000 r/min离心5 min,取上清液,利用高效液相色谱法分析苯并芘的质量浓度。所有的吸附操作都进行3个平行实验,并计算平均值,标准偏差都在1%以内。平衡吸附量(qe)计算公式如下:
qe=V(C0-Ce)/m
(1)
式中:qe—平衡吸附量,μg/g;C0—苯并芘初始质量浓度,mg/L;Ce—苯并芘吸附平衡时质量浓度,mg/L;V—吸附溶液的体积,mL;m—吸附剂松香淀粉酯的质量,g。
1.3.3 色谱检测条件 参考文献[14-16]进行检测。色谱柱AichromBond-AQ C18 (4.6 mm×250 mm, 5 μm),流动相甲醇-水(体积比90 ∶10),流速1 mL/min,柱温35 ℃,进样量20 μL,检测波长UV-290 nm。
将10 mg/L的苯并芘储备液分别取2、4、6、8和10 mL,用正辛烷稀释定容至10 mL,配成2、4、6、8和10 mg/L的苯并芘溶液,测定峰面积(y)与浓度(x)之间的关系, 得到标准曲线y=175.68x+0.796 3,相关系数(R2)0.999 8,苯并芘在 2~10 mg/L 呈良好的线性关系。
2 结果与分析
2.1 产物检测
2.1.1 扫描电镜(SEM)分析 样品的SEM图如图1所示。由图1(a)可知,木薯淀粉颗粒呈圆型或椭圆型,表面光滑,无裂缝或破面;经过酯化后的产物(Ds=0.12)已不再保持其圆型或椭圆型,而是结构疏松且规整度差,露出内部结构,晶体呈现与原淀粉完全不同的形貌和结构,表明酯化反应不但发生在淀粉的非定型区,而且还发生在淀粉的结晶区域,此结果和文献[13]的结果类似。

图1 样品的SEM图
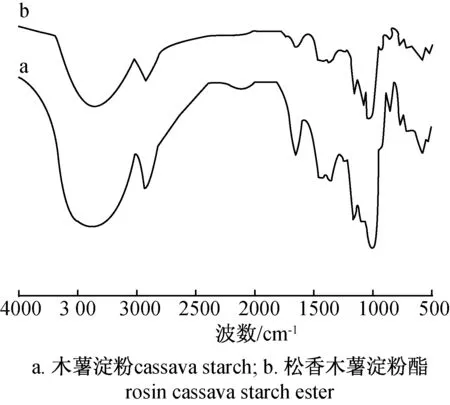
图2 红外光谱图Fig.2 Infrared spectrograms

2.2 不同条件对松香淀粉酯吸附苯并芘的影响
2.2.1 吸附时间 吸附温度为50 ℃,苯并芘的初始质量浓度为10 mg/L,用Ds=0.12的松香淀粉酯进行吸附实验,研究吸附时间对松香淀粉酯吸附苯并芘的影响,以确定松香淀粉酯对苯并芘吸附达到平衡时所需要的时间,qt为不同时间段的吸附量,结果如图3(a)所示。0~120 min内吸附速率迅速增加,90 min时吸附量为 17.45 μg/g,120 min时吸附量为20.76 μg/g;从120~240 min,苯并芘的吸附量只增加了0.67%,这可能是由于苯并芘分子对松香淀粉酯表面吸附位点的竞争,使得苯并芘分子之间形成了排斥力,导致松香淀粉酯上剩余的吸附位点难以被占据。故而后续实验均采用反应时间为120 min。
2.2.2 吸附温度 吸附时间为120 min,苯并芘的初始质量浓度10 mg/L,考察吸附温度(35、40、45和50 ℃)对松香淀粉酯(Ds=0.12)吸附苯并芘的影响,结果如图3(b)所示。在实验温度范围内,松香淀粉酯对苯并芘的吸附量随着温度的升高而增加,这是因为随着温度升高增加了松香淀粉酯与苯并芘的接触几率。相关研究结果表明活性炭吸附苯并芘也有类似的效果[7]。因此,后续实验选择吸附温度为50 ℃。
2.2.3 初始质量浓度 在温度为50 ℃,吸附时间120 min,用Ds=0.12的松香淀粉酯进行吸附实验,研究苯并芘初始质量浓度对松香淀粉酯吸附苯并芘的影响,结果如图3(c)所示。由图可见,随着苯并芘初始质量浓度增加,松香淀粉酯对苯并芘的吸附量呈线性增加。当苯并芘质量浓度为2 mg/L时,吸附量为6.79 μg/g;10 mg/L时,吸附量为20.76 μg/g,是2 mg/L时的3.06倍。这是因为随着苯并芘初始质量浓度的提高,增加了松香淀粉酯和苯并芘之间的接触几率,并且增加了液相中苯并芘与松香淀粉酯表面吸附基团之间的传质推动力,从而提高了松香淀粉酯对苯并芘的吸附量。另一方面,溶液中苯并芘的质量浓度提高,可使苯并芘的扩散率增加,有利于促进松香淀粉酯对苯并芘的吸附。因此,选择松香淀粉酯的初始质量浓度为10 mg/L。
2.2.4 取代度 在温度50 ℃,吸附时间120 min,苯并芘初始质量浓度为10 mg/L,考察不同Ds值的松香淀粉酯对苯并芘吸附的影响,结果如图3(d)所示。松香淀粉酯对苯并芘的吸附量随着Ds的增加而增加,这是因为Ds越高,淀粉颗粒接入的松香基团越多,样品的亲油性能越高,对苯并芘的吸附能力增强。然而取代程度受到实验条件的限制,有待进一步提高。因此,实验选择Ds为0.12。

图3 不同条件对松香淀粉酯吸附苯并芘的影响
综上,以取代度为0.12的松香淀粉酯为吸附剂,在吸附温度50 ℃,吸附时间120 min,苯并芘初始质量浓度100 mg/L条件下,松香淀炂酯对苯并芘的吸附量达20.76 μg/g。
2.3 吸附等温线
为了探索松香淀粉酯对苯并芘的吸附特征[18],采用Langmuir吸附等温模型(式(2))[19]和Freundlich方程(式(3))[20]对吸附数据进行拟合。
(2)

(3)
式中:qe—平衡吸附量,μg/g;Ce—吸附平衡时苯并芘的质量浓度,mg/L;qm—最大吸附量,μg/g;KL—吸附系数,L/μg;KF—Freundlich吸附常数,(μg/g)· (L/mg)n;n—与吸附质、吸附剂作用强度相关的Freundlich常数。
Langmuir模型是单分子层吸附的理论模型,Freundlich模型通常应用于分布不均匀的非均相体系表面的吸附。本研究使用OriginPro 9.0软件通过非线性回归拟合计算出两种等温线模型的参数。Langmuir等温线参数为qm=95.6552μg/g,KL=0.0576 L/μg,R2=0.9942和Freundlich等温线的参数为KF=0.5667;n=4.2483;R2=0.8539。从数据可以发现Langmuir等温线模型的R2大于Freundlich模型,这表明松香淀粉酯对苯并芘的吸附是单分子层吸附。
2.4 吸附热力学
在探讨松香淀粉酯在不同温度下吸附苯并芘的吸附热力学过程中,分别计算了吉布斯自由能变(ΔG)、焓变(ΔH)和熵变(ΔS)这3个重要参数,公式如下:
ΔG=-RTlnKc
(4)
ΔG=ΔH-TΔS
(5)
lnKc=ΔS/R-ΔH/RT
(6)
式中:Kc—吸附平衡常数;R—气体常数,8.314 J/(mol·K);T—绝对温度,K。
根据式(4)对lnKc与1/T作图(见图4),由斜率与截距分别求得ΔH为17.91 kJ/mol,ΔS为 0.88 J/(mol·K),并可得到35、40、45和50 ℃对应的ΔG分别为-0.96、-1.06、-1.40 和-2.18 kJ/mol。
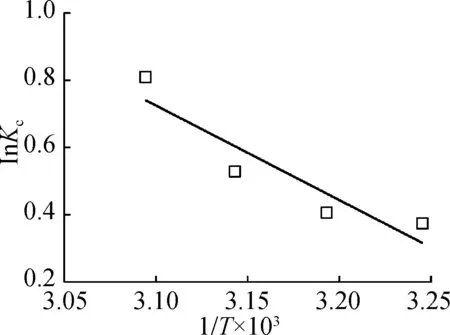
图4 lnKc对1/T的线性拟合Fig.4 Plots of lnKc versus reciprocal temperature (1/T)
在不同的吸附温度下,ΔG<0表明苯并芘在松香淀粉酯上的吸附是自发进行的过程;ΔH>0表明,该吸附反应是一个吸热过程,并且升高温度可使松香淀粉酯对苯并芘的吸附量增加也证明了此吸附反应为吸热过程;ΔS>0表明,松香淀粉酯对苯并芘的吸附在固液界面的无序性增加。
2.5 吸附动力学
为了描述松香淀粉酯对苯并芘的吸附反应速率及探讨吸附过程[22],采用准一级动力学模型[23]、准二级动力学模型[24]和颗粒内扩散模型[25]对试验数据进行分析,方程式如下:
ln(qe-qt)=lnqe-k1t
(7)
(8)
qt=kidt0.5+ci
(9)式中:qt—时间t时所对应苯并芘的吸附量,μg/g;k1—准一级反应的吸附速率常数, min-1;k2—准二级反应的吸附速率常数,g/(μg·min);kid—内扩散速率常数,μg/(g·h0.5);ci—涉及到厚度、边界层的常数。
图5和图6分别为准一级动力学模型和准二级动力学模型的拟合曲线。在qe为20.76 mg/g时,准一级动力学模型相关参数为qt为18.84μg/g,k1为0.02 min-1,R2为0.952 9;准二级动力学模型相关参数为qt为20.15μg/g,k2为0.001 5 g/(μg·min),R2为0.993 5。由此可见,准二级动力学模型有较高的R2,并且理论吸附量与实验值较为接近,因此松香淀粉酯吸附苯并芘符合准二级动力学模型。
通过颗粒内扩散模型分析的动力学数据,可探讨影响松香淀粉质吸附苯并芘的动力学机制和速率控制步骤[25],模型的拟合曲线见图7。相关参数为:kid为12.75μg/(g·h0.5),Ci为13.77,R2为0.872 7。
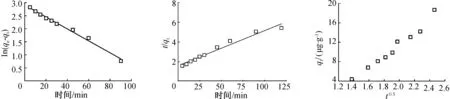
图5 ln(qe-qt)对t的线性拟合
Fig.5 Plots of ln(qe-qt) versust
图6t/qt对t的线性拟合
Fig.6 Plots oft/qtversust
图 7qt对t0.5的线性拟合
Fig.7 Plots ofqtversust0.5
由图7可看出,qt与t0.5不存在线性关系,且图没有通过原点,表明颗粒内扩散不是决定该吸附过程的唯一的控速步骤。
3 结 论
3.1 探讨了吸附温度、吸附时间、苯并芘初始质量浓度和松香淀粉酯的取代度(Ds)对松香淀粉酯吸附苯并芘的影响,结果显示:在温度50 ℃,吸附时间120 min,苯并芘的初始质量浓度为10 mg/L,香时淀粉酯的Ds0.120时,其对苯并芘的最大吸附量为20.76 μg/g。
3.2 对吸附过程的热力学参数ΔG,ΔH和ΔS进行分析,结果表明:吸附过程是自发进行(ΔG>0),吸附反应是吸热反应(ΔH>0),松香淀粉酯对苯并芘的吸附在固液界面的无序性增加(ΔS>0)。
3.3 通过比较Langmuir与Freundlich等温线模型对吸附数据的拟合,分析得到:松香淀粉酯对苯并芘的吸附更符合Langmuir等温线模型(R2>0.99),计算最大吸附量(qm)为95.655 2 μg/g。
3.4 吸附动力学数据通过准一级,准二级和内扩散动力学模型分析表明,准二级动力学模型能更好地描述松香淀粉酯对苯并芘的吸附过程。
[1]信维平.苯并芘的致癌性及快速检测[J]. 肉品卫生,2000(2):16-17. XIN W P. Carcinogenicity and rapid detection of benzoprene[J]. Meat Hygiene,2000(2):16-17.
[2]LOPEZ L M, KAPTEIN A, HELMERHORST F M. Analytical chemistry of polycyclic aromatic compounds[M].[S.l.]:Academic Press,1981.
[3]IARC Working Group Evaluation Carcinogenic Risks Humans. International Agency for Research on Cancer Iancer Monographs on the Evaluation of Carcinogenic Risks to Humans[M]. 2002.
[4]王丹,曹维强,王静. 食品安全隐患——苯并(a)芘的研究进展[J]. 食品研究与开发,2006,27(1):132-135. WANG D,CAO W Q,WANG J. Food safety concerns: Benzene and (a) pyrene research progress[J]. Food Research and Development,2006,27(01):132-135.
[5]肖苏尧,车科,陈雪香,等. 不同油茶籽油提取工艺中苯并(α)芘形成的溯源[J]. 现代食品科技,2012,28(2):156-159. XIAO S Y,CHE K,CHEN X X,et al. The origin of benzene and (alpha) pyrene in the extraction process of different oil tea seed oil[J]. Modern Food Technology,2012,28(2):156-159.
[6]赵欢欢,刘玉兰,张小涛,等.吸附法脱除芝麻油中苯并芘及脱色效果研究[J]. 粮油食品科技,2013,21(4):23-27. ZHAO H H,LIU Y L,ZHANG X T,et al. Adsorption method was studied in the study of benzene, pyrene and decoloration in sesame oil[J]. Oils and Foods Technology,2013,21(4):23-27.
[7]房涛,王月华,孙冬梅. 用活性炭脱除玉米油中苯并芘动力学模型及数值模拟的研究[J]. 粮食与食品工业,2015,22(6):18-21. FANG T,WANG Y H,SUN D M. Kinetic model and numerical simulation of benzo-pyrene removal from corn oil with activated carbon[J]. Foods and Food Industry,2015,22(6):18-21.
[8]唐世华,李景权,覃浩鹏,等.松香酸淀粉酯的合成与结构表征[J].林产化学与工业,2011,31(6):55-60. TANG S H, LI J Q, QIN H P, et al. Synthesis and structure characterization of rosin starch ester[J]. Chemistry and Industry of Forest Products,2011,31(6):55-60.
[9]RAVISHANKAR S A, PRADIP, KHOSLA N K. Selective flocculation of iron oxide from its synthetic mixtures with clays: A comparison of polyacrylic acid and starch polymers[J]. International Journal of Mineral Processing,1995,43(34):235-247.
[10]SHU W C, SHAW J F. Biocatalysis for the production of carbohydrate esters[J]. New Biotechnology,2009,26(34):109-116.
[11]LIN R, LI H, LONG H, et al. Structure and characteristics of lipase-catalyzed rosin acid starch[J]. Food Hydrocolloids,2015,43:352-359.
[12]LIN R, LI H, LONG H, et al. Optimization of lipase-catalyzed rosin acid starch synthesis by response surface methodology[J]. Journal of Molecular Catalysis B:Enzymatic,2014,105(7):104-110.
[13]LIN R H, LI H, LONG H, et al. Synthesis of rosin acid starch catalyzed by lipase [J/OL]. BioMed Research International,2014,2014:1-8[2014-05-25]http://dx.doi.org/10.1155/2014/647068.
[14]李念念,周光宏,徐幸莲,等. 高效液相色谱-荧光法测定腊肉中的苯并芘残留[J]. 食品工业科技,2013,34(1):319-322. LI N N,ZHOU G H,XU X L,et al. High performance liquid chromatographic fluorescence method to determine benzene and pyrene residue in cured meat[J]. Food Science and Technology,2013,34(1):319-322.
[15]武晓剑,李琼. 高效液相色谱法测定反应香精中的3,4-苯并芘[C]∥第七届中国香料香精学术研讨会论文集. 杭州:中国香料香精化妆品工业协会,2008:159-163. WU X J,LI Q. Determination of 3, 4-benzene [a] pyrene in process flavoring by HPLC[C]∥Proceedings of the 7th Chinese Spice Fragrance Symposium. Hangzhou:China Association of Fragrance Flavor and Cosmetic Industries,2008:159-163.
[16]胡奇杰,沈黎炜,戚民,等. 高效液相色谱法测定肉制品中的苯并芘[J]. 食品研究与开发,2010,31(6):146-149. HU Q J,SHEN L W,QI M,et al. Determination of benzo-pyrene in meat rroducts by high rerformance liquid chromatography[J]. Food Research and Development,2010,31(6):146-149.
[17]王月华,温江涛,孙冬梅,等. 用活性炭吸附玉米油中苯并芘的条件探讨及热力学研究[J]. 粮食与食品工业,2016,23(2):21-24. WANG Y H,WEN J T,SUN D M,et al. Study on the conditions of benzopyrene produced by activated carbon in corn oil and its thermodynamics[J]. Foods and Food Industry,2016,23(2):21-24.
[18]FOO K Y, HAMEED B H. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal,2010,156(1):2-10.
[19]LANGMUIR I. The constitution and fundamental properties of solids and liquids. Part II: Liquids[J]. Journal of the American Chemical Society,1917,38(5):102-105.
[20]HANAFIAH M A K M, NGAH W S W, IBRAHIM S C, et al. Kinetics and thermodynamic study of lead adsorption from aqueous solution onto rubber(Heveabrasiliensis), leaf powder[J]Journal of Applied Sciences,2006,6(13):2762-2767.
[22]YOUSEF R I, EL-ESWED B, AL-MUHTASEB A H. Adsorption characteristics of natural zeolites as solid adsorbents for phenol removal from aqueous solutions: Kinetics, mechanism, and thermodynamics studies[J]. Chemical Engineering Journal,2011,171(3):1143-1149.
[23]NAMASIVAYAM C, KADIRVELU K. Uptake of mercury (II) from wastewater by activated carbon from an unwanted agricultural solid by-product: Coirpith[J]. Carbon,1999,37(1):79-84.
[24]HO Y S, MCKAY G. Batch Lead(II) removal from aqueous solution by peat: Equilibrium and kinetics[J]. Process Safety & Environmental Protection,1999,77(3):165-173.
[25]WU F C, TSENG R L, JUANG R S. Initial behavior of intraparticle diffusion model used in the description of adsorption kinetics[J]. Chemical Engineering Journal,2009,153(1/2/3):1-8.
Absorption of Benzopyrene by Rosin Starch Ester
WU Jia1, LU Youda2, YANG Hui2, LAI Xichen2, LIN Rihui2, CHEN Qiyong3
(1.Guangxi Colleges and Universities Key Laboratory of Utilization of Microbial and Botanical Resources,College of MarineSciences and Biotechnology,Guangxi University for Nationalities, Nanning 530006, China; 2.Key Laboratory of NewTechniques for Chemical and Biological Conversion Process,School of Chemistry and Chemical Engineering,Guangxi University for Nationalities, Nanning 530006, China; 3.Nanning Dawn Light Chemical Co.,Ltd. Nanning 530007, China)
The absorption of benzopyrene in octane solution by rosin starch ester was studied in this paper. Affect factors including temperature, contact time, initial concentration of benzopyrene and the degree of substitution (Ds) of the rosin starch ester were investigated. The thermodynamics and kinetics of the absorption process were also studied. The results showed that increasing the absorption temperature, the benzopyrene concentration, and theDsof the adsorbent were beneficial to the adsorption process. Using rosin starch ester (Ds=0.12) as adsorbent, absorbing 120 min at 50 ℃ in 10 mg/L benzopyrene, the absorption capacity of benzopyrene reached to 20.76 μg/g. The measured results were fitted with the Langmuir isotherm better. Thermodynamic parameters ΔG, ΔHand ΔSindicated that the adsorption process was spontaneous and endothermic. Analysis of the kinetic data suggested the pseudo second order kinetic model was suitable for describing the adsorption process.
rosin starch ester; benzopyrene; absorption process
2016- 11- 25
资金项目:广西人才小高地建设创新团队资助计划项目(桂教人[2011]47);南宁市科学研究与技术开发计划项目(20151042);广西高校大学生创新创业计划项目(201610608014)
巫 佳 (1991— ),男,广西柳州人,硕士生,主要从事化学与生物转化研究工作
*通讯作者:林日辉,研究员,硕士生导师,主要从事发酵工程、酶工程研究;E-mail: rihuilin@aliyun.com。
10.3969/j.issn.0253-2417.2017.04.010
TQ35;TS231
A
0253-2417(2017)04-0067-06
巫佳,陆有达,杨慧,等.松香淀粉酯对苯并芘的吸附研究[J].林产化学与工业,2017,37(4):67-72.

