羧甲基化甜玉米芯多糖的制备
谢静南,王 鑫,马永强,吴媛媛
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
羧甲基化甜玉米芯多糖的制备
谢静南,王 鑫,马永强,吴媛媛
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨 150076)
以甜玉米芯为原料,通过细胞破壁的方式将多糖分子从细胞壁或者细胞质中释放,溶解出的多糖经过脱蛋白、脱色、乙醇沉淀等后续处理步骤得粗多糖.在此基础上,将分子修饰技术应用到甜玉米芯多糖研究中,通过羧甲基化进一步对其进行分子修饰和改性.且分别以氢氧化钠溶液浓度、一氯乙酸用量以及反应温度为单因素条件进行羧甲基化修饰,在单因素实验基础上,通过正交试验进一步确定了最适修饰反应条件为,氢氧化钠溶液浓度4.0 mol/L ,一氯乙酸用量2.360 g,反应温度45 ℃.在此条件下得到羧甲基化多糖取代度为0.051 6.
甜玉米芯;多糖;羧甲基化
甜玉米是玉米属的甜质类,是玉米的一个变种,被西欧称为蔬菜玉米[1].甜玉米中水溶性多糖的百分含量较高,还含有多种氨基酸、矿物质、胡萝卜素、维生素和玉米油,人体很容易消化吸收,根据水溶性多糖百分含量分为普通甜玉米、加强甜玉米和超甜玉米[2].随着生活水平不断地提高和人们对膳食结构的改善,甜玉米已变成不可缺少的保健和营养食品之一,受到人们越来越多的青睐[3].
多糖是有10个以上的单糖通过糖苷键连接而成的含有酮基或醛基的天然高分子聚合物,广泛存在于动物、植物、微生物中.多糖是膜蛋白、酶、遗传物质等不可或缺的组成成分,而它们是生命活动中起重要作用的分子.植物多糖是一种无细胞毒的免疫促进剂,可以作为预防治疗糖尿病、心血管疾病、肿瘤的药物[4].
多糖经羧甲基化修饰后溶解性提升,其生物活性增强,或者增加了其他新的活性,而且羧甲基化修饰具有过程易于控制、使用的试剂价格较低、生成的产物无毒等优点[5],因此在多糖改性研究中羧甲基化修饰应用较广泛.所以本文进行了羧甲基化甜玉米芯多糖的制备研究.
1 试验材料、试剂与仪器
甜玉米(美国脆王);FW177型中草药粉碎机(天津市泰斯特仪器有限公司)、202型常压恒温烘箱(吴江欧博电热设备有限公司)、TG328A型分析天平(赛多利斯科学仪器有限公司)、81-2型恒温磁力搅拌器(上海县曹行无线电元件厂)、TDL-5-A型飞鸽牌低速大容量离心机(上海安亭科学仪器厂)、RE52CS型旋转蒸发仪(上海亚荣生化仪器厂)、MD200-3型电子天平(上海光正医疗仪器有限公司)、DK-98-11A型电热恒温水浴锅(天津市泰斯特仪器有限公司)、SHB-ⅢA型循环水式多用真空泵(巩义市予华仪器有限责任公司)、TU-1900型双光束紫外可见分光光度计(上海奥析科学仪器有限公司)、3kl59000162型高速低温冷冻离心机(美国Sigma公司)、ZD-85恒温振荡器(金坛市新航仪器厂);正己烷、无水乙醇、丙酮、乙醚、硫酸、苯酚,均为分析纯.
2 试验方法
2.1甜玉米芯多糖提取工艺
将甜玉米芯分割成小块,置于干燥箱内,干燥后粉碎过80目筛,取甜玉米芯粉,加3倍体积的正己烷对其进行脱脂,离心弃上清液,残渣干燥.称取适量粉末,按料水比1∶20加水,在功率100%、频率28 kHz、25℃条件下超声波40 min[6],提取液以4 000 r/min离心10 min,取上清液,备用.
2.2多糖百分含量测定
采用苯酚-硫酸法[7].
2.3甜玉米芯多糖羧甲基化修饰方法
称取适量的甜玉米芯多糖溶解于一定浓度的氢氧化钠溶液中,在室温下搅拌30 min.然后加入一氯乙酸,水浴加热2 h.反应结束后,冷却到室温,随后加入一定量的冰醋酸,调节pH值至中性.收集样液,蒸馏水透析,浓缩后,经冻干得到羧甲基化甜玉米芯多糖[8].
2.4羧甲基取代度测定
参照GB/T 601—2002《化学试剂:标准滴定溶液的制备》方法,标定HCl标准溶液浓度、NaOH标准溶液分别为0.009 172、0.009 710 mol/L.
将羧甲基化甜玉米芯多糖溶解在一定浓度的盐酸溶液(70%甲醇溶液配置)中,磁力搅拌3 h,这段时间1 h更换一次新的盐酸溶液.将经盐酸洗过的甜玉米芯多糖用80%甲醇溶液洗涤2~3次,至无Cl-.然后加入0.01 mol/L NaOH标准溶液将其溶解,水浴使溶液透明后,冷却至室温,用0.01 mol/L 盐酸标准溶液反滴定剩余的氢氧化钠溶液.DS按下式计算:

(1)
其中:A为每克样品消耗NaOH的毫摩尔数(mmol/g);C0为NaOH溶液浓度(mol/L);V0为加入NaOH溶液的体积(mL);C1为HCl溶液浓度(mol/L);V1为消耗HCl溶液的体积(mL);M为羧甲基化甜玉米芯多糖的质量(mg).
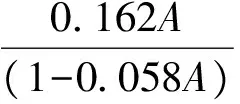
(2)
其中:DS为羧甲基化取代度;0.058为1毫克当量-OH转变为-OCH2COOH所净增的分子量(mmol/g);0.16为失去-OH的毫摩尔质量(mmol/g);A为每克样品消耗NaOH的毫摩尔数(mmol/g)
2.5甜玉米芯多糖羧甲基化修饰单因素的选择
对2.3中确定的甜玉米芯多糖羧甲基化方法进行单因素实验设计,以NaOH溶液浓度(mol/L)、反应温度(℃)和一氯乙酸用量(g)为基础条件进行单因素实验.
2.5.1 NaOH溶液浓度
准确称取5份甜玉米芯多糖,每份0.1 g分别置于5个50 mL的烧杯中,做好标记,分别选取氢氧化钠溶液浓度3.5、4.0、4.5、5.0、5.5 mol/L五个水平,一氯乙酸用量2.835 g,反应温度50 ℃的条件下进行实验,比较氢氧化钠溶液浓度不同水平下羧甲基化改性甜玉米芯多糖的羧甲基取代度,对氢氧化钠溶液浓度进行筛选.
2.5.2 一氯乙酸用量
准确称取5份甜玉米芯多糖,每份0.1 g分别置于5个50 mL的烧杯中,做好标记,分别选取一氯乙酸0.945、1.410、1.890、2.360、2.835 g五个水平,氢氧化钠溶液浓度4.5 mol/L,反应温度50 ℃的条件下进行实验,比较一氯乙酸用量不同水平下羧甲基化改性甜玉米芯多糖的羧甲基取代度,对一氯乙酸用量进行筛选.
2.5.3 反应温度
准确称取5份甜玉米芯多糖,每份0.1 g分别置于5个50 mL的烧杯中,做好标记,分别选取反应温度35、40、45、50、55 ℃五个水平,氢氧化钠溶液浓度4.5 mol/L,一氯乙酸2.835 g条件下进行实验,比较反应温度不同水平下羧甲基化改性甜玉米芯多糖的羧甲基取代度,对反应温度进行筛选.
2.6甜玉米芯多糖羧甲基化方法的正交试验
根据单因素试验,选取适合水平,并采用 L9(34)表正交试验设计方案进行最佳条件改性的选取试验.试验的羧甲基化主要因素为氢氧化钠溶液浓度,反应时间,一氯乙酸用量为实验因素,采用四因素三水平正交实验设计以选择最佳配方.
实验因素分别为氢氧化钠溶液浓度,反应温度,一氯乙酸用量.羧甲基化甜玉米芯取代度为主要衡量指标,根据以上试验设计原则确定实验设计的因素水平,见表1.
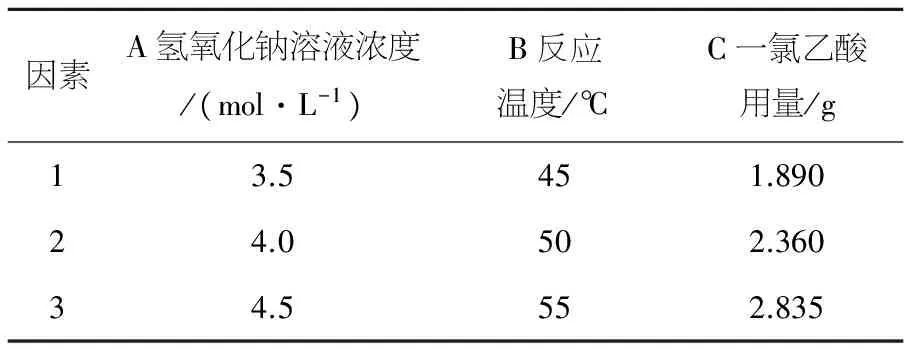
表1 正交实验设计因素水平表
3 结果与讨论
3.1甜玉米芯多糖百分含量结果分析
见表2.
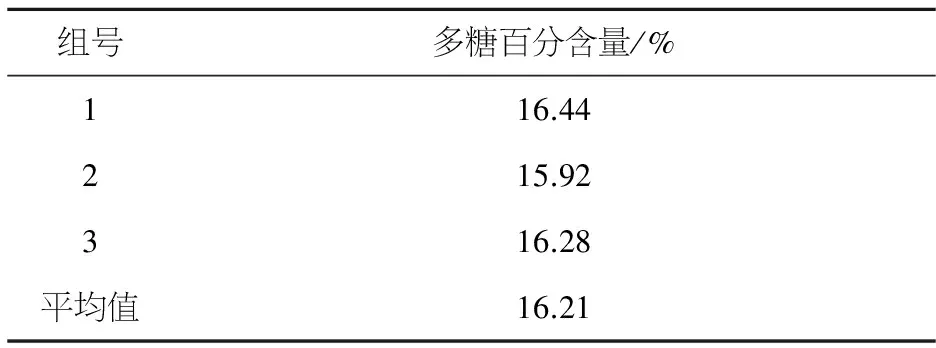
表2 甜玉米芯多糖百分含量
由表2可知,用超声波辅助水提取方法,获得甜玉米芯多糖百分含量为16.21%.
3.2多糖百分含量标准曲线的绘制
以葡萄糖质量浓度和吸光值为坐标作图,如图1所示.得到的回归方程为:y=0.014 6x+0.002 1,R2=0.999 4.糖质量浓度在0~48 μg/mL的范围,吸光值与糖浓度呈良好线性关系.
3.3甜玉米芯多糖羧甲基化方法的单因素实验
3.3.1 氢氧化钠溶液浓度对甜玉米芯多糖羧甲基化方法的影响
将100 mg甜玉米芯多糖分别溶于20 mL浓度分别为3.5、4.0、4.5、5.0、5.5 mol/L的氢氧化钠溶液中,加入1.890 g一氯乙酸,50 ℃水浴加热2 h.如图2所示,实验初期,随着氢氧化钠溶液浓度的增加,羧甲基化甜玉米芯多糖的取代度有所上升,在溶液浓度为4.0 mol/L时最大,取代度为0.048.然后随着改性时间延长改性甜玉米芯多糖的羧甲基化取代度有所下降,这是因为体系中水合钠离子的形成使其向多糖的迁移发生困难,过多的NaOH导致一氯乙酸碱化副反应的发生,降低氯乙酸的利用率,还可能造成多糖、多糖钠盐、羧甲基多糖的降解,反而不利于了取代反应,取代度不断地下降[9].所以确定甜玉米芯多糖羧甲基化最佳氢氧化钠溶液浓度为4.0 mol/L.
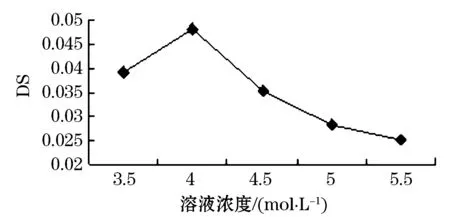
图2 氢氧化钠溶液浓度对甜玉米芯多糖羧甲基化方法的影响
3.3.2 一氯乙酸用量对甜玉米芯多糖羧甲基化方法的影响
在确定的氢氧化钠溶液浓度的条件下进行一氯乙酸用量的单因素时间.将100 mg甜玉米芯多糖溶解于20 mL浓度为4.5 mol/L的氢氧化钠溶液中,分别加入0.945、1.410、1.890、2.360、2.835 g一氯乙酸.如图3所示,当一氯乙酸质量为0.945 g和1.410 g时,其羧甲基取代度分别为0.025和0.034;当一氯乙酸质量为2.360 g时,取代度显著增大至0.041;当一氯乙酸质量为2.360 g时,取代度达到最大,为0.050.这是因为随着一氯乙酸用量的增加,使氢氧化钠分子渗透到多糖分子所形成的钠盐与一氯乙酸反应的机会增多,但一氯乙酸用量过多将会导致一氯乙酸的水解加快,需要消耗一部分的氢氧化钠溶液[10],从而导致整个体系的pH值下降,进一步导致取代度下降,所以最佳一氯乙酸用量为2.360 g.

图3 一氯乙酸用量对甜玉米芯多糖羧甲基化方法的影响
3.3.3 反应温度对甜玉米芯多糖羧甲基化方法的影响
将100 mg甜玉米芯多糖溶解于20 mL浓度为5.0 mol/L的氢氧化钠溶液中,加入1.890 g一氯乙酸,分别于35、40、45、50、55 ℃水浴反应2 h.如图4所示,取代度随着温度的升高而不断的升高,温度50 ℃时取代度达到最大,为0.047,温度高于50 ℃后取代度开始下降.这是因为提高温度,增加了钠离子向颗粒内部的扩散速度,增大了反应速率,但温度过高将导致多糖发生焦糖化反应,对主反应不利的同时还增加了副反应的速度[10],以及物料的黏附,导致一氯乙酸的利用率下降,另外温度升高、分子运动剧烈必然导致分子结合力的降低[11-12],因此反应的最佳反应温度为50 ℃.
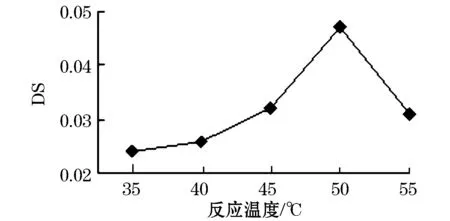
图4 反应温度对甜玉米芯多糖羧甲基化方法的影响
3.4甜玉米芯多糖羧甲基化方法的正交实验
根据单因素试验的结果确定出影响羧甲基化甜玉米芯多糖改性的主要因素是氢氧化钠溶液浓度,反应温度,一氯乙酸用量.采用L9(34)正交试验法对上述三个因素进行研究和分析,确定了羧甲基化甜玉米芯多糖制备的最佳配方及工艺.正交试验的结果见表3.
为进一步探究甜玉米芯多糖的最佳羧甲基化修饰条件,根据单因素试验结果,设计三因素三水平的正交试验,正交试验结果与显著性分析如表3、4所示.结果表明,对甜玉米芯多糖羧甲基化修饰反应影响最大的因素是一氯乙酸用量,其次是氢氧化钠溶液浓度、再次是反应温度.最佳修饰条件为NaOH溶液浓度为4.0 mol/L、一氯乙酸用量为2.360 g、反应温度为45 ℃.
根据正交试验的最佳条件:NaOH溶液浓度4.0 mol/L、一氯乙酸用量2.360 g、反应温度45 ℃进行三次多糖羧甲基化修饰平行试验,计算平均值,最终确定甜玉米芯多糖的羧甲基化取代度为0.051 6.
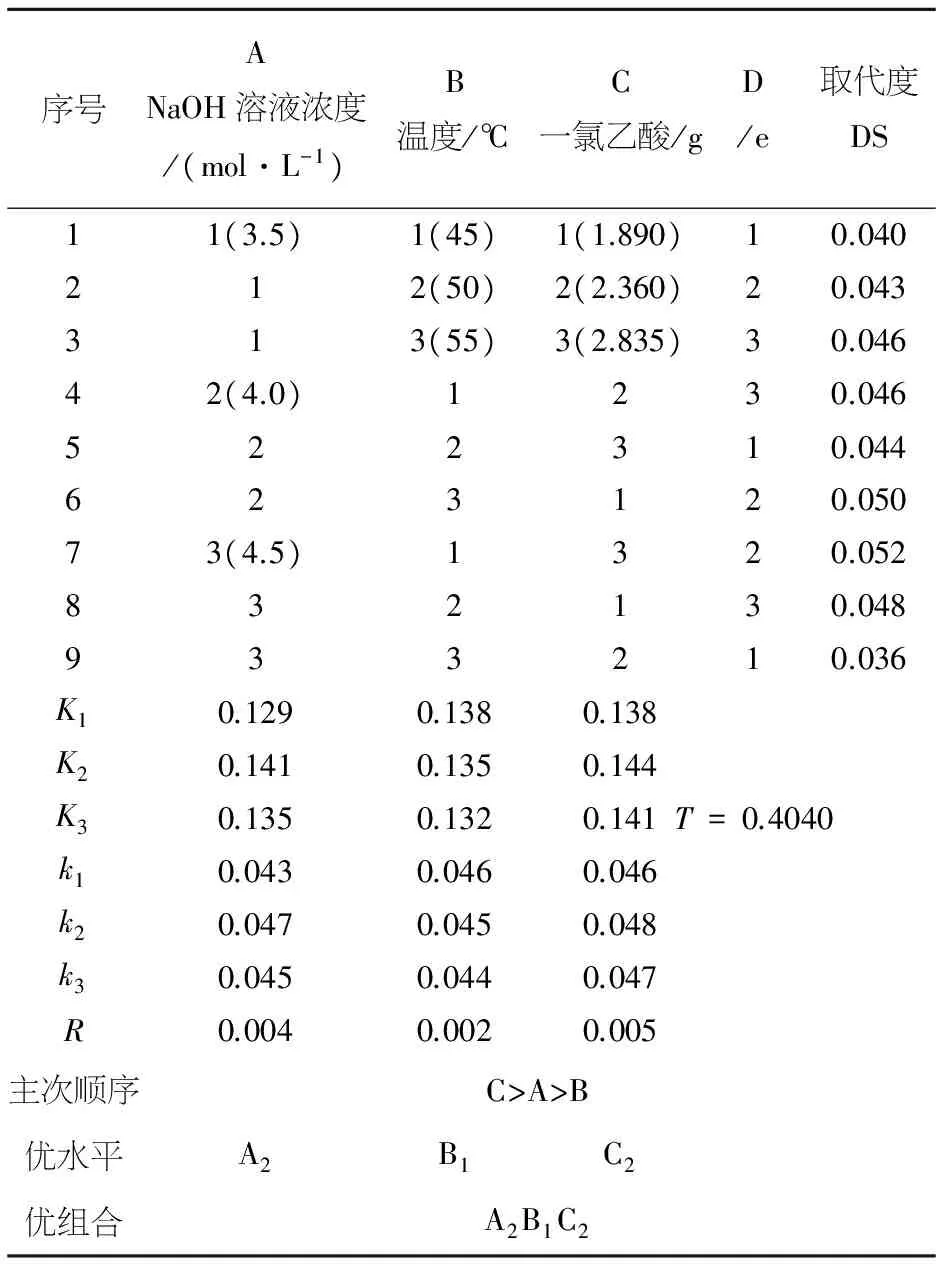
表3 L9(34)正交试验结果

表4 正交试验方差分析表
4 结 语
以甜玉米芯多糖作为研究对象,通过将甜玉米芯前处理、脱脂、提糖、浓缩、脱蛋白、脱色、冷冻干燥得到多糖原料,通过羧甲基化进一步对其进行分子修饰和改性,得到了不同取代度的改性后甜玉米芯多糖,采用超声波提取法对甜玉米芯进行了多糖的提取,测得所提多糖百分含量为21.32%.甜玉米芯多糖的羧甲基化修饰反应主要包括2个阶段:多糖与NaOH溶液作用形成活性中心,多糖分子变成了多糖氧负离子溶液,此阶段增加浓度可促进羧甲基化反应的进行,但达到一定程度之后再继续增加会导致副反应的发生.然后与醚化试剂一氯乙酸发生亲核取代反应,键断裂与多糖负氧离子形成新的多糖分子,即为羧甲基化后的甜玉米芯多糖.通过单因素试验对所得甜玉米芯多糖进行羧甲基化改性得到的最佳改性工艺条件为:NaOH溶液浓度为4.0 mol/L,温度50 ℃,一氯乙酸用量2.360 g.在此条件下得到羧甲基化多糖取代度为0.0500.通过正交试验对所得甜玉米芯多糖进行羧甲基化改性并优化了改性工艺,得到最佳工艺条件为NaOH溶液浓度为4.0 mol/L,温度45 ℃,一氯乙酸用量2.360 g.在此条件下得到羧甲基化多糖取代度为0.051 6.
[1] 亢晓霞. 甜玉米酸奶的工艺及风味的研究[D].武汉:华中农业大学硕士论文,2009.
[2] 黄世勇.广西横县甜玉米产业发展中的公共服务研究[D]. 武汉:华中农业大学硕士论文, 2008.
[3] 赵军华.浙江省甜玉米发展现状与对策研究[D].杭州:浙江大学硕士论文,2009.
[4] 田 卫.植物多糖的研究[D].甘肃:兰州大学硕士论文,2007.
[5] VERRAEST D L,PETERS J A,KUZEE H C,etal. Carboxymethylation of inulin[J]. Carbohydrate Research.1995,271(1):101-112.
[6] 严 成,严 夏. 枸杞多糖提取工艺比较及体外抗氧化性研究[J]. 食品科学, 2008(7): 183-187.
[7] 赵小旭. 东北林蛙皮多糖的提取、纯化、结构分析及抗氧化活性研究[D]. 哈尔滨: 东北林业大学, 2012.
[8] 焦中高, 刘杰超, 王思新. 羧甲基化红枣多糖制备及其活性[J]. 食品科学, 2011, 32(17): 176-180.
[9] 周 瑞, 田呈瑞, 张 静, 等. 鸡腿菇多糖羧甲基修饰及其抗氧化性研究[J]. 食品科学, 2010, 13: 10-15.
[10] 陈 慧, 陈义勇. 白背毛木耳多糖APP3a羧甲基化修饰工艺研究[J]. 食品工业科技, 2016 (1): 258-262,274.
[11] 李 哲, 袁 媛, 朱旻鹏, 等. 米糠多糖羧甲基化反应条件优化[J]. 食品与机械, 2016(1): 135-139,166.
[12] 吴 春,杜小雨.微波磷酸法制备玉米芯活性炭[J].哈尔滨商业大学学报:自然科学版,2017,33(2):163-167.
Modificationofpolysaccharidesfromsweetcorncobs
XIE Jing-nan, WANG Xin, MA Yong-qiang, WU Yuan-yuan
(Key Laboratory of Food Science and Engineering, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
Polysaccharide molecules released from the cell wall or cytoplasm by the way of cell wall with sweet corncobs as raw material. The polysaccharides were obtained by dissolving the polysaccharides after removal of protein and pigment, ethanol precipitation. On this basis, the molecular modification technology applied to sweet corncob polysaccharides and its molecular modification and modification by the carboxymethylation method. The single factor conditions of carboxymethylation modification with sodium hydroxide solution concentration, MCA dosage and reaction temperature as single factor conditions. The optimal reaction conditions of the modification were determined by orthogonal test on the basis of single factor experiment. The concentration of sodium hydroxide solution, the amount of MCA and the reaction temperature was 4.0 mol/L, 2.360 g and 45 ℃, respectively. The degree of substitution of carboxymethyl polysaccharides was 0.051 6 under the condition.
sweet corn cob; polysaccharides; carboxymethylation
2016-12-14.
谢静南(1993-),女,硕士,研究方向:食品生物技术.
王 鑫(1984-),女,博士,研究方向:农产品加工及贮藏,食品生物技术.
TQ281
:A
1672-0946(2017)04-0455-05

