金磁微粒的制备及其固定牛血清蛋白的研究
韩博林,关桦楠,刘晓飞,王 鑫,徐丽萍,陈凤莲,王 薇
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨150076)
金磁微粒的制备及其固定牛血清蛋白的研究
韩博林,关桦楠,刘晓飞,王 鑫,徐丽萍,陈凤莲,王 薇
(哈尔滨商业大学 食品工程学院 省高校食品科学与工程重点实验室,哈尔滨150076)
采用水热法快速制备Fe3O4纳米粒子,并通过表面氨基化与金纳米粒子自组装构建金磁微粒(Fe3O4@Au).表征Fe3O4@Au理化性质,并优化Fe3O4@Au对牛血清蛋白的固定体系.实验结果表明,所制备的金纳米粒子平均粒径达到(7.8±0.4) nm,氨基化的磁性材料可以固载金纳米粒子,金磁微粒饱和磁化强度为61 emu/g;金磁微粒对牛血清蛋白的固定化体系为金磁微粒添加量0.1 g,固定化温度50 ℃,固定化时间10 min,且平均固定量为5.189 mg/g.
金磁微粒;牛血清蛋白;固定化;优化工艺
金磁微粒是指表面包覆层包含金纳米粒,内核为磁性材料的复合纳米微粒[1-3],因其集合了外磁场中可分离性和金纳米粒的生物快速固定化等特点[4-5],在固定化酶、免疫测定、生物分离、DNA的分离、食品检验、核酸纯化[6-8]、肿瘤靶向药物载体等诸多领域有着广泛的应用前景[9-10].
固定化蛋白质的性能很大程度上取决于固定化蛋白质所使用载体材料.使用特定的添加剂例如电解质,聚合电解质以及多元醇等都比较有效.此外通过共价键将蛋白质截留在无机、有机以及聚合物基底上也是非常有效的固定化方法[11-12].常用固定化材料包括无机、有机聚合物、凝胶以及生物材料等.传统的蛋白质分离方法有盐析法、有机溶剂沉淀法、膜分离技术等,一般是通过改变蛋白质溶液的pH值、介电常数、温度或者是离子强度等因素来达到分离蛋白质的目的,这些方法步骤繁琐、耗能非常大并且对蛋白质的性能结构有很大影响[13-15].利用功能化磁性粒子分离蛋白,将磁性复合粒子与所要分离的蛋白混合在一起作用一段时间,然后磁分离即可.分离过程中不需对混合溶液进行调整,快捷、简便,还避免了传统分离中蛋白质的过度损失[16-17].
本研究以小牛血清蛋白(BSA)为模型,采用氨基化法制备金磁微粒,并构建其快速吸附固定小牛血清蛋白的体系,为蛋白质的固定、分离和纯化的相关研究积累基本资料.
1 材料与方法
1.1试验材料及仪器
FeCl3·6H2O、 NaAc·3H2O、氯金酸、乙二醇和PEG-4000均购自于天津市科密欧化学试剂有限公司;3-氨丙基三乙氧基硅烷(APTES)和牛血清蛋白(BSA)购自于国药集团化学试剂有限公司;试验中所用试剂均为分析纯.水热反应釜(上海耀冠仪器有限公司);透射电子显微镜(日本电子株式会社);激光粒度分布仪(美国麦克仪器公司);X射线多晶衍射仪(荷兰帕纳科公司);振动磁强计(北京翠海佳诚磁电科技有限责任公司).
1.2实验方法
1.2.1 纳米Fe3O4的制备
将1.35g的FeCl3·6H2O溶于40 mL乙二醇中,依次加入3.6 g的与1.0g PEG-4000,形成均一溶液后再搅拌30 min.然后将溶液倒入50mL 水热反应釜中,200 ℃保持8 h,结束后冷却至室温.所得黑色的产物用乙醇和水各洗涤3次.
1.2.2 金纳米粒子的制备
将10 g新鲜橘子皮粉碎并浸泡于100 mL的去离子水中,再将浸泡液于4 000 r/min条件下,离心3 min,取上清液,此上清液即为原液,冰箱4 ℃条件下保存.室温条件下,将提前4 ℃预冷的20 mL氯金酸溶液(1%,W/V)置于反应皿中,伴随磁力搅拌器温和搅动;2 min后,迅速加入橘皮浸泡工作液5 mL(20%原液),随即观察颜色的变化,即由黄色变为紫色再变为酒红色,当体系颜色出现酒红色时,搅拌速度提升,10 min后结束反应,获得金纳米粒子,将反应液置于冰箱4 ℃条件下保存.
1.2.3 金磁微粒的制备
取2 g合成的Fe3O4纳米微粒超声分散在50 mL含有20%乙醇水溶液中,逐滴加入1 mLAPTES,室温下搅拌7 h反应结束后得到浅棕色带细微颗粒的悬浊液,产物即为氨基化修饰后的Fe3O4纳米微粒.此产物用0.1 mol/L的HCl-乙醇溶液磁分离清洗3次,烘干后备用.取上述制备的氨基修饰的Fe3O4纳米微粒2 g于室温下150 r/min搅拌中迅速加入20 mL所制备的金纳米粒子溶液中,混合溶液由棕色逐渐变淡,低速搅拌反应12 h后,获得金磁微粒Fe3O4@Au.
1.2.4 表征
将制备的磁性材料粉末用适量的蒸馏水稀释后,置于超声波清洗器上超声振荡使其均匀分散,然后用激光粒度分布仪检测粒径的大小及分布情况.利用透射电子显微镜观察材料的形貌和粒径,其工作电压为80 kV.吸附材料的磁性能采用振动磁强计室温下测得.采用N2吸附BET 法测定材料的比表面积.采用傅里叶变换红外光谱仪进行分析,将合成的干燥的磁性纳米粒子粉末与溴化钾混合,充分研磨后压片,在红外光谱仪下进行表征.根据得到的红外光谱图对磁性纳米粒子产品进行分析.
1.2.5 BSA标准曲线的构建
分别配置8 mL质量浓度为200、100、50、25、12.5、6.25 μg/mL的牛血清蛋白标准液;摇匀放置5 min,以蒸馏水为空白,测定280 nm处吸光度,以吸光度为纵坐标,BSA质量浓度为横坐标绘制标准曲线.
1.2.6 单因素优化Fe3O4@Au微粒对BSA的固定体系
将一定量的Fe3O4@Au微粒(0.01、0.02、0.05、0.1、0.2 g)加入到8 mL(100 μg/mL) BSA溶液中,再将反应体系放置于不同温度的(4 ℃、室温、37 ℃、50 ℃、60 ℃)水浴锅中,水浴不同时间(5、10、20、30、60 min),测定280 nm处吸光度,重复试验3次.以固定量作为衡量指标,得出BSA固定量,优化Fe3O4@Au微粒对BSA的固定体系.
1.2.7 正交设计优化Fe3O4@Au对BSA固定体系的影响
根据正交设计表,分别制备不同的处理,将一定量的Fe3O4@Au加入到8 mL(100 μg/mL) BSA溶液中,再将反应体系放置于某一温度的水浴锅中,水浴不同时间后取出,采用磁铁将Fe3O4@Au固定在离心管底部,吸取上清液3 mL,缓慢通过微孔滤膜,获得含有游离BSA的反应液.以蒸馏水为空白,测定280 nm处吸光度,计算出BSA固定量,验证最优条件.
2 结果与讨论
2.1 Fe3O4纳米粒子的表征
从图1(A)中可以看出,所制备的Fe3O4纳米粒子为球形,存在团聚现象,平均粒径约为130nm.粒子聚集在一起这是由于磁性纳米粒子尺寸较小,比表面积大,具有高的比表面能,粒子间的偶极距作用使得粒子之间容易发生聚集,用以减小比表面能.通过比表面积仪测定Fe3O4纳米粒子比表面积为18.967 5 m2/g.为了考察产物的晶态结构,对其进行XRD分析,结果见图1(B).结果表明,所制备的纳米粒子在2θ为30.32°、35.47°、43.13°、53.50°、56.99°和62.58°时出现的特征衍射峰与标准卡片JCPDS 79-419特征峰对应,峰型尖锐,合成产物的基础仍为Fe3O4纳米粒子.评估Fe3O4纳米粒子的磁性特点,根据Fe3O4纳米粒子在300K的磁滞回线(Oe=79.578 A/m)结果所得,纳米Fe3O4为超顺磁性,测得磁饱和强度值(M)分别为66 emu/g.

图1 Fe3O4纳米粒子的扫描电子显微镜照片(A)和X射线衍射图谱(B)
2.2金纳米粒子的表征
将对所制备的金纳米粒子进行系统的表征.由图2(A)可知,橘皮浸泡液制备的金纳米粒子在波长530 nm处具有明显的吸收峰,初步判定橘皮浸泡液可以制备出金纳米粒子.采用透射电子扫描显微镜观察所制备出的金纳米粒子的外观形貌和粒径大小,结果见图2(B).由结果可知,所制备出的金纳米粒子形状均一,基本呈现圆球形,金纳米粒子分散度最好,基本没有聚集.利用激光粒度分布仪测得,橘皮浸泡液所制备的金纳米粒子的粒径分布见图5.由图5可知,金纳米粒子粒径呈现正态分布,主要分布在7~9 nm范围内,占整个分布体系的79%,平均粒径达到(7.8±0.4) nm.
2.3金磁微粒的表征
从图3可知,Fe3O4纳米粒子的表面吸附有密集的金纳米粒子,结果表明氨基化的磁性材料可以有效的固载金纳米粒子.原因是经过APTES修饰后的Fe3O4纳米粒子在表面形成一个氨基单分子层,金纳米粒子可以通过Au-N等原子之间的相互作用将金纳米粒子吸附在磁性颗粒表面形成金磁微粒.利用振动样品磁强计分别测量金磁微粒的磁滞回线组装型金磁微粒饱和磁化强度为61 emu/g,说明包覆Au的含量升高会导致复合微粒磁化强度的轻微降低,同时较低的饱和磁化强度也表明对比于组装型的金磁微粒,核壳型金磁微粒其中Fe3O4相对含量低而Au相对含量高,这一结论和其他同类磁性纳米复合微粒的磁学性质一致[14-17].
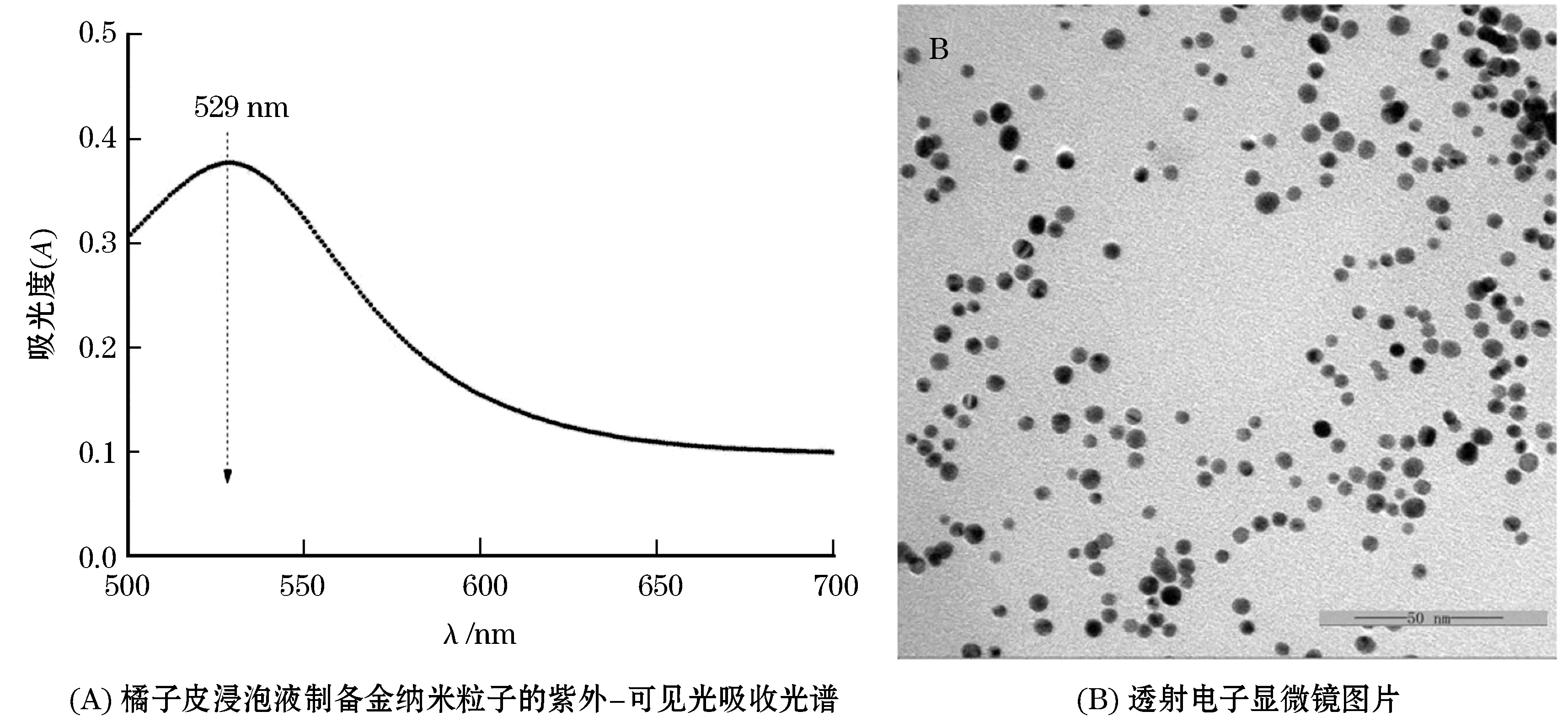
图2金纳米粒子的表征

图3 Fe3O4@Au透射电子显微镜图片
2.4 BSA标准曲线的构建
实验中,不同浓度的牛血清蛋白溶液为变量,用可见分光光度计测其吸光度,构建其标准曲线,结果见图4.根据图4可知,在6.25~200 μg/mL之间,BSA标准曲线为y=0.000 7x+0.006 4.R2=0.996 7,说明呈现较好的线性关系,可作为标准曲线的定量范围.
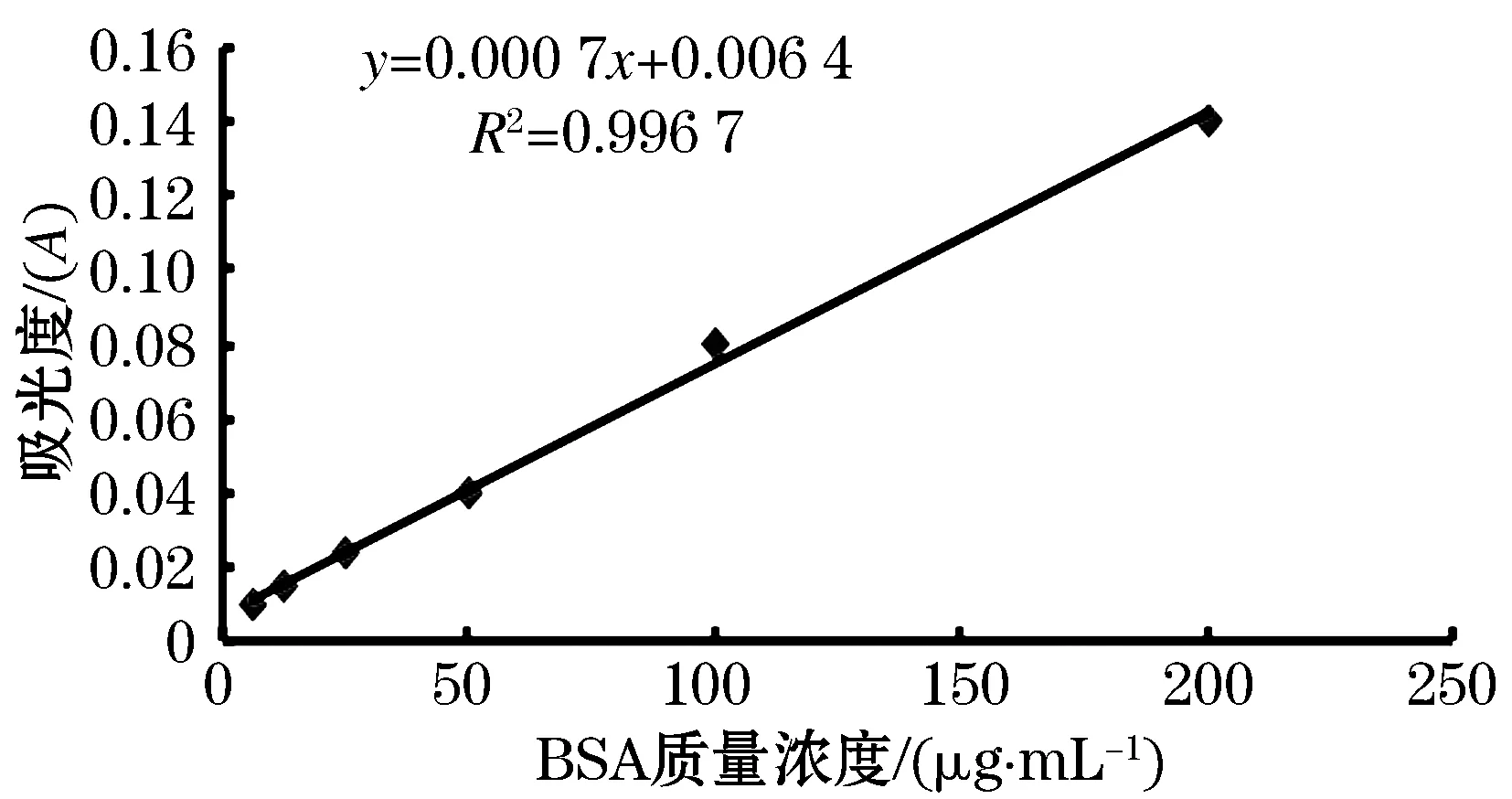
图4 牛血清蛋白溶液吸光度-质量浓度标准曲线
2.5单因素试验优化BSA固定体系
2.5.1 Fe3O4@Au添加量对BSA固定体系的影响
由图5可知,Fe3O4@Au微粒的添加量对牛血清蛋白的固定化体系有影响.当添加量在0.01~0.05 g范围内时,随着添加量的增加BSA固定量呈现出缓慢上升的趋势;当添加量在0.05~0.1 g时,对BSA的固定量处于快速增加阶段.添加量在0.1g~0.2 g范围内时,固定量缓慢平稳上升.综上所述,选择0.05、0.1 g和0.2 g 三个添加量水平参与正交试验设计.
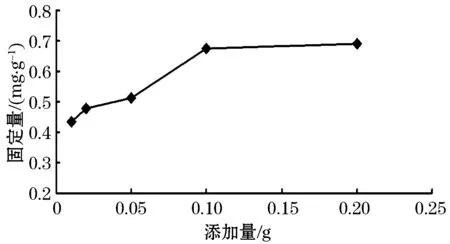
图5 Fe3O4@Au添加量对BSA固定量的影响
2.5.2 吸附温度对BSA固定量的影响
由图6可知,当温度在4~50 ℃范围内时,固定化温度可以影响牛血清蛋白的固定量,随着固定化的温度不断升高,固定量呈上升趋势.在固定化温度50 ℃以后,固定量稍有下降,表明温度过高会使活性减弱.根据实验结果,选择37、50 ℃和60 ℃三个温度水平参与正交试验设计.
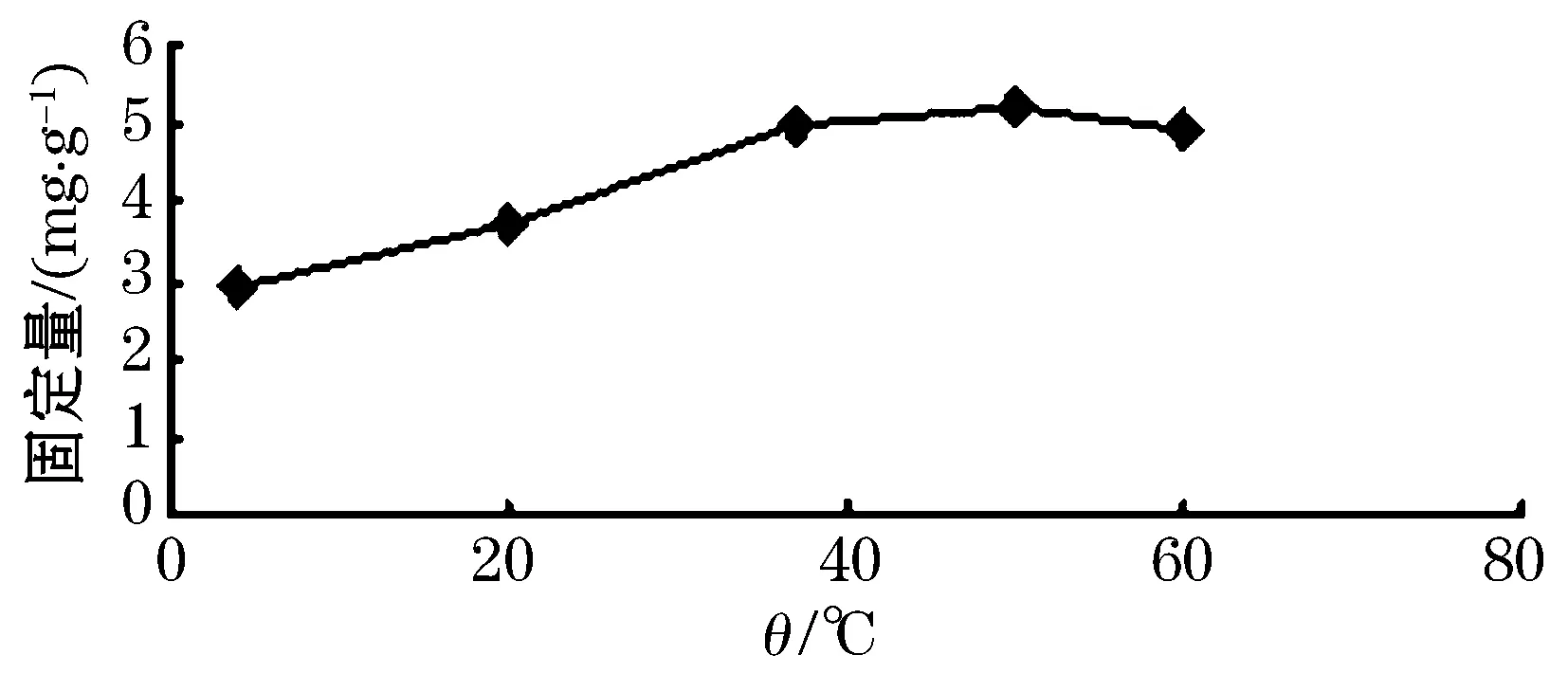
图6 吸附温度对BSA固定量的影响
2.5.3 吸附时间对BSA固定体系的影响
结果如图7所示,随着吸附时间的不断增加,牛血清蛋白固定量呈不断上升趋势.吸附时间为5~30 min范围内时,固定牛血清蛋白的量呈上升趋势;吸附时间在30~60 min范围内时,固定牛血清蛋白的量呈下降趋势.根据实验结果,选择10、20 min和30 min三个吸附时间水平参与正交试验设计.
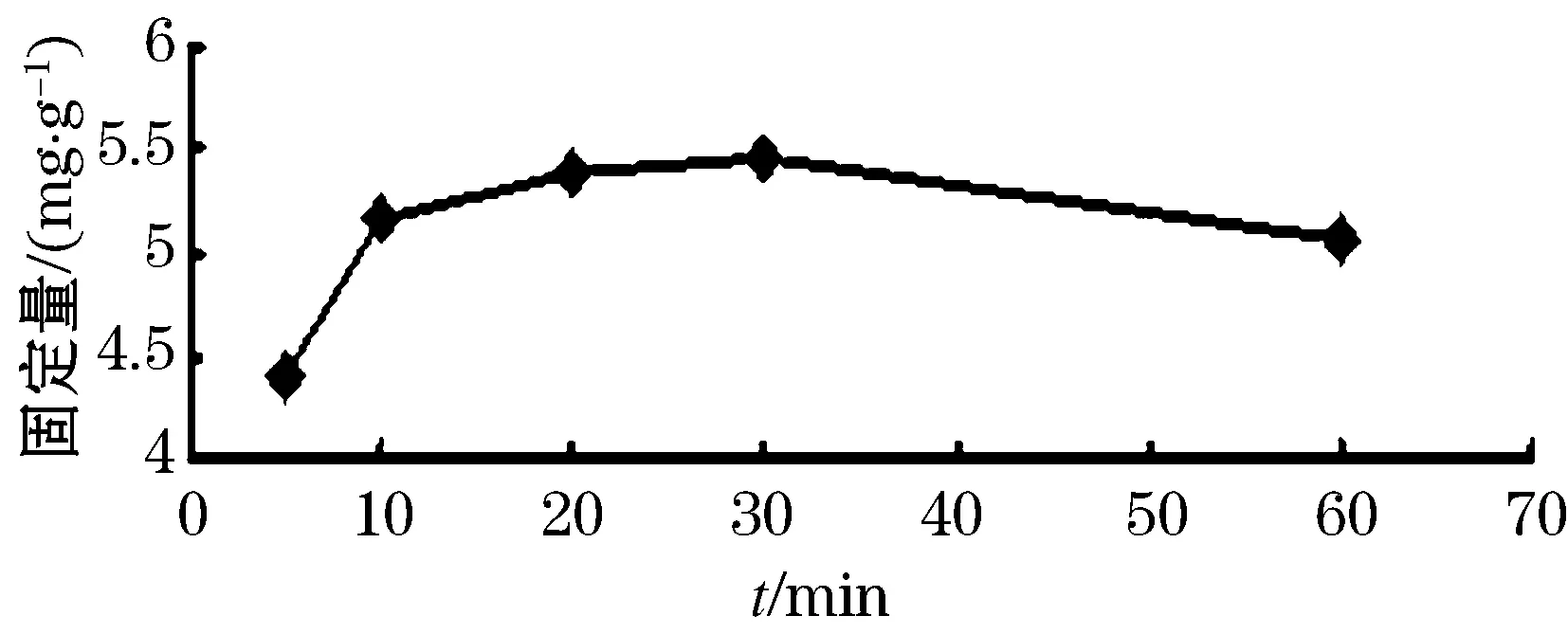
图7 吸附时间对BSA固定量的影响
2.6正交试验结果分析
以牛血清蛋白的固定量作为考察指标,采用L9(34)做正交试验表进行正交试验,再通过极差分析法确定最佳工艺条件.由表1可知,实验中各因素对牛血清蛋白固定量的影响主次顺序为:A>B>C,即Fe3O4@Au添加量>固定化温度>固定化时间.通过极差分析确定的最优方案组合为:A2B3C1,即Fe3O4@Au添加量0.1 g,固定化温度60 ℃,固定化时间10 min.正交优化的结果与单因素优化结果基本吻合,以最优工艺进行三次平行试验,BSA平均固定量约为5.189 mg/g.
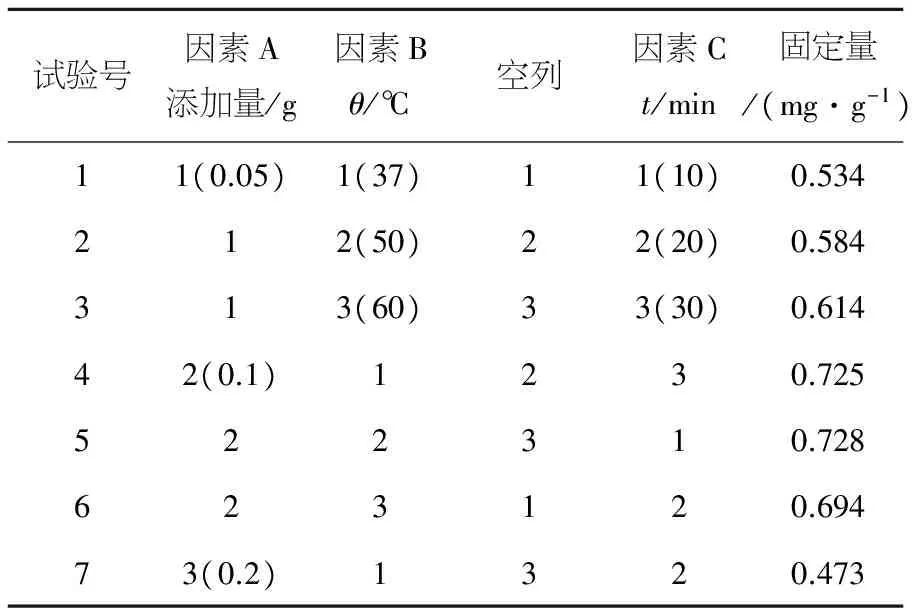
表1 正交实验结果分析
续表1
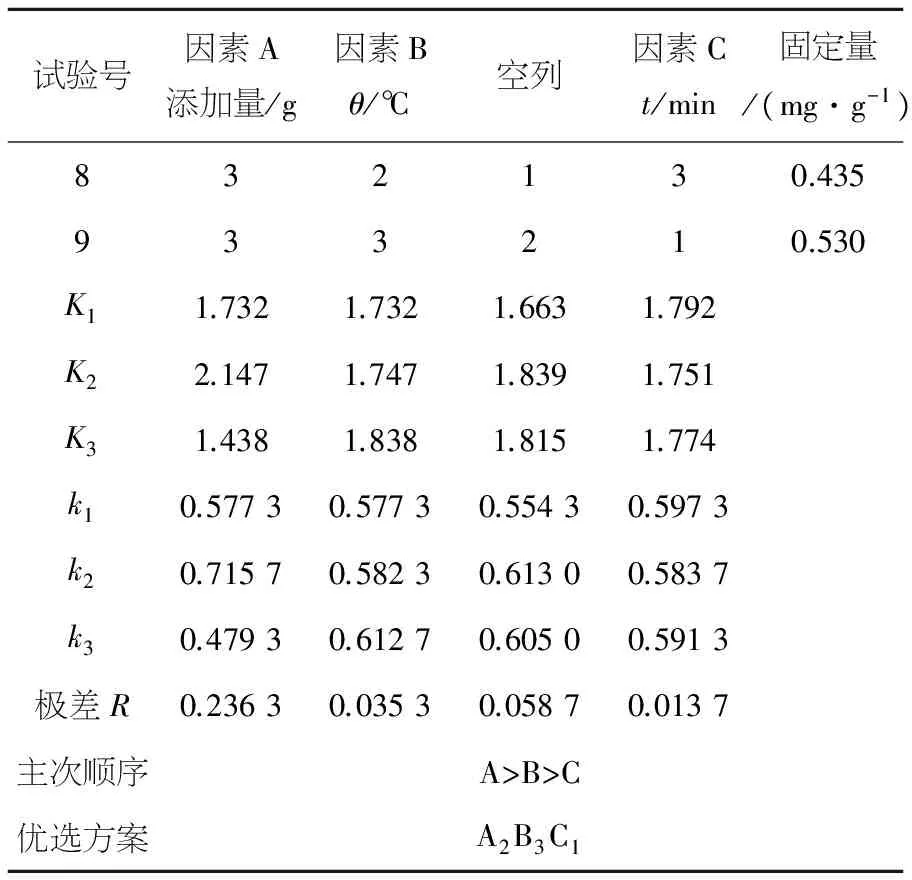
试验号因素A添加量/g因素Bθ/℃空列因素Ct/min固定量/(mg·g-1)832130.435933210.530K11.7321.7321.6631.792K22.1471.7471.8391.751K31.4381.8381.8151.774k10.57730.57730.55430.5973k20.71570.58230.61300.5837k30.47930.61270.60500.5913极差R0.23630.03530.05870.0137主次顺序A>B>C优选方案A2B3C1
3 结 语
本文采用自组装的方法制备了功能性的金磁微粒Fe3O4@Au.所制备的金磁微粒除具有磁性纳米微粒用于磁分离的特性外,同时其外包覆的金层具有金纳米粒具有的生物快速固定化特点,并在固定化酶、免疫测定、生物分离分类和DNA的分离等诸多领域有着广泛的应用前景.
[1] 姚素薇, 邹 毅, 张卫国. 金纳米粒子的特性、制备及应用研究进展[J]. 化工进展, 2007, 26(3): 310-319.
[2] SEGAL I, ZABLOTSKAYA A, LUKEVICS E,etal. Synthesis, physico-chemical and biological study of trialkylsiloxyalkyl amine coated iron oxide/oleic acid magnetic nanoparticles for the treatment of cancer [J]. Appl Organomet Chem, 2008, 22: 82-88.
[3] 崔亚丽, 张连营, 苏 蜻. 组装型金磁微粒的制备及其在免疫学检测中的应用[J]. 中国科学B辑. 化学, 2006, 36(2): 159-165.
[4] 赵晓鹏, 段 旭. 纳米材料的分子自组装合成述评[J]. 材料导报, 2001, 15(4): 44-47.
[5] BUTTER K, KASSAPIDOU K, VROEGE G,etal. Preparation and properties of colloidal iron dispersions [J]. Journal of colloid and interface science, 2005, 287(2): 485-495.
[6] ASTRUC M. Gold Nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis and nanotechnology [J]. Chem. Rev, 2004, 104: 293-346.
[7] SHEN X C, FANG X Z, ZHOU Y H,etal. Synthesis and characterization of 3-aminopropyl triethoxysilane-modified super paramagnetic magnetite nanoparticles [J]. Chem Lett., 2004, 33(11): 1468-1469.
[8] 任 琦, 周 漩, 倪忠斌, 等. 核-壳结构磁性复合微球的制备与表征[J]. 化工新型材料, 2009, 37(12): 23-25.
[9] 王延梅, 封麟先. 磁性高分子微球的研究进展[J]. 高分子材料科学与工程, 1998, 14(5): 6-8.
[10] MENAA B, HERRERO M, RIVES V,etal. Favourable influence of hydrophobic surfaces on protein structure in porous organically-modified silica glasses [J]. Biomaterials, 2008, 29: 2710-2718.
[11] 王玉恒, 寇正福, 江 邦, 等. 大孔球形纤维素载体固定化单宁的制备及其对蛋白质的吸附性能[J]. 离子交换与吸附, 2007, 23(4): 360-367.
[12] 龚 涛. 模板细乳液聚合法制备磁性复合微球及其在蛋白分离纯化中的而应用[D]. 上海: 复旦大学, 2008.
[13] HUANG X L, ZHUANG J, CHEN D,etal. General strategy for designing functionalized magnetic microspheres for different bioapplications [J]. Langmuir, 2009, 25(19): 11657-11663.
[14] YANG Y, YONG X B, LI Y F,etal. Characterization of Candida rugosa lipase immobilized onto magnetic microspheres with hydrophilicity [J]. Process Biochem, 2008, 43: 1179-1185.
[15] GONG X Q, PENG S L, WEN W J,etal. Design and fabrication of magnetically functionalized core/shell microspheres for smart drug delivery [J]. Adv Funct Mater, 2009, 19: 292-297.
[16] YANG Y, YONG X B, LI Y F,etal. Characterization of Candida rugosa lipase immobilized onto magnetic microspheres with hydrophilicity [J]. Process Biochem, 2008, 43: 1179-1185.
[17] GUO N, WU D C, PAN X H,etal. Magnetic polymer microspheres with azidocarbony groups: synthesis, characterization and application in protein immobilization [J]. Appl Polym Sci, 2009, 112: 2383-2390.
Preparationandapplicationtoimmobilizationofbovineserumalbumenongoldmagneticparticles
HAN Bo-lin, GUAN Hua-nan, LIU Xiao-fei, WANG Xin, XU Li-ping, CHEN Feng-lian, WANG Wei
(Key Laboratory of Food Science and Engineering, School of Food Engineering, Harbin University of Commerce, Harbin 150076, China)
In this paper, the Fe3O4nanoparticles were prepared using hydrothermal method. The gold magnetic particles (Fe3O4@Au) were formed by the Fe3O4nanoparticles combined with gold nanoparticles using layer-by-layer method based on the surface amino groups. The preparation processes and properties of the assembling-type Fe3O4@Au were described in this paper. And also the system of bovine serum albumin was established by single factor analysis and orthogonal design analysis. The results showed that the average particle size of gold nanoparticles was (7.8±0.4) nm. The magnetic materials functionalized with amino groups could be loaded with gold nanoparticles, and the saturation magnetization of Fe3O4@Au was 61 emu/g. The optimal process was determined that the quantity of gold magnetic particles was 0.1 g, and the temperature was 50 ℃, the time of immobilization was 10 min. The highest immobilize quantity was 5.189 mg/g under the condition of the optimization experiment.
gold magnetic particles; bovine serum albumen; immobilization; optimal process
2016-11-14.
韩博林(1993-),男,硕士,研究方向:农产品加工与贮藏.
关桦楠(1983-),男,博士,副教授,研究方向:食品质量与安全.
O647
:A
1672-0946(2017)04-0450-05

