叶黄素对人RPE细胞氧化应激损伤的保护作用
杨 敏,张倩玉,黄宏伟,马 譞,王 娇,马 乐
(1 西安交通大学公共卫生学院,西安 710061;2西安交通大学第一附属医院,西安 710061)
叶黄素对人RPE细胞氧化应激损伤的保护作用
杨 敏1,张倩玉1,黄宏伟1,马 譞2,王 娇2,马 乐1
(1西安交通大学公共卫生学院,西安 710061;2西安交通大学第一附属医院,西安 710061)
目的:外源性给予过氧化氢(H2O2)诱导构建人视网膜色素上皮细胞(Retinal pigment epithelial,RPE)细胞氧化损伤模型,探究H2O2的最佳建模浓度,并探讨叶黄素对H2O2诱导人RPE细胞氧化损伤的保护作用。方法:本研究以人RPE细胞为实验对象。不同浓度H2O2(0、50、100、200、400、600μmol/L)处理RPE细胞1 h后,观察细胞形态的改变,并测定细胞生存率和细胞内ROS浓度进而确定H2O2的最佳建模浓度。不同剂量叶黄素(1、2.5、5、7.5、10μg/mL)预处理RPE细胞24h,随后给予100μmol/L H2O2作用1h,测定各组细胞生存率和细胞内活性氧(ROS)浓度,从而评价叶黄素对RPE细胞氧化损伤的作用。结果:H2O2作用后,随H2O2浓度的增加,RPE细胞生存率逐步下降;细胞内ROS浓度随H2O2的浓度增加而显著升高。与损伤对照组相比,各叶黄素处理组RPE细胞生存率显著升高,同时细胞内ROS浓度显著下降。结论:H2O2可导致RPE细胞出现氧化应激损伤,细胞ROS含量显著增加。叶黄素干预后可显著减缓H2O2诱导的氧化应激反应,提示其可通过提高RPE细胞的生存率、抑制细胞内ROS浓度,保护RPE细胞免受氧化损伤,从而对年龄相关性黄斑变性等眼部退行性疾病起到预防和减缓作用。
过氧化氢;视网膜色素上皮细胞;氧化应激;叶黄素
年龄相关性黄斑变性(Age-related macular degeneration,AMD)是一种常见的神经退行性疾病,是导致西方发达国家中老年人视力丧失和致盲的主要眼底疾病[1]。目前该病的确切病因及发病机制仍不清楚,多数研究认为其是一种与遗传、环境、基因、代谢障碍等相关的多因素疾病[2]。视网膜色素上皮(Retinal pigment epithelial,RPE)作为眼底的重要组织,其可通过吞噬光感受器外节盘膜、合成分泌多种生长因子等途径发挥其特定生理功能,从而维持视网膜正常视觉功能[3]。有研究表明,氧化应激可引起RPE细胞功能紊乱及视网膜退行性改变,进而促进AMD的病理发展[4]。累积的活性氧(reactive oxygen species,ROS)引起的氧化应激是造成RPE细胞功能紊乱的重要使动因素[5]。过氧化氢(H2O2)作为主要的活性氧类物质,急性H2O2作用则会导致细胞出现氧化损伤[6],因而其常作为细胞氧化损伤模型的诱导剂。
叶黄素是一种天然的优良抗氧化剂,在机体内可特异性富集于视网膜黄斑区[7-8]。既往人群叶黄素干预研究结果提示其在维持RPE细胞正常生理功能及保护视网膜免受氧化损伤中扮演重要角色,但其保护机制尚不明确[9-10]。因此,探讨叶黄素对RPE细胞氧化损伤作用的保护机制对深入阐明AMD的发病机制具有重大意义[11]。鉴于以上研究背景,本研究外源性给予H2O2建立RPE细胞氧化损伤模型,初步探讨叶黄素对视网膜氧化损伤的保护作用,揭示叶黄素对RPE细胞保护功能的作用机理。通过探讨H2O2处理与叶黄素干预对RPE细胞的作用机制,为临床上治疗AMD等眼部退行性疾病提供理论依据,为进一步深入开展叶黄素减轻AMD等眼部退行性疾病的分子机制研究奠定实验基础。
1 材料与方法
1.1 主要试剂和仪器
叶黄素(美国ChromeDex公司);人视网膜色素上皮细胞A-RPE 19细胞系(美国标准菌种收集中心,ATCC);改良型 RPMI-1640 培养液(美国HyClone公司);胎牛血清(美国Gibco 公司);青霉素(山东鲁抗医药股份有限公司);链霉素(哈药集团制药总厂);0.25%胰蛋白酶溶液(美国 Solarbio 公司);MTT(美国Sigma公司);ROS试剂盒(南京建成生物工程研究所);30%H2O2(西安化学试剂厂);酶联免疫检测仪(美国 Bio-rad公司);CO2培养箱(美国Thermo公司);倒置相差显微镜AE31型(Motic公司);多功能酶标仪(德国BMG公司)。
1.2 方法
1.2.1 RPE细胞的复苏与培养 取出液氮中的RPE细胞置于37℃水浴迅速解冻,将细胞悬液移入含培养液的15毫升离心管中,800r/min离心5min,弃去上清,加入1 mL RPMI-1640培养液(含体积分数10%胎牛血清和1%的青霉素链霉素混合液),吹打混匀后将细胞悬液移入25 mL细胞培养瓶,置于37℃、5%CO2、湿度为90%的CO2培养箱中培养,待细胞贴壁后换液继续培养。细胞生长至对数期,即80%~90%融合状态时,弃去培养瓶内旧培养液,0.25%胰蛋白酶消化液消化以1:2传代继续培养。
1.2.2 试验分组 H2O2实验正常对照组RPMI-1640培养液培养1h;H2O2处理组不同浓度的H2O2(50、100、200、400、600μmol/L)培养1h。
叶黄素干预试验:损伤对照组100μmol/LH2O2培养1h;叶黄素干预组不同浓度的叶黄素(1、2.5、5、7.5、10μg/mL)培养24h后再更换100μmol/L H2O2继续培养1h。
1.2.3 细胞相对生存活力的测定 RPE细胞以7 000个/孔浓度接种于96孔板,常规培养48h后给予不同浓度梯度H2O2干预作用1h,弃去旧培养液。每孔避光加入20μL 5mg/mL MTT溶液,CO2培养箱培养4h。培养结束后小心弃去上清液,每孔加入150μL二甲基亚砜溶液,微量振荡器震荡10min,用多功能酶标仪于492nm波长处测出每孔吸光度OD值。每组设定5个复孔,3次重复实验,依据式(1)计算各组细胞生存率:

(1)
1.2.4 细胞内ROS水平测定 RPE细胞以2.5×105个/孔接种于6孔板,常规培养48h。每孔避光加入2mL新配的工作浓度为1μmol/L的DCFH-DA探针,37℃培养箱中孵育30min。弃旧培养液,PBS清洗3遍后给予不同浓度梯度H2O2干预作用1h。弃去培养液后以0.25%胰蛋白酶消化液消化制备单细胞悬液,调整细胞密度以7 000个/孔接种于酶标板。以激发波长502nm,发射波长530nm的酶标仪测出每孔荧光强度。每组设定5个复孔,3次重复实验,依据式(2)计算每孔相对荧光强度。

(2)
1.2.5 统计学分析 数据资料以均数±标准差表示,采用SPSS18.0统计软件进行统计分析,比较各组间差异。采用单因素方差分析比较各组细胞的相对生存率及细胞内ROS浓度的差异,LSD法进行两两组间差异比较。P<0.05可认为具有显著性差异。
2 结果与分析
2.1 不同浓度H2O2处理对RPE细胞生存力和ROS水平的影响
由细胞生存率数据结果可知,随着H2O2浓度的增大,细胞生存率逐渐下降;不同组细胞生存率具有显著统计学差异(P<0.01);50组与对照组及100组组间无统计学差异(P>0.05);其余组间两两比较均有显著统计学差异(P<0.01)。ROS检测结果表明H2O2浓度越高,细胞的相对荧光强度比值越大,细胞ROS水平越高。对照组与50μmol/L组两两比较无统计学差异(P>0.05),其余组间两两比较均有统计学差异(P<0.05)(图1~2)。

图1 不同浓度H2O2处理对RPE细胞生存力的影响

图2 不同浓度H2O2处理对RPE细胞内ROS水平的影响注:与对照组比较,**P<0.01
2.2 叶黄素对H2O2氧化损伤后RPE细胞生存率的影响
通过比较H2O2氧化损伤对照组和不同浓度叶黄素干预H2O2损伤后RPE细胞的细胞生存率可知,叶黄素浓度越高,则生存率越高。叶黄素浓度为10μg/mL时,细胞生存率较7.5μg/mL处理组下降,但仍高于实验对照组。组间两两比较,7.5μg/mL处理组与10μg/mL处理组细胞生存率无统计学差异,余组间两两比较均有统计学差异(P<0.01)(图3)。
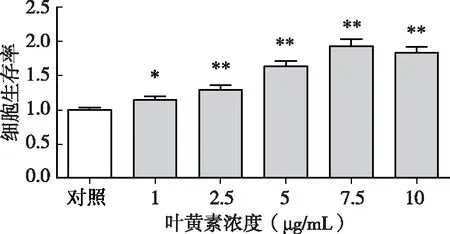
图3 叶黄素对H2O2损伤后RPE细胞的细胞生存率的影响注:与损伤对照组比较,**P<0.01、*P<0.05
2.3 叶黄素对H2O2诱导氧化损伤后细胞内ROS浓度的影响
不同浓度叶黄素预处理RPE细胞,各组间细胞相对荧光强度无统计学差异(P>0.05)。与损伤对照组相比,叶黄素各处理组较对照组细胞相对荧光强度比值下降,差异有统计学意义(P<0.05);叶黄素处理组组间两两比较无统计学差异(P>0.05)(附表、图4)。

附表 不同浓度叶黄素预处理RPE细胞的相对荧光强度

图4 叶黄素对H2O2损伤后RPE细胞内ROS浓度的影响注:与损伤对照组比较,**P<0.01、*P<0.05
3 讨论
在自然生理条件下,随着年龄的增长,人RPE细胞处于慢性、累积性的氧化损伤,逐步引起人RPE细胞正常生理功能紊乱,最终诱导RPE细胞凋亡坏死[12]。既往研究者主要采用蓝光照射和H2O2处理两种模型,实验证明两种处理方法都可成功诱导RPE细胞内ROS生成[13-14]。本研究结果显示,外源性50~600 μmol/L H2O2作用1 h后,可导致体外培养的RPE细胞活力呈现浓度依赖性显著降低,浓度越高,细胞损伤越重。此外,随H2O2浓度的增加凋亡程度增加,且与对照组相比ROS浓度明显增高,提示H2O2可诱导RPE细胞出现氧化损伤,其程度随H2O2浓度的增加而逐渐加重。为模拟自然条件,本研究采用有统计学差异的最小浓度(100 μmol/L H2O2)处理RPE细胞建立氧化损伤模型。H2O2是一种可在机体内发挥广泛生物介质效应的重要ROS,极易透过细胞膜,可与细胞内Fe2+通过Fenton反应生成高活性的自由基。短时间内暴露于H2O2环境中则会引起细胞正常代谢功能紊乱,可诱导细胞产生氧化应激和炎症反应、促进RPE细胞凋亡[15]。研究发现,当机体处于氧化应激状态时,机体产生的ROS超过其本身清除能力,视网膜上积累的ROS损伤线粒体DNA(mtDNA),氧化系统与抗氧化平衡系统逐步失衡,引起黄斑中心凹受到氧化应激的损害,最终导致与年龄相关的损伤,加速了AMD的发生、发展[16-17]。
叶黄素是一种存在于视网膜黄斑区的含氧类胡萝卜素,其自身不能转化生成维生素A,但在维持人体正常视觉功能中扮演重要角色。其化学结构含有多个不饱和共轭双键且链末端为烃基,该结构特点使其具有抗氧化作用,从而发挥独特而强大的生理功能[8,18]。近期研究发现,叶黄素是视网膜黄斑色素的主要成分,机体摄入叶黄素后可选择性地富集于视网膜黄斑部位,在维持视网膜正常生理功能及预防视网膜损伤中发挥重要作用[7,19]。本研究结果显示,叶黄素可显著提高H2O2氧化损伤后RPE细胞的生存率。叶黄素10 μg/mL组与叶黄素7.5 μg/mL组比较细胞生存率有所下降,但仍显著高于损伤对照组。猜测高剂量的叶黄素可能具有轻微的细胞毒性,在后续的研究中需进一步的验证。在对RPE细胞给予H2O2处理前叶黄素干预24 h,结果发现细胞内ROS浓度较损伤对照组明显下降,但未明显表现出呈剂量浓度依赖性下降。提示叶黄素可能是通过ROS清除作用进而减轻其对RPE细胞的氧化损伤,从而保护RPE细胞。叶黄素的保护机制可能是其可有效清除机体产生的ROS,淬灭大量的单氧基团和过氧化自由基,从而抑制脂类氧化反应,抵御氧化应激造成的继发性细胞损伤,进一步保护视网膜[20]。已有流行病学研究证实一定量的叶黄素摄入可使AMD的发病风险下降。AMD患者补充叶黄素,可提高视网膜黄斑色素密度,减缓黄斑的退化速度,从而提高早期AMD患者的视力水平[21-24]。提示适量增加叶黄素的摄入量可预防年龄相关性眼部退行性疾病的发生。
综上所述,外源性H2O2作用下,RPE细胞内ROS浓度明显增高,细胞生存率呈呈剂量依赖性下降;叶黄素干预后RPE细胞生存率明显提高,细胞内ROS浓度亦明显下降。提示其通过抑制H2O2诱导的氧化应激反应从而减轻H2O2对RPE细胞的损伤作用。叶黄素通过清除ROS过氧化自由基、减少脂质过氧化、抑制炎症因子表达等途径保护RPE细胞并抑制AMD等眼部退行性疾病的发生发展。因此膳食提高叶黄素等天然抗氧化物及其他抗氧化剂的摄入量,维持视网膜氧化状态平衡对AMD等眼部退行性疾病的缓解及治疗具有重大意义。◇
[1]Lim,L.S,Mitchell,P,Seddon,J.M,Holz,F.G.&Wong,T.Y.Age-related macular degeneration[J].Lancet,2012,379(5):1728-1738.
[2]Cheung CM,Li X,Cheng CY,et al.Prevalence,racial variations,and risk factors of age-related macular degeneration in singaporean chinese,indians,and malays.[J].Ophthalmology,2014,121(8):1598-1603.
[3]Jarrett SG,Boulton ME.Consequences of oxidative stress in age-related macular degeneration[J].Mol Aspects Med,2012,33(2):399-417.
[4]Beatty S,Koh H,Phil M,et al.The role of oxidative stress in the pathogenesis of age-related macular degeneration[J].Surv Ophthalmol,2000,45(2):115-134.
[5]李兰根,伟伟,张玉凤,等.H2O2及ox-LDL诱导视网膜色素上皮细胞氧化应激作用的观察[J].内蒙古医科大学学报,2015,37(6):525-529.
[6]韩飞,周孟良.过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J].食品科学,2011,32(5):55-57.
[7]朱海霞,郑建仙.叶黄素的结构、分布、物化性质及生理功能[J].中国食品添加剂,2005,5(5):48-55.
[8]马乐,林晓明.叶黄素对视网膜光损伤的保护作用和机制[J].中国慢性疾病预防与控制,2007,15(4):405-407.
[9]Murthy RK,Ravi K,Balaiya S,et al.Lutein protects retinal pigment epithelium from cytotoxic oxidative stress[J].Cutan Ocul Toxicol,2014,33(2):132-137.
[10]汪明芳,林晓明.叶黄素对视网膜光损伤的保护作用[J].卫生研究,2008,37(1):115-117.
[11]夏立营,刘维佳,寇秋爱,等.叶黄素治疗年龄相关性黄斑变性的临床研究[J].世界中医药,2013,33(5):517-519.
[12]邹玉凌.绿原酸对氧化应激损伤人视网膜色素上皮细胞保护作用的分子机制[D].南昌大学,2014.
[13]Drobek-Slowik M,Karczewicz D,Safranow K.The potential role of oxidative stress in the pathogenesis of the age-related macular degeneration(AMD)[J].Postepy Hig Med Dosw,2007,61(3):28-37.
[14]杨薇粒,金犇,孙靓,等.蓝光暴露对视网膜色素上皮细胞cAMP-PKA信号通路的影响[J].现代预防医学,2015,42(12):2223-2241.
[15]Bailery TA,Kanuga N,Romero IA,et al.Oxidative stress affects the junctional integrity of retinal pigment epithelial cells[J].Invest Ophthalmol Vis Sci,2004,45(2):675-684.
[16]Krinsky NI,Landrum JT,Bone RA.Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye[J].Annu Rev Nutr,2003,23(3):171-201.
[17]Drobek-Slowik M,Karczewicz D,Safranow K.The potential role of oxidative stress in the pathogenesis of the age-related macular degeneration(AMD)[J].Postepy Hig Med Dosw(Online),2007,6(2):28-37.
[18]Schalch W,Cohn W,Barker FM,et al.Xanthophyll accumulation in the human retina during supplementation with lutein or zeaxanthin-the LUXEA(LUtein Xanthophyll Eye Accumulation)study[J].Arch Biochem Biophys,2007,458(2):128-135.
[19]Liu R,Wang T,Zhang B,et al.Lutein and zeaxanthin supplementation and association with visual function in age-related macular degeneration[J].Invest Ophthalmol Vis Sci,2015,56(1):252-258.
[20]Wang W,Connor SL,Johnson EJ,et al.Effect of dietary lutein and zeaxanthin on plasma carotenoids and their transport in lipoproteins in age-related macular degeneration[J].Am J Clin Nutr,2007,85(3):762-769.
[21]Johnson EJ,Chung HY,Caldarella SM,et al.The influence of supplemental lutein and docosahexaenoic acid on serum,lipoproteins,and macular pigmentation[J].Am J Clin Nutr,2008,87(5):1521-1529.
[22]杨旭.叶黄素对H2O2诱导的人视网膜Muller细胞氧化应激损伤的干预作用及机制研究[D].郑州大学,2014.
[23]Chew BP,Brown CM,Park JS,et al.Dietary lutein inhibits mouse mammary tumor growth by regulating angiogenesis and apoptosis[J].Anticancer Res,2003,23(4):3333-3339.
[24]马婷婷,滕倩,梁惠,等.叶黄素持续补充对机体叶黄素水平及抗氧化能力影响研究[J].中国食物与营养,2016,22(5):61-65.
(责任编辑 李婷婷)
Protective Effect of Lutein on Human RPE Cells from Oxidative Stress
YANG Min1,ZHANG Qian-yu1,HUANG Hong-wei1,MA Xuan2,WANG Jiao2,MA Le1
(1School of Public Health,Xi'an Jiaotong University,Xi'an 710061,China;2The First Affiliated Hospital Medical School of Xi'an Jiaotong University,Xi'an 710061,China)

H2O2;retinal pigment epithelial cell;oxidative stress;lutein
国家自然科学基金(项目编号:81202198)。
杨敏(1993— ),女,硕士,研究方向:营养流行病学。
马乐(1983— ),男,博士,硕士生导师,研究方向:营养与慢性病。

