多靶点粪便基因检测在社区结直肠癌筛查中的应用价值研究
彭 晨,蒋小华,姜景蔚,郑 萍
·论著·
多靶点粪便基因检测在社区结直肠癌筛查中的应用价值研究
彭 晨1,蒋小华2*,姜景蔚1,郑 萍2
目的探讨多靶点粪便基因检测在社区结直肠癌(CRC)筛查中的应用价值。方法于2014年8月—2016年7月对浦东新区陆家嘴社区、三林社区、迎博社区居民进行筛查,包括采用《上海市社区居民大肠癌筛查危险度评估表》进行的危险度评估以及2次粪便隐血试验(FOBT)。以危险度评估阳性且2次FOBT中任1次阳性为初筛阳性,纳入试验组(n=294);以危险度评估阴性且2次FOBT均阴性为初筛阴性,纳入对照组(n=102)。入组居民在完成社区筛查后2周内至同济大学附属东方医院行肠镜检查并取病理活检,行肠镜检查前提取粪便DNA,检测异常甲基化BMP3、NDRG4启动子区域、KRAS突变。以肠镜和病理检查结果为“金标准”,评价多靶点粪便基因检测在试验组和对照组中的诊断价值。结果在试验组居民中,多靶点粪便基因检测对CRC、癌前病变的灵敏度分别为85.7%〔95%CI(59.8%,100.0%)〕、75.0%〔95%CI(32.6%,100.0%)〕,对普通息肉和完全阴性人群的特异度为84.0%〔95%CI(79.7%,88.3%)〕。在对照组患者中,多靶点粪便基因检测对普通息肉和完全阴性人群的特异度为83.8%〔95%CI(76.7%,89.2%)〕。结论多靶点粪便基因检测与FOBT联合应用于社区CRC筛查,可以提高社区CRC筛查的准确性。
结直肠肿瘤;粪便;基因检测;结肠镜检查;潜血试验;筛查
彭晨,蒋小华,姜景蔚,等.多靶点粪便基因检测在社区结直肠癌筛查中的应用价值研究[J].中国全科医学,2017,20(25):3132-3135.[www.chinagp.net]
PENG C,JIANG X H,JIANG J W,et al.Values of multi-target stool DNA test for community-based colorectal cancer screening[J].Chinese General Practice,2017,20(25):3132-3135.
当前我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率逐年升高,在肿瘤发病率中居第4位,死亡率居第5位[1]。早期CRC经治疗后的5年生存率可达90%以上[2],通过筛查进行干预是降低CRC发病率和死亡率的有效措施[3]。粪便隐血试验(fecal occult blood test,FOBT)是目前应用最为广泛的CRC筛查方法之一,但存在假阳性率高、需多次检测等缺陷[4]。目前,国内外已经有应用粪便DNA检测进行CRC筛查的相关研究,但使用的基因靶点各不相同[5-6]。2014年IMPERIALE等[7]报道了应用异常甲基化BMP3、NDRG4启动子区域、KRAS突变等基因检测(Cologuard检测)进行肠癌筛查的结果,发现其对CRC、癌前病变的检测灵敏度(分别为92.3%、42.4%)明显高于免疫法粪便检测的结果(分别为73.8%、23.8%),但其对良性病变和完全阴性人群的特异度无明显优势。基于此,美国食品药品管理局(FDA)已批准将Cologuard检测应用于普通人群的CRC筛查,但我国尚缺乏将其应用于社区CRC筛查的相关报道。“社区居民大肠癌筛查项目”是上海市自2012年起开展的重大公共卫生服务项目[8],陆家嘴社区卫生服务中心在2013—2015年共筛查居民11 824人次,检出CRC及癌前病变15例,筛查存在肠镜受检率低、肠癌检出率低的问题[9]。因此,本研究依托该项目,以肠镜和病理检查结果为“金标准”,探讨将粪便多靶点基因检测技术与目前应用广泛的FOBT相结合是否能改善社区CRC筛查的流程、提高筛查准确性,以明确粪便多靶点基因检测在社区CRC筛查中的应用价值,进一步增强社区居民的筛查依从性、降低相关医疗费用。
1 对象与方法
1.1 研究对象 于2014年8月—2016年7月对浦东新区陆家嘴社区、三林社区、迎博社区居民进行筛查。纳入标准:(1)年龄50~75岁[8,10];(2)完成《上海市社区居民大肠癌筛查危险度评估表》和FOBT。排除标准:(1)伴严重肝肾功能不全或心功能不全,无法完成肠镜检查;(2)不愿意参与本研究或不能耐受肠镜检查;(3)已确诊为CRC患者。本研究经同济大学附属东方医院伦理委员会审查批准,纳入居民均签署知情同意书。
1.2 研究方法
1.2.1 预试验 于2014年8月—2015年7月选取在同济大学附属东方医院消化中心就诊的CRC患者46例进行预试验,年龄均为50~75岁且经肠镜和病理检查确诊[11]。分别于肠癌手术前7~10 d、术后3个月留取患者粪便,送至同济大学附属东方医院医学转化平台进行FOBT,同时经专用试剂盒提取粪便DNA并检测异常甲基化BMP3、NDRG4启动子区域、KRAS突变等肿瘤基因。
1.2.2 社区筛查及分组方法 筛查方法:(1)由社区卫生服务中心专职医护人员,采用《上海市社区居民大肠癌筛查危险度评估表》对纳入居民进行危险度评估。共9项评价指标,包括:慢性腹泻史、慢性便秘史、黏液和/或血便史、慢性阑尾炎/阑尾切除史、慢性胆囊炎/胆囊切除史、近10年精神创伤/痛苦史、恶性肿瘤史、肠息肉史、一级亲属肠癌史,以第1~6项中≥2项阳性或第7~9项中≥1项阳性为危险度评估阳性。(2)完成危险度评估的居民,发放2支采便器,2次采便的时间间隔为1周,采便后于当天(夏季不超过4 h)送至相应社区卫生服务中心检测,检测方法为胶体金免疫色谱法。分组方法:以危险度评估阳性且2次FOBT中任1次阳性为初筛阳性,纳入试验组(n=294);以危险度评估阴性且2次FOBT均阴性为初筛阴性,纳入对照组(n=102)。
1.2.3 肠镜及病理检查 入组居民在完成社区筛查后2周内,至同济大学附属东方医院内镜中心行肠镜检查,并取病理活检。病理检查结果由病理室医师判读,类型包括CRC、癌前病变(重度不典型增生、直径≥1 cm的无蒂锯齿状息肉)、普通息肉(炎性息肉、增生性息肉、腺瘤等)、完全阴性及其他病变。
1.2.4 多靶点粪便基因检测 入组居民在行肠镜检查前,采用专用标本盒留取新鲜粪便并保存于-80 ℃冰箱内,送至同济大学附属东方医院医学转化平台,采用专用试剂盒(QIAamp®Fast DNA Stool Mini)提取粪便DNA。具体方法为:采用分光光度法检测DNA纯度,根据设计好的引物PCR法分别检测异常甲基化BMP3、NDRG4启动子区域、KRAS突变,以β-肌动蛋白作为内参。以BMP3、NDRG4甲基化指数>25%为高风险,结合KRAS是否突变,判断标本风险[7,12]。

2 结果
2.1 预试验结果 确诊为CRC的46例患者中,男21例(45.7%),女25例(54.3%),平均年龄(63.3±5.2)岁。术前7~10d,FOBT、多靶点粪便基因检测的诊断阳性患者数分别为38例(82.6%)、42例(91.3%),灵敏度分别为82.6%〔95%CI(71.7%,93.6%)〕、91.3%〔95%CI(83.2%,99.4%)〕;术后3个月,FOBT、多靶点粪便基因检测的诊断阳性患者数分别为5例(10.9%)、6例(13.0%),特异度分别为89.1%〔95%CI(80.1%,98.1%)〕、87.0%〔95%CI(77.2%,96.7%)〕。
2.2 多靶点基因检测在试验组中的诊断价值 294例试验组居民中,男126例(42.9%),女168例(57.1%),平均年龄(63.6±6.1)岁。肠镜和病理检查示:CRC7例(早期肠癌5例),癌前病变4例(重度不典型增生1例、直径≥1cm的无蒂锯齿状息肉3例),普通息肉82例,完全阴性193例,其他病变8例(慢性炎症4例、黑变病1例、单发溃疡1例、多发憩室1例、黏膜下囊肿1例)。多靶点粪便基因检测诊断CRC、癌前病变的灵敏度分别为85.7%〔95%CI(59.8%,100.0%)〕、75.0%〔95%CI(32.6%,100.0%)〕,诊断CRC和癌前病变的阳性预测值为16.7%〔95%CI(6.7%,26.6%)〕、假阴性率为18.2%〔95%CI(0,41.0%)〕,对普通息肉和完全阴性人群的特异度为84.0%〔95%CI(79.7%,88.3%)〕、阴性预测值为99.1%〔95%CI(32.6%,100.0%)〕、假阳性率为7.5%〔95%CI(2.3%,18.5%)〕(见表1)。
2.3 多靶点基因检测在对照组中的诊断价值 102例对照组中,男58例(56.9%),女44例(43.1%),平均年龄(59.7±5.3)岁。肠镜和病理检查示:无CRC病例,癌前病变1例(直径≥1cm的无蒂锯齿状息肉),普通息肉12例,完全阴性87例,其他病变2例(慢性炎症2例)。多靶点粪便基因检测对普通息肉和完全阴性人群的特异度为83.8%〔95%CI(76.7%,89.2%)〕(见表2)。
3 讨论
对于大肠癌筛查,检测项目的灵敏度至关重要。尽早发现癌前病变和早期肠癌,可以极大地减少肠癌后期的治疗费用,提高肠癌患者的生存率和生活质量。而应用更有效的非创伤性手段、提高筛查效能,是提高大肠癌筛查准确性的关键。
目前国内尚无应用异常甲基化BMP3、NDRG4启动子区域、KRAS突变等粪便肿瘤基因作为标志物进行社区CRC筛查的报道,因此本研究首先筛选了46例50~75岁经肠镜和病理检查确诊的CRC患者进行多靶点粪便基因检测作为预试验。结果显示,多靶点粪便基因检测与FOBT相比,在特异度无明显下降的情况下,其诊断灵敏度明显升高,与IMPERIALE等[7]的报道相似,表明粪便多靶点基因检测可以应用于我国社区居民的CRC筛查。
表1 294例试验组居民的多靶点粪便基因检测结果〔n(%)〕
Table1Resultsofmulti-targetstoolDNAtestingfor294casesintheexperimentalgroup
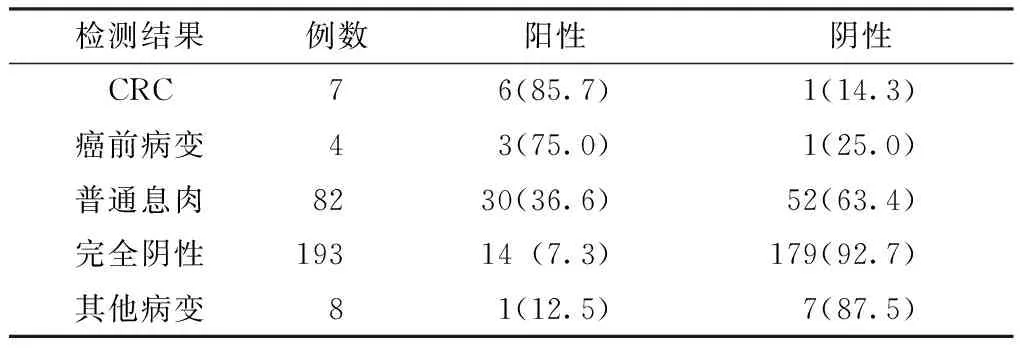
检测结果例数阳性阴性CRC76(85.7)1(14.3)癌前病变43(75.0)1(25.0)普通息肉8230(36.6)52(63.4)完全阴性19314(7.3)179(92.7)其他病变81(12.5)7(87.5)
注:CRC=结直肠癌
表2 102例对照组居民的多靶点粪便基因检测结果〔n(%)〕
Table2 Results of multi-target stool DNA testing for 102 cases in the control group
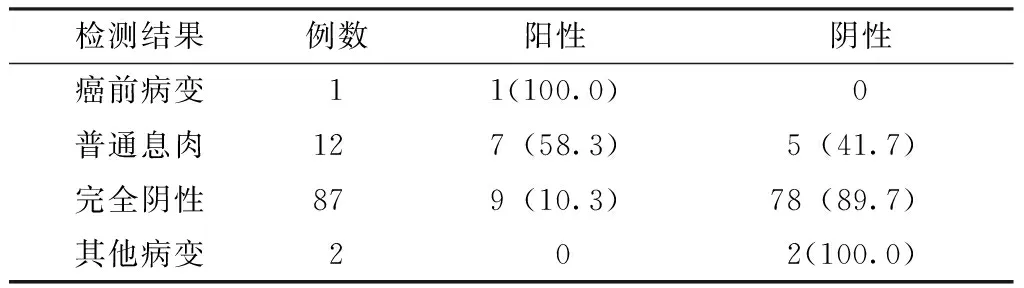
检测结果例数阳性阴性癌前病变11(100.0)0普通息肉127(58.3)5(41.7)完全阴性879(10.3)78(89.7)其他病变202(100.0)
本研究依托上海市“社区居民大肠癌筛查项目”,对浦东新区3个社区的居民进行CRC筛查。结果显示,对于危险度评估和FOBT阳性的人群,多靶点粪便基因检测诊断CRC和癌前病变的灵敏度高,同时其对普通息肉和完全阴性人群亦有着较高的特异度。因此,FOBT与多靶点粪便基因检测在CRC筛查上的联合应用可能会提高筛查的准确性。在“社区居民大肠癌筛查”(自然人群筛查)方案中,危险度评估、FOBT中任一项阳性的居民即被判断为高危人群,建议其行肠镜检查,但由于FOBT具有较高的假阳性率,使得筛查效能降低。目前的社区大肠癌筛查往往存在居民参与率低、依从性差的问题,对筛查效能的质疑和对肠镜的排斥是影响人群参与度、依从性的重要因素[13-14]。因此,在筛查策略的应用上,建议调整为对FOBT阳性的居民加测多靶点粪便基因检测,对于FOBT、多靶点粪便基因检测均呈阳性的人群,积极鼓励其进行肠镜检查并重点监测。
综上所述,多靶点粪便基因检测与传统FOBT相比,可以提高CRC筛查的效率与准确性,是一种更为有效的筛查手段。此种方法可以考虑与FOBT联合运用,作为社区CRC筛查的常规手段,以提高筛查的准确性。但本研究样本量较少、涉及地区范围也较小,在一定程度上影响了本研究的统计可信度与代表性。另外,检测技术与检测费用是最重要的两个限制因素。随着技术的不断改进、成熟以及试剂盒的商业化推广,多靶点粪便基因检测将越来越多地被应用于CRC筛查的实践中。国内现行指南和美国国立综合癌症网络指南均不推荐将粪便基因检测作为CRC筛查的常规监测手段,其主要原因在于该技术应用时间过短、缺乏相关临床数据支持[10,15]。如能在社区CRC筛查中推广试行,其临床数据的累积也将为多靶点粪便基因检测的应用提供更多证据。
作者贡献:彭晨参与文章的构思与设计,负责统计学处理、结果的分析与解释,撰写论文并负责论文的中英文修订;蒋小华参与文章的构思与设计,负责文章的质量控制及审校,对文章整体负责,监督管理;姜景蔚负责数据收集与整理;郑萍进行研究的实施与可行性分析。
本文无利益冲突。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer Statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.DOI:10.3322/caac.21338.
[2]DE SANTIS C E,LIN C C,MARIOTTO A B,et al.Cancer treatment and survivorship statistics,2014[J].CA Cancer J Clin,2014,64(4):252-271.DOI:10.3322/caac.21149.
[3]郑莹,龚杨明.上海地区人群大肠癌筛查的研究和实践[J].中国肿瘤,2013,22(2):86-89. ZHENG Y,GONG Y M.Research and practice of screening for colorectal cancer in population of Shanghai[J].China Cancer,2013,22(2):86-89.
[4]FRASER C G.Faecal occult blood tests?Eliminate,enhance or update?[J].Ann Clin Biochem,2008,45(Pt 2):117-121.DOI:10.1258/acb.2008.007223.
[5]ABOLA M V,FENNIMORE T F,CHEN M M,et al.Stool DNA versus colonoscopy based colorectal cancer screening:patient perceptions and preferences[J].Fam Med Community Health,2015,3(3):2-8.
[6]钟选芳,甘爱华,张晓慧,等.联合检测粪隐血试验与粪便DNA在大肠癌机会性筛查中的探讨[J].肿瘤基础与临床,2015,28(6):508-511.DOI:10.3969/j.issn.1673-5412.2015.06.016. ZHONG X F,GAN A H,ZHANG X H,et al.Investigation of combined detection of fecal occult blood test and fecal DNA test in the opportunity screening for colorectal cancer[J].Journal of Basic and Clinical Oncology,2015,28(6):508-511.DOI:10.3969/j.issn.1673-5412.2015.06.016.
[7]IMPERIALE T F,RANSOHOFF D F,ITZKOWITZ S H,et al.Multitarget stool DNA testing for colorectal-cancer screening[J].N Eng J Med,2014,370(14):1287-1297.DOI:10.1056/NEJMc1405215.
[8]郑莹,龚杨明,吴春晓,等.上海市社区居民大肠癌筛查项目[J].上海预防医学,2016,28(10):739-742. ZHENG Y,GONG Y M,WU C X,et al.Community colorectal cancer screening program in Shanghai[J].Shanghai Journal of Preventive Medicine,2016,28(10):739-742.
[9]彭晨,蒋小华,杨丽萍,等.上海陆家嘴社区2013—2015年大肠癌筛查结果分析[J].中国公共卫生,2017,33(Suppl):S120-122. PENG C,JIANG X H,YANG L P,et al.Colorectal cancer screening results in Lujiazui Community,Shanghai from 2013 to 2015[J].Chinese Journal of Public Health,2017,33(Suppl):S120-122.
[10]中华医学会消化内镜学分会消化系早癌内镜诊断与治疗协作组,中华医学会消化病学分会消化道肿瘤协作组,中华医学会消化内镜学分会肠道学组,等.中国早期结直肠癌及癌前病变筛查与诊治共识[J].中国实用内科杂志,2015,35(3):211-227.DOI:10.3760/cma.j.issn.1000-8039.2016.17.011.
[11]国家卫生计生委医政医管局,中华医学会肿瘤学分会.中国结直肠癌诊疗规范(2015版)[J].中华消化外科杂志,2015,14(10):783-799.DOI:10.3760/cma.j.issn.1673-9752.2015.10.001. Bureau of Medical Administration,National Health Oncology Branch of Chinese Medical Association.Standardization of diagnosis and treatment for colorectal cancer in China(2015 edition)[J].Chinese Journal of Digestive Surgery,2015,14(10):783-799.DOI:10.3760/cma.j.issn.1673-9752.2015.10.001.
[12]KADIYSKA T,NOSSIKOFF A.Stool DNA methylation assays in colorectal cancer screening[J].World J Gastroenterol,2015,21(35):10057-10061.DOI:10.3748/wjg.v21.i35.10057.
[13]潘霞,王冠中,方德宁,等.上海市徐汇区2012—2013年大肠癌筛查实践[J].中华临床医师杂志:电子版,2015,9(18):3365-3368.DOI:10.3877/cma.j.issn.1674-0785.2015.18.013. PAN X,WANG G Z,FANG D N,et al.Colorectal screening in Xuhui District of Shanghai from 2012 to 2013[J].Chinese Journal of Clinicians:Electronic Edition,2015,9(18):3365-3368.DOI:10.3877/cma.j.issn.1674-0785.2015.18.013.
[14]邓尚新,蔡全才,安薇,等.结直肠癌筛查依从性影响因素定性研究的系统评价[J].中华医学杂志,2010,90(38):2679-2683.DOI:10.3760/cma.j.issn.0376-2491.2010.38.005. DENG S X,CAI Q C,AN W,et al.Factors influencing patient compliance in colorectal cancer screening:qualitative research synthesis[J].National Medical Journal of China,2010,90(38):2679-2683.DOI:10.3760/cma.j.issn.0376-2491.2010.38.005.
[15]PROVENZALE D,JASPERSON K,AHNEN D J,et al.The NCCN clinical practice guidelines in oncology for colorectal cancer screening[J].Journal of the National Comprehensive Cancer Network,2015,13(8):959-968.
(本文编辑:王凤微)
ValuesofMulti-targetStoolDNATestforCommunity-basedColorectalCancerScreening
PENGChen1,JIANGXiao-hua2*,JIANGJing-wei1,ZHENGPing2
1.LujiazuiCommunityHealthServiceCenter,Shanghai200120,China2.GastroenterologyCenter,DongfangHospitalAffiliatedtoTongjiUniversity,Shanghai200123,China
*Correspondingauthor:JIANGXiao-hua,Associatedchiefphysician,Mastersupervisor;E-mail:jxh@medmail.com.cn
ObjectiveTo explore the values of multi-target stool DNA test for community-based colorectal cancer(CRC) screening.MethodsWe conducted a CRC screening in Lujiazui Community,Sanlin Community,and Yingbo Community located in Pudong New Area,Shanghai between August 2014 and July 2016 by a survey with Colorectal Cancer Risk Assessment Scale for Community-dwelling Residents in Shanghai(CCRASCRS) and two rounds of fecal occult blood testing(FOBT).The assessment results of CCRASCRS,and one or two rounds of FOBT results were positive in 294 cases(experimental group),and those of CCRASCRS and the two rounds of FOBT results were negative in 102 cases(control group).Two weeks later,all of them successively underwent multi-target stool DNA test for detecting aberrantly methylated BMP3 and NDRG4 promoter regions and mutant KRAS,colonoscopy and colorectal biopsy in Dongfang Hospital Affiliated to Tongji University.The diagnostic value of multi-target stool DNA test was assessed by the gold standard for diagnosis,the results of colonoscopy and pathological examination of colorectal biopsy specimens.ResultsFor diagnosing CRC,colorectal precancerous lesion in the experimental group,the sensitivity of multi-target stool DNA test were respectively 85.7%〔95%CI(59.8%,100.0%)〕,75.0%〔95%CI(32.6%,100.0%)〕.For diagnosing the common colorectal polyps and identifying the residents without any colorectal lesions,the specificity of multi-target stool DNA test was 84.0%〔95%CI(79.7%,88.3%)〕 for the experimental group,and 83.8%〔95%CI(76.7%,89.2%)〕 for the control group.ConclusionCombined use of multi-target stool DNA test and FOBT can improve the accuracy of community-based CRC screening.
Colorectal neoplasms;Feces;Genetic testing;Colonoscopy;Occult blood testing;Screening
浦东新区科技发展基金创新资金(医疗卫生)项目(PKJ2014-Y39)
R 735.34
A
10.3969/j.issn.1007-9572.2017.25.014
2017-04-22;
2017-08-12)
1.200120 上海市浦东新区陆家嘴社区卫生服务中心
2.200123 上海市,同济大学附属东方医院消化中心
*通信作者:蒋小华,副主任医师,硕士生导师;E-mail:jxh@medmail.com.cn

