P21及CDK6与宫颈鳞状细胞癌的关系
刘 静,江 叶,闵 敏,许建琼,袁 华,曾 淋,宋大萍
(四川省绵阳市第三人民医院病理科 621000)
P21及CDK6与宫颈鳞状细胞癌的关系
刘 静,江 叶,闵 敏,许建琼,袁 华,曾 淋,宋大萍△
(四川省绵阳市第三人民医院病理科 621000)
目的 观察P21、CDK6在宫颈鳞状细胞癌中的表达情况,探讨其与宫颈鳞状细胞癌的关系。方法 采用免疫组织化学ABC法检测100例宫颈鳞状细胞癌、20例宫颈上皮内瘤变(CIN)及20例正常宫颈组织中P21及CDK6的表达情况,分析他们与癌组织分化程度、浸润深度、淋巴结转移及临床分期的关系。结果 宫颈鳞状细胞癌组织的P21及CDK6表达率均明显高于CIN组及正常组;P21的低表达与肿瘤浸润深度、淋巴结转移及临床分期(P<0.05)有关,与肿瘤分化程度(P>0.05)无关;CDK6的高表达与肿瘤分化程度、浸润深度、淋巴结转移及临床分期(P<0.05)均有关。结论 P21及CDK6表达异常可能在宫颈鳞状细胞癌的发生、发展中起重要作用;且二者对判断宫颈鳞状细胞癌的预后有一定意义。
P21;细胞周期蛋白依赖激酶6;宫颈肿瘤;肿瘤,鳞状细胞
近年来对于肿瘤发生、发展的分子机制研究很多,发现细胞癌变与细胞周期调控异常密切相关,细胞周期素依赖性激酶(CDK)推动细胞过度增殖,细胞CDK抑制剂抑制细胞过度增殖[1]。宫颈癌是一渐进性的细胞周期调控机制破坏的疾病,其发生是细胞增殖生长的调控与调节严重紊乱的结果[2]。本研究检测CDK6及CDKⅠ P21在宫颈鳞状细胞癌中的表达情况,探讨其与宫颈鳞状细胞癌的关系,评价其对于宫颈癌患者的预后意义。
1 资料与方法
1.1 一般资料 所有病例及标本均为本院2011年1月至2015年1月经病理诊断为宫颈鳞状细胞癌和宫颈上皮内瘤样变(CIN)的组织,以及因其他原因行子宫全切术而宫颈正常组织,并经过复验证实。病理诊断、分类均参照WHO的分类标准,临床病理分期均按宫颈癌国际妇产科联盟2000年(FIGO 2000)标准。选择对象均无术前放、化疗史,术后均有随访。其中宫颈鳞状细胞癌组100例,CIN组20例,正常宫颈组20例。宫颈鳞状细胞癌组低分化19例,中高分化81例;临床病理分期Ⅰ、Ⅱ期83例,Ⅲ、Ⅳ期17例;有淋巴结转移16例,无淋巴结转移84例。全部标本均为5%中性甲醛固定,常规石蜡包埋切片。
1.2 方法 采用免疫组织化学ABC法对标本进行P21、CDK6检测。即用型非生物素聚合物免疫组织化学Polink-1检测试剂盒(PV-6000)及鼠抗P21、CDK6单克隆抗体(工作液)均来自北京中杉金桥公司。以PBS液代替一抗作为阴性对照,以已知的多次试验对照有效的宫颈癌标本作为阳性对照。全部切片均厚4 μm。
1.3 判断标准 P21阳性着色定位于细胞核,细胞核出现棕黄色颗粒则为阳性细胞;反之,则为阴性细胞。CDK6阳性着色定位于细胞核、细胞质,细胞核、细胞质出现棕黄色颗粒则为阳性细胞;反之,则为阴性细胞。随机抽取20个高倍视野,计数大于或等于500个肿瘤细胞,按阳性细胞所占百分比分级如下:阳性细胞数小于10%为阴性表达;阳性细胞数大于或等于10%为阳性表达。
1.4 统计学处理 采用SPSS13.0软件进行统计分析,计数资料用率表示,率的比较采用四格表χ2检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 P21与CDK6在各组中表达 P21在正常宫颈组、CIN组及宫颈鳞状细胞癌组中的阳性表达率逐渐升高(依次为0、15.0%、44.0%),宫颈鳞状细胞癌组与正常宫颈组相比差异有统计学意义(P<0.01),宫颈鳞状细胞癌组与CIN组相比差异有统计学意义(P<0.05)。CDK6在正常宫颈组、CIN组及宫颈鳞状细胞癌组中的阳性表达率逐渐升高,宫颈鳞状细胞癌组与正常宫颈组比较差异有统计学意义(P<0.01),宫颈鳞状细胞癌组与CIN组比较差异有统计学意义(P<0.01),见图1、2及表1。

A:正常宫颈组;B:CIN组;C:鳞状细胞癌组
图1 P21在各组中的表达(×400)
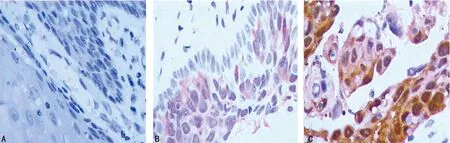
A:正常宫颈组;B:CIN组;C:鳞状细胞癌组
图2 CDK6在各组中的表达(×400)

表1 P21与CDK6在各组中的表达情况[n(%)]

表2 P21、CDK6阳性表达与临床病理特征的关系[n(%)]
2.2 P21及CDK6的表达与肿瘤临床病理特征的相关性 P21在高中分化及低分化宫颈鳞状细胞癌组中的阳性表达率逐渐降低(分别为48.1%、28.6%),但差异无统计学意义(P>0.05);P21的阳性表达降低与肿瘤浸润深度(P<0.05)及淋巴结转移(P<0.05)相关;在FIGO分期中,Ⅰ、Ⅱ期P21表达与Ⅲ、Ⅳ期相比差异有统计学意义(P<0.05)。CDK6的阳性表达与肿瘤分化程度(P<0.05)、浸润深度(P<0.05)、淋巴结转移(P<0.05)相关;在FIGO分期中,Ⅰ、Ⅱ期CDK6表达与Ⅲ、Ⅳ期比较差异有统计学意义(P<0.05)。见表2。
3 讨 论
肿瘤是一种细胞周期性疾病,细胞周期主要依靠细胞周期素(cyclin)、CDK及周期蛋白依赖性激酶抑制因子CKI三者的相互作用进行调控,cyclin和CDK是细胞周期正调节蛋白,CKI是细胞周期负调节蛋白[3]。
CDKs处于细胞周期调控中心,在细胞周期的特定时相激活或失活,其异常表达可使细胞周期调控发生障碍,导致肿瘤发生[4]。许多研究一致表明胃癌[5]、肝癌[6]、子宫内膜腺癌[7]、口腔鳞状细胞癌[8]等的CDK6蛋白水平表达增高。本研究在67%的宫颈鳞状细胞癌组织标本中检测到CDK6蛋白水平也异常增高,并发现CDK6的阳性表达与宫颈鳞状细胞癌的分化程度、浸润深度、淋巴结转移情况及临床分期相关,提示CDK6有可能成为预测宫颈鳞状细胞癌预后的新指标,并为肿瘤的基因治疗提供新途径。
CKIs家族成员包括P16、P21、P27、P15。1993年,Harper分离出P21的cDNA[9]。P21蛋白可抑制CDK2和CDK4/6的活性,使去磷酸化Rb水平升高,抑制转录因子E2F所调控基因的激活,使细胞周期停滞于G2期[10]。所以理论上P21的表达水平在肿瘤中应该降低。但对现有的关于肝癌[11]、直肠癌[12]、淋巴瘤[13]、外阴癌[14]等P21的表达情况及意义的文献进行分析,结果尚不一致。本研究发现P21在宫颈鳞状细胞癌中高表达,但随着肿瘤的分化程度变差,浸润深度加深,有淋巴结转移及临床分期晚时,P21的表达逐渐降低,且除了分化程度外(P>0.05),均有明显相关性(P<0.05),这与张宏等[15]的研究结果一致。P21在宫颈鳞状细胞癌中表达升高的发生机制有待进一步研究探讨。
[1]Mahler M,Miyachi K.The clinical significance of autoantibodies to the proliferating cell nuclear anrigen[J].Autoimmun Rev,2012,11(10):771-775.
[2]沈树娜,王俊飞,王辉.HPV和CDK6与宫颈癌的相关性研究[J].中国妇幼健康研究,2014,25(1):42-44.
[3]韦伟,龚建平,裘法祖.细胞周期调控与肿瘤的发生发展[J].癌症,1999,18(1):95-97.
[4]Evan GI,Vousden KH.Proliferation,cell cycle and apoptosis in tMulcer[J].Nature,2001,411(6835):342-348.
[5]潘新民,徐国辉,秦豪杰,等.胃癌中CDK6mRNA表达变化研究[J].河南科技大学学报,2014,32(2):81-83.
[6]车宇芳,叶飞,青海涛,等.XIAP通过调节CDK4/CDK6/cyclin D1复合物表达促进肝癌细胞增殖[J].胃肠病学和肝病学杂志,2011,20(10):939-944.
[7]廖秀芳,林宇静,曹婉维.CyclinD1、Cdk6在子宫内膜腺癌中的表达与临床意义[J].中国实用医学,2013,8(8):27-28.
[8]Yuan S,Qu Y,Dang S,et al.MiR-145 inhibits oral squamous cell carcinoma (OSCC) cell growth by targeting c-Myc and Cdk6[J].Cancer Cell Int,2013,13(1):51.
[9]Harper WJ,Adami GR,Wei N,et al.The p21 cdk-intaeractin proteincipl is a protent inhibitor of G1 cyclin-dependent kinases[J].Cell,1993,75:805-816.
[10]Wilson AJ,Byun DS,Popova N,et a1.Histone deacetylase 3(HDAC3)and other class I HDACs regulate colon cell maturation and p21 expression and are deregulated in human eolon cancer[J].J Biol Chem,2006,281(9),13548-13558.
[11]Baddour N,Farrag E,Zeid A,et al.Decreased apoptosis in advanced-stage/high-grade hepatocellular carcinoma complicating chronic hepatitis C is mediated through the downregulation of p21 ras[J].Chin J Cancer Res,2013,25(3):281-288.
[12]张文娟,鲁植艳,杨桂芳,等.骨桥蛋白和p21蛋白在直肠癌组织中的表达及意义[J].临床外科杂志,2010,18(9):609-611.
[13]徐刚,王槐富,何刚,等.鼻腔NK/T细胞淋巴瘤中P53、P21表达及其临床意义[J].四川大学学报,2010,41(1):132-136.
[14]罗雪慧,范余娟,杨开选,等.FHIT蛋白和p21蛋白在外阴癌和外阴尖锐湿疣中表达的研究[J].广西医科大学学报,2010,27(1):29-31.
[15]张宏,刘晓伟,苏秀兰.胃癌组织中P53蛋白及Ras P21蛋白的表达及意义[J].现代肿瘤医学,2012,20(11):2344-2348.
Expression and significance of P21 and CDK6 protein in cervical squamous cell carcinoma
LiuJing,JiangYe,MinMin,XuJianqiong,YuanHua,ZengLin,SongDaping△
(DepartmentofPathology,theThirdPeople′sHospitalofMianyangcity,Mianyang,Sichuan621000)
Objective To observe the expression of P21 and CDK6 in cervical squamous cell carcinoma,and to investigate the relationship between their expression and cervical squamous cell carcinoma.Methods The expression of CDK6 and P21 in 100 cases of cervical squamous cell carcinoma,20 cases of cervical CIN lesions and 20 cases of normal cervical tissues were detected by immunohistochemical ABC method,and the relationship between them and tumor differentiation,invasion depth,lymph node metastasis and clinical stage were analyzed.Results The expression rates of P21 and CDK6 in cervical squamous cell carcinoma tissues were significantly higher than those in CIN lesions and normal cervical tissues;The low expression of P21 was associated with the depth of tumor invasion,lymph node metastasis and clinical stage (P<0.05),and was not associated with the degree of tumor differentiation (P>0.05);The high expression of CDK6 was associated with tumor differentiation,invasion depth,lymph node metastasis and clinical stage (P<0.05).Conclusion The abnormal expression of P21 and CDK6 may play an important role in the occurrence and development of cervical squamous cell carcinoma,and the two may have a certain significance in the prognosis of cervical squamous cell carcinoma.
P21 protein;cyclin-dependent kinase 6;uterine cervical neoplasms;neoplasms,squamous cell
刘静(1980-),主治医师,本科,主要从事肿瘤病理研究。
△通信作者,E-mail:809906@qq.com。
10.3969/j.issn.1671-8348.2017.23.020
R737.33
A
1671-8348(2017)23-3231-03
2017-03-20
2017-05-11)
论著·临床研究

