纳米氧化锌细胞毒性的研究
冯 阁,姚依兰,黄凤华,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
纳米氧化锌细胞毒性的研究
冯 阁,姚依兰,黄凤华,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
研究ZnO NPs的细胞毒性。以ZnO NPs为研究对象,以小鼠睾丸的间质细胞为模型,检测纳米氧化锌的毒性作用。结果表明:ZnO NPs显著抑制了细胞活力,增加细胞 LDH和ROS的释放和产生,造成核DNA的泄露,并伴随着组蛋白γ-H2AX和RAD51位点的生成,最终导致细胞凋亡。ZnO NPs对于LCs细胞具有显著的细胞毒性。
纳米氧化锌;小鼠;间质细胞;凋亡
1 引言
纳米ZnO(ZnO NPs)是一种常见的被广泛应用于各类产品中的金属氧化物。纳米Zno由于粒子尺寸小,比表面大,具有表面效应、量子尺寸效应等,表现出许多优于普通氧化锌的特殊性能,如非迁移性、荧光性、压电性、吸收和散射紫外线能力等,在橡胶、陶瓷、日用化工、涂料、磁性材料等方面具有广泛的用途[1-3]。可以制造气体传感器、荧光体、紫外线遮蔽材料、变阻器、图像记录材料、压敏材料、压电材料、高效催化剂等,备受人们重视[4]。
ZnO NPs具有一定的生物学特性,已应用于生物传感器和医药行业。其在人体上的使用和环境中的暴露日益增长,纳米ZnO极易流入环境中且难于被回收,因此存在着短期和长期毒性的潜在风险。纳米氧化锌颗粒可以通过皮肤、呼吸道、消化系统不同的暴露途径进入生物机体,作用于不同的生物组织。纳米氧化锌在水中的溶解度较小,但纳米颗粒因其结构微小,很容易被吸收进入机体后引发类似于超微颗粒引起的炎症反应。而且纳米颗粒与微米尺度的颗粒相比,引起的炎症反应更加严重,还有导致肿瘤的危险。因此关于该物质在体外和体内的负面效应评估得到了更多的关注[5-6]。
本研究以小鼠睾丸的间质细胞(LCs)为模型,检测纳米氧化锌的毒性作用,为生产安全有效的纳米材料提供基础数据。
2 材料与方法
2.1 材料
纳米ZnO(粒径大约为70 nm)购自北京DK纳米科技公司;细胞培养相关试剂购自Sigma公司,其它所用试剂均为国产分析纯试剂;MTT、LDH和ROS检测试剂盒购自Beyotime公司,γ-H2AX和RAD51抗体的一抗和二抗购自abcam公司。
2.2 仪器与设备
荧光倒置显微镜及显微图像分析系统 Nikon TE2000U;CO2培养箱 Thermo。
2.3 方法
氧化应激标记物的检测方法参考试剂盒的说明书进行。 细胞的培养、MTT检测、LDH检测、ROS检测、核DNA泄漏和细胞的免疫荧光检测参照文献7和文献8[7-8]。
3 结果与分析
3.1 细胞活力的 MTT和LDH释放的检测
以细胞活力和LDH的释放作为细胞毒性的检测。由图1A所示,LCs细胞毒性对ZnNPs具有时间和剂量依赖性。在ZnO NPs处理细胞12 h和24 h后,细胞活力显著地降低(P<0.1)。LDH的增长水平也对ZnNPs呈剂量依赖性(图1B)。一些类型的纳米颗粒能够穿透细胞膜并积累在线粒体中对其的功能造成影响[9]。因此,可以用MTT实验来评估细胞的活力。LDH释放分析是通过估计细胞膜的破裂来评估细胞膜的稳定性[10]。从图1A来看,用ZnO NPs处理细胞12 h之后细胞活力显著地降低(P<0.1),而且随着ZnO NPs含量的增加也造成培养基中LDH释放的显著增加。在ZnO NPs的含量超过10 μg/mL之后,观察到细胞LDH的释放会明显增加。
3.2 ZnO NPs对LCs胞内ROS水平的影响
通过DCFH-DA荧光探针来标记来检测细胞内ROS的水平。结果如图2 所示,胞内的ROS水平被DCFH-DA荧光强度进行了量化。随着ZnO NPs的增加,实验组的荧光强度显著地增加,ZnO NPs通过积累ROS导致氧化应激。

图2 LCs细胞暴露ZnO NPs后ROS的检测
3.3 核DNA损伤的检测
为检测细胞对ZnO NPs毒性的应答,采用传统分析方法来检测ZnO NPs对DNA的损伤。用不同浓度的ZnO NPs处理LCs细胞。结果如图3所示,持续的处理细胞导致细胞核DNA泄露且ZnO NPs导致的细胞核DNA泄露具有剂量依赖性。
实验结果表明,导致DNA泄露的ZnO NPs最大处理浓度是20 μg/mL。用15 μg/mL和20 μg/mL的ZnO NPs处理LCs细胞24 h大约会分别造成27.4%和73.9%的DNA泄露(图3)。使用15μg/mL的ZnO NPs处理细胞12 h后,DNA泄露也变得非常明显(P<0.1),DNA泄露的数量越庞大,导致更多的染色体断裂或是染色体丢失。
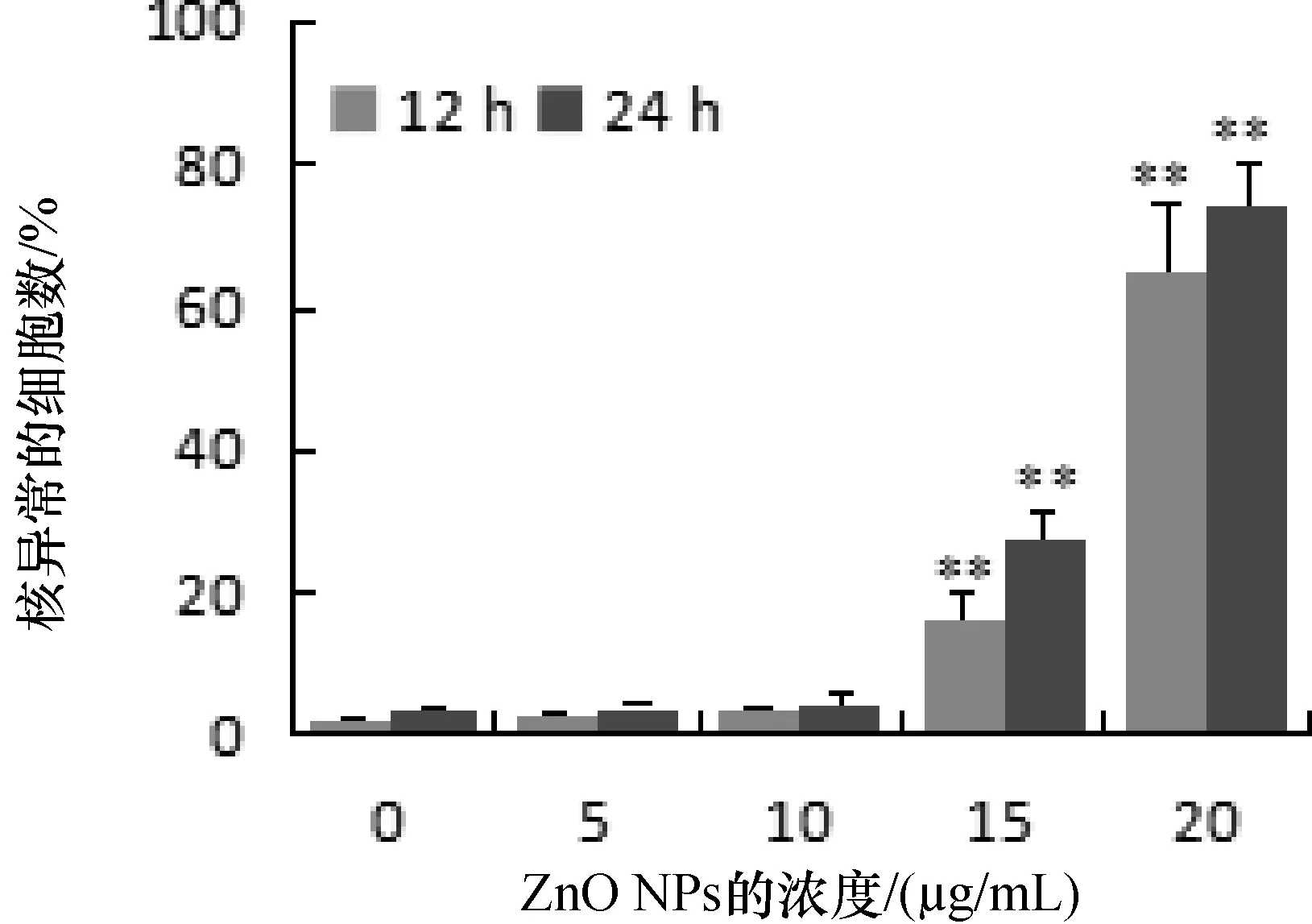
图3 LCs暴露ZnO NPs后DNA的损伤检测
3.4 ZnO NPs对细胞DNA损伤修复的影响
高浓度的ZnO NPs处理LCs细胞会造成显著地DNA损伤(图4)。由图A所示,我们观察到LCs细胞中γH2AX的表达量随着ZnO NPs浓度的增加而增加;图B所示,LCs细胞中RAD51的表达量也随着ZnO NPs浓度的增加而增加。
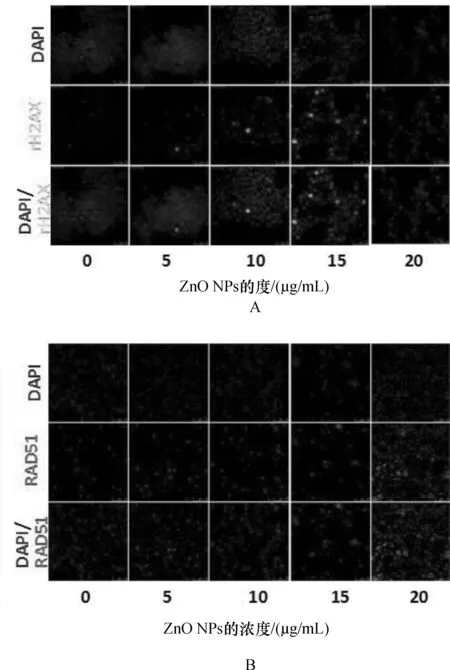
图4 LCs暴露ZnO NPs后γ-H2AX和Rad51细胞荧光结果
4 结论
细胞活力测定和LDH的释放结果相一致,这些表明LDH的释放量对ZnO NPs 的暴露量呈剂量依赖性(图1)。此研究的结果和先前的其他纳米药物对于LCs细胞毒性的研究结果一致[11]。即从细胞活力和LDH的释放结果分析,证实ZnO NPs 有明显的细胞毒性。
ROS作为活体在细胞代谢中普遍存在,是一种不断产生的物质,又因它的生成被视作促进细胞凋亡的信号,故也被认为是纳米材料引发细胞毒性的中间介质[12]。ROS的生成、氧化应激和可调控细胞不同阶段的细胞信号联级放大的扰动,这些都被认为是由金属纳米材料造成细胞损伤和诱发细胞凋亡的常规产物[13-14]。对结肠癌细胞暴露ZnO NPs的毒性研究表明,诱发氧化应激是造成其细胞毒性的关键[15]。ZnO NPs以氧化应激为媒介造成HepG2细胞的DNA损伤,从而导致细胞活力的下降。ROS引发线粒体膜蛋白的下降,同时升高Bax/Bcl2的比例导致以线粒体调控通路为媒介的细胞凋亡[16]。同样,ZnO NPs也会通过上调Bax,p53和caspase-3,下调抗凋亡基因Bcl2的表达来诱导HepG2、MCF-7癌细胞的氧化应激和凋亡[17]。
之前有研究表明,来源于JB6C141-5a小鼠表皮的正常细胞在暴露ZnO NPs之后会经由ROS引发导致自噬体的累计和线粒体的损伤从而造成细胞的死亡[18]。 ZnO NPs的细胞毒性可以用DNA损伤来研究,DNA链的断裂用γH2AX 和 RAD51位点统计来测量[19]。外源性因素导致产生的DNA断裂会存在γH2AX位点的形成,这类组蛋白会在双链DNA(DSB)断裂位点被迅速磷酸化,但是在松弛的染色体和单链DNA中也会出现这样的位点[20]。DSBs上的RAD51蛋白募集在同源重组中修复DSBs起到至关重要的作用[21]。研究表明ZnO NPs会引发大鼠早期神经细胞、皮肤细胞、人类幼成淋巴细胞、大鼠肾上皮细胞和人类结肠癌细胞的DNA损伤[22-23]。
rH2AX 和RAD51是两种重要的DNA损伤修复蛋白,它们可以立即保护DNA的合成和避免不利的内源性和外源性的因素使新生DNA过度延伸[24-25]。ROS在细胞凋亡和DNA损伤调节中扮演着关键作用。如图2所示,ROS的信号随着ZnO NPs的增加逐渐增强,与核DNA泄露检测的结果一致(图3)。
[1] Kruefu V, Wisitsoraat A, Tuantranont A, Phanichphant S. Gas sensing properties of conducting polymer/Au-loaded ZnO nanoparticle composite materials at room temperature [J].Nanoscale Res Lett, 2014, 9(1):467.
[2] Kim M, Lee HJ, Oh S, et al. Robust ZnO nanoparticle embedded memory device using vancomycin conjugate and its biorecognition for electrical charging node[J]. Biosens Bioelectron,2014, 56:33-38.
[3] Sasidharan A, Chandran P, Menon D, et al. Rapid dissolution of ZnO nanocrystals in acidic cancer microenvironment leading to preferential apoptosi[J]. Nanoscale, 2011, 3(9): 3657- 3669.
[4] 杜媛媛,丘克强.纳米氧化锌的制备和应用研究[J].材料导报,2007,5(21):104-107.
[5] Namvar F, Rahman HS, Mohamad R, et al. Cytotoxic effects of biosynthesized zinc oxide nanoparticles on murine cell lines[J].Evid Based Complement Alternat Med, 2015,593014.
[6] Saptarshi SR, Feltis BN, Wright PF, Lopata AL. Investigating the mmunomodulatory nature of zinc oxide nanoparticles at sub-cytotoxic levels in vitro and after intranasal instillation in vivo [J].Nanobiotechnology, 2015, 13:6.
[7] Changou CA, Chen YR, Xing L, et al.Arginine starvation-associated atypical cellular death involves mitochondrial dysfunction, nuclear DNA leakage, and chromatin autophagy[J].Proc Natl Acad Sci U S A. 2014 ,111(39):14147-52.
[8] Zhang X F, Choi Y J, Han JW,et al. Differential nanoreprotoxicity of silver nanoparticles in male somatic cells and spermatogonial stem cells[J]. Int J Nanomed, 2015,10: 1335-1357.
[9] Colvin V L.The potential environmental impact of engineered anomaterials[J].Nat Biotechnol, 2013,21:1166-1170.
[10] Yang P, Chen H, Tsai J. Lin L. Cadmium induces Ca2+-dependent necrotic cell death through calpain-triggered mitochondrial depolarization and reactive oxygen species-mediated inhibition of nuclear factor-κB activity[J].Chemical Research in Toxicology,.2007, 20(3):406-415.
[11] Zhang XF, Choi YJ, Han JW, et al. Differential nanoreprotoxicity of silver nanoparticles in male somatic cells and spermatogonial stem cells[J].International journal of nanomedicine,2015, 10:1335-1357.
[12] Circu ML, Aw TY. Reactive oxygen species, cellular redox systems, and apoptosi[J]. Free radical biology & medicine, 2010, 48:749-762.
[13] Nguyen KC, Willmore WG, Tayabali AF. Cadmium telluride quantum dots cause oxidative stress leading to extrinsic and intrinsic apoptosis in hepatocellular carcinoma HepG2 cells[J]. Toxicology,. 2013, 306:114-123.
[14] Simon HU, Haj-Yehia A, Levi-Schaffer F. Role of reactive oxygen species (ROS) in apoptosis induction[J] .Apoptosis,2000; 5:415-418.
[15] De Berardis D, Conti CM, Serroni N, et al. The effect of newer serotonin-noradrenalin antidepressants on cytokine production: a review of the current literature[J].International journal of immunopathology and pharmacology, 2010, 23:417-422.
[16] Sharma RK, Jaiswal SK, Siddiqi NJ, et al. Effect of carbofuran on some biochemical indices of human erythrocytes in vitro[J]. Cellular and molecular biology, 2012, 58:103-109.
[17] Wahab R, Siddiqui MA, Saquib Q, et al. ZnO nanoparticles induced oxidative stress and apoptosis in HepG2 and MCF-7 cancer cells and their antibacterial activity[J] .Colloids and surfaces B, Biointerfaces, 2014, 117:267-276.
[18] Yu KN, Yoon TJ, Minai-Tehrani A, et al. Zinc oxide nanoparticle induced autophagic cell death and mitochondrial damage via reactive oxygen species generation[J].Toxicology in vitro : an international journal published in association with BIBRA,2013, 27:1187-1195
[19] Smith AJ, Ball SS, Manzar K, Bowater RP, Wormstone IM. Ku80 Counters Oxidative Stress-Induced DNA Damage and Cataract Formation in the Human Lens[J].Invest Ophthalmol Vis Sci,2015, 56(13):7868-7874.
[20] Chen HT, Bhandoola A, Difilippantonio MJ, et al. Response to RAG-mediated VDJ cleavage by NBS1 and γH2AX [J].Science, 2000, 290:1962-1965.
[21] Daboussi F, Dumay A, Delacote F, Lopez BS. DNA double-strand break repair signalling: the case of RAD51 post-translational regulation[J].Cell Signal, 2002, 14(12):969-975.
[22] Chiang HM, Xia Q, Zou X, et al. Nanoscale ZnO induces cytotoxicity and DNA damage in human cell lines and rat primary neuronal cells[J].J Nanosci Nanotechnol, 2012,12(3):2126-2135.
[23] Wang CC, Wang S, Xia Q, et al. Phototoxicity of zinc oxide nanoparticles in HaCaT keratinocytes-generation of oxidative DNA damage during UVA and visible light irradiation[J]. J Nanosci Nanotechnol, 2013,13(6):3880-3888.
[24] Vallerga MB, Mansilla SF, Federico MB, Bertolin AP, Gottifredi V. Rad51 recombinase prevents Mre11 nuclease-dependent degradation ann.d excessive PrimPol-mediated elongation of nascent DNA after UV irradiatio[J]. Proc Natl Acad Sci U S A. 2015, 112(48):6624-6633.
[25] Baldock RA, Day M, Wilkinson OJ, et al. ATM Localization and Heterochromatin Repair Depend on Direct Interaction of the 53BP1-BRCT2 Domain with γH2AX[J]. Cell Rep, 2015, 13(10):2081-2089.
Research on cytotoxicity of ZnO NPs
FENGGe,YAOYi-lan,HUANGFeng-hua,SHUChang,ZHANGXi-feng
(School of Biology and Pharmaceutical Engineering,Wuhan Polytechnic University, Wuhan 430023, China)
The aim of this study was to investigate the potential toxicity of zinc oxide (ZnO) NPs in vivo systems using male mouse Leydig cells(LCs). LCs were treated with ZnO NPs, the result shows that ZnO NPs effectively inhibits cell viability, the increase leakage of LDH and the fluorescence intensity about ROS was significantly higher in the ZnO-NP-treated group of cells than in the control group, ZnO NPs resulting in nuclear DNA leakage nuclear DNA leakage, accompanying histone γ-H2AX and RAD51 foci, lead to the celluar apoptosis finally. ZnO NPs has cytotoxicity, which provides the reference for the development of sustainable and safer nanomaterials.
ZnO NPs; mice; leydig cell;poptosis
2017-04-18.
冯阁(1995-),女,硕士研究生,E.mail:834413034@qq.com.
张西锋(1977-),男,博士,副教授,E.mail:zhangxf9465@163.com.
国家自然科学基金(B020704).
2095-7386(2017)02-0026-05
10.3969/j.issn.2095-7386.2017.02.005
TB 383;R 114
A

