改良Vero细胞毒性试验法检测志贺毒素
毕旺来,杨 俊,杜文芳,李 睿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
改良Vero细胞毒性试验法检测志贺毒素
毕旺来,杨 俊,杜文芳,李 睿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
采用Vero细胞培养法检测5株肠出血性大肠杆菌O157食品分离株的志贺毒素。在48孔细胞培养板中培养Vero细胞24 h,然后加入梯度稀释的志贺毒素滤液。培养24 h及48 h后在倒置显微镜下观察Vero细胞形态。培养48 h后结晶紫染色,测定Vero细胞半致死时,对应的志贺毒素滤液稀释倍数。证实形态观察和结晶紫染色相结合可以准确测定肠出血性大肠杆菌O157食品分离株的志贺毒素。
细胞培养;肠出血性大肠杆菌O157;志贺毒素;Vero细胞毒性
1 引言
肠出血性大肠杆菌O157可引起人类一系列疾病,如水样性腹泻、出血性结肠炎、溶血性尿毒症综合征等[1]。肠出血性大肠杆菌O157有多种传播途径,如受污染的牛肉、原料奶、禽类食物等[2]。目前也报道了许多因摄入受污染的蔬菜、水果和水而感染肠出血性大肠杆菌O157的案例[3-4]。由于肠出血性大肠杆菌O157有很强的致病性和致死性,同时其爆发又有着极强的流行性,所以肠出血性大肠杆菌O157对人类的生命健康构成了巨大的威胁,受到了全球的关注[5]。
肠出血性大肠杆菌O157的主要毒力因子是志贺毒素(Stx),它由位于大肠杆菌噬菌体上的stx基因编码[6]。志贺毒素分为Stxl和Stx2两类。Stxl和Stx2的氨基酸相似性仅为55%—57%,但两者在免疫学上有交叉反应[7],两种毒素毒力并不相同。有文献表明Stx2毒素对肾脏微血管内皮细胞的毒性比Stx1毒素大1 000倍[8]。
Vero细胞系是日本千叶大学的Yasumura 及 Kawakita于1962年3月27日从非洲绿猴的肾上皮细胞中分离扩增培养出来的。Vero细胞用途十分广泛,常被用于大肠杆菌和痢疾志贺菌毒素的测定[9]。Vero细胞毒性检测的方法主要有 MTT检测法。MTT检测法的原理是,活的哺乳动物细胞线粒体中的琥珀酸脱氢酶可将黄绿色的MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。用二甲基亚砜(DMSO)溶解细胞中的甲瓒,通过酶联免疫检测仪在波长490 nm时测定其吸光度(OD值),在一定细胞数范围内,MTT结晶形成的量正比于活细胞数目,便可间接反映活细胞数量,从而推测出化学物对细胞抑制或杀伤的效率[10]。但此项方法中不仅MTT本身价格较昂贵, DMSO对实验者健康也有损害。
本研究采用细胞形态观察和结晶紫染色相结合的方法,测定肠出血性大肠杆菌O157食品分离株的志贺毒素,拟为志贺毒素的测定提供更为简便的方法。
2 材料与方法
2.1 材料
2.1.1 实验菌株
肠出血性大肠杆菌O157高毒株EC150由日本九州大学赠送,肠出血性大肠杆菌O157 EC9.23、EC5.11、 EC6.8、 EC9.10、 EC9.102 、EC9.12均为食品分离株。EC9.23已由RPLA试剂盒检测为不产志贺毒素的无毒株。
2.1.2 实验细胞
Vero细胞(非洲绿猴肾细胞),CX0322,购买于武汉博士德生物工程有限公司。
2.1.3 主要试剂
RPMI1640液体培养基PYG0066(含青霉素、链霉素、 L-谷氨酰胺),武汉博士德生物工程有限公司。胰蛋白酶溶液 PYG0067,武汉博士德生物工程有限公司。胎牛血清 131021型(无支原体,未灭活),浙江天杭生物技术有限公司。多粘菌素B 武汉鼎国生物有限公司。
2.2 方法
2.2.1 志贺毒素滤液的制备
将7株肠出血性大肠杆菌O157 菌株37 ℃、180 r/min条件下培养16 h。取过夜培养物分别涂布接种于BHI平板上,37 ℃培养16―20 h。用接种环刮取培养基表面三分之一平板大小的菌泥(火柴头3倍大小),悬浮于1 mL多粘菌素B溶液中。37 ℃下保温30 min,每5―10 min振荡一次。取1 mL菌液于1.5 mL离心管中,在室温下900×g离心15 min。取上清用0.22 μm 滤膜过滤,即为志贺毒素滤液原液。将志贺毒素滤液原液用生理盐水作10倍连续稀释,共5个稀释度,即1∶101,1∶102,1∶103,1∶104,1∶105。然后保存于-20 ℃冰箱中备用。
2.2.2 结晶紫染色检测志贺毒素滴度
将Vero细胞用RPMI 1640(含10%胎牛血清)培养基培养4至5代,至细胞形态大小比较均匀。在显微镜下观察贴壁单层细胞的生长状态,若细胞处于对数生长期,则可用于检测志贺毒素滴度。打开培养瓶盖,弃去培养液,吸取PBS洗液5―10 mL清洗1―2次,加入胰蛋白酶3 mL,37 ℃条件下静置约3 min。吸取RPMI 1640(含10%胎牛血清)8 mL,加入培养瓶终止消化,将细胞悬液转移到无菌离心管中,1 000 r/min离心5 min。吸去上清液,加入少量的RPMI1640培养基(约10 mL),初步调整细胞悬液浓度。用血球计数板进行计数,然后再次调节细胞悬液浓度,使细胞浓度为105/mL。向48孔板中加入细胞悬液,每孔所加悬液为250 μL。将48孔板放置于CO2培养箱中,CO2浓度为5%,37 ℃条件下恒温培养24 h。
24 h后取出48孔板,向每孔中加入250 μL梯度稀释的待检志贺毒素滤液样品,并设置只加了生理盐水的细胞孔做空白对照,设置加入EC9.23样品滤液的细胞孔为阴性对照。同时设置加入EC150样品滤液细胞孔为阳性对照。将48孔板放置于CO2培养箱中,CO2浓度为5%,37 ℃条件下恒温培养48 h。
培养24 h、48 h后在倒置显微镜下观察各孔细胞生长状况。孵育48 h后,取出48孔板,每孔加入2% PBS配制的福尔马林溶液固定1 min。用PBS洗涤一次,用微量移液器小心贴着孔壁吸去液体。用0.25%结晶紫染色10 min,用PBS洗涤2次,自然风干,肉眼对比各孔染色状况,观察实验结果。
3 结果与分析
3.1 志贺毒素对Vero细胞形态的影响
将细胞悬液加入48孔板,在37 ℃条件下培养24 h后在倒置显微镜下观察细胞生长状态(图1A)。所有孔内的细胞均生长均一,成扁平梭形,贴壁良好,细胞交织成网,细胞内无明显空泡,达到接入志贺毒素滤液的要求。在48孔板中各孔内接入不同样品的不同浓度梯度的志贺毒素滤液,在37 ℃条件下培养24 h后,再次观察各孔的细胞形态。空白对照孔、阴性对照孔中细胞无明显形态变化,保持正常形态贴壁生长。菌株EC9.12孔中细胞形态已发生明显改变,由紧密连接变为松散排列,扁平多角细胞变为椭圆形,细胞间隙明显增大,部分细胞已经开始脱壁(图1B)。阳性对照、EC9.10、EC6.8和EC5.11样品孔中细胞形态与菌株EC9.12孔中相似,细胞形态明显变化。菌株EC9.102孔中细胞形态与阴性孔中相似,细胞形态无明显变化。继续培养24 h,在倒置显微镜下重观察各孔细胞形态。菌株EC9.102、空白和阴性对照孔中细胞形态无明显变化,细胞生长正常。菌株EC9.12、EC9.10、EC6.8和EC5.11样品孔和阳性对照孔中细胞融合,变圆,大量细胞破裂、崩解、死亡(图1C)。
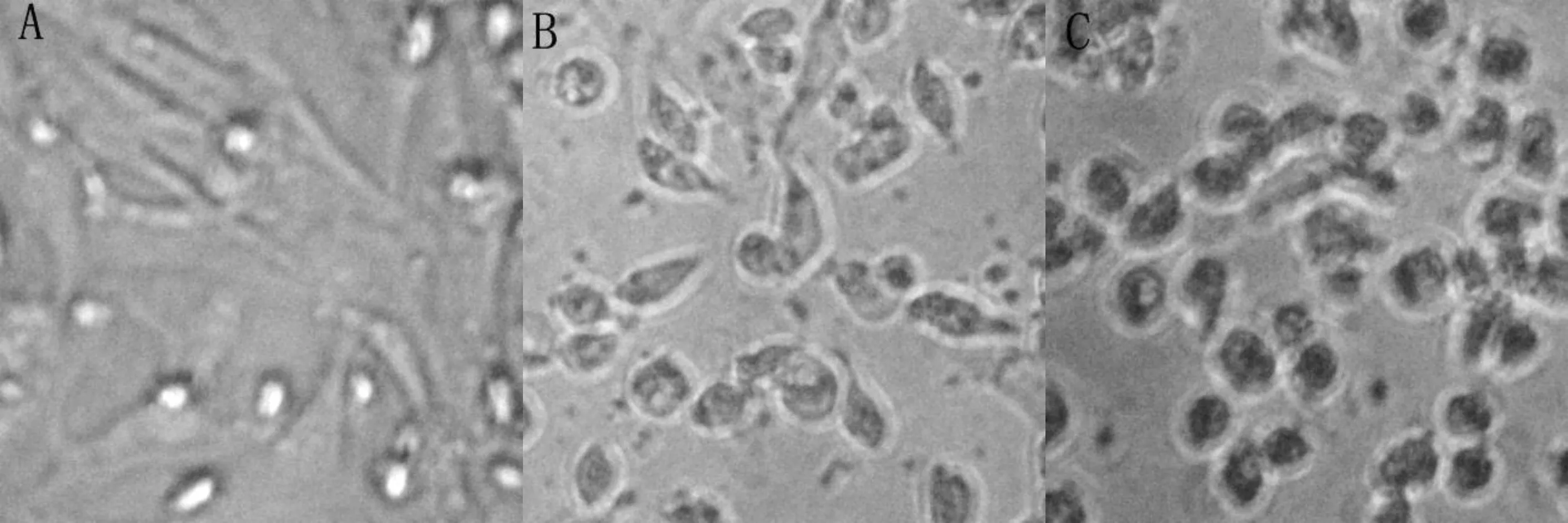
图1 志贺毒素对Vero细胞形态的影响
3.2 结晶紫染色测志贺毒素滴度
48孔板经结晶紫染色(图2)风干后观察,发现空白对照、阴性对照所有孔均被染上紫色,说明不产志贺毒素的菌株EC9.23滤液对Vero细胞的生长无明显影响。阳性对照中A—D孔,无色;E孔,有部分面积被染上紫色;F孔,全部面积被染上紫色。以此可以估算阳性对照EC150的毒素滴度为1∶104左右。菌株EC9.12、EC9.10样品孔中染色状况与阳性对照孔相似,所以EC9.12、EC9.10毒素滴度应同EC150相同,约在1∶104左右。菌株EC9.102孔中染色状况与空白对照、阴性对照相同,可以推测EC9.102不产志贺毒素。菌株EC6.8样品孔中从A—C孔中无色,D孔部分面积染上紫色,E、F孔中均为紫色,可估算EC6. 8的毒素滴度在1∶103左右。菌株EC5.11样品孔中A、B孔中无色,C、D孔中部分面积染上紫色,E、F孔全部被染上紫色,可估算EC5.11的毒素滴度为1∶102―03。21列加入了生理盐水,作空白对照;2列加入菌株EC9.23的梯度滤液,作阴性对照;3列加入菌株EC150的梯度滤液,作阳性对照;4—8列分别加入菌株EC9.12、EC9.102、 EC9.10、EC6.8和EC5.11的梯度滤液。除1列外,2—8列的A—F行所加的滤液稀释梯度为100到10-5。

图2 48孔板结晶紫染色
4 结论
笔者采用改良Vero细胞毒性试验法检测5株肠出血性大肠杆菌O157菌株的志贺毒素。实验同时采用了细胞形态学观察和结晶紫染色测毒素滴度这两种方法,对5株菌是否产生志贺毒素进行认定,并初步估算毒力大小。
在细胞形态学实验中,检测的5株菌中,菌株EC9.12、EC9.10、EC6.8和EC5.11 4株菌产志贺毒素,菌株EC9.102不产志贺毒素。接入了产志贺毒素的细菌细胞滤液后,重培养Vero细胞24 h,细胞形态会发生明显改变,细胞由紧密连接变得松散,扁平多角的细胞变为椭圆形,细胞间隙明显增大,部分细胞开始脱壁。培养48 h后,细胞变圆、融合,大量细胞脱壁,细胞开始破裂、凋亡。而接入了不产志贺毒素的细菌细胞滤液后,Vero细胞重培养24 h和48 h,细胞形态均正常,没有异常变化。
在结晶紫染色测定志贺毒素的实验中,测出致50%细胞死亡的阳性对照菌的毒素滴度约为1∶104,5株菌中有4株菌可产志贺毒素,导致Vero细胞脱壁,部分孔无明显染色。有一株菌不产志贺毒素,该菌对应的所有样品孔均被染上紫色。此结果与细胞形态学实验结果相符合。笔者通过此次实验研究证实形态观察和结晶紫染色相结合,可以准确测定肠出血性大肠杆菌O157食品分离株的志贺毒素。
[1] Law D. Virulence factors of Escherichia coli O157 and other Shiga toxin-producing E. coli [J]. J Appl Microbiol, 2000, 88(5), 729-745.
[2] Mainil J G, Daube G. Verotoxigenic Escherichia coli from animals, humans and foods: who’s who[J]. J Appl Microbiol, 2005, 98(6): 1332-1344.
[3] Oliveira M,Vinas I,Usall J,et a1. Presence and survival of Escherichia coli O157:H7 on lettuce leaves and in soil treated with contaminated compost and irrigation water[J]. Int J Food Microbiol,2012,156(2): 133-140.
[4] Koseki S,Mizuno Y, Kawasaki S,et a1. A Survey of Iceberg Lettuce for the Presence of Salmonella, Escherichia coli O157: H7, and Listeria monocytogenes in Japan [J]. J Food Protect, 2011, 74( 9): 1543-1546.
[5] 王燕,谢贵林. 大肠杆菌O157:H7感染流行概况[J]. 微生物学免疫学进展,2008,36(1):51-58.
[6] 周勇,万成松. 大肠杆菌O157:H7的毒力岛与毒力因子的研究进展[J]. 微生物学免疫学进展,2006,34(2):58-62.
[7] 陈洪章. 肠出血性大肠杆菌(E.coli)O157:H7志贺毒素研究进展[J]. 中国人兽共患病学报, 2007,23(1): 83-85.
[8] Ezawa A,Gocho F,Kawata K, et al. High prevalence of enterohemorrhagic Escherichia coli (EHEC) O157 from cattle in selected regions of Japan [J]. J Vet med Sci,2004,66(5):585-587.
[9] 白莉, 胡豫杰, 王佳慧,等. Stx-PCR方法、Vero细胞毒性试验和酶联免疫试剂盒3种方法检测产志贺毒素大肠埃希菌的评估[J]. 卫生研究, 2014,5: 797-804.
[10] 杜伟伟,杨洪涛.MTT检测肾疏宁含药血清对大鼠腹膜间皮细胞的作用[J].中国中西医结合肾病杂志,2012,12:1050-1052 .
The measurement of Shiga toxin by modified Vero cell cytotoxicity assay
BIWang-lai,YANGJun,DUWen-fang,LIRui
(School of biology and pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,China)
In this study, titers of Shiga toxins of five Enterohemorrhagic Escherichia coli O157 strains isolated from food have been measured by modified Vero cell cytotoxicity assay. Vero cells were incubated for 24h in 48-well cell plate, and then mixed with serial diluted Shiga toxin filtrates. After 24h and 48h incubation, the cell morphology was observed under an inverted microscope. After 48h incubation, the Vero cells were stained by crystal violet, and the toxin titers were determined as the reciprocal of the highest dilution of filtrates that caused 50% Vero cell death. This study demonstrated that morphology observation in combination with crystal violet staining could measure the Shiga toxin produced by Enterhemorrhagic Escherichia coli O157 strains isolated from food.
cell culture; Enterohemorrhagic Escherichia coli O157;Shiga toxin; Vero cytotoxicity
2017-02-28.
毕旺来(1972-),男,实验师,E-mail:6052777@qq.com.
2095-7386(2017)02-0022-04
10.3969/j.issn.2095-7386.2017.02.004
R 155.5
A

