普洱茶茶色素对HepG2细胞脂质代谢的影响及作用机理
陈亚蓝,王雪青,*,王怡雯,郑子晴,叶美霞,付芳芳,赵 培,宋文军,王素英,白晓丽,李长文
(1.天津商业大学生物技术与食品科学学院,天津市食品与生物技术重点实验室,天津 300134;2.云南天士力帝泊洱生物茶集团有限公司,云南 普洱 665100)
普洱茶茶色素对HepG2细胞脂质代谢的影响及作用机理
陈亚蓝1,王雪青1,*,王怡雯1,郑子晴1,叶美霞1,付芳芳1,赵 培1,宋文军1,王素英1,白晓丽2,李长文2
(1.天津商业大学生物技术与食品科学学院,天津市食品与生物技术重点实验室,天津 300134;2.云南天士力帝泊洱生物茶集团有限公司,云南 普洱 665100)
以正常培养和油酸诱导培养的人肝癌细胞系(human hepatocellular liver carcinoma cell line,HepG2)细胞为模型,通过测定普洱茶茶色素对HepG2细胞内甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)含量,细胞中脂肪酸合成酶(fatty acid synthase,FAS)、固醇调节元件结合蛋白1c(sterol regulatory element binding protein 1c,SREBP-1c)、三磷酸腺苷结合转运子A1(ATP binding cassette transporter A1,ABCA1)、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)的转录水平,磷酸化腺苷酸活化蛋白激酶(phospho-AMP-activated protein kina se,p-AMPK)的蛋白表达水平研究普洱茶茶色素的减肥降脂作用机制。结果显示,普洱茶茶色素能明显降低油酸诱导的HepG2细胞模型中TG和TC含量,作用程度依赖于普洱茶的作用质量浓度。但对正常培养的HepG2的TG、TC作用影响不显著。经过普洱茶茶色素作用油酸诱导HepG2细胞24 h后,能显著下调细胞的FAS和SREBP-1c的mRNA表达水平(P<0.05),显著上调ABCA1的转录水平(P<0.05),且使CYP7A1的转录水平呈上升趋势,并显著上调p-AMPK蛋白的表达量(P<0.05)。因此,普洱茶茶色素可通过调控上述调控因子和酶的表达而改善油酸诱导下HepG2细胞的脂质代谢水平。
HepG2;脂质代谢;普洱茶;色素
陈亚蓝, 王雪青, 王怡雯, 等. 普洱茶茶色素对HepG2细胞脂质代谢的影响及作用机理[J]. 食品科学, 2017, 38(17 ): 203-209. DOI:10.7506/spkx10 02-6630-201717033. http://www.spkx.net.cn
CHEN Yalan, WANG Xueqing, WANG Yiwen, et al. Effect and mechanism of pigments from Pu-erh tea on lipid metabolism in HepG2 cell model[J]. Food Science, 2017, 38(17): 203-209. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201717033. http://www.spkx.net.cn
在高节奏生活状态、不健康的生活方式、高热量饮食结构的作用下,肥胖已成为威胁人类健康的全球性问题之一。研究发现肥胖与多种疾病的发生关系密切,是Ⅱ型糖尿病、高脂血症、非酒精性脂肪肝、高血压等的重要危险因素[1]。因此,预防和治疗肥胖已成为重要的社会问题。目前减肥的方式有运动、药物治疗、手术治疗、中医治疗等,但这些方式难以坚持或对身体造成损伤而难以为继,所以从天然活性产物中获取安全有效的成分预防和治疗肥胖已刻不容缓。目前已有大量研究发现天然成分黄酮类物质、多糖类物质、茶多酚,或天然物质菊花、花椒、山楂、葡萄籽等均有较好的减肥降脂效果[2-6]。现有的研究表明一些天然活性物质可通过过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPARs)、肝X受体(liver X receptors,LXRs)和固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs)等信号途径调控脂质代谢而达到减肥效果[7],其中相关信号途径中脂肪酸合成酶(fatty acid synthase,FAS)、SREBPs、三磷酸腺苷结合转运子A1(ATP binding cassette transporter A1,ABCA1)、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,CYP7A1)、羟甲基戊二酰辅酶A还原酶(HMG-CoA reductase,HMGCR)、低密度脂蛋白受体等和调控因子及其信号间的相互作用被发现与脂质代谢密切相关[8-9]。
普洱茶已被证实有良好的减肥降脂功效,但其作用机理尚未完全阐明[10-11]。因此,本实验以HepG2细胞作为研究载体,经过普洱茶茶色素干预正常培养、油酸诱导培养HepG2后,测定HepG2细胞中甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)含量变化,脂质代谢相关酶和转录因子的mRNA转录水平及蛋白的表达水平,从而在TG代谢和TC代谢方面研究普洱茶茶色素在减肥降脂中的作用机制,为普洱茶茶色素的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
普洱茶茶色素干粉由云南天士力帝泊洱生物茶集团有限公司提供。具体制备方法如下:按照茶水料液比1∶10(m/V),水温90 ℃,浸提30 min, 两次浸提后合并浸液,减压蒸馏,喷雾干燥成粉。普洱茶色素干粉主要成分为茶色素(49.44%,其中茶褐素占47.32%)、蛋白质(25.75%)、多糖(16.74%)。
HepG2细胞由天津医科大学实验室提供。0.25%胰蛋白酶、Triton-100、双抗(100 U/mL青霉素、100 U/mL链霉素)、Bradford蛋白浓度测定试剂盒、饱和油红O原液、10%中性甲醛、50×TAE、还原型5×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液、30%的聚丙烯酰胺-N,N -亚甲双丙烯酰胺溶液(质量比为29∶1)、0.5 mol/L Tris-HCl(pH 6.8)溶液、1.5 mol/L Tris-HCl(pH 8.8)溶液 北京索莱宝科技有限公司;胎牛血清 以色列Biological Industries公司;DMEM高糖培养基 赛默飞世尔生物化学制品(北京)有限公司;6、96孔板 无锡耐思生物科技有限公司;油酸、无水乙醇、氯化钠、氯化钾、十二水合磷酸氢二钠、磷酸二氢钾(均为分析纯) 博欧特化工贸易有限公司;全蛋白提取试剂盒、引物合成 生工生物工程(上海)股份有限公司;p-AMPK单克隆抗体(兔抗人)、磷酸甘油醛脱氢酶多克隆抗体(兔抗人)美国Cell Signaling Technology公司;HRP标记山羊抗兔IgG 美国Abbkine公司;DNA Ladder2000、焦碳酸二乙酯处理水 上海依科赛生物制品有限公司;Gene Green核酸染料 天根生化科技(北京)有限公司;核糖核酸酶抑制剂、琼脂糖、Trizol试剂、M-MLV逆转录试剂盒、SYBR Select Master Mix实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 美国Life Technologies公司;显、定影液 天津世纪奥博商贸有限公司;Western发光检测试剂盒威格拉斯生物技术(北京)有限公司;TG、TC试剂盒南京建成生物总公司。
1.2 仪器与设备
3-18K高速离心机 美国Sigma公司;FHC-1200A超净工作台 北京国仪合信商贸有限公司;240i细胞培养箱 美国Thermo公司;SPECTRAMAX-M5酶联免疫检测仪 美国MD公司;Ti-u倒置荧光显微镜 日本尼康公司;UV-1紫外透射分析仪 珠海黑马医学仪器有限公司;DYY-4C电泳仪 北京六一仪器厂;StepOnePlusTM实时荧光定量PCR检测系统 美国Applied Biosystem公司;ChemiDocTMXRS凝胶电泳成像仪、T100 PCR扩增仪、Mini-PROTEAN®Tetra电泳槽、170-3940 Trans-Blot SD半干电转仪槽 美国Bio-Rad公司;UV-2550型半微量紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 HepG2细胞培养
采用含10%胎牛血清和双抗(100 U/mL青霉素、100 U/mL链霉素)的DMEM高糖培37℃、5% CO2、饱和湿度培养。每隔2~3 d传代一次,取对数生长期细胞进行后续实验。
1.3.2 细胞分组
将HepG2细胞分为6 组,将1×105个/mL的细胞悬液2 mL接种到6 孔板中,分别为对照组(正常培养基组,A1),对照组+300(A2)、400 μg/mL(A3)茶色素处理组,终浓度为3 mmol/L油酸模型组(B1,油酸溶于0.01 mmol/L的NaOH中,加入5%的牛血清白蛋白(bovine serum albumin,BSA),摇晃均匀制成20 mmmol/L的油酸母液,过0.22 μm滤膜备用),油酸模型+300(B2)、400 μg/mL(B3)茶色素处理组(油酸与普洱茶茶色素同时加入),培养24 h后进行后续细胞实验。
1.3.3 细胞内TC和TG含量测定
按1.3.2节的分组,细胞培养24 h后用除去培养基液用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗细胞2 次后加入1%的Triton-100裂解细胞40 min收集裂解液用试剂盒测定细胞内TC和TG含量。
1.3.4 油红O染色
参照文献[12]中油红O染色方法进行改良,将细胞培养24 h后除去培养液用PBS清洗2~3 次;用10%的中性甲醛固定30 min;后用PBS清洗2~3 次,加入油红O工作液1.5 mL,染色30 min;最后PBS清洗2~3 次,于显微镜下观察细胞结构。
1.3.5 实时荧光定量PCR测定基因表达
利用Trizol试剂提取HepG2肝细胞总RNA,并用紫外分光光度计测定260、280 nm波长处吸光度, 两者比值在1.8~2.1之间,表示RNA纯度高,并于1%琼脂糖凝胶电泳鉴定RNA完整性。按照试剂盒说明将RNA逆转录为cDNA并于20 μL反应体系中,进行实时荧光定量PCR。取八连排PCR管,加入SYBR Select Master Mix10 μL,cDNA 1 μL,上下游特异性引物各0.6 μL(5 μmol/L),7.2 μL DEPC水。先95 ℃预变性2 min,然后95 ℃ 15 s、60 ℃ 1 min 循环40 次,结束反应。产物经熔解曲线和扩增曲线确认特异性。应用2-△△Ct法计算RNA相对表达量,以GAPDH基因作为内参,测定基因及上下游引物分别为GAPD A:5 -TGGACCT GACCTGCCGTCTAG-3 ,5 -AGTGGGTGTCGCTGTTGAAGTC-3 ;FAS:5 -CCGCCATCGCCATCGCCCTCAGTC-3 ,5 -CGCCCTTCCCGCCCGTGTGC-3 ;SREBP-1c:5 -GCTCCTCCATCAATGACAAAATC-3 ,5 -TGCAGAAAGCGAATGTAGTCGAT-3 ;CYP7A1:5 -CCGATGGATGGAAATACCAC-3 ,5 -GGCAGCGGTCTTTGAGTTAG-3 ;ABCA1:5 -CAAGGGGTAGGAGAAAGAGACGC-3 ,5 -CTCAGCCAGCACCCCCAG-3 。
1.3.6 Western blot测定蛋白表达
利用蛋白提取试剂盒提取细胞内蛋白,取样进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)(80 V,45~60 min后100 V至溴酚蓝到达凝胶底部结束电泳),用PVDF膜进行半干式电转(采用恒压20 V进行转膜,转膜时间:GAPDH,80 min;p-AMPK,90 min),取出PVDF膜于5%脱脂奶粉制得封闭液封闭1 h后加入一抗4 ℃摇床孵育过夜(一抗稀释倍数1∶1000),次日二抗室温摇床孵育2 h(二抗稀释倍数1∶2 000),随后显色、曝光、显影、定影并于G el-pro analyzer凝胶定量分析软件中进行灰度值分析。
1.4 数据分析处理
数据采用±s表示,SPSS 16.0软件分析相关性和显著性。
2 结果与分析
2.1 普洱茶茶色素对细胞内TG含量的影响
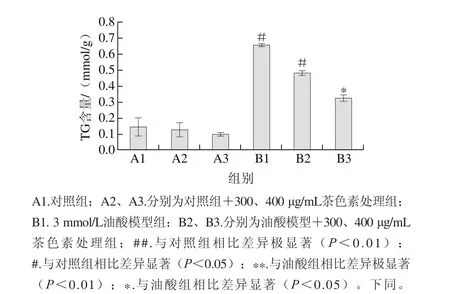
图 1 普洱茶茶色素对对HepG2细胞内TG含量的影响Fig. 1 Effect of pigments from Pu-erh tea on TG level of HepG2 cells
由图1可知,普洱茶茶色素作用于细胞24 h后无论是正常培养的HepG2细胞还是油酸处理培养的,其细胞内TG的含量均下降,且呈计量依赖性。相较于正常培养的对照组,油酸组细胞内TG含量显著升高(P<0.05),300 μg/mL的普洱茶茶色素作用于油酸富集培养HepG2细胞后,胞内TG含量相较于油酸组有所降低,但与对照组相比仍有显著差异(P<0.05)。而400 μg/mL的普洱茶茶色素使胞内TG含量相较于油酸组显著降低(P<0.05),且于对照组相比无显著差异。说明在实验质量浓度范围内普洱茶茶色素能有效降低细胞内TG含量。
2.2 普洱茶茶色素对细胞内TC含量的影响
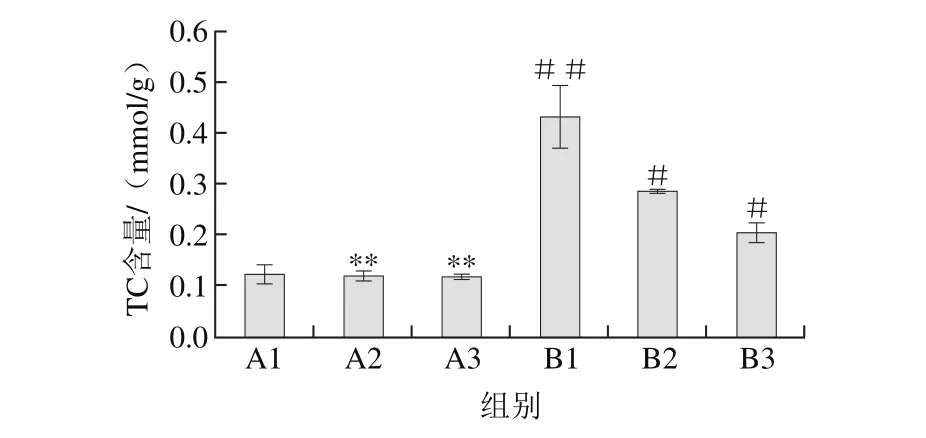
图 2 普洱茶茶色素对HepG2细胞内TC含量的影响Fig. 2 Effect of pigments from Pu-erh tea on TC level of HepG2 cells
由图2可明显看出,油酸组细胞内TC含量显著高出对照组约3 倍,差异极显著(P<0.01)。不同质量浓度的普洱茶茶色素能降低油酸培养状态下HepG2细胞内TC含量且作用效果呈剂量-效应关系。400 μg/mL的普洱茶茶色素作用于油酸处理的HepG2细胞使胞内TC含量从0.428 mmol/g减少到0.204 mmol/g,降低了约一半,但两者差异不显著(P>0.05)。说明在实验质量浓度范围内,普洱茶茶色素能降低油酸诱导培养的HepG2细胞内TC含量,但作用效果不明显。
2.3 油红O染色观察HepG2细胞内脂质堆积情况
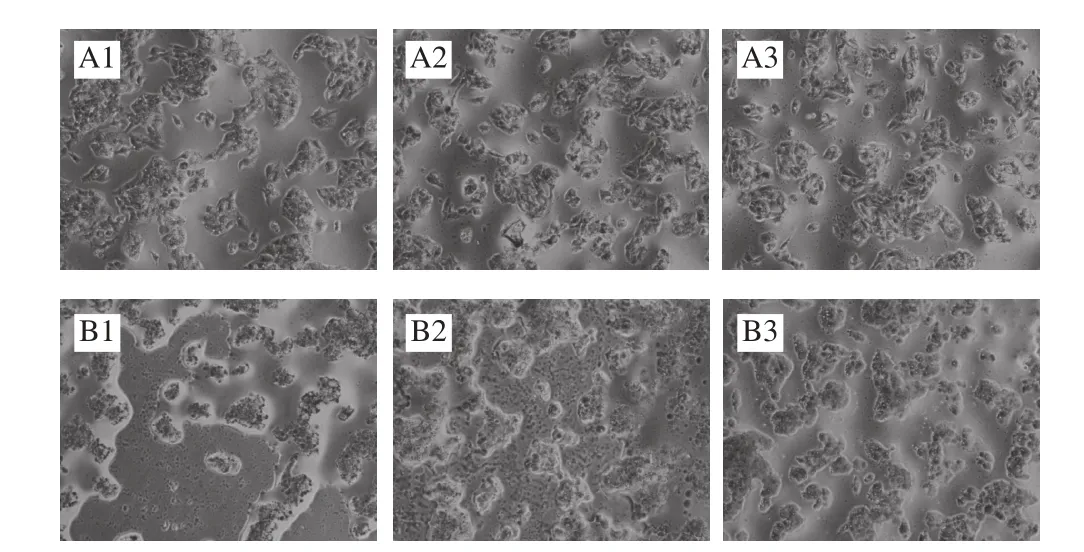
图 3 油红O染色法后观察普洱茶茶色素对HepG2细胞内脂质含量的影响(×200)Fig. 3 Effect of pigments from Pu-erh tea on lipid content in HepG2 cells evaluated by oil red O staining (× 200)
细胞中油脂富集情况见图3。通过油红O染色可以观察到,正常培养的细胞边界清晰,细胞形态明显,细胞周围有少许油滴。而油酸处理24 h后的细胞,细胞肿大变形,边缘轮廓不清晰,有明显油圈,且在细胞边缘和细
胞内有明显泡状油滴堆积。对于普洱茶茶色素干预的正常培养的HepG2细胞保持良好形态,细胞中红色油滴相较对照组无明显变化。而加入普洱茶茶色素的油酸处理组观察可知,随着茶色素质量浓度的增加其细胞内油滴量明显减少,且在400 μg/mL的普洱茶茶色素的干预条件下细胞相较对照组变化不明显,细胞边缘轮廓仍可见。
2.4 普洱茶茶色素对HepG2细胞FAS、SREBP-1c、ABCA1、CYP7A1基因表达水平的影响
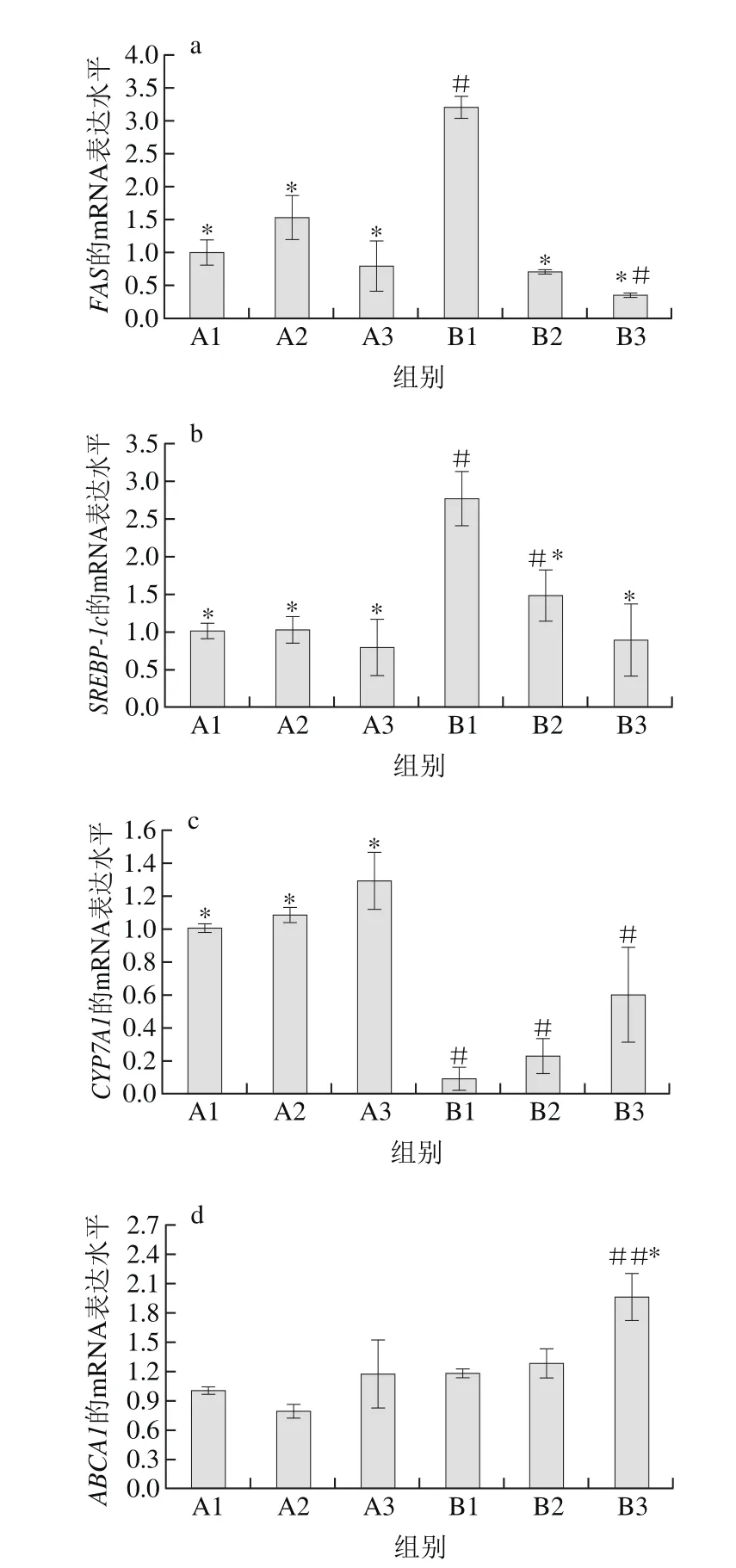
图 4 普洱茶茶色素对HepG2细胞中FAS(a)、SREBP-1c(b)、CYP7A1(c)、ABCA1(d)基因的mRNA表达水平的影响Fig. 4 Effect of pigments from Pu-erh tea on the mRNA expression level of FAS (a), SREBP-1c (b), CYP7A1 (c) and ABCA1 (d) in HepG2 cells
普洱茶茶色素对HepG2细胞中FAS和SREBP-1c表达水平的影响见图4a、b。油酸组FAS和SREBP-1c的表达水平显著高于对照组(P<0.05),不同质量浓度普洱茶茶色素干预油酸培养的情况下细胞中FAS和SREBP-1c表达水平明显低于油酸组,差异显著(P<0.05)且成剂量依赖性。茶色素对正常培养的HepG2细胞的FAS表达可上调和下调但作用效果不显著。其中400 μg/mL的普洱茶茶色素对油酸干预的HepG2细胞的FAS表达下调作用最为显著,且其下调水平显著低于对照组(P<0.05)。在300 μg/mL普洱茶茶色素作用下其SREBP-1c的表达水平虽较对照组显著增加,但明显低于油酸组(P<0.05),400 μg/mL普洱茶茶色素作用下,其SREBP-1c的相对表达水平(0.873)显著低于油酸组(P<0.05),且与对照组相差无几。说明在实验质量浓度范围内普洱茶茶色素能有效下调油酸环境下培养的HepG2细胞的SREBP-1c的表达水平,进而调控下游脂质代谢相关酶的合成从而抑制脂肪酸的合成。
由图4c可知,不同质量浓度的普洱茶茶色素对正常培养和油酸诱导培养的HepG2细胞的CYP7A1表达均能起到上调作用。油酸诱导的HepG2细胞中CYP7A1相对表达水平显著低于对照组(P<0.05)。400 μg/mL普洱茶茶色素干预油酸状态下HepG2细胞其CYP7A1相对表达水平(0.60)明显高于油酸组(0.09),但上调作用不显著(P>0.05)。
由图4d可知,不同质量浓度的普洱茶茶色素对正常培养的HepG2细胞的ABCA1的表达分别有下调和上调作用,但作用效果不显著。对油酸诱导培养的HepG2细胞的ABCA1的表达均能起到上调作用,且作用效果随质量浓度增加而上调作用加大。400 μg/mL普洱茶茶色素干预油酸状态下HepG2细胞其ABCA1的表达水平(0.60)显著高于油酸组(1.16)(P<0.05),且上调效果极显著高于对照组的表达水平(P<0.01),说明高质量浓度普洱茶茶色素能有效提高油酸诱导培养的HepG2细胞中ABCA1的mRNA表达水平,提高TC逆向转运能力。
2.5 普洱茶茶色素对HepG2细胞p-AMPK蛋白表达水平的影响

图 5 普洱茶茶色素对HepG2细胞中p-AMPK表达水平的影响Fig. 5 Effect of pigments from Pu-erh tea on the expression level of p-AMPK in HepG2 cells
由图5可知,油酸诱导培养的HepG2细胞中p-AMPK的表达水平明显下降,与对照组相比差异极显著(P<0.01),说明油酸诱导下是细胞内p-AMPK磷酸化程度降低。普洱茶茶色素对油酸培养的HepG2细胞的p-AMPK表达有极显著上调作用(P<0.01),其中400 μg/mL普洱茶茶色素干预油酸状态下HepG2细胞的p-AMPK磷酸化水平(0.281)略高于对照组(0.260)。
3 讨论与结论
FAS是脂肪酸生物合成的关键酶之一,可催化丙二酸单 酰辅酶A和乙酰辅酶A聚合成长链脂肪酸,最终以TG的形式贮存能量于肝细胞中[13-14]。研究发现FAS的表达与肥胖密切相关,Roncari等[15]研究发现肥胖动物的脂肪组织中FAS表达增加,且FAS表达水平的升高能显著增加TG在体内的沉积从而导致肥胖[16-17]。本研究中油酸诱导培养的HepG2细胞中FAS基因的表达较对照组明显上调,与上述研究成果一致。在Way等[18]的研究中发现普洱茶乙酸乙酯层萃取物作用HepG2细胞24 h后,FAS基因表达降低。本实验中不同质量浓度的普洱茶茶色素均能下调油酸培养状态下HepG2细胞的FAS基因表达且作用显著,说明普洱茶茶色素能有效降低FAS基因的表达水平,减少脂肪酸的合成。
SREBP-1c是保持脂质代谢稳态的主要转录调控因子,可直接激活脂肪酸、TG合成及其合成代谢相关的30多个基因,若SREBP-1c过度表达会引起脂质代谢紊乱,造成过多的脂质在非脂肪组织内沉积,引发脂肪肝、肥胖等一系列临床表现[19]。本研究结果中,油酸组SREBP-1c基因的mRNA表达较对照组显著增高,在普洱茶茶色素干预下其SREBP-1c基因的表达水平又有显著降低(图4b)。李苏[20]的研究发现黑茶提取物能下调脂肪变性的HepG2细胞模型的SREBP-1c的过度表达,该结果与本实验研究结果一致。
AMPK是预防肥胖、治疗脂质代谢紊乱的重要研究靶点,其能调控机体内能量代谢,是调控多个脂肪和成和胆固醇合成相关酶的上游影响因子[21]。本研究中,普洱茶茶色素能激活油酸诱导状态下HepG2细胞的p-AMPK蛋白磷酸化水平,从而直接或间接调控脂质代谢,预防和治疗肥胖。
脂质过度蓄积(主要是TG)是造成肥胖、形成非酒精性脂肪肝、影响肝功能正常进行的先决因素[22]。油酸组TG含量较正常培养组急剧上升且油酸组细胞形态发生变化,细胞轮廓不清晰,细胞内油脂滴多,细胞外有大量油圈,说明油酸诱导状态下的HepG2细胞已发生严重的细胞损伤且脂质蓄积过多。由此推测,在油酸诱导处理的情况下,HepG2细胞中SREBP-1c表达增加过多,超过细胞的自我调节能力,从而调控FAS等合成脂肪酸的基因过度表达,致使脂肪酸合成异常增加[23]。另一方面,油酸诱导作用下机体通过反馈调节上调了FAS的表达水平进一步增加了细胞合成脂肪酸的能力。由此,在油酸诱导下细胞中TG增加,同时也引起游离脂肪酸含量的提高,增添了肝细胞的工作负担,导致肝细胞脂肪变性进一步造成肥胖。而不同质量浓度的普洱茶茶色素能上调p-AMPK蛋白表达水平,下调SREBP-1c及FAS基因的mRNA表达量,特别是400 μg/mL时油酸状态下HepG2细胞p-AMPK蛋白表达水平相较于油酸组上调水平极显著(P<0.01),SREBP-1c及FAS基因的mRNA表达量显著下降(P<0.05),细胞内TG含量显著降低,细胞形态改善明显。推测可能是高质量浓度普洱茶茶色素激活AMPK蛋白磷酸化,继而增强分解代谢,磷酸化的AMPK蛋白能抑制SREBP-1c基因的mRNA表达,进而下调FAS基因的mRNA表达水平从而有效减少肝脏细胞中TG含量,预防过多TG在肝细胞中沉积,改善肝细胞形态,保障肝功能正常运行,有效预防肥胖和非酒精性脂肪肝的形成。
CYP7A1能够将肝脏中的TC以胆汁酸的形式排除体外从而降低肝脏中TC含量,普洱茶茶色素在TC调节方面的研究甚少。已有研究表明,激活PPARα能促进与RXRα的结合形成异源二聚体,从而刺激CYP7A1启动子,上调其表达量[24]。在徐惠龙[24]的研究中高脂模型的PPARα的表达低于正常对照组,说明在高脂作用下能下调机体中PPARα表达。本实验中在油酸作用下CYP7A1的表达量较对照组显著降低(P<0.05),由此推测在本实验研究中油酸诱导培养HepG2细胞,能下调其PPARα表达,而PPARα正向调节CYP7A1的表达水平,因此在油酸作用下HepG2细胞中CYP7A1表达量下降。不同质量浓度的普洱茶茶色素均能上调正常培养和油酸诱导培养HepG2细胞的CYP7A1的表达,且呈剂量依赖性,可能是肝脏循环中的胆汁酸反馈调节作用所致,推测普洱茶茶色素能与胆汁酸结合形成螯合物而排出体外,增加了肝脏细胞中胆汁酸的排出量,从而减少了胆汁酸对CYP7A1的负反馈调节,上调了CYP7A1表达量从而进一步促进TC转化为胆汁酸。但在该实验中,普洱茶茶色素虽能上调CYP7A1的表达量,但油酸+300 μg/mL茶色素和油酸+400 μg/mL茶色素组相较于油酸组均无显著差异,推测普洱茶茶色素在该方面作用不明显。
对于ABCA1的研究一般在外周细胞或组织中,在普洱茶的减肥降脂中鲜少有对肝细胞中ABCA1的研究。在肝细胞中,ABCA1位于肝细胞膜上,可将肝细胞内的TC转运到泛脂的载脂蛋白A-Ⅰ上,从而调控肝细胞中TC外流,以降低肝细胞中TC的含量[25],此外,这些已部分脂质化的载脂蛋白A-Ⅰ可以更多地接收外周细胞中由ABCA1转运的胆固醇,形成高密度脂蛋白,从而使外周细胞中的胆固醇进入肝脏进行代谢加工,以胆汁酸排出[26]。已有动物实验证实,敲除ABCA1基因的小鼠血浆低、高密度脂蛋白胆固醇降低,细胞内胆固醇也大量聚积,形成大量的泡沫状细胞[27]。在本研究中油酸诱导的高脂状态下,一方面HMGCR的表达水平提高[28];另一方面p-AMPK蛋白表达水平降低,负调控HMGCR的表达使其表达水平进一步提高从而增加内源性TC的合成,使细胞内TC增多[29-30]。TC含量增加再反馈调节ABCA1的表达,使其上调。在不同质量浓度普洱茶茶色素作用下,油酸诱导的HepG2细胞中ABCA1不同程度上调,特别在400 μg/mL普洱茶茶色素干预下其ABCA1表达水平高于对照组且差异显著(P<0.05)。说明普洱茶茶色素能有效上调肝细胞中ABCA1的表达,提高肝细胞中TC的外排,维护肝细胞内TC平衡。
经过本实验研究发现,普洱茶茶色素一方面通过激活AMPK磷酸化,从而下调SREBP-1c和FAS的转录水平达到降低肝细胞中TG含量的作用,另一方面,普洱茶茶色素通过上调ABCA1和CYP7A1的转录水平降低细胞中TC含量,从而在调节肝细胞中TG和TC代谢两方面起到减肥降脂作用。然而,AMPK是否能调控ABCA1和CYP7A1的上游调控因子LXRα和PPARs而达到减肥降脂作用还有待进一步研究。
[1] 范婷婷, 法鲁克, 方芳, 等. 荷叶总生物碱降脂减肥作用的体内外试验[J]. 浙江大学学报(农业与生命科学版), 2013, 39(2): 141-148. DOI:10.3785/j.issn.1008-9209.2012.11.064.
[2] KUMARI K, AUGUSTI K T. Lipid lowering effect of S-methyl cysteine sulfoxide from Allium cepa Linn in high cholesterol diet fed rats[J]. Journal of Ethnopharmacology, 2007, 109(3): 367-371. DOI:10.1016/j.jep.2006.07.045.
[3] 马永泽, 刘小渭. 复方山楂减肥汤对肥胖者生化指标的影响[J]. 中医药研究, 2002, 18(5): 28-29.
[4] 刘奇, 夏正燕, 周丹英, 等. 葡萄籽原花青素降血脂药效部位筛选[J].中国现代应用药学, 2016, 33(11): 1378-1381. DOI:10.13748/j.cnki. issn1007-7693.2016.11.006.
[5]HAIDARI F, SHAHI M M, ZAREI M, et al. Effect of green tea extract on body weight, serum glucose and lipid profile in streptozotocininduced diabetic rats. a dose response study[J]. Saudi Medical Journal, 2012, 33(2): 128-133.
[6] 王素敏, 徐欢欢, 黄业伟, 等. 茶多酚的降脂作用及其机制研究进展[J]. 食品研究与开发, 2016, 37(10): 219-224. DOI:10.3969/ j.issn.1005-6521.2016.10.054.
[7] 李龙江, 余瑜. 脂代谢的信号转导途径[J]. 儿科药学杂志, 2005, 11(1): 7-9. DOI:10.3969/j.issn.1672-108X.2005.01.003.
[8] EDWARDS P A, TABOR D, KAST H R, et al.Regulation of gene expression by SREBP and SCAP[J]. Biochimica et Biophysica Acta, 2001, 1529(1/2/3): 103-113. DOI:10.1161/01.RES.0000237920.70451.ad.
[9] 王宏伟. 甘薯抗性淀粉对高脂诱导肥胖小鼠脂质代谢及其相关基因表达水平的影响研究[D]. 雅安: 四川农业大学, 2013: 7-11.
[10] CAO Z H, GU D H, LIN Q Y, et al. Effect of Pu-erh tea on body fat and lipid profiles in rats with diet-induced obesity[J]. Phytotherapy Research, 2011, 25(2): 234-238. DOI:10.1002/ptr.3247.
[11] YAN H, SHAO W, RONG X, et al. Pu-erh tea aqueous extracts lower atherosclerotic risk factors in a rat hyperlipidemia model[J]. Experimental Gerontology, 2009, 44(6/7): 434-439. DOI:10.1016/ j.exger.2009.03.007.
[12] 龚受基. 六堡茶和茉莉花改善胰岛素抵抗功效及机制研究[D]. 长沙: 湖南农业大学, 2012: 73.
[13] 颜新春, 汪以真, 许梓荣. 动物脂肪酸合成酶(FAS)基因表达的调控[J]. 动物营养学报, 2002, 14(2): 1-4. DOI:10.3969/j.issn.1006-267X.2002.02.001.
[14] STUART S, ANDRZEJ W, ANIL K J. Structural and functional organization of the animal fatty acid synthase[J]. Progress in Lipid Research, 2003, 42(4): 289-317. DOI:10.1016/S0163-7827(02)00067-X.
[15] RONCARI D A. Abnormalities of adipose cells in massive obesity[J]. International Journal of Obesity, 1990, 14(Suppl 3): 187-192.
[16] SEMENKOVICH C F. Regulation of fatty acid synthase (FAS)[J]. Progress in Lipid Research, 1997, 36(1): 43-53. DOI:10.1016/S0163-7827(97)00003-9.
[17] 张英杰, 李宗波, 刘月琴, 等. 不同能量水平日粮对绵羊脂肪酸合成酶(FAS)基因表达的影响[J]. 中国草食动物, 2010(增刊1): 281-283. DOI:10.3969/j.issn.2095-3887.2010.z1.102.
[18] WAY T D, LIN H Y, KUO D H, et al. Pu-erh tea attenuates hyperlipogenesis and induces hepatoma cells growth arrest through activating AMP-activated protein kinase (AMPK) in human HepG2 cells[J]. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5257-5264. DOI:10.1021/jf900730e.
[19] 唐韬, 李燕. 固醇调节元件结合蛋白与脂质代谢[J]. 生理科学进展, 2005, 36(1): 29-34. DOI:10.3321/j.issn:0559-7765.2005.01.006.
[20] 李苏. 黑茶提取物对脂肪变性模型的干预及脂质代谢相关基因的影响[D]. 长沙: 湖南农业大学, 2013: 26-28.
[21] CHUN H P, CHIA H T, WEN H L, et al. Ethanolic extract of Vitis thunbergii exhibits lipid lowering properties via modulation of the AMPK-ACC pathway in hypercholesterolemic rabbits[J]. Evidence-Based Complementary and Alternative Medicine, 2012, 2012(8): 112. DOI:10.1155/2012/436786.
[22] CHEUNG O, SANYAL A J. Abnormalities of lipid metabolism in nonalcoholic fatty liver disease[J]. Seminars in Liver Disease, 2008, 28(4): 351-359. DOI:10.1055/s-0028-1091979.
[23] STOECKMAN A K, TOWLE H C. The role of SREBP-1c in nutritional regulation of lipogenic enzyme gene expression[J]. Journal of Biological Chemistry, 2002, 277(30): 27029-27035. DOI:10.1074/ jbc.M202638200.
[24] 徐惠龙. 黑米糙米皮对大鼠脂代谢的影响及其分子机制研究[D]. 福州: 福建农林大学, 2013: 93-94.
[25] 吴婷婷. 花椒对HepG2细胞和C57BL小鼠在高胆固醇和炎症状态下胆固醇代谢的影响及活性成分的分离纯化[D]. 上海: 复旦大学, 2012: 10.
[26] 刘伟. 过表达载脂蛋白A1对非酒精性脂肪性肝炎的作用的研究[D].北京: 首都医科大学, 2013: 3.
[27] SINGARAJA R R, HENK V, JAMES E R, et al. Specifi c mutations in ABCA1 have discrete effects on ABCA1 function and lipid phenotypes both in vivo and in vitro[J]. Circulation Research, 2006, 99(4): 389-397. DOI:10.1161/01.RES.0000237920.70451.
[28] 钟树生. 咖啡碱与落新妇苷对高脂饮食诱导肥胖小鼠脂肪代谢的影响[D]. 南昌: 江西农业大学, 2014: 29.
[29] 周亮, 申伟华. AMP激活的蛋白激酶研究新进展[J]. 北京体育大学学报, 2008, 31(6): 805-807. DOI:10.3969/ j.issn.1007-3612.2008.06.029.
[30] LIU S, JING F, YU C, et al. AICAR-Induced activation of AMPK inhibits TSH/SREBP-2/HMGCR pathway in liver[J]. PLoS ONE, 2015, 10(5): e0124951. DOI:10.1371/journal.pone.0124951.
Effect and Mechanism of Pigments from Pu-erh Tea on Lipid Metabolism in HepG2 Cell Model
CHEN Yalan1, WANG Xueqing1,*, WANG Yiwen1, ZHENG Ziqing1, YE Meixia1, FU Fangfang1, ZHAO Pei1, SONG Wenjun1, WANG Suying1, BAI Xiaoli2, LI Changwen2
(1. Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China; 2. Yunnan Tasly Deepure Biological Tea Group Co. Ltd., Puer 665100, China)
The contents of triglyceride (TG) and total cholesterol (TG), the mRNA expression level of fatty acid synthase (FAS), sterol regulatory element binding protein 1c (SREBP-1c), cholesterol 7α-hydroxylase (CYP7A1) and ATP binding cassette transporter A1 (ABCA1), and the protein expression level of phospho-AMP-activated protein kinase (p-AMPK) were investigated for studying the effects of pigments from Pu-erh tea on lipid metabolism in HepG2 cell line cultured with normal or oleic acid enriched medium. The results showed that pigments from Pu-erh tea signifi cantly decreased the contents of TG and TC in HepG2 cells cultured in oleic acid-enriched medium in a dose-dependent manner, although having no signifi cant effect on HepG2 cells cultured in normal medium. The mRNA expression levels of FAS and SREBP-1c were signifi cantly down-reg ulated, and the mRNA level of ABCA1 was signifi cantly up-re gulated, the mRNA expression level of CYP7A1 showed an increased tendency and the protein expression level o f p-AMPK was signifi cantly up-regulated after the treatment with pigments from Pu-erh tea for 24 hours in HepG2 cells cultured in oleic acid-enriched medium (P < 0.05). Therefore, pigments from Pu-erh tea could improve lipid metabolism in HepG2 cells cultured in oleic acid-enriched medium by regulating the mRN A levels of enzymes and transcription factors.
HepG2 ; lipid metabolism ; Pu-erh tea; pigments
10.7506/spkx1002-6630-201717033
R961
A
1002-6630(2017)17-0203-07引文格式:
2016-06-23
天津市高等学校创新团队建设规划资助项目(T D12-5049);天津市高校科技发展基金计划项目(20120603);天津商业大学大学生研究训练计划(SRT)基金项目
陈亚蓝(1991—),女,硕士研究生,研究方向为天然活性物质的研究与开发。E-mail:704930060@qq.com *通信作者:王雪青(1964—),女,教授,博士,研究方向为天然活性物质的研究与开发。E-mail:wxqing@tjcu.edu.cn

