γ射线联合肉桂精油对腐败希瓦氏菌的抑制机制
吕 飞,徐 静,魏倩倩,高 飞,周绪霞,丁玉庭,刘 璘*
(浙江工业大学食品工程与质量控制研究所,浙江 杭州 310014)
γ射线联合肉桂精油对腐败希瓦氏菌的抑制机制
吕 飞,徐 静,魏倩倩,高 飞,周绪霞,丁玉庭,刘 璘*
(浙江工业大学食品工程与质量控制研究所,浙江 杭州 310014)
研究γ射线辐照和肉桂精油联合对腐败希瓦氏菌(Shewanella putrefaciens)的抑制效果,分析联合作用对S. putrefaciens的抑制机制。结果表明:辐照D10(菌落总数降低到原始数量的10%所需要的辐照剂量)随着肉桂精油质量浓度的增加而减少,S. putrefaciens对辐照的相对敏感度随肉桂精油质量浓度的增加而增加。辐照和肉桂精油联合对S. putrefaciens具有较好的抑制作用,其对S. putrefaciens细胞形态、胞内外ATP、胞内pH值、膜蛋白以及膜脂肪酸等均具有显著破坏作用。联合作用处理S. putrefaciens的膜蛋白40 kD亚基减少,18 kD亚基增加,且使S. putrefaciens主要膜脂肪酸C14∶0、C16∶0、C16∶1、C17∶1、C18∶1显著减少(P<0.05),其机理可能在于γ射线辐照增加了肉桂精油对S. putrefaciens细胞膜的破坏,从而导致其死亡。
辐照;肉桂精油;腐败希瓦氏菌;联合作用;抑菌机理
水产品富含蛋白质,组织质地脆弱,极易受到微生物作用而腐败变质。腐败希瓦氏菌(Shewanella putrefaciens)是一种典型的水产品特定腐败菌[1-3],腐败活性较强,能产生H2S,还原氧化三甲胺(trimethylamine oxide,TMAO)成三甲胺(trimethylamine,TMA),参与蛋白水解和脂肪分解的过程,产生令人不愉快的气味,从而造成食品的腐败[4-5]。肉桂精油具有较强的抗菌活性[6],能够抑制食品腐败微生物的生长,但是由于其具有刺激性辛辣味,高浓度对食品风味造成一定的影响。γ射线辐照作为一种高新灭菌技术,可消除食品中的致病菌和腐败菌,达到食品保藏或保鲜的目的。但高剂量辐照所造成的“辐照味”将严重影响肉类及其制品的品质,这是辐照广泛应用于肉类制品中的主要技术障碍。
当前,针对精油和辐照对细菌作用机理的研究已有报道。Ultee等[7]在研究香芹酚对蜡状芽孢杆菌的抑菌机理的过程中,发现香芹酚能够改变蜡状芽孢杆菌细胞膜的通透性,使得细胞内K+外流,细胞膜电位和细胞内pH值下降,同时造成细胞内ATP的合成受到抑制。林雅慧[8]发现芳樟油能够改变一部分大肠杆菌菌体蛋白的二级结构和三级结构。γ射线辐照主要作用部位为细胞间质,当受到高能电子射线照射,微生物细胞间质会发生电离和化学作用,导致胞内的物质形成离子、激发态或分子碎片,另外也会使得细胞内水分经辐照和电离作用产生各种游离基和过氧化氢而与其他物质作用,生成新的化合物,导致细胞的生理活动发生紊乱而死亡[9-10]。
为充分抑制水产品腐败菌的生长,减少精油和辐照用量,本实验将肉桂精油和γ射线辐照联合应用,观察两者对S. putrefaciens的抑制效果,并在此基础上研究两者对S. putrefaciens细胞形态、胞内外ATP浓度、胞内pH值、细胞膜蛋白、细胞膜脂肪酸等的影响,探究两者联合对S. putrefaciens的抑制机制。
1 材料与方法
1.1 材料与试剂
肉桂精油由艾园有限公司(澳大利亚)提供,通过水蒸气蒸馏法从锡兰肉桂的叶中提取得到。腐败希瓦氏菌菌株(S. putrefaciens CICC 22940)由中国工业微生物菌种保藏管理中心提供。γ射线辐照在浙江省农业科学院作物与核技术利用研究所进行。
P0010BCA试剂盒 碧云天生物科技公司;细菌膜蛋白提取试剂盒 贝博生物科技有限公司;脂肪酸标准品 上海安谱实验科技股份有限公司。
1.2 仪器与设备
Finngan Trace气相色谱-质谱联用色谱仪 美国Thermo公司;HYJD超纯水器 杭州永洁达净化科技有限公司;BS-223S型精密电子天平 北京赛多利斯仪器系统有限公司;UV759型紫外分光光度计 上海奥谱勒仪器有限公司;SpectraMax M2型酶标仪 美国分子仪器公司;冷冻干燥机 北京博医康实验仪器有限公司;DYCZ-24EN型双垂直电泳仪 北京六一仪器厂;2000凝胶成像分析系统 美国Bio-Rad公司。
1.3 方法
1.3.1 肉桂精油的乳化
取所需不同体积的肉桂精油加入到含有1%吐温-80的去离子水中,加塞后漩涡振荡5 min,再超声分散10 min,制备稳定的精油乳化体系。
1.3.2 S. putrefaciens菌悬液的制备
取微量活化的S. putrefaciens菌悬液接种至100 mL营养肉汤,培养5 h,收集菌液,配制成108CFU/mL的S. putrefaciens菌悬液。
1.3.3 γ射线辐照S. putrefaciens的D10和相对敏感度的测定
取108CFU/mL的S. putrefaciens菌悬液,分别进行如下处理:Ⅰ:未处理(CK);Ⅱ:0.0875 μL/mL肉桂精油处理;Ⅲ:0.175 0 μL/mL肉桂精油处理;Ⅳ:0.350 0 μL/mL肉桂精油处理,然后进行γ射线辐照处理。γ射线辐照的辐照剂量依次为0.030、0.050、0.080、0.010、0.150、0.200 kGy,辐照源为137Cs,以0.10 kGy/min的辐照剂量率进行辐照,采用英国国家物理实验室放射量测定仪进行辐照计量测定校准。辐照后的各处理组用0.85%生理盐水进行适当梯度稀释后,涂布于营养琼脂平板,30 ℃培养(48±2) h后计数,每个辐照剂量设置3 个平行。
γ射线辐照D10[11]和相对辐照敏感度(relative irradiation sensitivity,RIS)[12]按公式(1)~(3)计算。
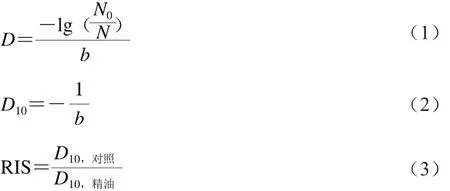
式中:N为辐照后的存活菌落总数/(CFU/mL);N0为辐照前的初始菌落总数/(CFU/mL);D为菌落总数从N0降到N所需的辐照剂量/kGy;b为辐照剂量与细菌存活率的线性拟合方程的斜率;D10为辐照处理杀灭90%的微生物所需的辐照剂量/kGy,即菌落总数降低到原始数量的10%所需要的辐照剂量/kGy;D10,对照为空白对照组D10;D10,精油为精油处理组的D10。菌落总数的计算方法按照GB 4789.2—2010《食品微生物学检验 菌落总数测定》的方法进行。
1.3.4 γ射线辐照和肉桂精油联合处理S. putrefaciens
取108CFU/mL S. putrefaciens菌悬液各100 mL,做如下处理:CK:未添加肉桂精油;G:0.080 kGy γ射线辐照;C1:0.175 μL/mL肉桂精油;C1+G:0.175 μL/mL肉桂精油和0.080 kGy γ射线辐照联合使用;C2:0.350μL/mL肉桂精油,每组处理设置3 个平行。
1.3.5 S. putrefaciens活性的测定
不同处理下S. putrefaciens每隔0.0、0.5、1.0、2.0、3.0、5.0、7.0、9.0 h取样1 mL于9 mL 0.85%生理盐水中进行适当的10 倍梯度稀释后涂布平板,30 ℃培养(48±2) h后计数,以平板计数的对数值(lg (CFU/mL))来表征S. putrefaciens的细菌活性。
1.3.6 细胞形态变化的分析
利用扫描电子显微镜分析法分析不同处理下S. putrefaciens细胞形态的变化[13]。
1.3.7 胞内外ATP的测定
ATP的测定参考Lee[14]、Carson[15]和Siragusa[16]的方法,并做略微修改。取不同处理的S. putrefaciens菌悬液,8000×g离心15 min后,分别得到上清液(上清液代表胞外ATP浓度,ATP外)和沉淀(沉淀代表胞内ATP浓度,ATP内),使用ATP检测试剂盒来测定S. putrefaciens胞内外的ATP浓度。
1.3.8 胞内pH值的测定
取不同处理的108CFU/mL的S. putrefaciens菌悬液,8000×g离心15 min,用5 mmol/L含50 mmol/L乙二胺四乙酸的羟乙基哌嗪乙磺酸缓冲液8 000×g离心洗涤15 min,3 次后重新溶解,根据490 nm与440 nm波长处荧光强度比值,查pH值校准曲线[17-19],求得各个处理对应的胞内pH值(pH内)。
1.3.9 膜蛋白电泳分析
蛋白质的定量曲线测定使用BCA试剂盒进行测定[20]。膜蛋白的提取方法参考细菌膜蛋白提取试剂盒说明书,并作略微调整[21]。膜蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)所需的各类试剂按照汪家政[22]、郭尧君[23]等的方法进行配制。电泳时的电压分别为:浓缩胶的电泳电压为80 V,分离胶的电泳电压为120 V。电泳结束后染色脱色,直到蛋白质条带清晰后用凝胶成像系统拍照,分析结果。
1.3.10 膜脂肪酸含量测定
取不同处理S. putrefaciens菌悬液,0 ℃、8000×g离心10 min,弃去上清液,沉淀用磷酸缓冲液(pH 7.0,0.1 mol/L)离心洗涤3 次后,重悬于磷酸缓冲液(pH 7.0,0.1 mol/L),冻干。将冷干S. putrefaciens粉末用于细胞膜脂肪酸的提取,在脂肪酸色谱分析前,将脂肪酸衍生为易挥发的脂肪酸甲酯[24]。S. putrefaciens膜脂肪酸的甲酯化参考王瑞白等[25]的方法,并做适当的改进。气相色谱-质谱联用色谱分析测定脂肪酸含量[26]。
1.4 数据分析
采用Origin 8.0软件绘图,SPSS 19.0软件进行相关性分析,实验结果表述为±s(n=3),差异性分析采用单因素方差分析方法。
2 结果与分析
2.1 γ射线辐照S. putrefaciens的D10和相对辐照敏感度
D10值用来表征不同处理下微生物的辐射抗性,是选择合适辐照杀菌剂量的重要参数[27]。不同剂量肉桂精油处理的S. putrefaciens的D10和RIS的结果见表1。随着精油剂量的增加,γ射线辐照S. putrefaciens的D10值显著下降(P<0.05),D10由未加精油的空白对照组的0.133 kGy下降到0.350 0 μL/mL精油处理的0.056 kGy,同时,相对辐照敏感度随精油剂量的提高而增加。结果说明随精油剂量的提高,S. putrefaciens对辐照的耐受能力下降。在添加精油的条件下,较低的γ射线辐照剂量即可杀死细菌[12]。

表 1 γ射线辐照S. putrefaciens的D10和相对辐照敏感度Table 1 D10and relative irradiation sensitivity of S. putrefaciens
2.2 γ射线辐照和肉桂精油联合作用对S. putrefaciens生长的影响

图 1 γ射线辐照和肉桂精油对S. putrefaciens活性的影响Fig. 1 Effect of γ irradiation combined with CEO on cell viability of S. putrefaciens
γ射线辐照和肉桂精油处理对S. putrefaciens生长的影响如图1所示。处理组C2对细菌的抑制作用最强,C1+G、C1、G组次之,未处理组CK细菌的生长能力最强。C1+G组对S. putrefaciens的活性的抑制效果优于C1和G组,说明γ射线和肉桂精油联合使用可以显著降低S. putrefaciens的活性(P<0.05),这与2.1节研究结果一致。Cox等[28]的研究发现茶树精油可快速抑制大肠杆菌、金黄色葡萄球菌、白色念珠菌的活性,且随着茶树精油质量浓度的提高,对细菌活性的抑制作用增强。γ射线辐照对细菌活性抑制研究文献亦有报道[29],但肉桂精油和γ射线辐照联合作用对S. putrefaciens抑制研究则鲜见报道。
2.3 γ射线辐照联合肉桂精油对S. putrefaciens细胞形态的影响
不同处理对S. putrefaciens细胞外部形态的影响如图2所示。与CK组相比,G组的S. putrefaciens的整体形态并未发生明显改变,但其表面略显不平整。C1、C1+G、C2组对S. putrefaciens的细胞外部形态的影响较为明显,使得S. putrefaciens表面变得不光滑,部分细胞被破坏。其中,C1+G和C2对细胞形态的作用效果更为明显,大部分细胞遭到破坏,且C1+G和C2组的作用效果相近,这说明γ射线辐照和肉桂精油联合作用对S. putrefaciens的细胞形态的影响更大。另外,C1+G组对细胞形态的破坏效果比C1组强,说明γ射线辐照可以协助肉桂精油促进其对细胞形态的破坏作用。李娅男等[30]发现牛至精油和罗勒精油复配处理大肠杆菌3 h后,部分菌体出现溢裂,表面形成沟痕,并且伴有一定的萎缩迹象,牛至精油和佛手柑精油复配处理枯草芽饱杆菌3 h后,细胞表面变得粗糙,菌体发生严重的断裂和溶解,并且伴有菌体碎片的产生。本研究发现γ射线对S. putrefaciens细胞形态影响较小。γ射线辐照主要通过高能射线能够穿过细胞而作用于细胞内的大分子物质,DNA和酶遭到破坏,使其形成离子、激发态或分子碎片,从而引发微生物死亡[10]。
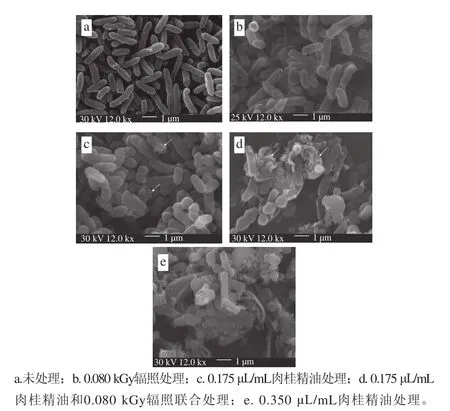
图 2 S. putrefaciens扫电子显微镜图Fig. 2 Scanning electron microphotographs of S. putrefaciens
2.4 γ射线辐照联合肉桂精油对S. putrefaciens胞内外ATP的影响
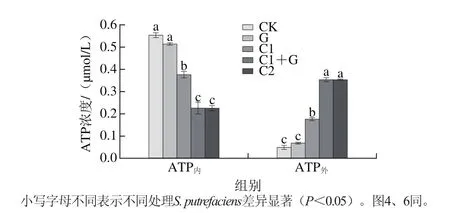
图 3 S. putrefaciens的ATP内和ATP外浓度变化Fig. 3 Effect of γ irradiation combined with CEO on ATP concentration inside and outside S. putrefaciens cells
细菌细胞膜的破坏和与膜相关的能量转换系统有着密切的关系[31],不同γ射线辐照和肉桂精油处理对S. putrefaciens胞内外ATP浓度的作用效果如图3所示。对照组CK的S. putrefaciens胞内外ATP浓度分别为0.553 μmol/L和0.049 μmol/L。与CK组相比,G组的胞内外ATP浓度无显著性差异,但添加精油的处理组(C1、C1+G、C2)使得S. putrefaciens ATP内浓度显著降低,ATP外浓度增加显著(P<0.05),且C1+G和C2组对胞内外ATP浓度影响更显著。结合电子显微镜的结果,说明γ射线辐照和肉桂精油联合作用于S. putrefaciens细胞时,更大程度地改变了细胞的通透性,从而使得ATP内浓度下降而ATP外浓度升高。同时ATP的合成可能受到抑制也会导致ATP内的下降。Turgis等[32]在研究芥子精油对大肠杆菌O157:H7和沙门氏菌的作用机理的过程中发现,芥子精油均能对这两种菌的细胞膜的完整性造成破坏,使得胞内ATP大量流失,并且伴有明显的细胞内容物流出,最终导致了细胞死亡。Ultee等[7]在研究香芹酚对枯草芽孢杆菌的作用机制时,得到了与Turgis等相同的结论。
2.5 γ射线辐照联合肉桂精油对S.putrefaciens胞内pH值的影响

图 4 S. putrefaciens胞内pH值的变化Fig. 4 Effect of γ irradiation combined with CEO on pH inside S. putrefaciens cells
细菌内环境pH值的稳定对细菌的正常生理活动的进行起着至关重要的作用,如DNA转录、蛋白质合成和与生理活动相关酶的活性等[21],S. putrefaciens pH内值的变化如图4所示。G、C1、C1+G、C2组的pH内值均低于CK。G和C1的pH内值显著高于C1+G和C2(P<0.05),说明联合处理对细胞pH内值的影响高于肉桂精油和γ射线辐照单独处理,可能更大程度地破坏了S. putrefaciens细胞的完整性,使得正常生理活动紊乱而导致S. putrefaciens的死亡。C1+G组和高质量浓度肉桂精油处理C2的pH内值无显著差异(P>0.05)。Turgis等[32]研究发现芥子精油能够破坏大肠杆菌O157:H7和沙门氏菌细胞膜的完整性,造成胞内ATP流失和pH值下降,引发细胞的死亡。
2.6 γ射线辐照联合肉桂精油对S. putrefaciens膜蛋白的影响
S. putrefaciens膜蛋白的SDS-PAGE结果如图5所示,S. putrefaciens有30多条蛋白亚基条带,分子质量大多集中在30~172 kD之间。与CK组相比,G组蛋白亚基条带变化不大,说明低剂量γ射线辐照并未对S. putrefaciens的膜蛋白造成显著影响。与G组相比,处理组C1、C1+G、C2对膜蛋白的影响较显著,其中C1和C1+G处理S. putrefaciens膜蛋白的18 kD亚基增加而40 kD亚基减少,C2处理组膜的49、43kD亚基增加,对膜的影响比C1和C1+G组更显著。γ射线辐照和肉桂精油联合处理作用下,其蛋白条带较C1和G组明显,且随着精油质量浓度增加,蛋白质条带显示亦明显增强,这可能是较高精油质量浓度处理C2及联合处理C1+G组均对膜蛋白质造成了较强的破坏作用,导致更多的氨基和巯基暴露出来,从而通过染料磺酸基和活性蛋白氨基的离子间交互作用和范德华引力,使得考马斯亮蓝R-250与更多的蛋白亚基结合,从而使得C1+G和C2组的蛋白质电泳条带较其他处理组更为明显。

图 5 S. putrefaciens膜蛋白的SDS-PAGE图谱Fig. 5 SDS-PAGE images of S. putrefaciens membrane proteins
2.7 γ射线辐照联合肉桂精油对S. putrefaciens膜脂肪酸的影响
生物膜对细胞的完整性至关重要,它为细胞在膜内和膜外环境之间形成了一道屏障。细菌能够适应不同环境的改变,膜脂肪酸的作用显得尤为重要[29]。细菌所含脂肪酸的种类和相对含量变化可以间接反映细菌的不同生长状态[33]。S. putrefaciens膜脂肪酸甲酯图谱的出峰时间与37种脂肪酸甲酯的混和标准品进行比照,并结合在脂肪酸样品中添加内标C19:0进行定性和定量[34]。S. putrefaciens 细胞膜含多种脂肪酸,如饱和脂肪酸C12∶0、C14∶0、C16∶0、C18∶0,不饱和脂肪酸C16∶1,9c、C17∶1,10c、C18∶1,9c,且不饱和脂肪酸含量达50%[35]。

图 6 S. putrefaciens膜脂肪酸的变化Fig. 6 Effect of γ irradiation combined with CEO on membrane fatty acids in S. putrefaciens
不同处理下S. putrefaciens膜脂肪酸种类及含量的变化如图6所示。与CK组相比,处理组G、C1、C1+G和C2的S. putrefaciens 细胞膜饱和不饱和脂肪酸含量均呈现减少趋势,特别是C14∶0、C16∶0、C16∶1、C17∶1、C18∶1(P<0.05)。C1+G组对S. putrefaciens膜脂肪酸的影响比C1和G组要大,并且C1组的影响大于G组。在所有处理中,C2组使得膜脂肪酸减少幅度最大(P<0.05),说明高质量浓度的肉桂精油对膜脂肪酸的影响较大。di Pasqua等[36]研究了百里香酚、香芹酚、丁香酚、柠檬烯及肉桂醛对大肠杆菌菌体细胞脂肪酸含量变化的影响,发现处理后的各菌体细胞中的不饱和脂肪酸的含量显著下降。特别地,肉桂醛处理的大肠杆菌的C18∶2,trans和C18∶3,cis含量明显降低。另外,di Pasqua等[36]的研究发现与抗菌活性物质如百里香精油相比,γ射线辐照对膜脂肪酸的影响要小得多,这主要是因为γ射线辐照对膜脂肪酸的影响与其辐照剂量密切相关。此外,γ射线辐照对脂肪酸的作用还与细菌的种类相关,Dussault等[29]的研究发现在相同γ射线处理下,枯草芽孢杆菌的总不饱和脂肪酸减少,而大鼠肺成纤维细胞的总不饱和脂肪酸显著增加(P<0.05)。
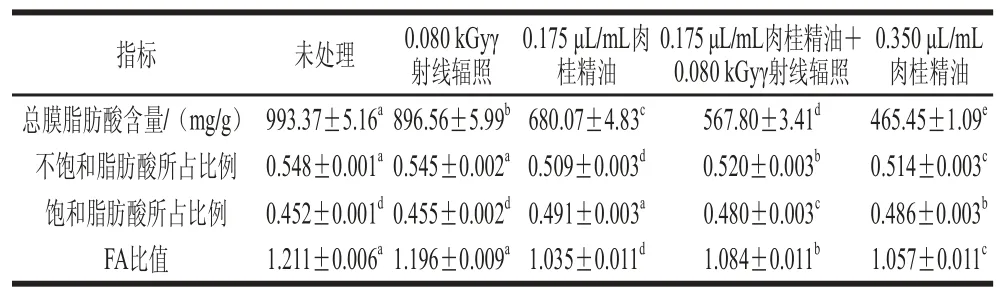
表 2 与S. putrefaciens膜脂肪酸相关参数的变化Table 2 Effect of γ irradiation combined with CEO on fatty acid profi le of membrane lipids in S. putrefaciens
S. putrefaciens膜脂肪酸相关的参数的变化如表2所示。总脂肪酸含量反映了肉桂精油对S. putrefaciens的影响大于γ射线辐照。FA比值的降低表明不饱和脂肪酸比例的降低或饱和脂肪酸比例的增加。C1、C1+G和C2组的FA比值范围为1.035~1.084,比CK和G组的FA比值低。这主要是由于添加精油的处理组可对细菌的膜脂肪酸产生直接显著影响。
3 结 论
本实验主要研究γ射线辐照联合肉桂精油对S. putrefaciens生长的抑制作用,并研究肉桂精油单独和联合作用对S. putrefaciens细胞形态、胞内外ATP、胞内pH值、膜蛋白、膜脂肪酸的影响,探究肉桂精油和γ射线辐照联合作用机理。精油和γ射线辐照的联合使用对S. putrefaciens的活性的抑制效果优于单独处理。在减少精油用量和辐照剂量的前提下,γ射线辐照和肉桂精油联合使用可以显著降低S. putrefaciens的活性(P<0.05),从而达到抑菌目的。γ射线辐照和肉桂精油联合抑制S. putrefaciens的机制可能在于γ射线辐照改变了细胞膜脂肪酸组分的变化,从而促进了肉桂精油对细菌细胞膜的作用效果,因此两者联合作用时胞内外ATP和胞内pH值变化较单独作用时的效果显著。
[1] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1): 121-137. DOI:10.1016/0168-1605(96)01134-8.
[2] GRAM L, WEDELL-NEERGAARD C, HUSS H H. The bacteriology of fresh and spoiling Lake Victorian Nile perch (Lates niloticus)[J]. International Journal of Food Microbiology, 1990, 10(3): 303-316. DOI:10.1016/0168-1605(90)90077-I.
[3] BORCH E, KANT-MUERMANS M L, BLIXT Y. Bacterial spoilage of meat and cured meat products[J]. International Journal of Food Microbiology, 1996, 33(1): 103-120. DOI:10.1016/0168-1605(96)01135-X.
[4] STENS TRÖM I M, MOLIN G. Classification of the spoilage flora offish, with special reference to Shewanella putrefaciens[J]. Journal of Applied Bacteriology, 1990, 68(6): 601-618. DOI:10.1111/j.1365-2672.1990.tb05226.x.
[5] LOPEZ-CA BALLERO M, SÁNCHEZ-FERNÁNDEZ J A, MORAL A. Growth and metabolic activity of Shewanella putrefaciens maintained under different CO2and O2concentrations[J]. International Journal of Food Microbio logy, 2001, 64(3): 277-287. DOI:10.1016/S0168-1605(00)00473-6.
[6] WU J, LIU H, GE S, et al. The preparation, characterization, antimicrobial stability and in vitro release evaluation of fish gelatin fi lms incorporated with cinnamon essential oil nanoliposomes[J]. Food Hydrocolloids, 2015, 43: 427-435. DOI:10.1016/j.foodhyd.2014.06.017.
[7] ULTEE A, KETS E, SMID E. Mechanisms of action of carvacrol on the food-borne pathogen Bacillus cereus[J]. Applied and Environmental Microbiology, 1999, 65(10): 4606-4610.
[8] 林雅慧. 芳樟油气相抗菌机制的研究[D]. 广州: 广东工业大学, 2012: 31-48. DOI:10.7666/d.y2097717.
[9] 段鑫, 欧杰, 李柏林. 辐照技术在肉制品杀菌保鲜中的应用[J]. 食品科学, 2010, 31(1): 278-282.
[10] 吴海霞, 韩雪孟. 食品冷杀菌研究技术进展[J]. 畜牧兽医科技信息, 2005(12): 67-69.
[11] 刘睿哲. 食品菌落总数测定中TTC做显色剂的探索[J]. 产业与科技论坛, 2011, 10(20): 64-65 . DOI:10.3969/j.issn.1673-5641.2011.20.035.
[12] TURGIS M, HAN J, MILLETTE M, et al. Effect of selected antimicrobial compounds on the radiosensitization of Salmonellatyphi in ground beef[J]. Letters in Applied Microbiology, 2009, 48(6): 657-662. DOI:10.1111/j.1472-765 X.2009.02587.x.
[13] 梁静南, 刘一苇, 谢家仪. 制备细菌类单细胞生物扫描电镜样品方法的改进[J]. 电子显微学报, 2013, 32(3): 276-278. DO I:10.3969/ j.1000-6281.2013.03.016.
[14] LEE S H, LEE S Y, SON D J, et al. Inhibitor y effect of 2 -hydroxycinnamaldehyde on nitric oxide production through inhibition of NF-κB activation in RAW 264.7 cells[J]. Bioche mical Pharmacology, 2005, 69(5): 791-799. DOI:10.1016/j.bcp.2004.11.013.
[15] CARSON C F, MEE B J, RILEY T V. Mechanism of action of Melaleuca alternifolia (tea tree) oil on Staphylococcus aureus determined by time-kill, lysis, leakage, and salt tolerance assays and electron microscopy[J]. Antimicrobial Agents and Chemotherapy, 2002, 46(6): 1914-1920.
[16] SIRAGUSA G R, CUTTER C N, DORS A W J, et al. Use of a rapid microbial ATP bioluminescence assay to detect contamination on beef and pork carcasses[J]. Journal of Food Protection, 1995, 58(7): 770-775.
[17] LAMBERT R, SKANDAMIS P N, COOTE P J, et al. A study of the minimum inhibitory c oncentration and mode of action of oregano essential oil, thymol and carvacrol[J]. Journal of Applied Microbiology, 2001, 91(3): 453-462. DOI:10.1046/j.1365-2672.2001.01428.x.
[18] SPILIMBERGO S, QUARANTA A, GARCIA-GONZALEZ L, et al. Intracellular pH measurement during high-pressur e CO2pasteurization evaluated by cell fi uorescent staining[J]. The Journal of Supercritical Fluids, 2010, 53(1): 185-191. DOI:10.1016/j.supfi u.2010.03.004.
[19] BREEUWER P, DROCOURT J, ROMBOUTS F M, et al. A novel method for continuous determination of the intracellular pH in bacteria with the internally conjugated fluorescent probe 5 (and 6-)-carboxyfluorescein succinimidyl ester[J]. Applied and Environmental Microbiology, 1996, 62(1): 178-183.
[20] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[21] 李丰良, 韩妮萍, 杜廷义, 等. 铜绿假单胞菌对亚胺培南耐药性的 动态变化特征及分析[J]. 中国药房, 2006, 17(10): 765-767. DOI:10.3969/j.issn.1001-0408.2006.10.020.
[22] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 万方数据资源系统, 2000: 77-100.
[23] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学技术出版社,1999: 123-157.
[24] 徐敏, 王静, 柴子涵, 等. 海洋细菌脂肪酸的气相色谱分析[J]. 海洋科学, 2013, 37(2): 76-83.
[25] 王瑞白, 刘海洪, 邱海燕, 等. 我国霍乱弧菌的脂肪酸分型研究[J]. 中国生物工程杂志, 2007, 27(6): 15-21. DO I:10.3969/ j.issn.1671-8135.2007.06.004.
[26] SCHUMMER C, DELHOMME O, APPENZELLER B M, et al. Comparison of MTBSTFA and BSTFA in derivatization reactions of polar compounds prior to GC/MS analysis[J]. Tala nta, 2009, 77(4): 1473-1482. DOI:10.1016/j.talanta.2008.09.043.
[27] 袁忠谊, 岳玲, 吴富兰, 等. 电子束和γ射线辐照对左归丸粉杀菌效果的研究[J]. 辐射研究与辐射工艺学报, 2012, 30(2): 93-96.
[28] COX S D, MA NN C M, MARKHAM J L, et al. The mode of antimicrobial action of the essenti al oil of Melaleuca alternifolia (tea tree oil)[J]. Journal of Applied M icrobiology, 2000, 88(1): 170-175.
[29] DUSSAULT D, CAILLET S, LE TIEN C, et al. Effect of γ-irradiation on membrane fatty acids and peptidoglycan’s muropeptides of Pantoea agglomerans, a plant pathogen[J]. Journal of Applied Microbiology, 2009, 106(3): 1033-1040. DOI:10.1111/j.1365-2672.2008.04070.x.
[30] 李娅男, 梁浩, 袁其朋, 等. 4 种植物精油体外抑菌活性及其稳定性的研究[J]. 北京化工大学学报: 自然科学版, 2012, 39(3): 81-85. DOI:10.3969/j.issn.1671-4628.2012.03.016.
[31] AYARI S, DUSSAULT D, MILLETTE M, et al. Changes in membrane fatty acids and murein composition of Bacillus cereus and Salmonella typhi induced by gamma irr adiation treatment[J]. International Journal of Food Microbiology, 2009, 135(1): 1-6. DOI:10.1016/j.ijfoodmicro.2009.07.012.
[32] TURGIS M, HAN J, CAILLET S, et al. Antimicrobial activity of mustard essential oil against Escherichia coli O157:H7 and Salmonella typhi[J]. Food Control, 2009, 20(12): 1073-1079. DOI:10.1016/ j.foodcont.2009.02.001.
[33] ŠPITSMEISTER M, ADAMBERG K, VILU R. UPLC/MS based method for quantitative determination of fatty acid composition in Gram-negative and Gram-positive bacteria[J]. Journal of Microbiological Methods, 2010, 82(3): 288-295. DOI:10.1016/ j.mimet.2010.07.006.
[34] 孔祥会, 王桂忠, 李少菁. 低温适应下锯缘青蟹肌肉 及其细胞膜脂肪酸组成的变化[J]. 水产学报, 2006, 30(5): 603-610. DOI:10.3321/ j.issn:1000-0615.2006.05.005.
[35] MOULE A L, WILKINSON S G. Polar lipids, fatty acids, and isoprenoid quinones of Alteromonas putrefaciens (Shewanella putrefaciens)[J]. Systematic and Applied Microbiology, 1987, 9(3): 192-198. DOI:10.1016/S0723-2020(87)80021-8.
[36] DI PASQUA R, BETTS G, HOSKINS N, et al. Membrane toxicity of antimicrobial compounds from essential oils[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4863-4870. DOI:10.1021/ jf0636465.
Antimicrobial Mechanism of Combination of γ Irradiation and Cinnamon Essential Oil against Shewanella putrefaciens
LÜ Fei, XU Jing, WEI Qianqian, GAO Fei, ZHOU Xuxia, DINY Yuting, LIU Lin*
(Food Engineering and Quality Control Institution, Zhejiang University of Technology, Hangzhou 310014, China)
The combined antibacterial effect of γ irradiation and cinnamon essential oil (CEO) against Shewanella putrefaciens was evaluated and the underlying mechanism was investigated. The irradiation dose required to reduce total colony number to 10% of the initial level (D10) was reduced and the relative irradiation sensitivity was increased with increased concentration of CEO. The combination of γ irradiation and CEO was more effective in inhibiting the growth of S. putrefaciens than each alone. The combination treatment exhibited an obvious negative effect on cell morphology,
intracellular ATP and pH, membrane proteins and fatty acids in S. putrefaciens. The combination resulted in a reduction of 40 kD subunits and an increase of 18 kD subunits in membrane proteins, as well as a signifi cant reduction of C14:0, C16:0, C16:1, C17:1, and C18:1in membrane lipids (P < 0.05). The mechanism for the synergism was due to the potential of γ irradiation to increase the destructive effect of CEO on the cell membrane of S. putrefaciens thus causing its death.
irradiation; cinnamon essential oil; Shewanella putrefaciens; synergistic effect; antimicrobial mechanism
10.7506/spkx1002-6630-201717003
TS254.4
A
1002-6630(2017)17-0014-06
吕飞, 徐静, 魏倩倩, 等. γ射线联合肉桂精油对腐败希瓦氏菌的抑制机制[J]. 食品科学, 2017, 38(17): 14-19.
DOI:10.7506/spkx1002-6630-201717003. http://www.spkx.net.cn
LÜ Fei, XU Jing, WEI Qianqian, et al. Antimicrobial mechanism of combination of γ irradiation and cinnamon essential oil against Shewanella putrefaciens[J]. Food Science, 2017, 38(17): 14-19. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201717003. http://www.spkx.net.cn
2016-07-08
国家自然科学基金青年科学基金项目(31301579)
吕飞(1980—),女,副教授,博士,研究方向为农产品贮藏加工。E-mail:lvfei_zju@163.com *通信作者:刘璘(1956—),男,副教授,硕士,研究方向为农产品贮藏加工。E-mail:linliu85@126.com

