坛紫菜多酚抗氧化及抑制UVB致HSF细胞氧化损伤作用
李 锋,李清仙,程志远,郭养浩,石贤爱*
(福州大学生物科学与工程学院,福建 福州 350116)
坛紫菜多酚抗氧化及抑制UVB致HSF细胞氧化损伤作用
李 锋,李清仙,程志远,郭养浩,石贤爱*
(福州大学生物科学与工程学院,福建 福州 350116)
从坛紫菜中提取分离制备多酚组分,通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、抑制β-胡萝卜素褪色能力和铁还原能力分析法评价坛紫菜多酚的体外抗氧化作用;以紫外线B(ultraviolet radiation B,UVB)致人表皮成纤维细胞(human skin fi broblast cells,HSFs)损伤模型评价坛紫菜多酚抑制紫外损伤表皮作用,考察其用于防护紫外损伤领域的可行性。体外实验结果显示,坛紫菜多酚具有较强的抗氧化作用,其DPPH自由基清除能力与同等质量浓度的二丁基羟基甲苯(butylated hydroxytoluene,BHT)相当;但抑制β-胡萝卜素亚油酸体系褪色能力和铁还原能力弱于同等质量浓度的BHT。细胞实验结果显示,坛紫菜多酚能有效降低UVB辐照所致HSFs的乳酸脱氢酶活力,维护细胞膜的完整性;降低受损细胞的活性氧类水平,增加超氧化物歧化酶、谷胱甘肽过氧化物酶活性,从而降低细胞的氧化应激状态,提升内皮细胞的抵抗氧化应激的能力,显著抑制HSFs凋亡水平。坛紫菜多酚能在细胞水平有效保护HSFs免受UVB的氧化损伤,表明紫菜多酚具有用于紫外损伤防护领域的潜力。
坛紫菜多酚;抗氧化;紫外线B;氧化应激
坛紫菜(Porphyra haitanensis)系暖温性海洋红藻,是我国特有的传统海水养殖大宗品种,主要分布于福建、浙江两省。现代研究发现,坛紫菜中富含多种海洋生物活性物质:海藻多酚[1]、红藻糖苷[2]、藻红(蓝)蛋白[3]以及海藻多糖等。多酚是一大类结构不同、含有多个酚羟基化合物的总称,广泛存在于植物中。随着现代分析和分离技术应用于海藻资源的开发以及对海藻的次级代谢产物研究的逐步深入,海藻多酚日益引起人们的关注。近年来研究表明,海藻多酚主要具有以下几方面的生物活性:抗氧化活性[4-6],可有效降低实验动物血清和肝脏中丙二醛含量,提高超氧化物岐化酶(superoxide dismutase,SOD)等抗氧化酶活性,在体外具有较强的抑制自由基活性;抗肿瘤活性[7-8],海藻多酚对多种肿瘤细胞株具有较强的抑制作用;调血脂降血糖活性[9-11],可有效降低模型动物的空腹甘油三酯、胆固醇等血脂水平,有效降低糖尿病小鼠的空腹血糖值,提高实验动物的葡萄糖耐受能力和对胰岛素的敏感性。目前对于海藻多酚的研究主要集中在褐藻多酚方面,而对于红藻多酚的研究相对较少。
随着社会发展,人们有更多的时间从事户外文体娱乐活动,这使得人体皮肤直接暴露于太阳紫外照射的时间大大延长。每年仅美国的新增非黑素瘤皮肤癌(non melanoma skin cancers,NMSCs)临床病例数量就超过100万,其发病率位居北美各类癌症之首[12]。我国虽无详细的流行病学及临床统计资料,但紫外辐照所致皮肤损伤正日益引起重视。紫外线是波长范围介于200~400 nm的电磁波[13],可分为3 个波段:320~400nm的长波段,紫外线A(ultraviolet radiation A,UVA);290~320 nm的中波段,UVB;200~290 nm的短波段,UVC[14]。受臭氧层的吸收作用,太阳光中的UVC不能穿透大气层到达地面,在自然环境中几乎不存在。UVB辐照是产生表皮损伤形成一系列皮肤疾病最普遍的环境致病因子,UVB能通过与表皮细胞中一系列组分发生反应而产生活性氧类(radical oxygen species,ROS)。生成的ROS主要为·OH,易与脂质、蛋白质和糖类等生物大分子发生过氧化反应,生成更有危害的过氧化物,破坏表皮细胞中酶性及非酶性抗氧化防御系统,使得皮肤受损,造成皮肤红斑、光化角质和NMSCs等病理状态[15]。
为了减少在户外时UVB对皮肤的损伤,人们常采用遮光剂和防晒乳来保护皮肤,这两种主要是通过吸收和反射紫外线的方式来保护皮肤,但考虑到紫外皮肤病的高发病率,其所起的作用十分有限,故临床亟需更为有效的基于新机制的皮肤保护制剂。目前,一些天然来源的小分子化合物表现出较好地抑制UVB致皮肤损伤的潜力[16-18],引起了学界的极大关注,从天然植物化合物中开发皮肤光保护剂已成为该领域新的趋势,这方面的研究方兴未艾;也有较多的研究表明天然多酚类物质能有效地抑制紫外线对于皮肤细胞的氧化损伤[19-21],但主要集中于茶多酚等陆生植物的多酚类物质,目前鲜见将海藻多酚用于抑制UVB致皮肤细胞损伤方面的研究报道。本实验以新鲜坛紫菜为原料,提取分离其中多酚组分,通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除实验、抑制β-胡萝卜素褪色能力和铁还原能力(ferric reducing antioxidant power,FRAP)分析法考察其体外抗氧化作用;以UVB致人表皮成纤维细胞(human skin fibroblast cells,HSFs)损伤模型考察坛紫菜多酚抑制紫外损伤表皮作用,探索坛紫菜多酚天然成分用于紫外防护的可行性。
1 材料与方法
1.1 材料与试剂
新鲜坛紫菜采自福建省平潭岛。
DPPH、2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)、β-胡萝卜素、三吡啶三吖嗪(tripyridyl-triazine,TPTZ)、Folin-Ciocaltea试剂 上海阿拉丁试剂公司;HSFs 鼎国生物技术有限公司;RPMI-1640培养基、胎牛血清(fetal bovine serum, FBS)、双抗(青霉素-链霉素)溶液、胰蛋白酶等细胞培养相关试剂 美国HyClone公司;2 ,7 -二氯荧光黄双乙酸盐(dichlorodihydrofluorescein diacetate,DCFH-DA) 美国Sigma公司;Annexin V/PI双染试剂盒 上海贝博生物技术公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)测定试剂盒 南京建成生物工程研究所;其他试剂均为分析纯。
1.2 仪器与设备
COULTER EPICS XL型流式细胞仪 美国Beckman公司;UV-1800紫外-可见分光光度计 日本岛津公司;SHB-Ⅲ循环水式真空泵 郑州长城科工贸公司;YRE-202A真空旋转蒸发器 日本Eyela公司;二氧化碳培养箱 美国Thermo公司;倒置显微镜 重庆光电仪器公司;KN-4006B紫外光疗仪 科诺医学设备有限公司。
1.3 方法
1.3.1 坛紫菜多酚的提取及分离
在Wang Tao等[22]方法的基础上加以修改。新鲜坛紫菜-80 ℃冷冻后进行冷冻干燥,粉碎;用乙醇按料液比1∶20(m/V)于35 ℃摇床200 r/min提取3 次,每次2 h,过滤收集提取液;合并滤液,减压浓缩去除乙醇;浓缩液用等体积石油醚剧烈振荡萃取以除去油脂,分液漏斗静置分层,收集上层水相,重复萃取操作2 次;浓缩萃取分离后的水相。由于水相层提取物中含有较多的糖分,采用硅胶柱层析以去除糖分。硅胶柱高径比25∶1湿法装柱,上样之后,采用乙酸乙酯-甲醇体系梯度洗脱,洗脱流速0.5 BV/h,部分收集器收集过柱液。每只试管取样于微孔板中,减压干燥去除有机溶剂,每孔加入同体积水,以消除有机溶剂对后续分析的干扰;硫酸-苯酚法测定糖分含量,采用Folin-Ciocaltea试剂分析多酚含量;绘制洗脱曲线,收集多酚洗脱峰;收集液减压浓缩去除有机溶剂,冷冻干燥即得坛紫菜多酚(Porphyra haitanensis polyphenol,PP)样品,-20 ℃保存备用。
1.3.2 坛紫菜多酚DPPH自由基清除能力测定
采用Souza等[23]的方法略有改动。2 mL DPPH-甲醇或水溶液(1 mmol/L)与5 mL不同质量浓度(0.125、0.250、0.500、1.000、2.000、4.000、8.000 mg/mL)的提取物溶液混合,振荡摇匀,室温避光放置30 min。用2 mL蒸馏水代替样品作为阴性对照,相同方法处理。以BHT为阳性对照。于517 nm波长处测定吸光度,DPPH自由基清除率计算见式(1)。
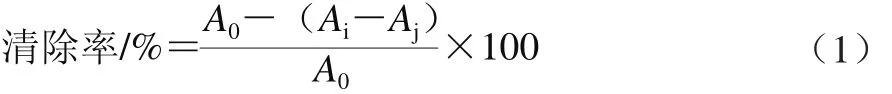
式中:Α0为样品与溶剂混合液的吸光度;Αi为DPPH自由基与样品反应后的吸光度;Αj为DPPH自由基与溶剂混合后的吸光度。实验重复3 次求平均值。
1.3.3 β-胡萝卜素-亚油酸体系抗氧化分析
采用Shon等[24]的方法略做修改。将1 mg β-胡萝卜素溶解于5 mL氯仿中,随后加入100 μL亚油酸和1 mL吐温-80,混合物室温振荡混合10 min。随后,40 ℃减压旋蒸去除氯仿,再加入100 mL氧饱和蒸馏水,剧烈摇晃1 min,形成乳化液(β-胡萝卜素-亚油酸乳化液)。96 孔微孔板,每孔加入50 μL样品溶液和200 μL的上述乳化液,摇床80 r/min混匀1 min,50 ℃孵育反应。在酶标仪上于470 nm波长处测定初始反应的吸光度以及反应120 min后的吸光度,分别记为Α0和Α120,ΔA=Α0-Α120,ΔA越大表明β-胡萝卜素氧化程度越高、褪色越多。计算不同质量浓度(0.125、0.250、0.500、1.000、2.000、4.000、8.000 mg/mL)的坛紫菜多酚样品对β-胡萝卜素-亚油酸乳化液褪色的抑制率,计算见式(2)。

式中:ΔA0表示不加样品抑制时的褪色情况;ΔAi表示坛紫菜多酚样品加入后产生抑制作用时的褪色情况。
1.3.4 铁还原能力分析
FRAP抗氧化分析采用Benzie等[25]的方法。
配制FRAP工作液:取2.5mL 10 mmol/L的TPTZ,用40 mmol/L HCl配制)、2.5 mL 20 mmol/L的FeCl3和25 mL 0.3 mol/L的醋酸缓冲液(pH 3.6)混合均匀,即得FRAP工作液。
测定方法:取0.3 mL不同质量浓度(0.125、0.250、0.500、1.00、2.000、4.000、8.000 mg/mL)的样品,加入2.7 mL预热至37 ℃的FRAP工作液,摇匀后放置10 min,于593 nm波长处测定吸光度,用空白溶剂作参比对照测定。根据反应后的吸光度,从FeSO4标准曲线上求得对应FeSO4浓度(μmol/L),根据样品质量浓度,换算成对应的当量“μmol FeSO4/g样品”值,简写为“μmol/g”,定义为FRAP值。此值越大,表明抗氧化能力越强。
绘制FeSO4标准曲线:准确称量6.08 mg FeSO4溶于适量水中,加入18 mol/L浓硫酸0.25 mL,再加水定容至50 mL,并放入一小铁钉,作为贮液(浓度为800 μmol/L),将此贮液稀释成25、50、100、200、400、800 μmol/L系列标准液浓度,各取0.3 mL按以上测定方法处理,测定吸光度,绘制标准曲线。
1.3.5 坛紫菜多酚抑制UVB致HSFs氧化损伤实验
1.3.5.1 细胞培养
HSFs用RPMI-1640培养基(含10% FBS、100 U/mL链霉素、100 U/mL青霉素),置于5% CO2、37 ℃培养箱中培养,每48 h换液一次。取对数生长期的细胞用0.25%胰酶消化,制备细胞悬液,密度调整至1×105个/mL,每孔100 μL接种于12 孔板,继续培养24 h,随后转换无血清培养基培养4 h。
1.3.5.2 UVB辐照剂量、坛紫菜多酚安全剂量的确定及分组
辐照前将细胞用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2 次后加入少量PBS覆盖细胞,分别用10、25、50、75、100 mJ/cm2剂量的UVB(290~320 nm)辐照细胞,辐照后立即加入无血清培养基继续培养24 h,噻唑蓝(methyl thiazolyl tetrazolium,MTT)法分析细胞活力以确定合适的辐照损伤剂量[26]。用含不同质量浓度(5、20、50、100、500、1000 μg/mL)坛紫菜多酚的无血清培养基分别处理细胞24 h,参考文献[27]采用MTT法分析细胞活力,以确定坛紫菜多酚对正常细胞不产生抑制作用的安全剂量范围。
抑制UVB辐照实验:细胞辐照前用药物处理2 h,经固定剂量UVB辐照后,立即加入含不同质量浓度药物(10、50、100 μg/mL PP;50 μg/mL BHT)的无血清培养基培养24 h,MTT法检测细胞活性,考察药物对UVB损伤的抑制 作用。将培养孔分成3组:空白对照组(不经UVB辐照、不加坛紫菜多酚);UVB辐照模型组(用50 mJ/cm2UVB辐照细胞,不加坛紫菜多酚)、药物组(50 mJ/cm2UVB辐照,不同质量浓度坛紫菜多酚无血清培养基处理)。
1.3.5.3 MTT法分析细胞活性
细胞按照1.3.5.2节方法,经UVB辐照处理或药物处理后,培养板吸去培养基,加入含5 mg/mL MTT的无血清无酚红培养基,于37 ℃、5% CO2条件下继续培养4 h,吸取MTT溶液,加入DMSO溶解所形成的甲簪晶体,570 nm波长处测定吸光度,按式(3)计算细胞活性。
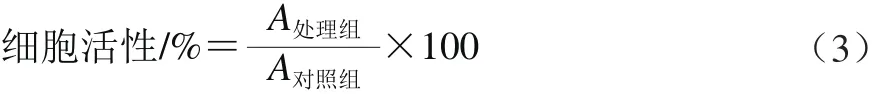
1.3.5.4 细胞ROS水平、LDH活力及SOD、GPx活力测定
细胞ROS水平测定:采用黑壁底透96 孔板培养细胞,药物处理方法同前。弃上清液,PBS清洗。每孔加入100 μL 10 μmol/L的DCFH-DA荧光染液,37 ℃避光染色30 min。PBS清洗2 次,用SpectraMax i3x型荧光酶标仪测定荧光强度,其激发光波长为480 nm,发射光波长为520 nm;以最高组荧光强度为100%,计算其他各组的相对荧光强度。
LDH活力测定:取细胞培养上清液,按照LDH试剂盒说明书操作,测定LDH活力(U/mL)。
SOD、GPx活力测定:收集6 孔培养板中细胞,冰浴超声波破碎,收集蛋白,BCA试剂盒测定蛋白质量浓度,样品采用SOD和GPx试剂盒测定酶活力。
1.3.5.5 流式细胞术Annexin V/PI双染分析细胞凋亡情况
将处于对数生长期的细胞接种于6 孔培养板中,接种密度为每孔5×105个细胞,组别设置及处理同1.3.5.2节,培养24 h。吸除培养基,胰蛋白酶消化贴壁细胞,收集106个细胞,PBS洗涤1 次,3 000 r/min离心2 min,弃上清液。按照Annexin V/PI双染试剂盒说明书操作制备染色悬浮细胞,用于流式细胞法(flow cytometry,FCM)分析。200 目尼龙网过滤,流式细胞仪检测分析,激发波长488 nm,发射波长530 nm,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记Annexin V的绿色荧光通过FITC通道(FL1)检测,PI红色荧光通过PI通道(FL3)检测。
1.4 数据统计分析
采用Origin软件单因素方差分析,P<0.05表明差异显著,P<0.01表明差异极显著。结果用±s表示。
2 结果与分析
2.1 坛紫菜多酚的提取分离
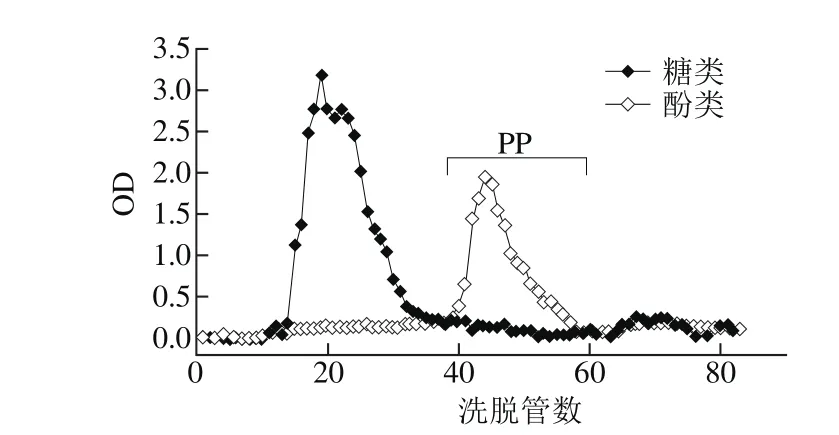
图 1 坛紫菜多酚硅胶柱层析洗脱图谱Fig. 1 Chromatographic elution of PP on silica gel column
由图1可知,坛紫菜多酚粗提物中还有部分的糖类物质,主要为小分子碳水化合物类物质(low molecularmass carbohydrates,LMMCs),在海藻体内主要发挥维持渗透压的作用[28],较易溶于乙酸乙酯等中等极性溶剂。本实验采用硅胶柱层析来实现LMMCs和多酚类物质的分离。采用乙酸乙酯-甲醇体系进行梯度洗脱,流动相组成由100%乙酸乙酯逐渐过渡到100%甲醇,可得如图1所示洗脱效果,坛紫菜多酚与小分子糖分(小分子质量的寡糖、糖苷可溶于有机溶剂,而较大分子质量的多糖则不溶于有机溶剂)可基本分离。单独收集多酚洗脱峰作为纯化的组分坛紫菜多酚,减压浓缩,冻干样品,-20 ℃保存,用于后续实验。坛紫菜多酚样品采用Folin-Ciocaltea法测定总酚含量为47.82%。
2.2 坛紫菜多酚的DPPH自由基清除能力
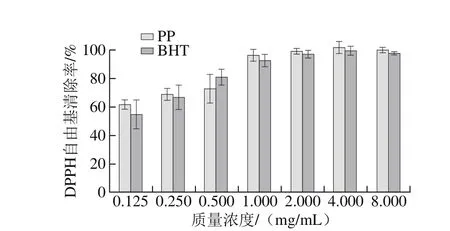
图 2 坛紫菜多酚的DPPH自由基清除能力Fig. 2 DPPH radical scavenging effect of PP
由图2可知,坛紫菜多酚具有较强的DPPH自由基清除能力,在质量浓度1、2、4、8 mg/mL时清除率都接近100%,在最低质量浓度0.125 mg/mL时清除率也超过60%。其DPPH自由基清除能力与同等质量浓度的BHT相当,甚至略优于BHT。
2.3 坛紫菜多酚的铁还原能力
FRAP实验结果如图3所示。BHT的FRAP较强,在0.25 mg/mL时可达838.3 μmol/g,但随着质量浓度的增加,其FRAP值增加幅度并不明显,8 mg/mL时FRAP值为1 213.4 μmol/g。而坛紫菜多酚在同等质量浓度条件下,与BHT的FRAP值有一定差距,在较低质量浓度下差距较大,0.25 mg/mL时FRAP值为70.3 μmol/g,而在较高质量浓度下差距则不太明显,8 mg/mL时FRAP值为1 038.8 μmol/g。说明坛紫菜多酚也具有较强的FRAP值,但其活性弱于同等质量浓度的BHT。
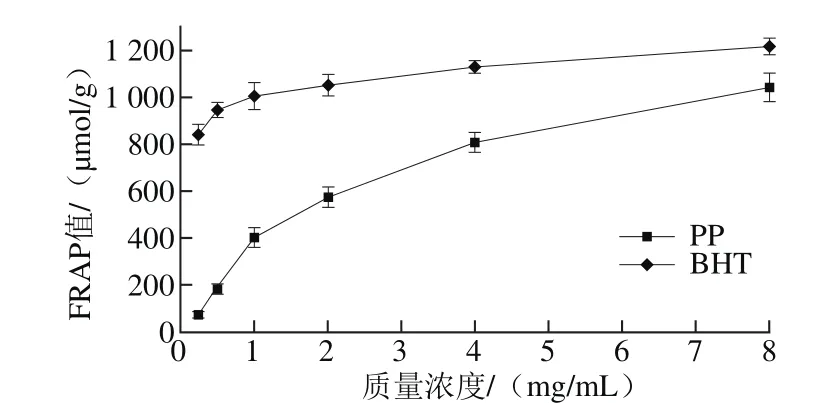
图 3 坛紫菜多酚FRAP分析Fig. 3 FRAP analysis of PP
2.4 坛紫菜多酚的β-胡萝卜素-亚油酸体系抗氧化能力
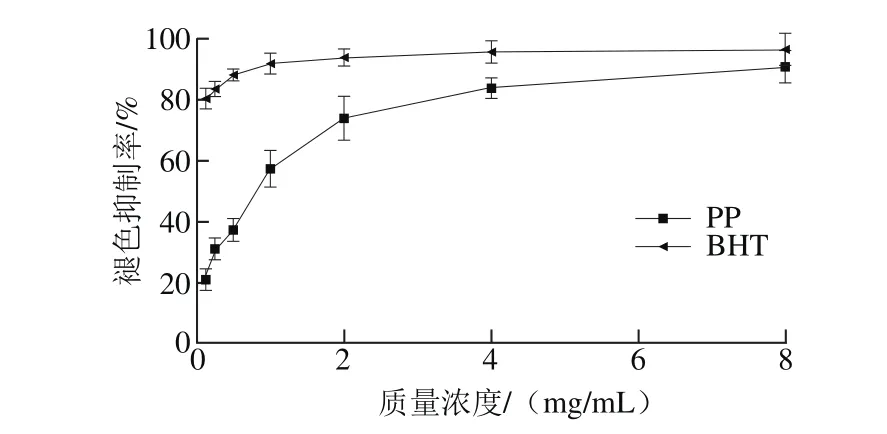
图 4 坛紫菜酚体对β-胡萝卜素-亚油酸体系抗氧化分析Fig. 4 Antioxidant effect of PP on β-carotene-linoleic acid system
由于体系中亚油酸氧化产生过氧化氢自由基,使得β-胡萝卜素漂白褪色,如果体系中同时存在抗氧化剂,则会对抗过氧化氢自由基,对该漂白褪色产生抑制作用。β-胡萝卜素漂白实验结果如图4所示。与FRAP实验结果相类似,BHT同样具有较强的抑制β-胡萝卜素褪色能力,其在质量浓度1、2、4、8 mg/mL时抑制率均超过90%;坛紫菜多酚在8 mg/mL时的抑制率为90.5%,与BHT差距较小,而在0.125 mg/mL时的抑制率为21.4%,与BHT差距较大,推测BHT抗氧化的线性范围较小,在较低质量浓度范围内具有较强的抗氧化活性,但其质量浓度超过1 mg/mL褪色抑制率提升的幅度不及坛紫菜多酚。
2.5 坛紫菜多酚对正常HSFs活性的影响
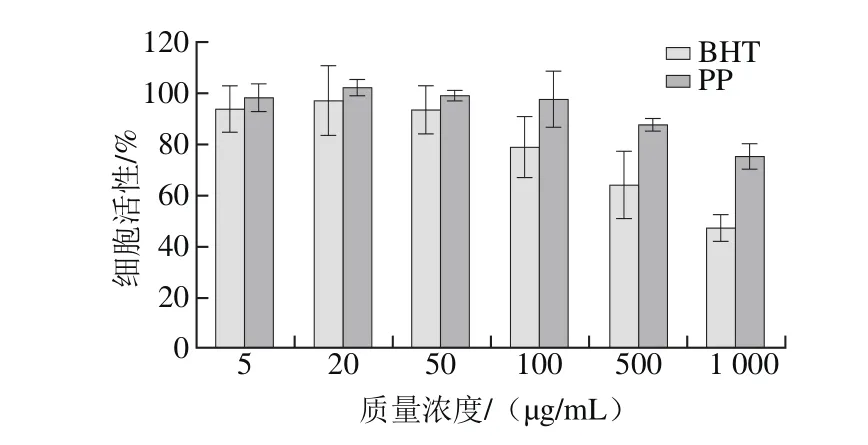
图 5 坛紫菜多酚对正常HSFs活性的影响Fig. 5 Effect of PP on HSFs viability
由图5可知,通过MTT法分析各组细胞活性,在0~100 μg/mL范围内,坛紫菜多酚对实验细胞株无毒性作用,细胞活性都接近100%,当质量浓度增加到500 μg/mL时,细胞活性还可达到87.6%,当质量浓度达到1 000 μg/mL时细胞活性才明显降低到约75%。与坛紫菜多酚相比,BHT的安全无毒剂量范围较小,0~50 μg/mL范围内无明显抑制作用,当质量浓度为100 μg/mL及以上时,细胞活性降低明显,小于80%。因此,后续实验选择的安全无毒性的剂量坛紫菜多酚为0~100 μg/mL,BHT为50 μg/mL。
2.6 UVB辐照对HSFs活性的影响

图 6 UVB辐照强度对HSFs活性的影响(n=3)Fig. 6 Effect of UVB intensity on HSFs viability (n = 3)
由图6可知,在10~100 mJ/cm2UVB辐照剂量范围内,同样培养24 h条件下,随着辐照剂量的增加,细胞活性逐渐呈降低趋势,10 mJ/cm2时与对照组相比虽有下降但无显著差异(P0.05),25 mJ/cm2及以上剂量时与对照相比具有显著性差异(P<0.05)。辐照剂量50 mJ/cm2时,HSFs活性抑制率约35%,处于合适的水平,后续研究统一选择50 mJ/cm2作为制造UVB损伤细胞模型的标准辐照剂量。
2.7 坛紫菜多酚对UVB损伤细胞的LDH活力、ROS水平及SOD、GPx活力影响
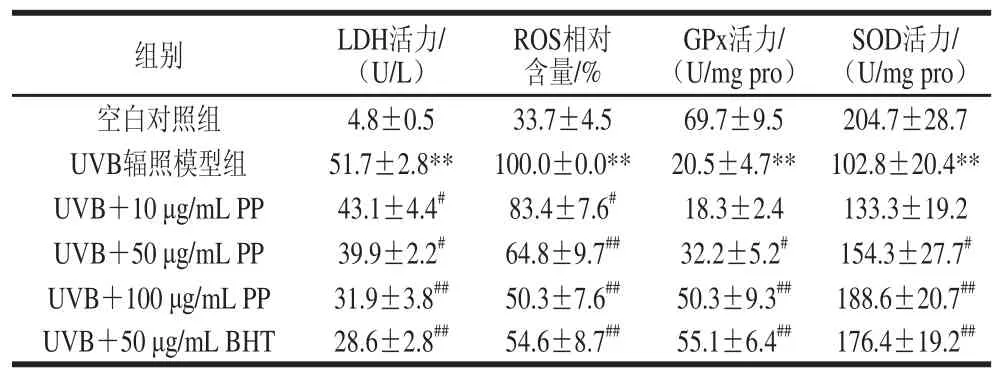
表 1 坛紫菜多酚对UVB致HSFs损伤细胞LDH活力、ROS相对含量、SOD及GPx活力的影响(n= 3)Table 1 Effect of PP on LDH, ROS, SOD and GPx in HSFs treated by UVB (n= 3)
通过分析培养基中LDH活性来测定细胞LDH的漏出量,从而间接反映出细胞膜所受氧化损伤程度,结果如表1所示。与空白对照组相比,50 mJ/cm2UVB辐照模型组培养基中HSFs的LDH活力显著增加到51.7 U/L,说明HSFs细胞膜受损伤严重,而坛紫菜多酚能有效保护细胞膜而降低细胞LDH活力,呈剂量依赖性。细胞ROS水平反映了细胞氧化应激的程度,由表1可知,坛紫菜多酚也能显著抑制UVB辐照所致HSFs的ROS相对水平增加,在10 μg/mL时与UVB对照相比,ROS相对水平显著降至83.4%(P<0.05),且随着剂量增加,进一步极显著降低至54.6%(P<0.01),表明坛紫菜多酚能有效减轻损伤细胞的胞内氧化应激水平。SOD和GPx是机体重要的抗氧化酶,其活力反映细胞的抗氧化应激状态,本实验结果表明坛紫菜多酚同样能提高UVB所致损伤细胞的SOD、GPx活力,提升细胞的抵抗氧化应激能力。
2.8 坛紫菜多酚抑制UVB辐照所致HSFs凋亡作用
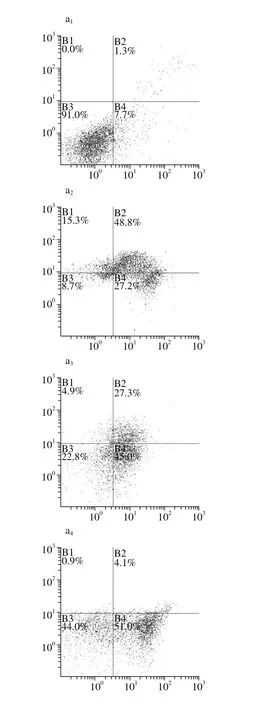
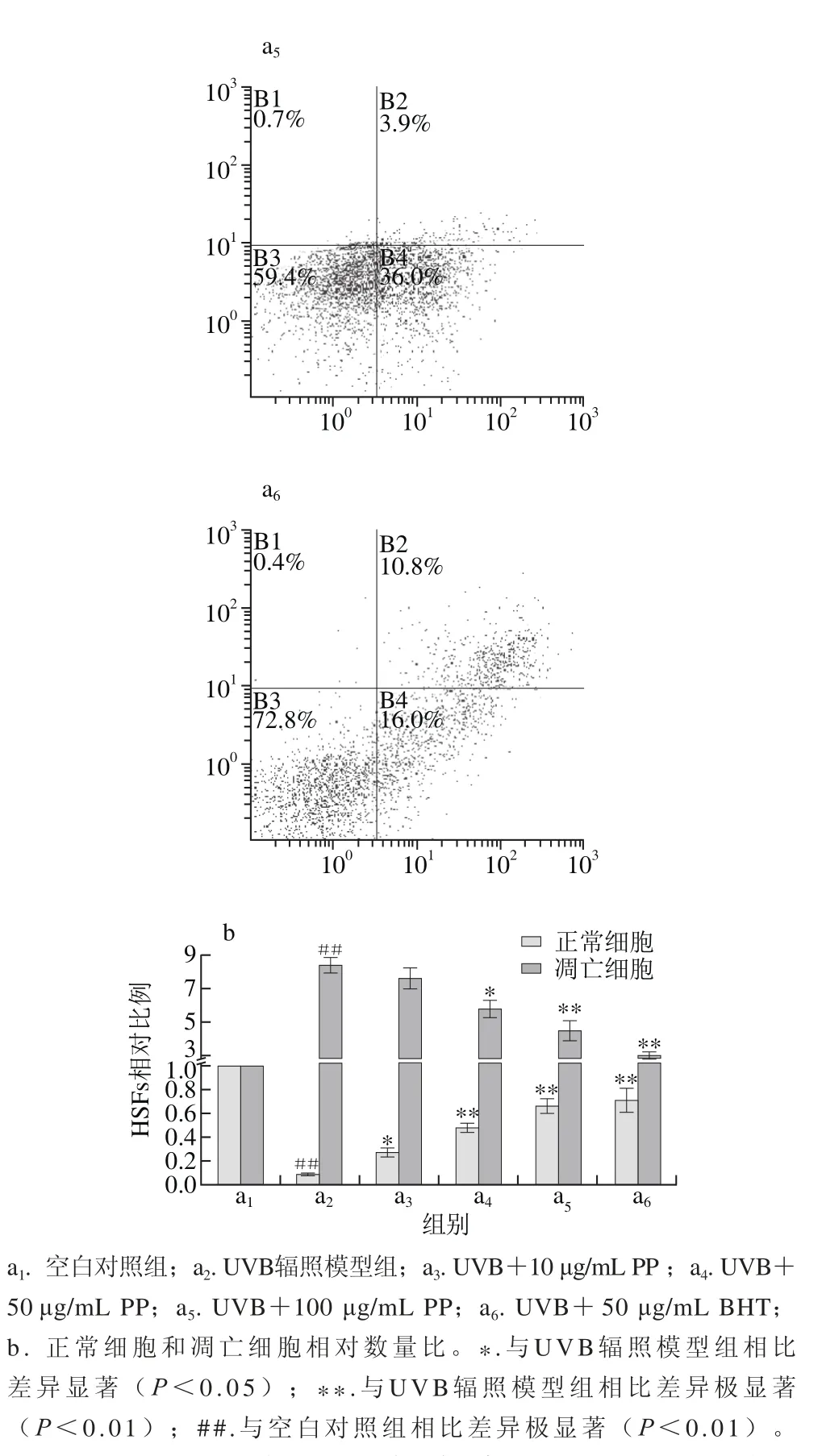
图 7 AnnexinV/PI双染法检测坛紫菜多酚抑制UVB诱导HSFs凋亡作用Fig. 7 Inhibitory effect of PP on HSFs apoptosis induced by UVBevaluated by AnnexinV/PI dual staining assay
Annexin V/PI双染法利用细胞凋亡早期磷脂酰丝氨酸外翻的特征,配合PI进行细胞通透性检测,可同时区分正常细胞(AV/PI)、早期凋亡细胞(AV+/PI)、晚期凋亡细胞或坏死细胞(AV+/PI+)等处于不同病理状态的细胞[29]。从图7a1、a2和图7b可知,50 mJ/cm2UVB辐照剂量可使HSFs的凋亡比例从正常细胞的约8.9%显著增加到约75.0%(P<0.01),正常细胞比例下降到8.7%(P<0.01),表明UVB辐照诱导凋亡作用明显。从图7a3~a5和图7b中可知,坛紫菜多酚在10 μg/mL时,细胞凋亡比例有所降低,但不呈显著性;50 μg/mL时,可极显著降低至55%(P<0.01),100 μg/mL时进一步降低至40%左右(P<0.01)。结果表明,坛紫菜多酚能显著抑制UVB辐照所致的HSFs凋亡,呈剂量依赖性,但抑制作用略逊于同等质量浓度的BHT(图7a6)。
3 讨 论
本实验以新鲜坛紫菜原料,经乙醇提取,硅胶树脂柱层析乙酸乙酯/甲醇体系洗脱除去小分子糖类物质等杂质而分离得到了坛紫菜多酚,具有较强的体外抗氧化活性。
BHT是广泛使用的通用型酚类抗氧化剂,具有较强的抑制ROS活性作用,常用作考察抗氧化作用的阳性对照物;紫外辐射是一种重要的氧化应激因素,UVB能通过与水、含半胱氨酸蛋白等发生光分解反应而产生ROS对细胞产生氧化损伤;故本实验以BHT作为考察紫菜多酚抗氧化及抑制UVB氧化损伤HSFs的阳性对照物。DPPH作为一种较稳定的自由基供体,广泛用于天然抗氧化剂自由基清除能力的评估,化合物对DPPH自由基的清除能力主要取决于其对未成对电子的配对能力,坛紫菜多酚的DPPH自由基清除能力与同等质量浓度的BHT相当甚至略优于BHT;FRAP分析反映了抗氧化剂通过电子转移将氧化态的Fe3+还原为Fe2+复合物的 能力,也间接反映还原机体活性氧的能力,实验结果显示坛紫菜多酚也具有较强的FRAP,但其活性弱于同质量浓 度的BHT;β-胡萝卜素-亚油酸体系用于抗氧化分析是由于体系中亚油酸氧化产生过氧化氢自由基,使得β-胡萝卜素漂白褪色,如果体系中同时存在抗氧化剂,则会对抗过氧化氢自由基,对该漂白褪色过程产生抑制作用,坛紫菜多酚同样具有较强的抑制β-胡萝卜素褪色作用,但弱于BHT的效果,在8 mg/mL时的抑制率为90.5%,与BHT差距较小,而在0.125 mg/mL时的抑制率为21.4%,与BHT差距较大。
UVB辐照会打破细胞的氧化/抗氧化平衡状态,导致氧化应激增强,抗氧化系统严重受损,对细胞产生氧化损伤,破坏细胞膜结构,使细胞产生凋亡等[30]。SOD、GPx是机体重要的抗氧化酶,对维持细胞氧化还原平衡具有重要作用。LDH是较为稳定的蛋白质,存在于绝大多数正常细胞的胞质中,不能分泌到胞外,而一旦细胞膜受损,LDH即被释放到细胞外[31];通过检测细胞培养液中的LDH活性(即LDH的漏出量),可判断细胞受损的程度。本研究结果表明,在一定质量浓度范围内(0~100 μg/mL),坛紫菜多酚能有效降低UVB辐照所致HSFs的LDH活力,维护细胞膜的完整性;增加受损细胞的SOD、GPx活力,从而提升内皮细胞的抵抗氧化应激的能力;显著抑制UVB辐照所致的HSFs凋亡情况。
综上,坛紫菜多酚具有较强的体外抗氧化作用;保护HSFs免受UVB辐照所致的氧化损伤,降低损伤细胞ROS水平,降低细胞的凋亡程度,维护细胞结构的完整性。其机制有可能是通过增加细胞中诸如SOD、GPx等抗氧化酶而实现,具体的分子机理还需进一步深入研究。本实验的结果表明,坛紫菜多酚有望应用于防护紫外照射损伤领域,为紫菜资源的有效利用提供了科学依据。
[1] 蔡建秀, 曾伟, 陈姗龙, 等. 紫菜多酚的超声波辅助提取工艺及其抗氧化作用[J]. 食品研究与开发, 2015, 36(21): 54-60. DOI:10.3969/ j.issn.1005-6521.2015.21.014.
[2] 宋丹丹. 高温胁迫下坛紫菜中红藻糖苷含量变化以及相关抗逆基因的表达[D]. 宁波: 宁波大学, 2014: 4-5.
[3] 闫国良. 坛紫菜藻红蛋白和藻蓝蛋白主要亚基基因的克隆及其蛋白表达与纯化的初步研究[D]. 厦门: 厦门大学, 2007: 10-12.
[4] MACHU L, MISURCOVA L, VAVRA A A J, et al. Phenolic content and antioxidant capacity in algal food products[J]. Molecules, 2015, 20(1): 1118-1133. DOI:10.3390/molecules20011118.
[5] AHN G N, KIM K N, CHA S H, et al. Antioxidant activities of phlorotannins purifi ed from Ecklonia cava on free radical scavenging using ESR and H2O2-mediated DNA damage[J]. European Food Research and Technology, 2007, 226(1): 71-79. DOI:10.1007/s00217-006-0510-y.
[6] IWAI K. Antidiabetic and antioxidant effects of polyphenols in brown alga Ecklonia stolonifera, in genetically diabetic KK-A(y) mice[J]. Plant Foods for Human Nutrition, 2008, 63(4): 163-171. DOI:10.1007/ s11130-008-0098-4.
[7] KIM S K, THOMAS N V, LI X. Anticancer compounds from marine macroalgae and their application as medicinal foods[J]. Advances in Food and Nutrition Research, 2011, 64: 213-224. DOI:10.1016/B978-0-12-387669-0.00016-8.
[8] KARADENIZ F, KIM S K. Antitumor and antimetastatic effects of marine algal polyphenols[M]. Handbook of Anticancer Drugs from Marine Origin, Heidelberg: Springer International Publishing, 2015: 177-183. DOI:10.1007/978-3-319-07145-9-9.
[9] CHOI E K, PARK S H, HA K C, et al. Clinical trial of the hypolipidemic effects of a brown alga Ecklonia cava extract in patients with hypercholesterolemia[J]. International Journal of Pharmacology, 2015, 11(7): 798-805. DOI:10.3923/ijp.2015.798.805.
[10] LEE H A, PARK M H, SONG Y O, et al. Anti-hyperglycemic and hypolipidemic effects of baechukimchi with Ecklonia cava in type 2 diabetic db/db mice[J]. Food Science and Biotechnology, 2015, 24(1): 307-314. DOI:10.1007/s10068-015-0041-z.
[11] HUANG Ling, WEN Kewei, GAO Xuan, et al. Hypolipidemic effect of fucoidan from Laminaria japonica in hyperlipidemic rats[J]. Pharmaceutical Biology, 2010, 48(4): 422-426. DOI:10.3109/13880200903150435.
[12] VAID M, KATIYAR S K. Molecular mechanisms of inhibition of photocarcinogenesis by silymarin, a phytochemical from milk thistle (Silybum marianum L. Gaertn.)(review)[J]. International Journal of Oncology, 2010, 36(5): 1053-1060. DOI:10.3892/ijo_00000586.
[13] 涂国荣, 王旭辉. 紫外线对皮肤的光辐射损伤与防护研究[J]. 日用化学工业, 2002, 32(1): 55-58.
[14] 孟耀斌, 黄霞, 钱易. 不同波段紫外光在TiO2悬浊液中的消光特点[J].环境科学, 2001, 22(2): 46-50. DOI:10.13227/j.hjkx.2001.02.009.
[15] LEE C H, WU S B, HONG C H, et al. Molecular mechanisms of UV-induced apoptosis and its effects on skin residential cells: the implication in UV-based phototherapy[J]. International Journal of Molecular Sciences, 2013, 14(3): 6414-6435. DOI:10.3390/ ijms14036414.
[16] SAW C L, HUANG M T, LIU Y, et al. Impact of Nrf2 on UVB-induced skin infi ammation/photoprotection and photoprotective effect of sulforaphane[J]. Molecular Carcinogenesis, 2011, 50(6): 479-486. DOI:10.1002/mc.20725.
[17] BYUN S, PARK J, LEE E, et al. Src kinase is a direct target of apigenin against UVB-induced skin infi ammation[J]. Carcinogenesis, 2013, 34(2): 397-405. DOI:10.1093/carcin/bgs358.
[18] KIM J K, KIM Y, NA K M, et al. [6]-Gingerol prevents UVB-induced ROS production and COX-2 expression in vitro and in vivo[J]. Free radical Research, 2007, 41(5): 603-614. DOI:10.1080/10715760701209896.
[19] ELMETS C A, SINGH D, TUBESING K, et al. Cutaneous photoprotection from ultraviolet injur y by green tea polyphenols[J]. Journal of the American Academy of Dermatology, 2001, 44(3): 425-432. DOI:10.1067/mjd.2001.112919.
[20] KATIYAR S K, AFAQ F, PEREZ A, et al. Green tea polyphenol (-)-epigallocatechin-3-gallate treatment of human skin inhibits ultraviolet radiation-induced oxidative stress[J]. Carcinogenesis, 2001, 22(2): 287-294. DOI:10.1093/carcin/22.2.287.
[21] NICHOLS J A, KATIYAR S K. Skin photoprotection by natural polyphenols: anti-inflammatory, antioxidant and DNA repair mechanisms[J]. Archives of Dermatological Research, 2010, 302(2): 71-83. DOI:10.1007/s00403-009-1001-3.
[22] WANG Tao, JÓ NSDÓ TTIR R, LIU Haiyan, et al. Antioxidant capacities of phlorotannins extracted from the brown algae Fucus vesiculosus[J]. Journal of Agricultural and Food Chemistry, 2012, 60(23): 5874-5883. DOI:10.1021/jf3003653.
[23] SOUZA B W, CERQUEIRA M A, MARTINS J T, et al. Antioxidant potential of two red seaweeds from the Brazilian coasts[J]. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5589-5594. DOI:10.1021/jf200999n.
[24] SHON M Y, KIM T H, SUNG N J. Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenochaetaceae) extracts[J]. Food Chemistry, 2003, 82(4): 593-597. DOI:10.1016/S0308-8146(03)00015-3.
[25] BENZIE I F, STRAIN J. Ferric reducing/antioxidant power assay: Direct measure of total antioxidant activity of biological fluids and mo dified version for simultaneous measurement of total antioxidant power and ascorbic acid concentration[J]. Methods in Enzymology, 1999, 299: 15-27.
[26] 刘赛君, 郭梅艳, 邓列华, 等. 亚硒酸钠对UVB损伤人角质形成细胞的保护作用[J]. 中国病理生理杂志, 2015, 31(1): 177-180. DOI:10.3969/j.issn.1000-4718.2015.01.033.
[27] 梁俊, 李建科, 刘永峰, 等. 石榴皮多酚对脂变L-02肝细胞胆固醇合成的影响及机制探究[J]. 食品与生物技术学报, 2013, 32(5): 487-493. DOI:10.3969/j.issn.1673-1689.2013.05.007.
[28] ASC NCIO S D, ORSATO A, FRAN A R A, et al. Complete1H and13C NMR assignment of digeneaside, a low-molecular-mass carbohydrate produced by red seaweeds[J]. Carbohydrate Research, 2006, 341(5): 677-682. DOI:10.1016/j.carres.2006.01.002.
[29] ZHENG Y, XIN Y, SHI X, et al. Anti-cancer effect of rubropunctatin against human gastric carcinoma cells BGC-823[J]. Applied Microbiology and Biotechnology, 2010, 88(5): 1169-1177. DOI:10.1007/s00253-010-2834-6.
[30] YASUI H, SAKURAI H. Chemiluminescent detection and imaging of reactive oxygen species in live mouse skin exposed to UVA[J]. Biochemical and Biophysical Research Communications, 2000, 269(1): 131-136. DOI:10.1006/bbrc.2000.2254.
[31] FOTAKIS G, TIMBRELL J A. In vitro cytotoxicity assays: comparison of LDH, neutral red, MTT and protein assay in hepatoma cell lines following exposure to cadmium chloride[J]. Toxicology Letters, 2006, 160(2): 171-177. DOI:10.1016/j.toxlet.2005.07.001.
Antioxidant and Protective Effect of Porphyra haitanensis Polyphenols against Oxidative Damage Induced by UVB in HSF Cells
LI Feng, LI Qingxian, CHENG Zhiyuan, GUO Yanghao, SHI Xian’ai*
(College of Biological Science and Engineering, Fuzhou University, Fuzhou 350116, China)
In the present study, polyphenols from Porphyra haitanensis (PP) were extracted and separated, and their in vitro antioxidant activity was investigated by 1,1-diphenyl-2-picrylhydrazyl (DPPH) ra dical scavenging capacity, the ability to inhibit the color fading of β-carotene and ferric reducing antioxidant power (FRAP), as well as their protective effect against oxidative damage induced by ultraviolet radiation B (UVB) in human skin fi broblast cells (HSFs). The aim of this investigation was to ascertain the applicability of PP to protect the skin against UV damage. In vitro tests demonstrated that PP had strong antioxidant activity, whose DPPH radical scavenging capacity was equivalent to that of BHT at the same concentration but whose ability to inhibit the color fading of β-carotene in the presence of linoleic acid and FRAP were weaker. The cellular experiment showed that PP significantly reduced lactic dehydrogenase (LDH) leakage from HSFs induced by UVB irradiation, maintained cell membrane integrity, decreased reactive oxygen species (ROS) level, enhanced the activity of antioxidant enzymes such as superoxide dismutase (SOD) and glutathione peroxidase (GPx), therefore attenuating cellular oxidative stress, enhancing the oxidative stress resistance of endothelial cells and signifi cantly inhibiting the apoptosis of HSFs. These fi ndings led us to conclude that PP can protect HSFs against UVB-induced oxidative damage and has potential for protection against UV-induced skin damage.
Porphyra haitanensis polyphenol; antioxidant; ultraviolet radiation B (UVB); oxidative stress
10.7506/spkx1002-6630-201717031
TS201.4
A
1002-6630(2017)17-0190-08
李锋, 李清仙, 程志远, 等. 坛紫菜多酚抗氧化及抑制UVB致HSF细胞氧化损伤作用[J]. 食品科学, 2017, 38(17): 190-197.
DOI:10.7506/spkx1002-6630-201717031. http://www.spkx.net.cn
LI Feng, LI Qingxian, CHENG Zhiyuan, et al. Antioxidant and protective effect of Porphyra haitanensis polyphenols against oxidative damage induced by UVB in HSF cells[J]. Food Science, 2017, 38(17): 190-197. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717031. http://www.spkx.net.cn
2016-07-02
国家海洋公益性行业科研专项(201205022);福建省教育厅科技项目(JA13045)
李锋(1976—),男,助理研究员,硕士,主要从事天然成分生物活性研究。E-mail:lifeng9676@aliyun.com *通信作者:石贤爱(1971—),男,教授,博士,主要从事海洋生物工程研究。E-mail:shixa@fzu.edu.cn

