部分KCl替代NaCl对强化高温成熟工艺干腌火腿肌肉色泽形成的影响
陈文彬,黎良浩,王 健,戴照琪,徐幸莲,章建浩*
(南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,农业部畜产品加工与质量控制重点开放实验室,江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
部分KCl替代NaCl对强化高温成熟工艺干腌火腿肌肉色泽形成的影响
陈文彬,黎良浩,王 健,戴照琪,徐幸莲,章建浩*
(南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,农业部畜产品加工与质量控制重点开放实验室,江苏省肉类生产与加工质量安全控制协同创新中心,江苏 南京 210095)
采用强化高温成熟现代工艺(36 ℃强化高温成熟45 d,用盐量6.5%,以火腿质量计)制作干腌火腿,分析加工过程中火腿半膜肌盐分含量、水分含量、pH值、色差值、肌红蛋白氧化状态、血红素类色素和锌卟啉(Zn-protoporphyrin,Zn-PP)Ⅸ含量,研究火腿色泽的形成及KCl替代NaCl对火腿加工过程中色泽变化的影响。结果表明:盐量30% KCl替代NaCl对干腌火腿产品理化特性、色差值及色素状态和含量没有显著影响(P>0.05);干腌火腿的独特色泽是由肌 红蛋白的氧化状态、红色色素的含量及肌肉组织的状态共同形成的,火腿加工过程中氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白(metmyoglobin,MMb)相对含量分别上升约22.07%和25.21%,脱氧肌红蛋白(deoxymyolglobin,DMb)相对含量下降约47.27%,DMb与亮度L*值呈极显著正相关(P<0.01),OMb、MMb与L*值呈极显著负相关(P<0.01),并受OMb与MMb相对含量比值极显著影响(P<0.01)。在较低范围内(0%~27.49%),MMb相对含量越高红绿度a*值越大,并且MMb的影响力大于OMb。血红素类色素和Zn-PP Ⅸ含量在火腿加工过程中都显著增加,约394%和5 296%,并与a*值和色饱和度C值呈极显著正相关关系(P<0.01)。
干腌火腿;KCl替代;强化高温成熟;色泽
陈文彬, 黎良浩, 王健, 等. 部分KCl替代NaCl对强化高温成熟工艺干腌火腿肌肉色泽形成的影响[J]. 食品科学, 2017, 38(17): 77-84. DOI:10.7506/spkx1002-6630-201717014. http://www.spkx.net.cn
CHEN Wenbin, LI Lianghao, WANG Jian, et al. Effect of partial replacement of NaCl with KCl combined with high-temperature ripening on color formation in dry-cured hams[J]. Food Science, 2017, 38(17): 77-84. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717014. http://www.spkx.net.cn
食品颜色是评价食品感官品质的一个重要指标,良好的颜色外观能提高消费者的食欲与购买欲[1-2]。干腌火腿做为传统腌腊肉制品中的典型代表具有“鲜红似火”的肉色特点[3]。以金华火腿为例,其皮色黄亮,肉色红润,香气浓郁,以色、香、味、形“四绝”闻名于世。其中,“色”做为“四绝”之首是火腿等级鉴定的重要依据[4-5]。在干腌火腿加工过程中,保持火腿良好的色泽状态是一项重要的工艺目标。干腌火腿的独特色泽依赖于其独特的加工方式,受原料猪品种、光照、氧气、加工时间、微生物繁殖、添加剂等因素的影响[6-11]。火腿中的呈色物质主要是肌红蛋白类和血红素及其衍生物类[12]。如果放血较为彻底,肌红蛋白含量可占肉中色素物质的80%~90%,因此其含量和化学状态对于肌肉的色泽呈现具有很大的影响[13]。使用硝酸盐或亚硝酸盐腌制时,因生成亚硝基血色原,肌肉会呈现品红色[1]。如果不使用硝酸盐,肌红蛋白在加工过程中也会发生珠蛋白变性脱离,生成血红素类物质,表现为红色[14-15]。近年来研究人员还发现巴马火腿之所以具有稳定的亮红色是因为肌肉中存在锌卟啉(Zn-protoporphyrin,Zn-PP)Ⅸ[16-17],它占肌肉中卟啉化合物的60%~70%[18],并且在火腿加工过程中含量逐渐上升[19]。
然而随着近年来国内传统火腿市场的日益萎缩,寻求新的火腿加工工艺成为众多企业的迫切需求。其中,降低火腿盐分,缩短加工时间成为了火腿现代化工艺的两大突破点。由于过多的高钠饮食容易引起人体心血管疾病[20],利用部分盐替代技术降低食品中钠盐含量,开发低钠食品成为了近些年的研究热点。研究表明,采用KCl替代部分NaCl在降低火腿盐分尤其是Na含量上具有很大的潜力。吴海舟[21]、黎良浩[22]等研究发现,KCl替代不仅可以有效降低火腿Na含量和咸度,且对火腿加工过程中肌肉蛋白质水解无显著影响,并能保持火腿原有的风味品质。章建浩等[23]通过强化高温成熟工艺缩短火腿加工时间至原时长一半左右,且同样能保持传统火腿优良的风味感官品质。但是国内外关于KCl 替代对火腿色泽形成的影响研究还比较少,且大多都停留在色泽的视觉色差方面,并没有对决定色泽形成的色素及肌红蛋白含量的变化进行系统研究。Aliño等[24-25]采用盐量0%~70%的KCl替代NaCl加工干腌里脊,发现部分盐替代对产品色差值无影响。Lorenzo等[26]用盐量25%、50% KCl加上少量CaCl2、MgCl2替代部分NaCl腌制肉块,发现产品色差值也未受到显著影响。
为此,在盐替代腌制方式和强化高温加工条件下,能否保持火腿的肌肉色泽具有重要的研究意义。本实验在黎良浩等[21-22]研究基础上,以盐量30% KCl替代NaCl对火腿进行腌制,强化高温成熟工艺进行风干,研究了干腌火腿加工过程中理化指标、色差值、肌红蛋白氧化状态和血红素及其衍生物的变化,通过与非替代组火腿的比较,探讨KCl部分替代NaCl对强化高温成熟工艺下火腿色泽可能产生的影响,以期为KCl替代结合强化高温成熟工艺在干腌火腿加工中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
火腿由南京农业大学食品科技学院实验室制作加工而成。
KCl(食品级) 连云港树人科创食品添加剂有限公司;NaCl 市售;核黄素、血红素 美国Sigma公司;甲醇、丙酮、硝酸、浓盐酸、硝酸银、乙酸锌、硫氰酸钾、磷酸氢二钠、磷酸二氢钠等均为国产分析纯试剂。
1.2 仪器与设备
人工气候控制系统 江苏省农业科学院;T18型分散机 德国IKA公司;Allegra 64R型高速冷冻离心机美国Beckman公司;JA2203N电子天平 上海民桥精密科学仪器有限公司;UV-2600紫外分光光度计 日本岛津公司;M2e多功能酶标仪 美国MD公司;96 孔酶标板美国Corning/Costar公司;S20K型pH计 梅特勒-托利多仪器(上海)有限公司;CR400型色差计 日本Minolta集团;CNWBOND HC-C18反向固相萃取(solid phase extraction,SPE)柱(1 g/6 mL)、真空SPE装置 上海安普公司;101-O-S电热恒温鼓风干燥箱 上海跃进医疗器械厂。
1.3 方法
1.3.1 火腿加工与取样
火腿工艺流程及参数参照章建浩等[23]的方法:原料腿选择→修胚→摊凉→上盐堆叠→腌制(4 ℃、60 d)→发酵成熟(10~15 ℃、相对湿度75%、10 d;16~20 ℃、相对湿度65%、15 d;21~30 ℃、相对湿度55%、15 d;31~35 ℃、相对湿度60%、15 d;35~37 ℃、相对湿度70%、45 d)→贮藏后熟。实验组根据黎良浩[22]、章建浩[23]等方法稍作调整,采用强化高温36 ℃,高温强化45 d,腌制用盐量为6.5%(以火腿质量计,下同),KCl替代组配比为70% NaCl+30% KCl,对照组为100% NaCl。
取火腿工艺过程中原料(工艺点1)、腌制结束(工艺点2)、成熟30 d(工艺点3)、成熟60 d(工艺点4)、成熟100 d(工艺点5)5 个工艺点的半膜肌中间样品为实验材料,每个工艺点各取自3 条腿,切成2 cm见方的小块真空包装,于-40 ℃条件下冻藏。
1.3.2 水分含量的测定
参照GB 5009.3—2010《食品中水分的测定》中的直接干燥法测定水分含量。
1.3.3 盐分含量的测定
参照GB/T 9695.8—2008《肉与肉制品中氯化物含量测定》,盐分含量以NaCl含量计。
1.3.4 pH值的测定
参照GB/T 969 5.5—2008《肉与肉制品中pH测定》。
1.3.5 色差值的测定
参照Parolari等[27]的方法。光源D65,角度10º,色差计开机预热1 h,标准黑筒较零,再用标准白板校正。完成火腿取样后立即测量亮度L*值、红绿度a*值、黄蓝度b*值,测试时测量口垂直于肉面,紧扣肉面不漏光,按下测量键,改变位置重复测量5 次取平均值。色饱和度C值按照下式计算。
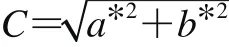
1.3.6 肌红蛋白氧化状态的测定
参照Krzywicki[28]、Tang[29]等的方法,略作改动。样品解冻后剔除肉表部分、结缔组织、可见脂肪并绞碎,称取3.000 g原料肉,加入25 mL 50 mmol/L pH 7.2的磷酸缓冲液,冰浴条件下以10 000 r/min匀浆20 s。匀浆物在4 ℃环境避光放置1 h后在4 ℃、4 000×g条件下冷冻离心30 min,过滤,用磷酸缓冲液在棕色容量瓶中定容至50 mL。滤液分别在503、525、557、582、710 nm波长处用紫外分光光度计测定吸光度,测定时用磷酸缓冲液调零。
1.3.7 血红素类色素含量的测定
根据Møller[14]、Aliño[24]等的方法,略作改动。样品解冻后剔除肉表部分、结缔组织、可见脂肪并绞碎,称取4.000 g样品于离心管中,加入40 mL浓盐酸酸化过的体积分数75%的丙酮溶液(HCl终浓度为0.38 mol/L),冰浴条件下10 000 r/min匀浆15 s。匀浆物在4 ℃环境避光放置45 min并不时搅拌,然后6 500r/min条件下冷冻离心20 min,上清液用定性滤纸过滤,滤液以丙酮溶液定容至50 mL,在640 nm波长处以75%的丙酮溶液作空白比色测定。用体积分数75%的丙酮溶液溶解血红素标准品制作标准曲线,并确定样品血红素类色素含量。
1.3.8 Zn-PPⅨ含量的测定
根据Wakamatsu[16]、Adamsen[19]等的方法,略作改动。样品解冻后剔除肉表部分、结缔组织、可见脂肪并绞碎,称取2.500 g样品于离心管中加10 mL蒸馏水,冰浴条件下10 000 r/min匀浆15 s。然后6 500 r/min冷冻离心20 min,快速定性滤纸过滤后向滤液中加入3 倍体积的冰丙酮,振荡摇匀,冰浴15 min。混合物6 500 r/min冷冻离心4 min,取上清液加入等体积的蒸馏水,混匀备用。用7.5 mL甲醇和7.5 mL蒸馏水活化C18SPE柱后,过滤备用样液。过滤完毕,用12.5 mL蒸馏水清洗柱体,再用10 mL体积分数75%的丙酮溶液洗脱Zn-PPⅨ物质,洗脱液以含有1.000 mg/mL核黄素的体积分数为75%的丙酮溶液作参照,取激发波长420 nm、发射波长589 nm处的相对荧光强度指示Zn-PPⅨ含量。
1.4 数据分析
实验重复3 次,用Excel 2013软件进行整理并用SAS 9.2统计软件进行方差分析,平均值之间利用Fisher’s最小显著差异法进行差异显著性检验,用Origin软件进行作图。
2 结果与分析
2.1 干腌火腿加工过程中盐分含量的变化
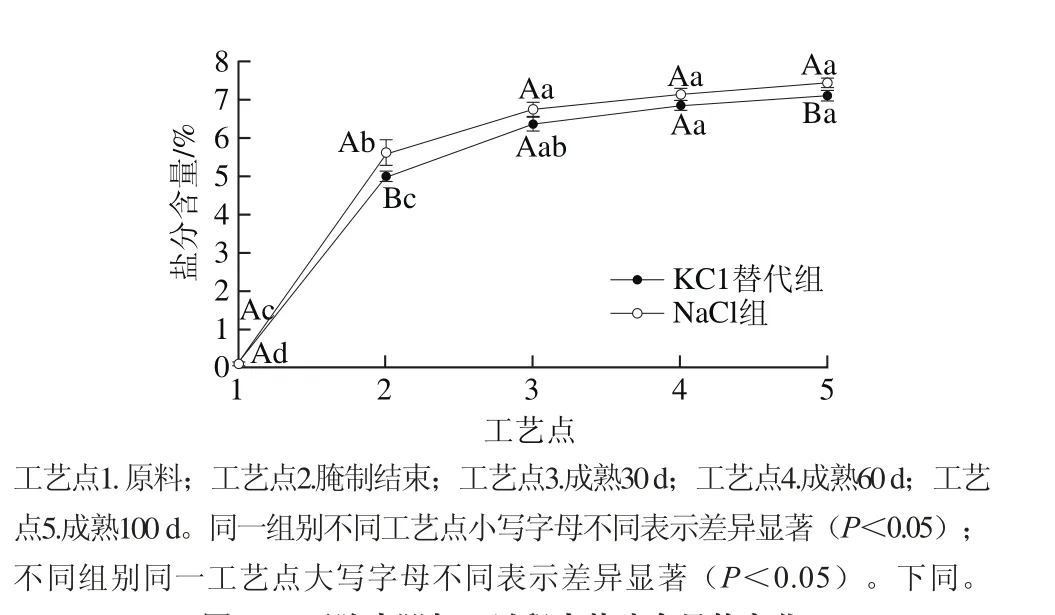
图 1 干腌火腿加工过程中盐分含量的变化Fig. 1 Changes in salt content in dry-cured ham during processing
由图1可知,盐分含量随着火腿加工过程的进行逐渐上升,KCl替代组半膜肌盐分由原料的0.11%上升到成熟100 d时的7.08%(P<0.05),NaCl组在成熟100 d时盐分达到7.42%,KCl替代组和NaCl组盐分含量变化趋势相近。腌制结束及成熟100 d时,NaCl组的盐分含量显著高于KCl替代组(P<0.05),这主要是NaCl相对分子质量比KCl小导致的,也说明了采用KCl替代NaCl可以降低产品盐分。腌制阶段和成熟初期,火腿半膜肌盐分含量显著上升(P<0.05),且速率较快,成熟中后期,两者盐分含量上升不显著(P>0.05),略有增加。
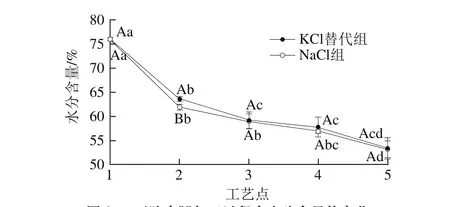
图 2 干腌火腿加工过程中水分含量的变化Fig. 2 Changes in moisture content in dry-cured ham during processing
2.2 干腌火腿加工过程中水分含量的变化由图2可知,火腿加工过程中半膜肌水分含量呈显著下降趋势(P<0.05)。KCl替代组和NaCl组的下降趋势相近,在腌制期水分含量下降迅速,进入风干成熟期水分含量下降趋势变得相对平缓,各工艺点之间差异不显著(P>0.05)。腌制期盐离子在半膜肌外形成很高的渗透压,造成肌肉水分含量显著下降(P<0.05);成熟前期,温度升高同时风速加大是造成肌肉失水的主要原因;成熟中期,尽管温度进一步升高,但是由于前期肌肉表面失水较快形成阻隔带,此阶段水分散失较慢,各点间差异不显著(P>0.05);成熟后期,在长时间高温作用下,水分又加快散失,但差异并不显著(P>0.05)。
2.3 干腌火腿加工过程中pH值的变化
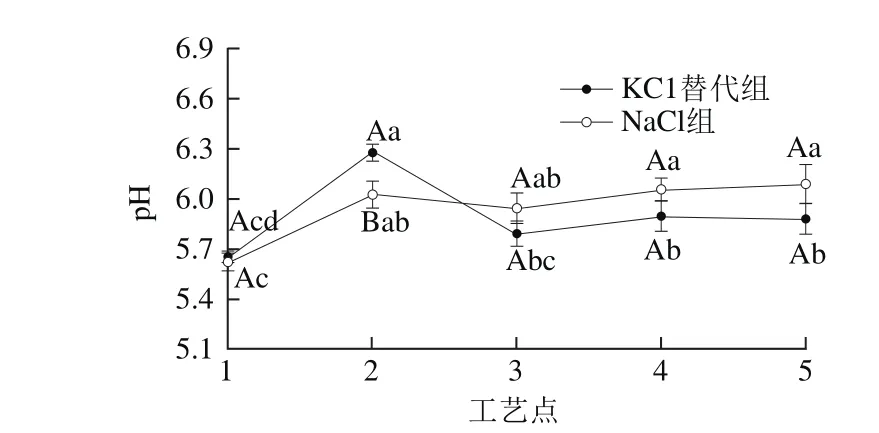
图 3 干腌火腿加工过程中pH值的变化Fig. 3 Changes in pH in dry-cured ham during processing
由图3可知,加工过程中火腿的pH值偏差较大,总体略有上升。KCl替代组和NaCl组的pH值分别从原料的5.63上升到成熟100 d时的5.88和6.09(P<0.05),腌制阶段KCl替代组pH值高于NaCl组,进入风干成熟期二者差异缩小,KCl替代组pH值略低于NaCl组并呈上升趋势,成熟结束时二者差异不显著(P>0.05)。
2.4 干腌火腿加工过程中色差值的变化
干腌火腿加工过程中,半膜肌的颜色随着水分的降低、肌红蛋白状态的变化而变化。由图4A可得,火腿半膜肌L*值在加工过程中呈显著下降趋势(P<0.05),KCl替代组和NaCl组无显著性差异(P>0.05)。处理组间a*值在腌制期略有下降,在风干成熟期则逐步上升,处理组间无显著性差异(P>0.05)(图4 B)。a*值反映肌肉红度变化,腌制期肌红蛋白会发生降解导致红度下降,进入成熟期,随着红色色素物质的增加及水分含量的下降,红度值上升,产品逐步形成特征性的红色[30]。b*值反映黄度变化,由图4C可知,两组产品在加工过程中b*值都不稳定但总体都呈上升趋势(P<0.05),这与孙卫青[4]及王艳[31]等在切片火腿和中式培根中得出的实验结果趋势相近。成熟末期上升比较显著(P<0.05),这与脂肪的氧化加剧是相对应的,有学者认为黄度值更能反映肉制品品质[32]。C值为色饱和度,由红度与黄度计算得来,色饱和度越高表示颜色越鲜艳。由图4可知,色饱和度与红度变化趋势较为接近,这与中式培根加工中的研究结果一致[31]。随着加工的进行,火腿中的色素物质含量升高,颜色也越发鲜艳[30]。
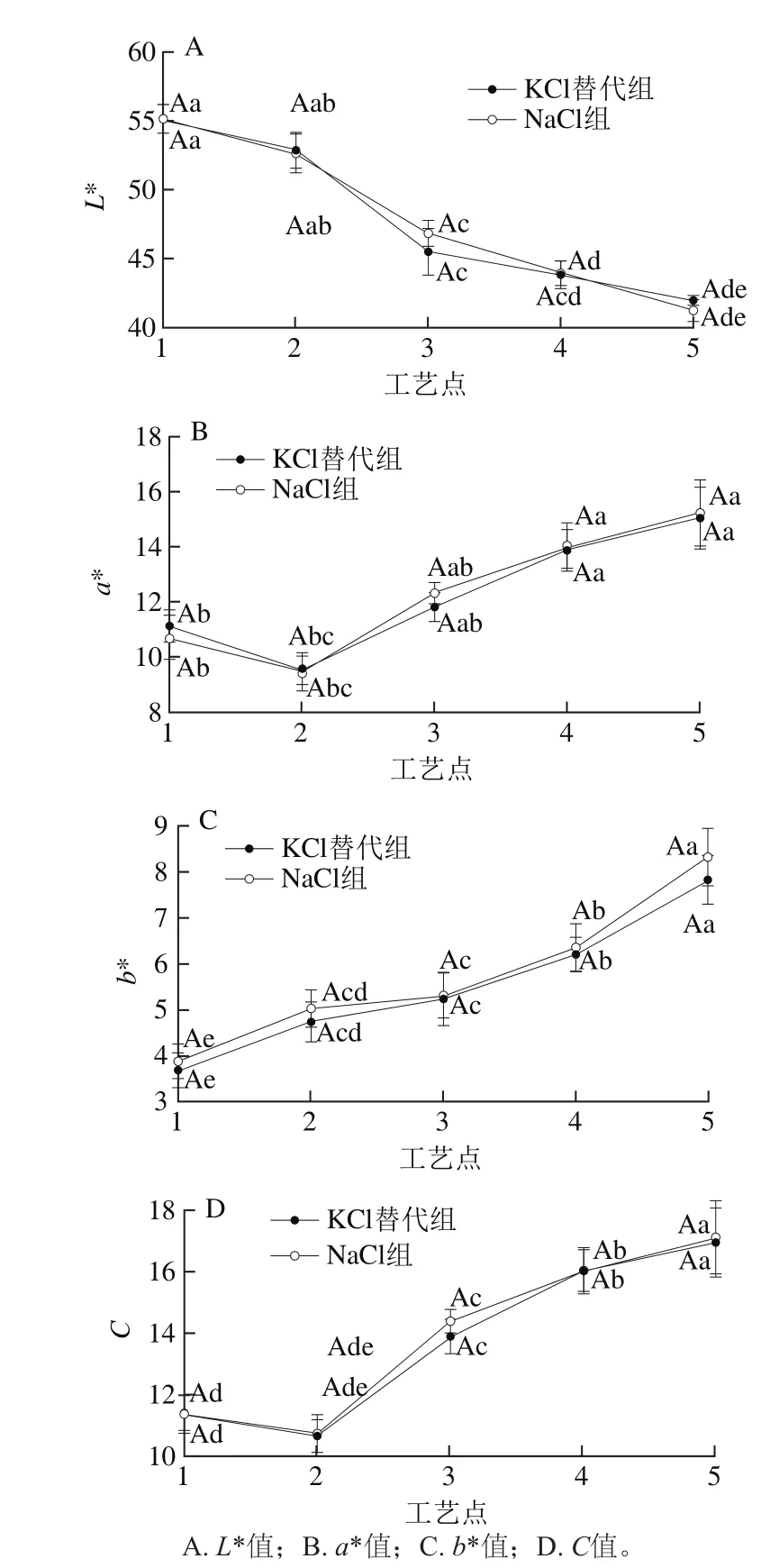
图 4 干腌火腿加工过程中色差值的变化Fig. 4 Changes in color values in dry-cured ham during processing
综合各色差指标实验结果,采用KCl替代30% NaCl对火腿半膜肌色差值影响不显著(P>0.05)。这与西式火腿、干腌里脊上用盐量0%~40% KCl替代NaCl的实验结果是一致的[32]。
2.5 干腌火腿加工过程中肌红蛋白的氧合及氧化变化

图 5 干腌火腿加工过程中肌红蛋白的氧化变化Fig. 5 Evolution of myoglobin oxidation in dry-cured ham during processing
肌红蛋白是干腌火腿中呈色物质的基础,脱氧肌红蛋白(deoxymyolglobin,DMb)存在时可以发生氧合及氧化反应生成氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白(metmyoglobin,MMb),它还能通过降解反应产生其他衍生物。由图5可知,在干腌火腿加工过程中,DMb向氧化形式转变,相对含量呈显著下降趋势(P<0.05),OMb的相对含量在腌制期和成熟前期逐渐升高,在成熟中后期变化不显著(P>0.05),MMb的相对含量则呈显著上升趋势(P<0.05),在成熟期上升速率加快。采用盐量30% KCl替代NaCl后,处理组间各工艺点的DMb、OMb及MMb相对含量无显著性差异(P>0.05)。腌制期,温度较低、水分活度较高,氧分子容易渗透到半膜肌中,肌肉中的氧含量较高,此时利于DMb氧合为OMb而不利于MMb的形成,因为MMb的形成需要氧分压较低[13]。成熟前期,温度升高氧气扩散变慢溶解度下降,OMb形成变慢但利于MMb的形成,同时温度升高,MMb还原酶系活性较高,MMb可以向OMb转化,此阶段DMb相对含量下降较快。成熟中后期,温度和盐分进一步升高,水分含量下降,氧气溶解度进一步下降,同时肌肉表面致密层的形成进一步造成氧气的渗透,DMb直接氧化为MMb,而MMb还原酶系逐渐丧失活性则阻断了MMb向DMb及OMb的转化;而OMb上血红素周围的疏水环境使其具有更大稳定性[31],OMb的相对含量变化不显著(P>0.05)。
2.6 干腌火腿加工过程中红色色素的变化
肌红蛋白由一条珠蛋白链联接血红素分子构成,其中血红素分子为发色基团[33-34]。干腌火腿加工过程中肌红蛋白受到温度、盐分含量上升的影响,珠蛋白变性并可能与血红素分子断开,形成血红素衍生物,它们也使肌肉呈现红色[35-36]。由图6A可以看出,血红素类色素含量从腌制开始就在显著上升(P<0.05),且各工艺点KCl替代组和NaCl组间总体无显著性差异(P>0.05)。腌制期,盐离子大量渗入是造成肌红蛋白变性红色色素含量上升的主要原因。进入风干成熟期,温度升高,水分含量降低,理化环境的改变使肌红蛋白变性加剧[35],血红素类色素含量显著上升(P<0.05)。成熟中后期,血红素类色素含量的增加速率变慢,可能是因为高温使得某些红色色素的血红素分子的结构发生了改变。整个火腿加工过程中,KCl替代组和NaCl组的血红素类色素含量分别显著增加了394%和533%,差异显著(P<0.05)。
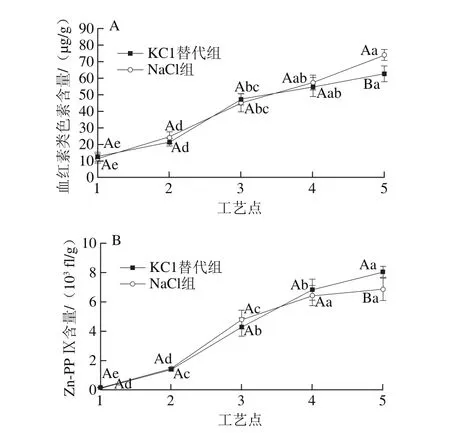
图 6 干腌火腿加工过程中红色色素含量的变化Fig. 6 Changes in red pigment content in dry-cured ham during processing
在研究巴玛火腿时,研究人员发现尽管腌制过程中没有使用硝酸盐或亚硝酸盐,但其色泽仍非常鲜艳,且有部分色素物质对光和热都极其稳定[37],被认为是巴玛火腿的特征色素。后来,研究人员通过高分辨率电喷雾电离质谱(high resolution electrospray ionization mass spectrometry,ESI-HR-MS)及色谱手段证实它为Zn-PP Ⅸ,并且可在酶催化下合成[16,18]。由图6B可以看出,原料中Zn-PP Ⅸ含量几乎没有,但从腌制开始后就显著增加(P<0.05),这与Adamsen等[19]等在巴玛火腿中的研究结果一致。进入风干成熟期,Zn-PP Ⅸ含量上升显著(P<0.05)。这可能与肌红蛋白分子的变性有关,Adamsen等[19]认为肌红蛋白分子变性,易于Zn2+进入血红素卟啉环中间生成Zn-PP Ⅸ。整个火腿加工过程中,KCl替代组和NaCl组的Zn-PP Ⅸ含量分别显著增加了5 296%和4 497%,差异显著(P<0.05)。
2.7 干腌火腿加工过程中呈色物质对产品表观色泽的影响
对于鲜肉及腌制期间的肉品,肌红蛋白的氧化状态对肉品的表观色泽有很大的影响。L*值与a*值直接反映肉与肉制品的色泽品质,被广泛地用来进行肉色分析。Lindahl等[15]对新鲜猪背最长肌和股二头肌的研究表明MMb相对含量与a*值为显著正相关(P<0.05),而OMb相对含量对a*值影响不显著(P>0.05)。Karamucki等[38]对新鲜背最长肌的研究则表明OMb相对含量与a*值为显著正相关(P<0.05),DMb相对含量与a*值为显著负相关(P<0.05),而MMb相对含量对a*值影响不显著(P>0.05)。

表 1 KCl替代组干腌火腿加工过程中肌红蛋白氧化状态与色差的相关性分析结果Table 1 Correlation analysis between changes in myoglobin oxidation state and color values during the processing of dry-cured hams with partial KCl replacement
由表1可得,在干腌火腿中肌红蛋白的氧化状态都与表观色泽显著相关(P<0.05,P<0.01)。DMb相对含量与L*值呈极显著正相关(P<0.01),OMb、MMb相对含量与L*值呈极显著负相关(P<0.01),而OMb/MMb与L*值呈显著正相关(P<0.05),说明L*值受OMb和MMb相对含量的交互作用影响也很大。结合图5中MMb的相对含量变化可知,在火腿加工过程中MMb相对含量在0%~27.49%的较低范围内呈缓慢上升趋势。因为MMb显红褐色且MMb相对含量与a*值呈极显著正相关(P<0.01),说明当MMb相对含量较低时,a*值随着MMb相对含量的升高而变大,MMb对a*值影响力大于OMb,这与Lindahl等[15]的研究结果是一致的。DMb相对含量与a*值呈极显著负相关(P<0.01),这与Karamucki等[38]的研究也是一致的。b*值在加工过程中通常是极不稳定的,但干腌火腿由于加工期长,b*值表现得相对稳定。当肌红蛋白发生氧合或氧化反应时,b*值都会上升,同时色饱和度C值也会上升。
由表1还可以看出,红色色素物质含量都与L*值呈极显著负相关(P<0.01),而与a*、b*、C值呈极显著正相关(P<0.01)。除了色素物质与b*值的相关关系结果不同外,其他相关关系结果与Lindahl等[15]在鲜肉中的结果一致。这可能是因为在鲜肉中,b*值通常表现不稳定,而火腿中b*值相对稳定。火腿的加工周期比一般腌腊肉制品要长很多,在加工过程中受到高盐高温的作用,会产生很多的红色色素物质,它们很可能是形成火腿特征红色的主要原因[19,37]。
水对色素物质具有稀释作用,同时水作为一种光敏剂,可以通过光的作用显著影响肉品的表观色泽[1]。火腿在加工过程中水分逐渐散失,肌肉变得致密,肉品中的肌红蛋白及其他色素物质产生富集,这可能是水分含量对表观色泽产生影响的主要原因。猪肉中肌红蛋白含量约为0.05%,当水分含量降到55%以下时,水分含量及其造成的肌肉组织的改变对肉品表观色泽产生的影响可能会大于肌红蛋白的氧化状态。
2.8 干腌火腿加工过程中理化指标变化对呈色物质的影响
干腌火腿加工过程中的水分和盐分含量发生了显著变化,它们通过影响呈色物质的变化最终影响产品的感官色泽变化。表2是干腌火腿加工过程中水分、盐分含量及pH值与呈色物质的相关分析结果。水分含量越低盐分含量越高,水分活度越低,氧分子在肌肉组织中的渗透越困难,MMb还原酶系随着水分活度的下降而下降,利于OMb氧化形成MMb。同时由于OMb相对较高的稳定性[39]和MMb还原条件被破坏的不可逆性,OMb和MMb在组织中存在一定的积累效应,它们与时间的正相关性也造成了与水分含量之间的负相关性,与盐分之间的正相关性。pH值通过影响亚硝酸盐的还原从而对含亚硝酸盐的肉品的色泽产生重要影响,但在本研究中pH值与呈色物质间的相关性较弱。
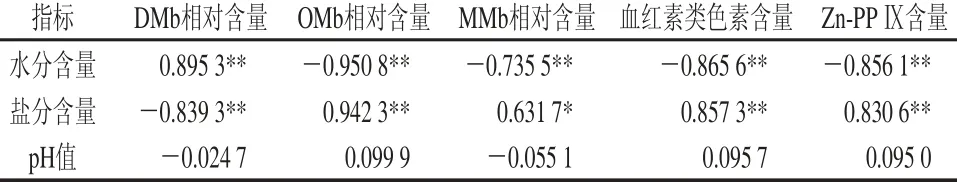
表 2 KCl替代组干腌火腿加工过程中理化条件与呈色物质的相关性分析Table 2 Correlation analysis between changes in physicochemical properties and pigments during the processing of dry-cured hams with partial KCl replacement
由表2可知,血红素类色素与Zn-PP Ⅸ含量变化都与水分含量呈极显著负相关关系(P<0.01),与盐分呈极显著正相关关系(P<0.01),这主要是因为这两类色素在干腌火腿的加工过程中具有很强的积累效应。同时,高盐低水分含量的环境结合高温作用易造成肌红蛋白分子上珠蛋白链的断裂形成其他色素。关于Zn-PP Ⅸ的形成,有学者认为是血红素分子发生了中心原子的置换[25],有学者认为它是在特定酶系催化下由卟啉Ⅸ合成的[40]。而有学者进一步证实,合成Zn-PP Ⅸ的酶在高盐条件下活性更强[41]。因此,Zn-PP Ⅸ含量与盐分含量呈现出极显著正相关关系(P<0.01)。
3 结 论
干腌火腿独特色泽的形成是由肌红蛋白的氧化状态、红色色素的含量及肌肉组织的状态共同决定的。KCl部分替代NaCl的工艺条件下,火腿的OMb和MMb相对含量分别上升约22.07%和25.21%,DMb相对含量下降约47.27%,L*值与DMb呈极显著正相关(P<0.01),与OMb、MMb呈极显著负相关(P<0.01),且受OMb与MMb相对含量比值影响。在较低范围内(0%~27.49%),MMb相对含量越高,a*值越大,并且MMb的影响力大于OMb。30% KCl替代NaCl后血红素类色素和Zn-PP Ⅸ含量在火腿加工过程中都显著增加,约394%和5 296%,并与a*值和C值呈极显著正相关关系(P<0.01)。采用KCl替代30% NaCl结合强化高温成熟工艺对干腌火腿产品半膜肌理化性质、色差值及色素状态和含量没有显著影响,因此,在火腿生产过程中通过KCl部分替代NaCl腌制可以在降低火腿盐分的同时依旧保持传统火腿独特的色泽状态,可为实际生产中采用该工艺提供较好的参考。
[1] SINDELAR J J, CORDRAY J C, OLSON D G, et al. Investigating quality attributes and consumer acceptance of uncured, no-nitrate/ nitrite-added commercial hams, bacons, and frankfurters[J]. Journal of Food Science, 2007, 72(Suppl 8): 551-559. DOI:10.1111/j.1750-3841.2007.00486.x.
[2] GRASSO S, BRUNTON N P, LYNG J G, et al. Healthy processed meat products–regulatory, reformulation and consumer challenges[J]. Trends in Food Science & Technology, 2014, 39(1): 4-17. DOI:10.1016/j.tifs.2014.06.006.
[3] 韦何雯. 金华火腿的研究现状及发展趋势[J]. 肉类工业, 2012(4): 46-49. DOI:10.3969/j.issn.1008-5467.2012.04.026.
[4] 孙卫青, 尹中. 巴氏杀菌切片火腿冷藏期间褪色机理研究[D]. 南京:南京农业大学, 2009: 24-52. DOI:10.7666/d.Y1764511.
[5] MORALES R, GUERRERO L, AGUIAR A P S, et al. Factors affecting dry-cured ham consumer acceptability[J]. Meat Science, 2013, 95(3): 652-657. DOI:10.1016/j.meatsci.2013.05.012.
[6] STANIŠIĆ N, PARUNOVIĆ N, STAJIĆ S, et al. Differences in meat colour between free-range Swallow Belly Mangalitsa and commercially reared Swedish Landrace pigs during 6 days of vacuum storage[J]. Archives Animal Breeding, 2016, 59(1): 159-166. DOI:10.5194/aab-59-159-2016.
[7] MUNK M B, HUVAERE K, VAN BOCXLAER J, et al. Mechanism of light-induced oxidation of nitrosylmyoglobin[J]. Food Chemistry, 2010, 121(2): 472-479. DOI:10.1016/j.foodchem.2009.12.067.
[8] MØLLER J K S, SKIBSTED L H. Mechanism of nitrosylmyoglobin autoxidation: temperature and oxygen pressure effects on the two consecutive reactions[J]. Chemistry-A European Journal, 2004, 10(9): 2291-2300. DOI:10.1002/chem.200305368.
[9] 周光宏. 畜产品加工学[M]. 2版. 北京: 中国农业出版社, 2012: 1-68.
[10] LI H, LI C B, XU X L, et al. Effects of illumination and packaging on non-heme iron and color attributes of sliced ham[J]. Meat Science, 2012, 91(4): 521-526. DOI:10.1016/j.meatsci.2012.03.008.
[11] MAINAR M S, WECKX S, VUYST L D, et al. Alternatives for nitrate and nitrite in fermented meat products: potential contribution of the nitric oxide synthase activity of coagulase-negative staphylococci[J]. Archives of Public Health, 2014, 72(Suppl 1): 1-2. DOI:10.1186/2049-3258-72-S1-O4.
[12] SUMAN S P, JOSEPH P. Myoglobin chemistry and meat color[J]. Annual Review of Food Science and Technology, 2012, 4(3): 79-99. DOI:10.1146/annurev-food-030212-182623.
[13] 于新, 赵春苏, 刘丽. 酱腌腊肉制品加工技术[M]. 北京: 化学工业出版社, 2012: 1-85.
[14] MØLLER J K S, ADAMSEN C E, SKIBSTED L H. Spectral characterisation of red pigment in Italian-type dry-cured ham. Increasing lipophilicity during processing and maturation[J]. European Food Research and Technology, 2003, 216(4): 290-296. DOI:10.1007/ s00217-003-0668-5.
[15] LINDAHL G, LUNDSTRÖM K, TORNBERG E. Contribution of pigment content, myoglobin forms and internal reflectance to the colour of pork loin and ham from pure breed pigs[J]. Meat Science, 2001, 59(2): 141-151. DOI:10.1016/S0309-1740(01)00064-X.
[16] WAKAMATSU J, NISHIMURA T, HATTORI A. A Zn-porphyrin complex contributes to bright red color in Parma ham[J]. Meat Science, 2004, 67(1): 95-100. DOI:10.1016/j.meatsci.2003.09.012.
[17] GROSSI A B, NASCIMENTO E S P D, CARDOSO D R, et al. Proteolysis involvement in zinc-protoporphyrin Ⅸ formation during parma ham maturation[J]. Food Research International, 2014, 56(2): 252-259. DOI:10.1016/j.foodres.2014.01.007.
[18] MAERE H D, JAROS M, DZIEWIĘCKA M, et al. Determination of hemin, protoporphyrin IX, and zinc (Ⅱ) protoporphyrin Ⅸ in Parma ham using thin layer chromatography[J]. Journal of Liquid Chromatography & Related Technologies, 2014, 37(20): 2971-2979. DOI:10.1080/10739149.2014.906995.
[19] ADAMSEN C E, MØLLER J K S, PAROLARI G, et al. Changes in Zn-porphyrin and proteinous pigments in Italian dry-cured ham during processing and maturation[J]. Meat Science, 2006, 74(2): 373-379. DOI:10.1016/j.meatsci.2006.04.003.
[20] GOU P, GUERRERO L, GELABERT J, et al. Potassium chloride, potassium lactate and glycine as sodium chloride substitutes in fermented sausages and in dry-cured pork loin[J]. Meat Science, 1996, 42(1): 37-48. DOI:10.1016/0309-1740(95)00017-8.
[21] 吴海舟, 张迎阳, 黎良浩, 等. KCl部分替代NaCl腌制对干腌肉制品蛋白质水解和感官品质的影响[J]. 食品科学, 2014, 35(1): 39-43. DOI:10.7506/spkx1002-6630-201401008.
[22] 黎良浩, 王永丽, 唐静, 等. KCl部分替代NaCl对干腌火腿工艺过程中蛋白质水解的影响[J]. 食品工业科技, 2015, 36(18): 103-107; 112. DOI:10.13386/j.issn1002-0306.2015.18.012.
[23] 章建浩, 唐志勇, 曾弢, 等. 金华火腿发酵成熟现代工艺及装备研究[J]. 农业工程学报, 2006, 22(8): 230-234. DOI:10.3321/ j.issn:1002-6819.2006.08.048.
[24] ALIÑO M, GRAU R, TOLDRÁ F, et al. Influence of sodium replacement on physicochemical properties of dry-cured loin[J]. Meat Science, 2009, 83(3): 423-430. DOI:10.1016/j.meatsci.2009.06.022.
[25] ALIÑO M, GRAU R, TOLDRÁ F, et al. Physicochemical properties and microbiology of dry-cured loins obtained by partial sodium replacement with potassium, calcium and magnesium[J]. Meat Science, 2010, 85(3): 580-588. DOI:10.1016/j.meatsci.2010.03.009.
[26] LORENZO J M, BERMÚDEZ R, DOMÍNGUEZ R, et al. Physicochemical and microbial changes during the manufacturing process of dry-cured lacón salted with potassium, calcium and magnesium chloride as a partial replacement for sodium chloride[J]. Food Control, 2015, 50: 763-769. DOI:10.1016/ j.foodcont.2014.10.019.
[27] PAROLARI G, AGUZZONI A, TOSCANI T. Effects of processing temperature on color properties of dry-cured hams made without nitrite[J]. Foods, 2016, 5(2): 1-14. DOI:10.3390/foods5020033.
[28] KRZYWICKI K. Assessment of relative content of myoglobin, oxymyoglobin and metmyoglobin at the surface of beef[J]. Meat Science, 1979, 3(1): 1-10. DOI:10.1016/0309-1740(79)90019-6.
[29] TANG J, FAUSTMAN C, HOAGLAND T A. Krzywicki revisited: equations for spectrophotometric determination of myoglobin redox forms in aqueous meat extracts[J]. Journal of Food Science, 2004, 69(9): C717-C720. DOI:10.1111/j.1365-2621.2004.tb09922.x.
[30] RENERRE M, DUMONT F, GATELLIER P. Antioxidant enzyme activities in beef in relation to oxidation of lipid and myoglobin[J]. Meat Science, 1996, 43(2): 111-121. DOI:10.1016/0309-1740(96)84583-9.
[31] 王艳. 强化高温风干成熟工艺对中式培根脂质分解氧化及品质风味影响的研究[D]. 南京: 南京农业大学, 2012: 42-72. DOI:10.7666/ d.Y2361586.
[32] CARRAPISO A I, GARCÍA C. Instrumental colour of Iberian ham subcutaneous fat and lean (Biceps femoris): infi uence of crossbreeding and rearing system[J]. Meat Science, 2005, 71(2): 284-290. DOI:10.1016/j.meatsci.2005.03.024.
[33] WHYTE R. Does it look cooked? A review of factors that infi uence cooked meat color[J]. Journal of Food Science, 2006, 71(4): R31-R40. DOI:10.1111/j.1750-3841.2006.00029.x.
[34] SAKATA R. Studies on physicochemical characteristics of red pigments in meat products[J]. Nihon Chikusan Gakkaiho, 2000, 71(1): 1-16. DOI:10.2508/chikusan.71.1.
[35] MØLLER J K S, ADAMSEN C E, SKIBSTED L H. Spectral characterisation of red pigment in Italian-type dry-cured ham. increasing lipophilicity during processing and maturation[J]. European Food Research and Technology, 2003, 216(4): 290-296. DOI:10.1007/ s00217-003-0668-5.
[36] CROSS A J, HARNLY J M, FERRUCCI L M, et al. Developing a heme iron database for meats according to meat type, cooking method and doneness level[J]. Food and Nutrition Sciences, 2012, 3(7): 905-913. DOI:10.4236/fns.2012.37120.
[37] BECKER E M, CARDOSO D R, SKIBSTED L H. Quenching of excited states of red-pigment zinc protoporphyrin Ⅸ by hemin and natural reductors in dry-cured hams[J]. European Food Research & Technology, 2011, 232(2): 343-349. DOI:10.1007/s00217-010-1392-6.
[38] KARAMUCKI T, JAKUBOWSKA M, RYBARCZYK A, et al. The influence of myoglobin on the colour of minced pork loin[J]. Meat Science, 2013, 94(2): 234-238. DOI:10.1016/j.meatsci.2013.01.014.
[39] CHAU T T, ISHIGAKI M, KATAOKA T, et al. Ferrochelatase catalyzes the formation of Zn-protoporphyrin of dry-cured ham via the conversion reaction from heme in meat[J]. Journal of Agricultural and Food Chemistry, 2011, 59(22): 12238-12245. DOI:10.1021/jf203145p.
[40] SUMAN S P, JOSEPH P. Chemical and physical characteristics of meat/color and pigment[J]. Encyclopedia of Meat Sciences, 2014, 36(3): 244-251. DOI:10.1016/B978-0-12-384731-7.00084-2.
[41] BENEDINI R, RAJA V, PAROLARI G. Zinc-protoporphyrinⅨ promoting activity in pork muscle[J]. LWT-Food Science and Technology, 2008, 41(7): 1160-1166. DOI:10.1016/j.lwt.2007.08.005.
Effect of Partial Replacement of NaCl with KCl Combined with High-Temperature Ripening on Color Formation in Dry-Cured Hams
CHEN Wenbin, LI Lianghao, WANG Jian, DAI Zhaoqi, XU Xinglian, ZHANG Jianhao*
(Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, Key Laboratory of Agricultural and Animal Products Processing and Quality Control, Ministry of Agriculture, National Central of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural Universi ty, Nanjing 210095, China)
Dry-cured hams were produced by intensifi ed high-temperature ripening at 36 ℃ for 45 days with 6.5% salt curing. Changes in the salt and moisture contents, pH, color, myoglobin oxidation, and haem pigments and Zn porphyrinⅨ (Zn-PP Ⅸ) of semimembranosus were examined during processing. Furthermore, the color formation of dry-cured hams was studied and the effect of NaCl replacement with KCl on the color change during processing was examined. The results showed that there was no signifi cant difference (P > 0.05) in physicochemical indicators, color parameters, and the content and state of red pigments between the control and 30% NaCl substitution with KCl. The unique color of dry-cured hams was formed by a combination of the oxidation state of myoglobin, red pigments contents and the state of muscle tissue. The relative contents of oxymyoglobin (OMb) and metmyoglobin (MMb) increased by about 22.07% and 25.21%, but deoxymyoglobin (DMb) decreased about 47.27%. L* value was signifi cantly positively correlated with the relative content of DMb (P < 0.01) and negatively with the relative contents of OMb and MMb (P < 0.01) and it was signifi cantly affected by the ratio of OMb to MMb (P < 0.01). In the low range (0%–27.49%), the higher relative content of MMb could result in a bigger a* value, and MMb had a bigger impact on a* value than did OMb. The contents of haem pigments and Zn-PP IX increased by about 394% and 5 296% during the processing of dry-cured hams and were signifi cantly positively correlated with a* and C values (P < 0.01).
dry-cured ham; partial replacement with KCl; high-temperature ripening; color
10.7506/spkx1002-6630-201717014
TS201.1
A
1002-6630(2017)17-0077-08引文格式:
2016-06-30
公益性行业(农业)科研专项(201303082-2)
陈文彬(1992—),男,硕士研究生,研究方向为畜产品加工与质量控制。E-mail:2014108074@njau.edu.cn *通信作者:章建浩(1961—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:nau_zjh@njau.edu.cn

