干扰素α对乙型肝炎病毒感染小鼠血清病毒标记物的影响*
周 云,李 盛,唐宗生,杨东亮,宋景娇
·短篇论著·
干扰素α对乙型肝炎病毒感染小鼠血清病毒标记物的影响*
周 云,李 盛,唐宗生,杨东亮,宋景娇
目的 探讨干扰素-α(IFN-α)在高压尾静脉注射乙型肝炎病毒(HBV)感染小鼠血清HBV标记物的影响。方法 采用高压尾静脉注射pAAV/HBV1.2和pCMV2/IFN-α4表达质粒,建立HBV感染小鼠模型,采用ELISA法检测血清HBsAg、HBeAg、HBsAb和HBcAb。分离小鼠肝脏内淋巴细胞,使用流式细胞仪检测淋巴细胞FoxP3表达情况。结果 在高压尾静脉注射pAAV/HBV1.2质粒后第1 d,小鼠血清HBsAg和HBeAg开始出现阳性,而第20 d时HBsAg和HBeAg已消失;在注射pAAV/HBV 1.2+IFNα 后第 1 d,血清 HBeAg水平为(0.55±0.16),显著低于 pAAV/HBV 1.2 组【(1.40±0.13),P<0.05);在注射后第 10 d,血清 HBsAg水平为(0.35±0.20),显著低于 pAAV/HBV 1.2 组【(2.35±0.15),P<0.05】;在高压尾静脉注射后 20 d,两组小鼠血清HBsAb阴性;在注射pAAV/HBV1.2后第10 d和20 d,两组小鼠血清HBcAb阳性水平差异无统计学意义(P>0.05);注射后,两组小鼠肝内CD4+T淋巴细胞FoxP3表达未见显著变化。结论 IFN-α具有抗HBV作用,并未诱导免疫负调控反应。
乙型肝炎;pCMV2/IFN-α4表达质粒;HBsAg;HBeAg;小鼠
全世界约有20亿人感染过HBV,其中3.5亿为慢性HBV携带者,每年死于肝炎、肝硬化和肝癌患者约60万[1]。干扰素α(Interferon-alpha,IFN-α)是目前治疗慢性乙型肝炎的主要药物之一,具有广谱抗病毒和免疫调节作用,抑制病毒复制,促进人类白细胞抗原表达,增强NK和细胞毒性T淋巴细胞(CTL)活性[2,3]。我们在高压尾静脉注射HBV感染小鼠探讨了IFN-α的抗病毒和免疫调节作用。
1 材料与方法
1.1 动物与试剂 SPF级BALB/c雌性小鼠,8周龄,购自湖北省疾病控制中心,饲养于我院实验动物中心。所有动物实验均符合本校动物实验伦理委员会的规定。pAAV/HBV1.2和pCMV2/IFN-α4分别由台湾大学陈培哲教授和德国伊斯堡-埃森大学病毒研究所陆蒙吉教授惠赠。检测HBV标记物的ELISA试剂盒购自上海科华生物工程股份有限公司;Endo-free Plasmid Maxi Kit购自美国OMEGA公司;APC标记的抗鼠CD4、PE标记的抗小鼠/大鼠FoxP3抗体和FoxP3穿孔/固定浓缩稀释液购自美国ebioscience公司。胶原酶II和Percoll淋巴细胞分离液购自美国Sigma公司。
1.2 HBV感染小鼠模型的建立 将pAAV/HBV1.2 10μg或pCMV2/IFN-α4质粒20μg单独或共同溶解于相当于小鼠体质量10%的生理盐水,混匀后转移至注射器,自小鼠尾静脉末端1/3处迅速注入。注射后第1 d、10 d、20 d采血,分离血清,标本冻存于-80℃冰箱。
1.3 血清HBV标记物的检测 将小鼠血清与1×PBS按照1:10比例稀释,混匀后加入96孔板,每孔加稀释血清50 μl,再加50μl相应的酶结合物,轻轻混匀,37℃孵育1 h,洗板,加显色剂,37℃孵育30 min,终止显色,酶标仪读取450 nm吸光度。
1.4 小鼠肝脏内淋巴细胞分离 给予小鼠1%戊巴比妥200 μl腹腔注射,麻醉成功后,摘除眼球,取血约800μl,断颈处死小鼠后,置于75%酒精中浸泡3 min,仰卧固定,切开皮肤和腹膜,充分暴露肝脏。通过门静脉缓慢注射少量PBS后使肝脏颜色变为灰白色,剪断下腔静脉,取PBS 10 m l,缓慢灌洗肝脏,直至灌洗液中无血细胞流出。取小鼠肝脏于虑筛研磨肝脏,加入RPMI 1640培养基洗脱,加胶原酶II溶液于沉淀中,37℃温箱中放置40 min,期间振荡数次。然后,加冷DPBS,离心,重悬细胞沉淀于淋巴细胞分离液,离心,弃上清,用RPMI 1640培养基600μl重悬淋巴细胞,计数。
1.5 肝脏内CD4+T淋巴细胞FoxP3表达 取淋巴细胞,接种于 96 孔板,加抗 CD4-APC(1:100)50 μl,4℃避光 30 min。将dilution液与buffer液按照1:3混合,每孔100 μl,4℃孵育2 h,每孔再加100μl 1×buffer,洗涤。每孔加抗FoxP3(1:100)50 μl,4℃放置30 min。洗涤,PBS重悬,上流式细胞仪检测。
1.6 统计分析 应用GraphPad Prism软件作图和SPSS 17.0软件进行统计分析,计量资料以±s表示,组间均数的比较采用两独立样本的t检验,P<0.05被认为具有统计学意义。
2 结果
2.1 两组动物血清HBeAg和HBsAg水平变化 在高压尾静脉注射pAAV/HBV1.2质粒后第1 d,小鼠血清HBsAg和HBeAg开始出现阳性,而第20 d时HBsAg和HBeAg已消失。在注射pAAV/HBV 1.2+IFNα后第1 d,血清HBeAg水平为(0.55±0.16),显著低于pAAV/HBV 1.2组【(1.40±0.13),P<0.05,图 1);在注射 pAAV/HBV 1.2+IFNα 后第 10 d,血清 HBsAg水平为(0.35±0.20),显著低于 pAAV/HBV 1.2 组【(2.35±0.15),P<0.05,图 2)。

图1 两组小鼠血清HBeAg水平比较

图2 两组小鼠血清HBsAg水平比较
2.2 两组动物血清HBsAb和HBcAb水平变化 在高压尾静脉注射后20 d,两组小鼠血清HBsAb阴性(图3);在注射pAAV/HBV1.2后第10 d和20 d,竞争ELISA法检测小鼠血清HBcAb呈阳性,而注射pAAV/HBV 1.2+IFNα小鼠血清HBcAb水平下降,但差异无统计学意义(P>0.05,图4)。
2.3 两组动物肝内Treg变化 两组小鼠肝内CD4+T淋巴细胞FoxP3表达未见显著变化(图5)。

图3 两组小鼠血清HBsAb水平变化

图4 两组小鼠血清HBcAb水平变化
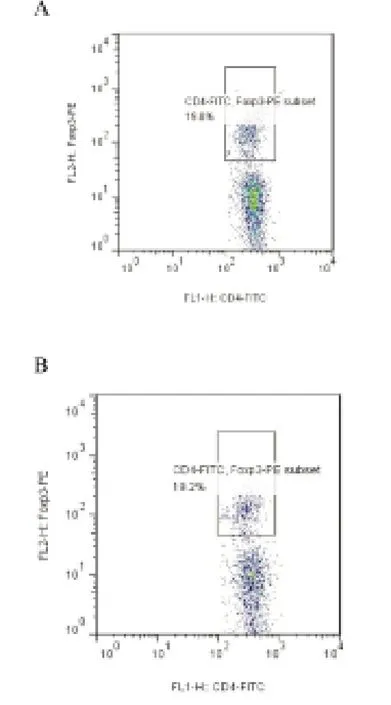
图5 两组小鼠肝内CD4+T淋巴细胞FoxP3表达比较A:pAAV/HBV 1.2组;B:pAAV/HBV 1.2+IFNα 组
3 讨论
尽管发现Ⅰ型IFN近60年了,它具有抗病毒作用和免疫调节作用,但是其作用机制尚不完全清楚[4]。IFNα是一个多能细胞因子,主要由单核细胞和B细胞经病毒诱导产生,与IFNAR结合,激活Jak/STAT信号通路,导致大量ISGs转录,表达多种抗病毒蛋白[5]。目前,临床上所用的IFNα仅仅对部分乙型肝炎患者有效,说明IFNα可能具有极其复杂的抗病毒作用和免疫激活或免疫抑制功能[6]。
在高压尾静脉注射小鼠,IFN-α能抑制HBV复制,显著抑制HBsAg和HBeAg表达,促进病毒的清除。IFNα与其受体结合,引发细胞膜上信号传导,诱导抗病毒蛋白如OAS、MxA和PKR等表达,抑制肝细胞内病毒复制,促进病毒的清除。在HBV转基因小鼠中,可能因免疫耐受等原因,IFNα对血清HBsAg水平无影响,但是,IFNα能显著提高小鼠外周血CD4+T细胞和CD19+B细胞数量,发挥免疫调节作用[7]。
最近研究发现,Ⅰ型IFN具有免疫抑制作用[8-11]。在LCMV系统,持续性IFN信号驱动表达DC和巨噬细胞表达免疫抑制因子PDL1和IL10,而敲除IFNAR能暂时性升高病毒滴度,但最终的结果是促进病毒清除[12,13]。LCMV诱导产生的IFN活化STAT2而非STAT1,从而抑制DC增殖发育[14]。在结核菌持续感染小鼠,IFN诱导DC和巨噬细胞产生IL-10,抑制结核菌特异性免疫反应[15]。IFNα在HIV患者可诱导CD4+T细胞和记忆B细胞凋亡[16]。I型干扰素抑制病毒特异性CD4+Th1细胞免疫反应[17]。目前,IFNα治疗慢性乙型肝炎的持续应答率不足40%。那么,IFNα是否诱导了免疫负调控的产生呢?
IFN-α在高压尾静脉注射小鼠未诱导免疫负调控。肝脏是一个免疫耐受器官[18]。我们不仅分离脾脏淋巴细胞,同时分离了肝脏内淋巴细胞。经流式细胞仪分析发现,肝脏内免疫负调控分子PD1和FoxP3表达没有任何变化,这可能与我们使用的急性HBV感染小鼠模型有关。在体液免疫方面,IFN-α处理与否,两种小鼠均未检测到HBsAb产生,在该模型中HBsAb可能在病毒早期清除过程中未发挥作用,而HBcAb产生较早,高压尾静脉注射小鼠第4天就开始产生(数据未列出),这是因为HBcAg可以直接刺激B细胞产生抗体,无需抗原递呈细胞[19]。IFN-α处理组HBcAb产生水平稍低,一方面原因是IFN-α可能抑制了HBcAg表达,从而导致抗体的减少;另一方面,IFN-α可能抑制了体液免疫应答。
[1] Liaw YF,Chu CM.Hepatitis B virus infection.Lancet,2009,373(9663):582-592.
[2] Yang PL,Althage A,Chung J,et al.Hydrodynamic injection of viral DNA:a mouse model of acute hepatitis B virus infection.Proc Natl Acad Sci U S A,2002,99(21):13825-13830.
[3]Huang LR,Wu HL,Chen PJ,et al.An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection.Proc Natl Acad Sci U S A,2006,103(47):17862-17867.
[4] Isaacs A,Lindenmann J.Virus interference.The interferon.Proc R Soc Lond B Biol Sci,1957,147(927):258-267.
[5] Zoulim F,Durantel D.Antiviral therapies and prospects for a cure of chronic hepatitis B.Cold Spring Harb Perspect Med,2015,5(4):232-236.
[6] 康富标,孙殿兴,李东,等.干扰素-α2b治疗非母婴传播HBeAg阳性慢性乙型肝炎患者疗效分析.实用肝脏病杂志,2016,19(4):471-473.
[7] 严鑫,钟锐华,刘锦红,等.HBV转基因小鼠体内淋巴细胞表型特点及干扰素α对其的影响.南方医科大学学报,2016,36(6):870-874.
[8] Snell LM,Brooks DG.New insights into type I interferon and the immunopathogenesis of persistent viral infections.Curr Opin Immunol,2015,34:91-98.
[9] Schreiber G,Piehler J.The molecular basis for functional plasticity in type I interferon signaling.Trends Immunol,2015,36(3):139-149.
[10]McNab F,Mayer-Barber K,Sher A,et al.Type I interferons in infectious disease.Nat Rev Immunol,2015,15(2):87-103.
[11]Crouse J,Kalinke U,Oxenius A.Regulation of antiviral T cell responses by type I interferons.Nat Rev Immunol,2015,15(4):231-242.
[12]Wilson EB,Yamada DH,Elsaesser H,et al.Blockade of chronic type I interferon signaling to control persistent LCMV infection.Science,2013,340(6129):202-207.
[13]Teijaro JR,Ng C,Lee AM,et al.Persistent LCMV infection is controlled by blockade of type I interferon signaling.Science,2013,340(6129):207-211.
[14]Hahm B,Trifilo MJ,Zuniga EI,et al.Viruses evade the immune system through type I interferon-mediated STAT2-dependent,but STAT1-independent,signaling.Immunity,2005,22(2):247-257.
[15]Mayer-Barber KD,Andrade BB,Oland SD,et al.Host-directed therapy of tuberculosis based on interleukin-1 and type I interferon crosstalk.Nature,2014,511(7507):99-103.
[16]Cha L,Berry CM,Nolan D,et al.Interferon-alpha,immune activation and immune dysfunction in treated HIV infection.Clin Transl Immunology,2014,3(2):e10.
[17]Osokine I,Snell LM,Cunningham CR,et al.Type I interferon suppresses de novo virus-specific CD4 Th1 immunity during an established persistent viral infection.Proc Natl Acad Sci U S A,2014,111(20):7409-7414.
[18]Thomson AW,Knolle PA.Antigen-presenting cell function in the tolerogenic liver environment.Nat Rev Immunol,2010,10(11):753-766.
[19]Milich DR,McLachlan A.The nucleocapsid of hepatitis B virus is both a T-cell-independent and a T-cell-dependent antigen.Science,1986,234(4782):1398-1401.
(收稿:2016-11-20)
(本文编辑:陈宗炳)
Serum HBsAg and HBeAg changes in pCMV 2/IFN-α4 p lasm id-in fected m ice
Z hou Yun,Li Sheng,Tang Zongsheng,et al.Department of Infectious Diseases,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Hepatitis B;pCMV2/IFN-α4 plasmid;HBsAg;HBeAg;Mice
10.3969/j.issn.1672-5069.2017.04.026
国家传染病防治科技重大专项项目(编号:2008ZX10002-011)
430022武汉市 华中科技大学同济医学院附属协和医院感染性疾病科(周云,李盛,唐宗生,杨东亮);附属同济医院实验医学中心(宋景娇);河南大学医学院(周云)
周云,男,36岁,医学博士。主要从事感染与免疫研究。E-mail:zyky120@126.com
宋景娇,E-mail:jjsong@tjh.timu.edu.cn

