基于Cole- Cole模型评价纳米二氧化钛的细胞毒性作用
包秀玲 廖 聪 马 青
(宁波大学医学院,浙江 宁波 315211)
基于Cole- Cole模型评价纳米二氧化钛的细胞毒性作用
包秀玲 廖 聪 马 青*
(宁波大学医学院,浙江 宁波 315211)
利用Cole- Cole模型评价不同剂量纳米二氧化钛(Nano- TiO2)的细胞毒性作用,并探讨电生理机制。150和300 mg/L的Nano- TiO2悬液作用人胃癌MGC803细胞24 h后,制备成细胞悬浮液。在1 kHz~100 MHz范围,采用Agilent 4294A精密阻抗分析仪测量了人胃癌MGC803细胞悬浮液电阻抗的幅值和相位角,经电阻抗频谱和Nyquist图的曲线拟合的残差分析,建立Cole- Cole模型参数,评估Nano- TiO2对MGC803细胞导电性能的影响。结果表明,150和300 mg/L的Nano- TiO2引起第一电阻抗增量(ΔZ1)分别减少18.18%(P<0.001)和39.39%(P<0.001),第二电阻抗增量(ΔZ2)分别减少6.56%(P<0.001)、8.2%(P<0.001),降低了MGC803细胞膜及其核膜的电阻,增加了其导电性能;第一特征频率(fC1)分别增加19.74%(P<0.001)和29.67%(P<0.001),第二特征频率(fC2)分别增加6.28%(P<0.001)、23.43%(P<0.001);第一散射角(β1)分别降低1.35%(P>0.05)和2.70%(P<0.05)。Cole- Cole模型可评价Nano- TiO2的细胞毒性作用并解释其电生理机制,为纳米颗粒的细胞毒理研究提供一种电特性方法。
纳米二氧化钛;胃癌;电阻抗谱;Cole- Cole模型;细胞毒性作用
引言
纳米二氧化钛(Nano- TiO2)在药品、化妆品和食品添加剂中得到了广泛使用[1],并可通过血液注射、呼吸道吸入、胃肠道摄取和皮肤渗透等方式进入人体[2]。2006年国际癌症研究机构(IARC)认定Nano- TiO2为2B组致癌物[3],引起人们对其毒性作用关注。以往研究表明,Nano- TiO2对人胃癌BGC- 823细胞具有毒性作用[4],可激活巨噬细胞的氧化损伤[5]和凋亡[6],引发人肺腺癌A549细胞的DNA损伤[7],增加人角质形成细胞(HaCaT)内噬作用[8]等。Nano- TiO2与细胞膜相互作用,伴随一系列的生物化学反应,产生活性氧(ROS)[9],过多的ROS对细胞产生毒性作用。Nano- TiO2细胞毒性的电生理机制尚不清楚,有待阐明。
细胞电阻抗是利用不同频率的交流电压(V)施予细胞悬浮液,测其电流(I),依据欧姆定律,电阻抗(Z=V/I)获得电阻抗谱。它是一种快速、廉价、非损伤的细胞电生理方法[10],已经成功地用于监测细胞增殖和迁移[11]、细胞活力[12]、抗癌药物的评价[13]等研究。细胞膜是Nano- TiO2接触的第一对象。一些有毒物质作用细胞的早期反应表现在细胞膜特性的改变[14]。而细胞的电阻抗谱能直观反映细胞膜的变化,具有衡量细胞膜电特性的优点[9]。
故此,本研究利用电阻抗谱技术检测Nano- TiO2对胃癌细胞株MGC803的毒性作用,并基于Cole- Cole模型参数变化,探讨Nano- TiO2改变细胞膜和核膜的电阻抗作用机制,为纳米TiO2的细胞毒性作用提供一种电学评价方法。
1 材料和方法
1.1 细胞培养
人胃癌细胞株MGC803购于中国科学院上海生命科学研究院细胞库,使用RPMI- 1640培养基(Hyclone公司)培养,培养基中含有10%胎牛血清(Hyclone公司)和1%100 U/mL青霉素和链霉素(GIBCO公司),置于温度37℃、5% CO2的培养箱中培养。
1.2 制备Nano- TiO2母液
在无菌条件下,使用超纯水配制1 g/L Nano- TiO2母液(Sigma公司),120 ℃高温灭菌1 h,采用超声波仪(SB- 120DT)分散30 min后,使用RPMI-
1640培养基(Hyclone公司)稀释至所需浓度。
1.3 细胞分组
对照组:培养细胞不加Nano- TiO2处理,即0 mg/L Nano- TiO2组,n=15;实验组:细胞加入Nano- TiO2染毒,依据Nano- TiO2终浓度不同分成:实验组1∶150 mg/L Nano- TiO2组,n=16;实验组2∶300 mg/L Nano- TiO2组,n=17。细胞培养24 h后,通过2%胰蛋白酶消化后,收集到15 mL离心管中,配制细胞体积分数(cell volume fraction,CVF)约30%的细胞悬浮液,待电阻抗测量。
1.4 电阻抗测量
测量池(measuring cell)是由透明的有机玻璃制成圆筒形室,嵌入两平行铂片,电极圆盘直径d=3 mm,电极间距L=9.4 mm, 容积约66 μL,测量温度(25±1)℃[15]。
电阻抗谱测量由4194A阻抗分析仪、42942A适配器和16192A夹具组成。在1 kHz~100 MHz频率范围选取N=156个频率点。每个样本在1 min内完成测量。交流激励电压100 mV,测量幅值|Z|和相位角θ,复电阻抗Z*=|Z*|e-jθ=ReZ-jImZ,电阻抗实部ReZ=|Z*|cosθ,电阻抗虚ImZ=|Z*|sinθ。
1.5 Cole- Cole模型[16]

(1)
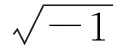
因胃癌细胞存在细胞膜和核膜,故采用两项式Cole- Cole模型,其计算解析方法见文献[17]。
1.6 拟合曲线的残差分析
利用最小二乘法对实测数据与Cole- Cole方程计算数据进行残差分析[18],其残差为
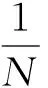
(2)
式中,D和Dcal是实测值和Cole- Cole方程计算的数值,Dmax和Dmin是实测值的最大值和最小值,N=156。具体残差数据见表1。
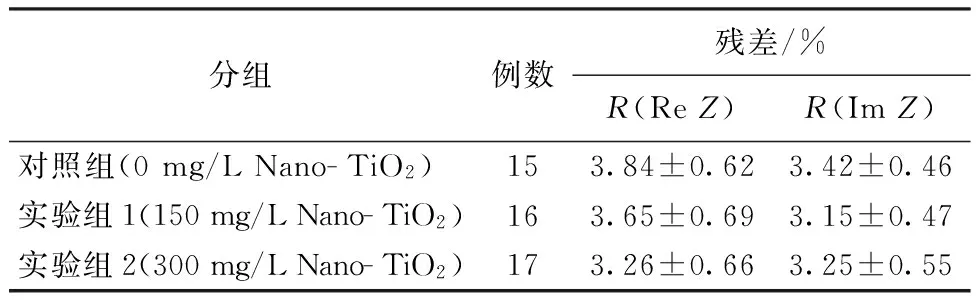
表1 电阻抗谱的拟合残差Tab.1 Fitting residual of electrical impedance spectra
1.7 统计处理
统计数据采用均数±标准差,两组间数据比较采用t检验,当P<0.5时,认为两组间存在显著性差异。
2 结果
2.1 Nano- TiO2对人胃癌细胞电阻抗谱的影响
图1(a)显示Nano- TiO2对人胃癌MGC803细胞电阻抗实部(ReZ)频谱的影响。
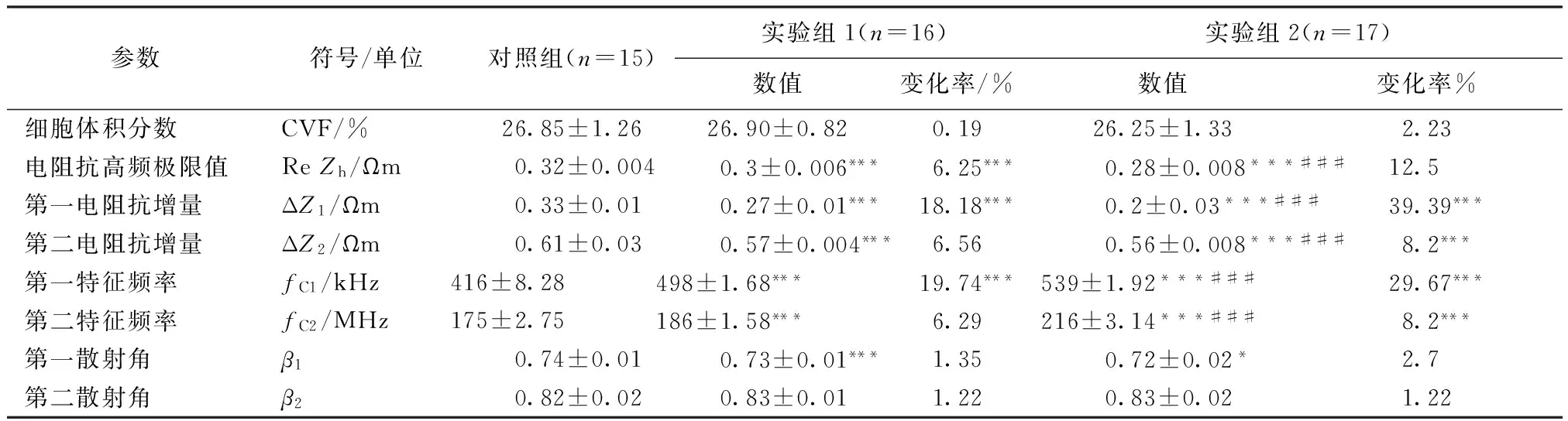
表2 Nano- TiO2对人胃癌细胞Cole- Cole方程参数的影响Tab.2 Effect of Nano- TiO2 on parameters of the Cole- Cole equation of the human gastric cancer cells
注:*P<0.05,***P<0.001与对照组比较;###P<0.001 与实验组1比较。
Note:*P<0.05,***P<0.001 compared with the control group;###P<0.001 compared with experience group 1.
1) ReZ频率依存性:在1~100 kHz频段,ReZ数值恒定不变,称为电阻抗低频极限值ReZL;在100 kHz~10 MHz频段,ReZ数值随频率增大而减小,构成第一个阻抗弛豫变化,称为第一电阻抗增量(ΔZ1);在10~50 MHz频段,ReZ出现较缓平台;当电场频率>50 MHz时,构成第二个阻抗弛豫变化,称为第二电阻抗增量(ΔZ2)。
2) ReZ的剂量依存性:随Nano- TiO2剂量(150 mg/L、300 mg/L)增加,电阻抗低频极限值(ReZL)和电阻抗增量(ΔZ1,ΔZ2)随之减小。具体地讲,与对照组比较,实验组(150 mg/L、300 mg/L)的ΔZ1分别减小18.18%(P<0.001)和39.39%(P<0.001);ΔZ2分别减小6.56%(P<0.001)、8.2%(P<0.001);ReZh分别减小6.25%(P<0.001)、12.5%(P<0.001)。
图1(b)显示Nano- TiO2对MGC803细胞的电阻抗虚部(ImZ)的影响。
1) ImZ频率依存性:在1 kHz~10 kHz频段,ImZ数值不变,称为电阻抗虚部低频极限值ImZL;在10 kHz~10 MHz频段,ImZ随频率变化出现第一个弛豫峰,峰值对应的频率是第一特征频率(fC1);在10 MHz~10 GHz频段,ImZ出现第二个峰,峰值对应的频率是第二特征频率(fC2)。
2)剂量依存性:随Nano- TiO2剂量(150 mg/L、300 mg/L)增加,特征频率(fC1、fC2)随之增加。也就是说,与对照组比较,实验组(150 mg/L、300 mg/L)的fC1分别增加19.74%(P<0.001)和29.67%(P<0.001);fC2分别增加6.28%(P<0.001)、23.43%(P<0.001)。Nano-TiO2对人胃癌细胞Cole-Cole方程参数的影响如表2所示。
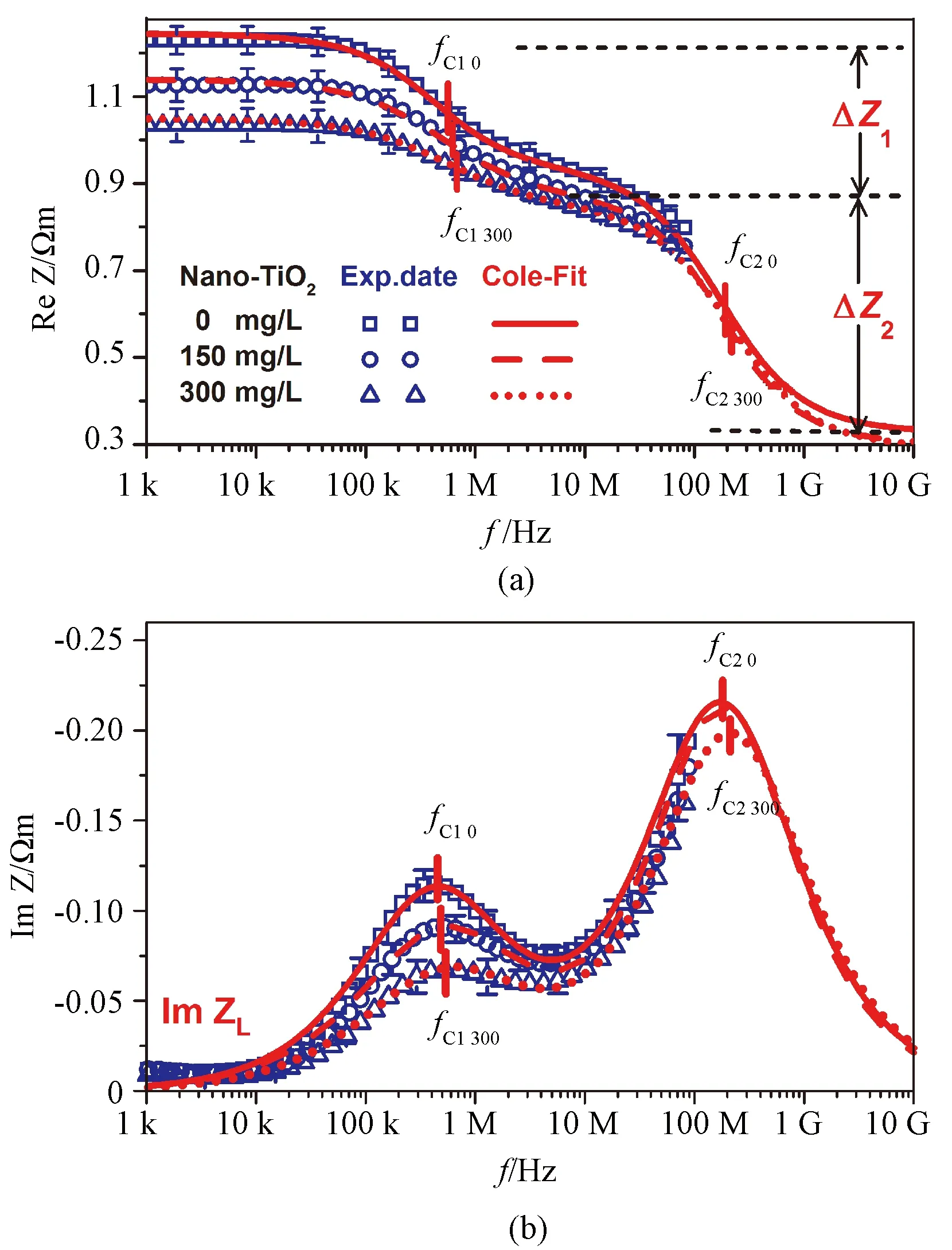
图1 Nano- TiO2对人胃癌MGC803细胞阻抗谱的影响。(a)实部;(b)虚部Fig.1 Effect of Nano- TiO2 on the impedance spectra of human gastric carcinoma MGC803 cells. (a)The real part; (b)The imaginary part
2.2 Nano- TiO2对人胃癌细胞复平面图的影响
图2是Nano- TiO2影响MGC803细胞电特性的三维图。曲线具有2个半圆弧,左侧半圆由第一弛豫形成,右侧半圆属于第二弛豫。两个圆弧顶点的频率分别是第一、第二特征频率(fC1、fC2)。左截距是电阻抗低频极限值(ReZL),右截距是电阻抗高频极限值(ReZh)。随着Nano- TiO2剂量的增加,圆弧曲线向右移动,且圆弧面积变小。散射角(β1,β2)分别决定第一、第二半圆弧弯曲程度。Nano- TiO2对β1的影响:实验组(150 mg/L、300 mg/L)分别低于对照组1.35%(P>0.05)和2.70%(P<0.05)。Nano- TiO2对β2的影响:实验组(150 mg/L、300 mg/L)高于对照组1.22%(P>0.05),但无显著性差异。
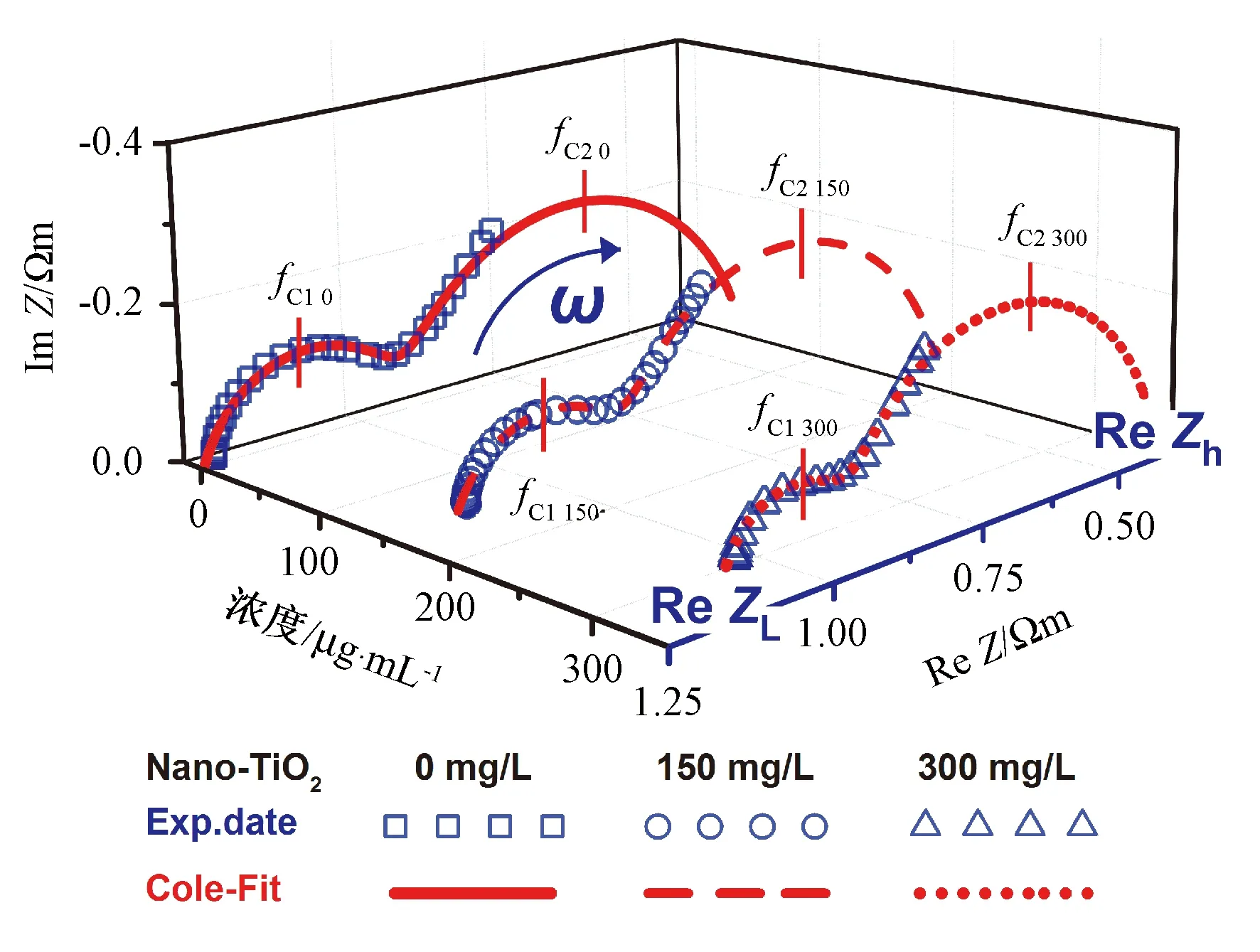
图2 Nano- TiO2对MGC803细胞三维Nyquist图的影响Fig.2 Effect of Nano- TiO2 on the Nyquist plot of human gastric carcinoma MGC803 cells at 3D
3 讨论
胃癌细胞由细胞膜、细胞质、细胞器、细胞核膜和细胞核质构成,这些结构的电学性质各异,特别是膜性结构(细胞膜和细胞核膜)主要由脂质和少量蛋白质组成,其电导率几乎为零[19]。当宽频电场作用MGC803细胞时,因非导电的膜性结构存在,在膜的内侧和外侧聚集的带电离子形成了界面极化效应,称为Maxwell- Wagner效应[20]。此效应在电阻抗谱表现出两个弛豫:第一弛豫和第二弛豫,它们分别来源于细胞膜和细胞核膜的极化效应。并且用Cole- Cole模型参数分别表征第一弛豫(ΔZ1、fC1和β1)和第二弛豫(ΔZ2、fC2和β2)的特征。
在图1(a)中,当f=1~100 kHz频段,细胞膜界面极化作用较大,细胞膜容抗(Zm=1/(jωCm),Cm细胞膜电容)较大,电流选择低电阻的细胞外液流动,绕过细胞,此时细胞膜相当于电容性断路状态或高阻抗特性。当外加电场频率f=100 kHz~10 MHz频段,细胞膜的界面极化作用减弱,细胞膜容抗(Zm=1/(jωCm))逐渐减小,电流可以通过细胞膜进入细胞质,电阻抗逐渐减小,形成了第一弛豫的电阻抗增量(ΔZ1),故ΔZ1反映细胞膜对电磁场响应的参量,也体现细胞膜的导电性能。当电场频率增至f=10~50 MHz频段,细胞膜跟不上如此高频电场变化,也来不及产生极化作用,相当于细胞膜电容短路,电流直接穿过细胞膜,流入细胞质,ReZ出现了较缓的平台,此平台反映细胞质的信息。流入细胞质的电流引起细胞核膜的界面极化,当外加电场频率f=50 MHz~1 GHz时,细胞核膜的界面极化作用减弱,核膜容抗(Zne=1/(jωCne))随之减小,构成了第二弛豫的电阻抗增量(ΔZ2),故ΔZ2反映细胞核膜对电磁场响应的参数,也代表细胞核膜的离子通透性。当电场频率f=1~10 GHz频段,造成核膜的电容性短路,电流通过细胞核膜进入核质,电阻抗高频极限值(ReZh)代表细胞核内的信息。
在图1(b)中,外加交变电场诱导的膜结构(细胞膜和核膜)界面极化作用,当外加电场频率分别等于fC1和fC2时,电阻抗虚部(ImZ)产生了两个极大的损耗,分别出现了两个峰值,其峰值对应的频率(fC1、fC2)反映了MGC803细胞的频率特性。
Nano- TiO2可以损伤胃癌细胞株BGC的膜结构,引起膜通透性增加,导致其导电性增加[4]。故在图1中,随Nano- TiO2剂量增加,胃癌细胞株MGC803的电阻抗高频极限值(ReZh)降低,细胞膜电阻抗增量(ΔZ1)和核膜电阻抗增量(ΔZ2)皆降低,Nano- TiO2造成细胞膜和核膜的电阻抗降低,电导率增加。其可能原因是在Nano- TiO2处理24 h后,诱导氧化应激产生活性氧(ROS),引起膜细胞骨架肌动蛋白重排[6],造成细胞膜损伤,且随着浓度的增加,毒性作用递增,最后导致Nano- TiO2染毒组的电阻抗低于对照组的电阻抗。
在图2中,Nano- TiO2剂量增加的同时,特征频率(fC1、fC2)变大,第一散射角(β1)变小,第二散射角(β2)变化不大。这可能是大多数情况中,活性氧(ROS)在诱导的氧化应激导致细胞损伤过程中扮演着重要角色。已知的细胞功能损害包括ROS的产生过剩可导致DNA链断裂,通过调节基因表达和信号转导的炎症反应,引起细胞凋亡[21],细胞皱缩,细胞尺度变小,使得界面极化效应加快,导致特征频率变大[22]。
本研究实测频率在1 kHz~100 MHz范围内,为了深入了解Nano- TiO2对胃癌细胞的毒性作用,今后有必要扩展电场实测频率范围,研究其对核膜的影响。此外,考虑到细胞对纳米材料的敏感性不同,引起的毒性作用也可能存在差异。需要进一步研究其他类型的细胞,探究其是否存在相同的作用。
4 结论
1)利用电阻抗谱的Cole- Cole模型评价纳米TiO2的细胞作用,阐述其电生理机制。
2)纳米TiO2对胃癌MGC803细胞电特性的作用是降低细胞膜和核膜电阻,增加其导电性能,增加特征频率(fC1、fC2),降低第一散射角(β1)。
3)纳米TiO2对胃癌MGC803细胞电特性的影响具有剂量依赖性,即随纳米TiO2剂量增加,电阻抗增量(ΔZ1、ΔZ2)随之减小,而特征频率(fC1、fC2)随之增加。
Cole- Cole模型可以简便地观察细胞膜和核膜导电性能或通透度,有效地解释Nano- TiO2对胃癌细胞膜的电性能,为纳米颗粒的细胞毒理性研究提供一种电生理学方法。
[1] Wang Yan, He Yiming, Lai Qinghua, et al. Review of the progress in preparing nano TiO2: An important environmental engineering material [J]. J Environ Sci, 2014, 26(11): 2139- 2177.
[2] Zhang Xiaochen, Li Wen, Yang Zhuo. Toxicology of nanosized titanium dioxide: an update [J]. Arch Toxicol, 2015, 89(12): 2207- 2217.
[3] International Agency for Research on Cancer. IARC monographs on the evaluation of carcinogenic risks to humans: carbon black, titanium dioxide, and talc [EB/OL]. http://monographs.iarc.fr/ENG/Monographs/vol93/mono93.pdf 2006- 02- 07/2016- 06- 01.
[4] 曲秋莲,张英鸽. 纳米活性炭,纳米二氧化硅和纳米二氧化钛对人胃肿瘤BGC- 823细胞的毒性作用 [J]. 中国药理学与毒理学杂志, 2010, 24(6): 481- 487.
[5] Masoud R, Bizouarn T, Trepout S, et al. Titanium dioxide nanoparticles increase superoxide anion production by acting on NADPH oxidase [J]. PLoS ONE, 2015, 10(12): e0144829.
[6] Gali NK, Ning Zhi, Daoud W, et al. Investigation on the mechanism of non- photocatalytically TiO2- induced reactive oxygen species and its significance on cell cycle and morphology [J]. J Appl Toxicol, 2016, 36(10): 1355- 1363.
[7] Wang Yurong, Cui Haiyan, Zhou Jiaping, et al. Cytotoxicity, DNA damage, and apoptosis induced by titanium dioxide nanoparticles in human non- small cell lung cancer A549 cells [J]. Environ Sci Pollut Res, 2014, 22 (7): 5519- 5530.
[8] Lopes VR, Loitto V, Audinot JN, et al. Dose- dependent autophagic effect of titanium dioxide nanoparticlesin human HaCaT cells at non- cytotoxic levels [J]. J Nanobiotechnol, 2016, 14(22): 1- 13.
[9] 张艳芳,马春旺,金蝉,等. 2种晶型纳米二氧化钛材料对A549细胞的毒性效应[J]. 河南师范大学学报(自然科学版), 2013, 41(2): 74- 77.
[10] Xu Youchun, Xie Xinwu, Duan Yong, et al. A review of impedance measurements of whole cells [J]. Biosens Bioelectron, 2016, 77: 824- 836.
[11] Wang SC, Ye Lin, Sanders AJ, et al. Tumour endothelial marker- 8 in wound healing and its impact on the proliferation and migration of keratinocytes [J]. Int J Mol Med, 2016, 37(2): 293- 298.
[12] Pradhan R, Mandal M, Mitra A, et al. Monitoring cellular activities of cancer cells using impedance sensing devices [J]. Sensor Actuat B: Chem, 2014, 193: 478- 483.
[13] Pradhan R, Rajput S, Mandal M, et al. Frequency dependent impedimetric cytotoxic evaluation of anticancer drug on breast cancer cell [J]. Biosens Bioelectron, 2014, 55: 44- 50.
[14] Srivastava RK, Rahman Q, Kashyap MP, et al. Nano- titanium dioxide induces genotoxicity and apoptosis in human lung cancer cell line, A549 [J]. Hum Exp Toxicol, 2013, 32(2): 153- 166.
[15] 宫宇,沈斌,陈林,等. 模拟失重对大鼠血液电阻抗谱影响的实验研究 [J]. 中国生物医学工程学报, 2012, 31(6): 853- 858.
[16] Cole KS, Cole RH. Dispersion and absorption in dielectrics I. Alternating current characteristics [J]. J Chem Phys, 1941, 9(4): 341- 351.
[17] 张倩,方云,李会英,等. Cole- Cole方程参数对细胞介电频谱的影响 [J]. 宁波大学学报(理工版), 2014, 27(4): 115- 121.
[18] 马青,侯晓荣,王立洪. 骨骼肌细胞频响特性的数值分析 [J]. 生物数学学报, 2006, 21(1): 33- 39.
[19] 李成祥,孙才新,姚陈果,等. 电穿孔过程中细胞膜电导率变化条件下的跨膜电压研究 [J]. 中国生物医学工程学报, 2011, 30(4): 576- 581.
[20] Foster KR, Schwan HP. Dielectric properties of tissues and biological materials: a critical review [J]. Crit Rev Biomed Eng, 1989, 17(1): 25- 104.
[21] Fu PP, Xia Qingsu, Hwang H M, et al. Mechanisms of nanotoxicity: generation of reactive oxygen species [J]. J Food Drug Anal, 2014, 22(1): 64- 75.
[22] Justice C, Brix A, Freimark D, et al. Process control in cell culture technology using dielectric spectroscopy [J]. Biotechnology Advances, 2011, 29(4): 391- 401.
Evaluation of Cytotoxicity of Nano Titanium Dioxide Based on Cole- Cole Model
Bao Xiuling Liao Cong Ma Qing*
(The Medicine School, Ningbo University, Ningbo 351211, Zhejiang, China)
The aim of this work is to evaluate the cytotoxicity of titanium dioxide nanoparticles (Nano- TiO2) at different doses based on Cole- Cole model and explore the electrophysiological mechanism. The human gastric cancer cell MGC803 was exposed to 150 mg/L and 300 mg/L Nano- TiO2suspension for 24 h. The amplitude and phase angle of the impedance of human gastric cancer MGC803 cell suspension were measured by 4294A Agilent precision impedance analyzer in the range of 1 kHz-100 MHz. Based on the residual analysis of the curve fitting of the electrical impedance spectroscopy and the Nyquist plot, the parameters of the Cole- Cole model were established, and the effect of Nano- TiO2on the conductivity of MGC803 cells was evaluated based on the Cole- Cole model. Results showed that 150 mg/L and 300 mg/L of Nano- TiO2induced the first impedance increment (ΔZ1) decreased 18.18% (P<0.001) and 39.39% (P<0.001) respectively, the second impedance increment (ΔZ2) decreased 6.56% (P<0.001) and 8.2% (P<0.001) respectively, and reduced the resistance of cellular membrane and nuclear membrane of MGC803 cells, increased its conductivity. The first characteristic frequency (fC1) was increased by 19.74% (P<0.001) and 29.67% (P<0.001) respectively, and second characteristic frequency (fC2) was increased by 6.28% (P<0.001) and 23.43% (P<0.001) respectively. The first dispersion angle (β1) was reduced by 1.35% (P>0.05) and 2.70% (P<0.05), respectively. The Cole- Cole model can be applied to evaluate the role of Nano- TiO2and explain its electrophysiological mechanism, providing a method for the study of cytotoxicity of nanoparticles.
Nano titanium dioxide; gastric cancer; electrical impedance spectroscopy; Cole- Cole model; cytotoxicity
10.3969/j.issn.0258- 8021. 2017. 03.011
2016-06-24, 录用日期:2016-11-29
国家自然科学基金项目(51277099);宁波市科技惠民项目(2015C5009)
R318
A
0258- 8021(2017) 03- 0336- 06
*通信作者(Corresponding author),E- mail: maqing@nbu.edu.cn

