广西大果山楂叶提取物对大鼠的长期毒性初步研究
尹利君 陈 路 刘 钰 蒙兰兰 方秀玲 蓝鸣生 吴无畏*
1. 广西壮族自治区药用植物园,广西 南宁 530023;2. 桂林医学院,广西 桂林 541004
广西大果山楂叶提取物对大鼠的长期毒性初步研究
尹利君1陈 路1刘 钰1蒙兰兰2方秀玲2蓝鸣生1吴无畏1*
1. 广西壮族自治区药用植物园,广西 南宁 530023;2. 桂林医学院,广西 桂林 541004
目的:研究广西大果山楂叶提取物对大鼠的长期毒性影响。方法:将大果山楂叶提取物以20 g/(kg·d)剂量(临床推荐剂量的133倍)给雄性大鼠连续灌胃30d,每天观察大鼠外观行为情况、记录体重和摄食量,30d后解剖大鼠,测定血液学和血生化指标、计算脏器指数并对主要脏器进行病理组织学检查。结果:给药组动物的外观行为、体重、脏器系数,与正常对照组比较均无统计学差异,血液学和生化学个别指标有统计学差异,但均在正常参考值范围内,主要脏器未见明显的异常。结论:大果山楂叶提取物样品对雄性大鼠无明显毒性作用,临床推荐剂量是安全的。
大果山楂;毒性;血液学;血清生化;脏器指数;病理组织学
大果山楂又叫山楂(广西)、涩梨、古蝉子、鸟婵子(广西苗语),麻缺顿、墨鸡屯(广西壮族),撒多、撒两比(台湾),广西楂(商品名),为蔷薇科苹果属植物台湾林檎Malusdoumeri(Bois) Chev.的成熟果实[1]。台湾林檎果实在广西、广东、贵州、云南等南方地区作为山楂使用已久,其味甘、酸、涩,性微温,具有理气健脾,消食导滞之功效;台湾林檎叶味甘甜、微芬芳,性平,具有开胃、消滞、去湿的功效,在广西、湖南、广东、云南等南方地区作为代用茶饮料广泛长期使用。广西大果山楂及其叶收载于《广西壮族自治区壮药质量标准》第二卷[2]。有研究报道广西大果山楂具有降血压、降血脂、保肝、抑菌、抗氧化等作用[3-4]。金雪萍等[5]对林檎叶提取物的小鼠急性毒性实验进行了研究,潘莹等[6]对大果山楂总黄酮的小鼠急性毒性进行了研究,但广西大果山楂叶提取物对大鼠的安全性评价的研究尚未见有报道。本实验参考国家食品药品监督管理局发布的《中药、天然药物长期毒性研究技术指导原则》[7]、《辅助降血脂功能评价方法》[8]等相关规定,将大果山楂叶提取物以20g/(kg·d)(为临床推荐剂量的133倍[2])剂量给大鼠连续灌胃30d,观察其对大鼠的毒性影响。
1 材料与方法
1.1 实验动物 SPF级SD雄性大鼠,体重(200±20)g,由广西医科大学动物实验中心提供,动物许可证号:SCXK桂2014-0002。
1.2 药物 大果山楂叶购自于广西柳江县,经广西壮族自治区药用植物园保育中心农新东助理研究员鉴定为蔷薇科苹果属植物台湾林檎Malusdoumeri(Bois) Chev.的成熟叶片。
1.3 仪器 日本奥林巴斯AU400全自动生化仪;西森美康XT1800i全自动血球计数仪;德国徕卡DM6000B显微镜。
1.4 大果山楂叶提取物提取方法 首先采用70%乙醇提取,然后水提醇沉,最后将70%醇提浓缩液与水提醇沉浓缩液混合均匀,置于托盘中80℃以下,纯水浴蒸发到足够浓度(每g浸膏相当于药材大于2.0g),装入大口具塞瓶中,冷藏备用,临用前用蒸馏水配制成相应浓度。
1.5 分组及给药 将20只大鼠随机分为两组,每组10只,即正常对照组和山楂提取物高剂量组(生药浓度为20g/kg),山楂组每天按照10mL/kg灌胃给药1次,正常对照组给予等量蒸馏水,连续灌胃30d,末次给药后24h,动物采用5%水合氯醛按照0.4mL/100g剂量腹腔注射麻醉,解剖取血,检测各项指标。
1.6 检测项目
1.6.1 一般检查 每周称量体重1次,每天记录采食情况,观察动物毛发、排泄物、精神状态、行为状态。
1.6.2 血液学检查 取EDTA抗凝的大鼠腹主动脉血,用全自动血球计数仪检测大鼠白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白(HGB)、红细胞容积(HCT)、血小板计数(PLT)、血小板平均体积(MPV)、血小板比容(PCT)、 红细胞平均体积(MCV)、 红细胞平均血红蛋白含量(MCH)、中性粒细胞百分比(NEUT%)、淋巴细胞百分比(LYMPH%)、 单核细胞百分数(MONO%)、 嗜酸性粒细胞百分比(EO%)。
1.6.3 血清生化学检查 大鼠腹主动脉取血,2500rpm/min,离心15min,取血清,全自动生化分析仪检测大鼠葡萄糖( Glu) 、肌酐( Cr)、尿素氮( BUN) 、总蛋白( TP) 、白蛋白( ALB) 、谷丙转氨酶( ALT)、谷草转氨酶( AST)、甘油三酯(TG)、总胆固醇( TCHO) 等指标。
1.6.4 脏器指数及病理组织学检查 大鼠麻醉放血后解剖,对主要脏器进行全面检查并称重,按照下列公式计算脏器指数:脏器指数=脏器质量/体质量×100。对肝脏、肾脏、脾脏、胃、肠、睾丸等组织进行病理组织学检查。

2 结果
2.1 一般情况 给药期间,所有大鼠全部存活,与正常组相比,大鼠毛色、精神状态、呼吸、行为活动、饮食、排泄等均未见异常。
2.2 大果山楂叶提取物对大鼠体重和摄食量的影响 给药前2周,大鼠体重增长缓慢,较正常对照组有统计学差异(P<0.05),随着时间延长,体重逐渐增长,给药3周、4周后,体重与正常组比较无统计学差异(P>0.05)。见表1。随着时间延长,给药组摄食量明显大于正常组(P<0.05),表明山楂叶提取物给药3周后可增加大鼠的食欲。见表2。


组别起始体重第1周第2周第3周第4周正常对照组183.30±6.95240.40±7.96290.70±15.25327.20±21.80354.80±26.02山楂叶提取物组185.40±5.27226.00±13.04**275.50±13.84*307.70±20.02351.10±25.36
注:与正常对照组比较,*P<0.05,**P<0.01。


组别例数第1周第2周第3周第4周正常对照组1023.81±0.7224.89±0.7723.56±0.7623.41±0.96山楂叶提取物组1018.73±3.81*24.93±2.1625.03±1.20*26.39±1.47**
注:与正常对照组比较,*P<0.05,**P<0.01。
2.3 大果山楂叶提取物对大鼠血液学指标的影响 大果山楂叶提取物可以增加淋巴细胞百分比(LYMPH%)(P<0.05),降低中性粒细胞百分比(NEUT%)(P<0.05)。但是均在正常参考值范围内,不属于药物引起的病理变化,可能是由于大鼠之间的个体差异导致,以上指标两组之间有统计学差异。其余指标较正常对照组无统计学差异(P>0.05)。见表3。


参数正常对照组山楂叶提取物组实验室参考值范围WBC/×109/L7.19±1.397.49±2.517~11RBC/×1012/L8.49±0.488.80±0.657~9HGB/g/L157.11±5.84164.22±1.46120~170HCT/%47.96±1.8550.93±3.3543~58
续表3

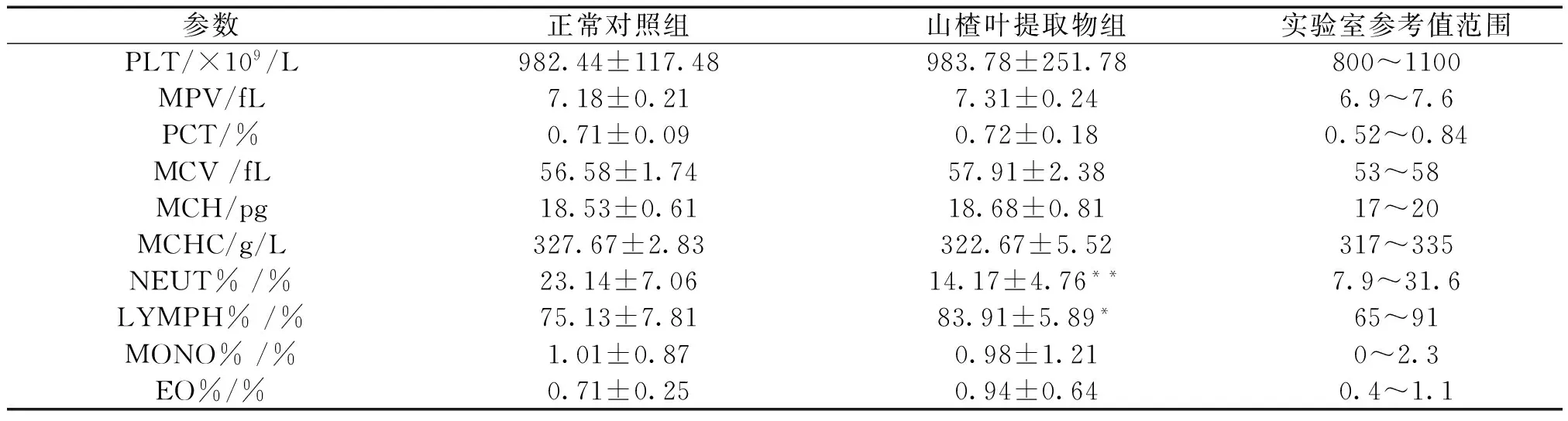
参数正常对照组山楂叶提取物组实验室参考值范围PLT/×109/L982.44±117.48983.78±251.78800~1100MPV/fL7.18±0.217.31±0.246.9~7.6PCT/%0.71±0.090.72±0.180.52~0.84MCV/fL56.58±1.7457.91±2.3853~58MCH/pg18.53±0.6118.68±0.8117~20MCHC/g/L327.67±2.83322.67±5.52317~335NEUT%/%23.14±7.0614.17±4.76**7.9~31.6LYMPH%/%75.13±7.8183.91±5.89*65~91MONO%/%1.01±0.870.98±1.210~2.3EO%/%0.71±0.250.94±0.640.4~1.1
注:与正常对照组比较,*P<0.05,**P<0.01。
2.4 大果山楂叶提取物对大鼠血清生化学指标的影响 大果山楂叶提取物可以升高大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)、总蛋白(TP)、白蛋白(ALB)的含量(P<0.05),降低BUN 尿素氮、胆固醇(TCHO)的含量(P<0.05),但是各项指标值均在正常参考值范围内,不属于药物引起的病理变化,可能是由于大鼠之间的个体差异导致以上指标两组之间有统计学差异。大果山楂叶提取物对血糖无影响(P>0.05)。见表4。

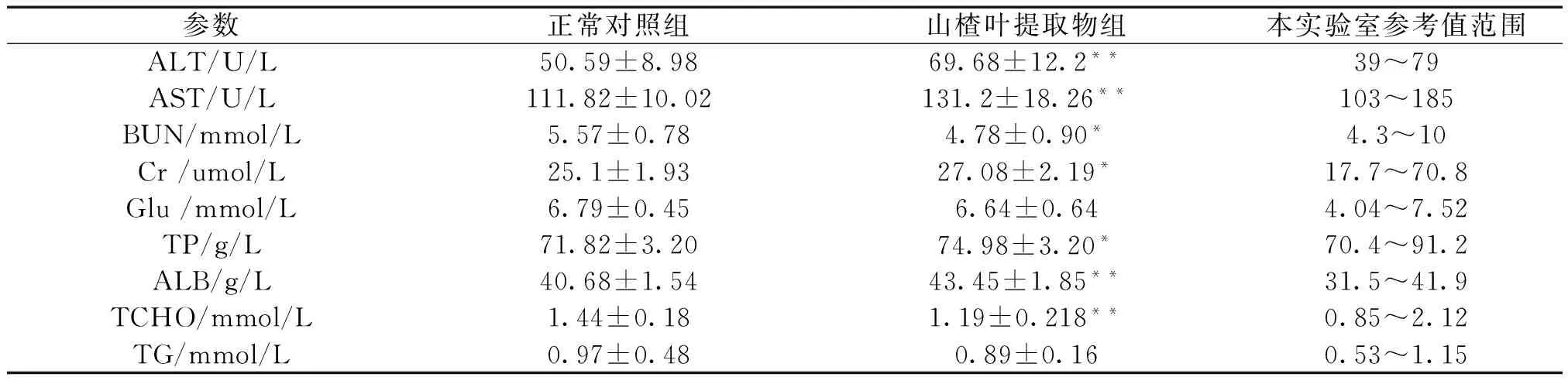
参数正常对照组山楂叶提取物组本实验室参考值范围ALT/U/L50.59±8.9869.68±12.2**39~79AST/U/L111.82±10.02131.2±18.26**103~185BUN/mmol/L5.57±0.784.78±0.90*4.3~10Cr/umol/L25.1±1.9327.08±2.19*17.7~70.8Glu/mmol/L6.79±0.456.64±0.644.04~7.52TP/g/L71.82±3.2074.98±3.20*70.4~91.2ALB/g/L40.68±1.5443.45±1.85**31.5~41.9TCHO/mmol/L1.44±0.181.19±0.218**0.85~2.12TG/mmol/L0.97±0.480.89±0.160.53~1.15
注:与正常组对照组比较,*P<0.05,**P<0.01。
2.5 大果山楂叶提取物对大鼠脏器指数的影响 大果山楂叶提取物可提高肝指数(P<0.05),但给药组肝指数在正常范围内,不属于药物引起的病理变化。肾指数、脾指数、睾丸指数相比较正常对照组无统计学差异(P>0.05)。见表5。


组别肝指数肾指数脾指数睾丸指数正常对照组2.59±0.340.73±0.040.21±0.190.92±0.07山楂叶提取物组2.92±0.27*0.74±0.080.14±0.020.93±0.10
注:与正常对照组比较,*P<0.05。
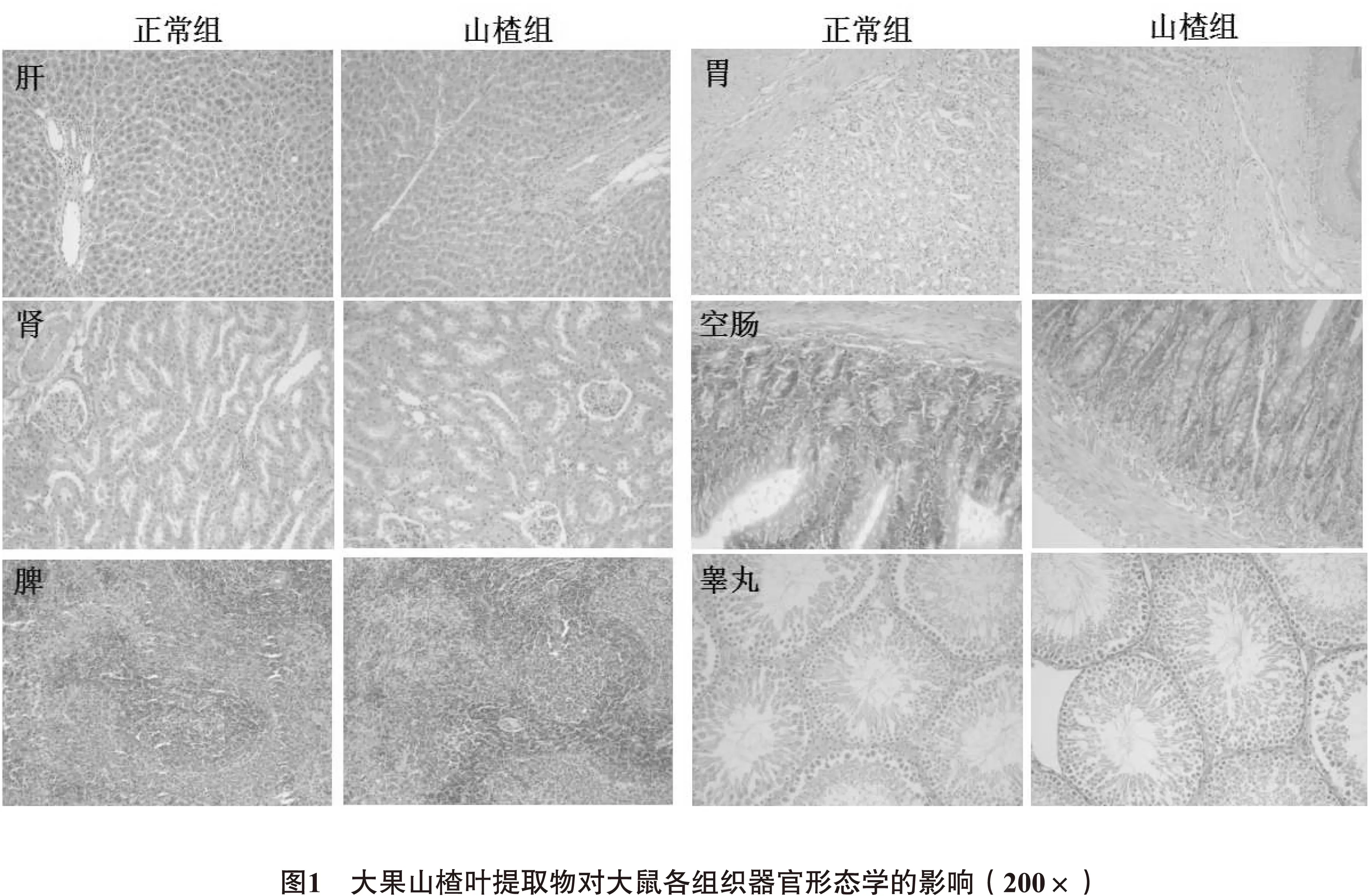
2.6 病理组织学检查 正常对照组和山楂叶提取物组大鼠大体解剖检查结果均未见明显异常,主要脏器镜检结果示:肝脏被膜结构正常,肝小叶结构完整清楚,肝细胞索排列整齐,围绕中央静脉呈放射状排列,毛细胆管及小叶间胆管未见增生、坏死,无胆汁淤积或单栓形成,未见纤维组织增生及假小叶形成。肾脏被膜结构正常,肾小球均匀分布,其毛细血管内皮细胞及及间质细胞未见增生纤维化。脾脏被膜结构正常,无纤维组织增生,及炎细胞浸润。脾小梁结构正常,脾小结散在均匀分布,内见有结构正常的中央动脉,红髓区淋巴细胞索网状分布,血窦隙及小血管无扩张淤血。胃、肠道黏膜未见糜烂、溃疡、增生、萎缩、出血及水肿,均可见黏膜层少量炎细胞浸润。睾丸白膜完整,组织结构正常。可见曲细精管,外围菲薄的基底膜,内衬以精原细胞,并可见初级精母细胞及次级精母细胞,大量成熟精子,初级精母细胞之间可见柱状之支持细胞。睾丸间质未见炎细胞浸润,未见萎缩及精子成熟障碍。如图1所示。
综合上述,病理观察结果显示,主要脏器未见异常,表明大果山楂叶提取物对上述脏器组织无损害作用。
3 讨论
大果山楂是为蔷薇科苹果属植物台湾林檎Malusdoumeri(Boris) chev. 的干燥成熟果实。其果实、叶与普通的北山楂不同,有研究报道北山楂果实和叶具有降血脂的效果,与山楂果实和叶当中含有的黄酮类物质有关[9-10]。有研究报道大果山楂中黄酮含量是普通北山楂的2倍[11-12],因此大果山楂在开发降血脂药物和保健品这方面很有研究价值。此前,金雪萍等[5]对林檎叶提取物的小鼠急性毒性实验进行了研究,潘莹等[6]对大果山楂总黄酮的小鼠急性毒性进行了研究,但是目前为止大果山楂叶提取物对大鼠的毒性实验研究尚未见有报道。为开发基于广西大果山楂叶提取物在治疗高血脂症方面的保健品,本研究根据国家食品药品监督管理局发布的《辅助降血脂功能评价方法》[8]要求,首先研究大果山楂叶提取物对雄性SD大鼠的长期毒性。结果显示,将大果山楂叶提取物以20g/(kg·d)(为临床推荐剂量的133倍)剂量给雄性大鼠连续灌胃30d,给药期间,实验组动物的外观行为、体重、脏器系数,与正常对照组比较均无统计学差异,血液学和血清生化学个别指标有差异但均在正常参考值范围内,主要脏器未见异常,表明该样品临床推荐剂量是安全的,为后续大果山楂叶的保健品开发提供了依据。
[1]潘莹,张林丽. 大果山楂的研究进展[J]. 时珍国医国药,2007,18(12):2972-2973.
[2] 广西壮族自治区食品药品管理局.广西壮族自治区壮药标准(2011年版)[S]. 南宁:广西科学技术出版社,2011:27.
[3] 林启云,潘晓春,方敏. 广西大果山楂药理作用研究[J]. 广西中医药,1990,13(3):45-46.
[4] 潘莹,张林丽. 大果山楂黄酮提取物对四氯化碳致大鼠慢性肝损伤的保护作用[J]. 时珍国医国药,2008,19(2):318-319.
[5] 金雪萍. 林檎叶提取物急性毒性实验研究[J]. 食品与机械,2004,20(2):16-17.
[6] 潘莹,林启云. 大果山楂黄酮护肝作用的实验研究[J]. 广西中医学院学报,2004,7(2):7-10.
[7] 国家食品药品监督管理局.中药、天然药物长期毒性研究技术指导原则[Z].
[8] 国家食品药品监督管理局.辅助降血脂功能评价方法[Z].
[9] Chunlei Fan, Jin Yan, Ying Qian, et al. Regulation of lipoprotein lipase expression by effect of hawthorn flavonoids on peroxisome proliferator response element pathway[J]. J Pharmacol Sci, 2006, 100(1): 51-58.
[10] Zhongping Li, Jiaoya Xu, Peiyong Zheng, et al. Hawthorn leaf avonoids alleviate nonalcoholic fatty liver disease by enhancing the adiponectin/AMPK pathway[J]. Int J Clin Exp Med,2015, 8(10): 17295-17307.
[11] 陈勇,甄汉深,董艺. 广山楂及其叶质量分析研究[J]. 时珍国医国药,1999,10(7):511.
[12] 陈勇,甄汉深,陆雪梅. 广山楂主要化学成分的定量研究[J]. 中药研究信息,2000,2(11):18.
The Long-term Toxicity of the Extract ofMalusDoumeri(Bois) Chev. Leaves from Guangxi in Rat
YIN Lijun1CHEN Lu1Liu Yu1MENG Lanlan2FANG Xiuling2LAN Mingsheng1WU Wuwei1*
1. Guangxi Botanic Garden of Medical Plants, Nanning 530023, China;2. Guilin Medical University, Guilin 541004, China
Objective To investigate the long-term toxicity of the leaf extract of Malus Doumeri(Bois) Chev.(LEM) from Guangxi in rat. Methods The rats were
orally in dose of 20g/kg/d(133 times the clinical recommended dose) for 30 days, where normal controls were treated orally with distilled water. The body weight, behavior and food intake were recorded daily. All rats were sacrificed after 30 days and biochemical and hematological analyses, as well as macro-and microscopic observations of several organs were performed. Results Compared with the normal control group, the body weight, behavior and food intake in LEM-treated rats groups showed no obvious differences. Some hematological and biochemical indexes of experiment rats showed statistically difference from control rats, but all within the normal reference range. Major organs of two groups of rats were similar and showed no obvious abnormalities. Conclusion In summary, the leaf extract of Malus Doumeri(Bois) Chev.(LEM) samples showed no obvious toxicity on rats, the clinical recommended dose is safe.
Malus Doumeri(Bois) Chev.;Toxicity;Hematology;Serum biochemistry;Organ Index;Histopathology
广西特聘专家专项经费;广西科技计划项目(桂科AD16380013)。
尹利君,女,硕士研究生,研究实习员,研究方向为中草药抗病毒。E-mail: 734292146@qq.com
吴无畏,男,博士研究生,副研究员,研究方向为中草药抗病毒。E-mail: wuweiwu2013@163.com
R285.5
A
1007-8517(2017)15-0062-04
2017-05-26 编辑:陶希睿)

