半夏泻心汤不同配伍组分对伊立替康致小鼠迟发性腹泻的影响
史家文,关焕玉,何 洋,王小明,覃文婷,3,雒晓梅,宿美凤,3,岳佳菁,石 钺
(1.中国医学科学院药用植物研究所,北京 100193; 2.山东省泰安市中心医院,山东 泰安 271000;3.北京中医药大学中药学院,北京 100102)
·实验研究·
半夏泻心汤不同配伍组分对伊立替康致小鼠迟发性腹泻的影响
史家文1,2,关焕玉1,何 洋1,王小明1,覃文婷1,3,雒晓梅1,宿美凤1,3,岳佳菁1,石 钺1
(1.中国医学科学院药用植物研究所,北京 100193; 2.山东省泰安市中心医院,山东 泰安 271000;3.北京中医药大学中药学院,北京 100102)
目的 观察半夏泻心汤不同配伍组分对伊立替康所致小鼠迟发性腹泻的防治效果,并探讨其配伍机制。方法 给ICR小鼠腹腔注射伊立替康40 mg/kg,连续4 d,复制伊立替康所致小鼠迟发性腹泻。将健康雌性ICR小鼠90只随机分为正常组、模型组、阳性药组、半夏泻心汤全方组(简称全方组)及5种不同配伍组分组,各10只。腹泻模型造模方法同上,正常组腹腔注射等体积生理盐水,阳性药组、全方组及5种不同配伍组分组于注射伊立替康前4 d开始,每天1次灌胃给药,共用药8 d。对各组大鼠腹泻情况进行评分,记录体质量;实验小鼠于第8天处死,取盲肠及结肠组织,光镜下观察肠黏膜组织结构,测定肠道 -葡萄糖醛酸酶的活性和血清白细胞介素15(IL-15)水平。结果 小鼠腹腔注射伊立替康后均出现明显的腹泻,全方组、苦寒组、辛温+苦寒组、苦寒+补益组腹泻指数较模型组明显降低(P<0.01),体质量下降得到明显改善,且光镜下肠黏膜损坏程度较模型组轻微,小肠内容物 -葡萄糖醛酸酶活性降低(P<0.01),血清IL-15水平升高。结论 半夏泻心汤全方组及苦寒组、辛温+苦寒组、苦寒+补益组分对伊立替康所致小鼠迟发性腹泻具有良好的预防作用,也体现了该方“寒热同调”的配伍特点。
伊立替康;迟发性腹泻;半夏泻心汤;配伍机制
迟发性腹泻是伊立替康(irinotecan,CPT-11)临床剂量的限制性毒性反应,研究表明,接受本品治疗的患者可出现3~4度腹泻,并致化学治疗(简称化疗)方案提前终止的比例超过40%[1-2],如何预防和治疗迟发性腹泻成为近些年肿瘤临床研究的一个热门课题。临床已证实,半夏泻心汤能有效预防CPT-11所致迟发性腹泻[3-4],但其作用机制尚不明确。半夏泻心汤出自张仲景所著《伤寒杂病论》,为泻心汤类代表方,由半夏、黄芩、干姜、党参、炙甘草、黄连、大枣7味中药组方,具有调和肝脾、寒热平调、消痞散结功效,用药具有寒热、苦辛、补泻并用的特点。前期研究表明,半夏泻心汤可通过改变CPT-11及其代谢物的药代动力学参数发挥防治CPT-11所致迟发性腹泻的作用[5]。本研究中着重考察了半夏泻心汤及其不同配伍组分(辛温、苦寒和补益)对迟发性腹泻的改善作用,同时对其配伍机制进行了初步探讨,现报道如下。
1 动物与试药
1.1 试验动物
ICR小鼠90只,清洁级,雌性,体质量30~35 g(北京维通利华实验动物技术有限公司,合格证号为SCXK 2013007),动物饲养房间(SPF级)内的温度控制在(25±1)℃,相对湿度为55% ~70%,12 h光照和12 h黑暗交替,给予普通饲料,自由饮水。适应性喂养7 d,实验前12 h禁食不禁水。实验遵循动物伦理学原则。
1.2 药材与药品
清半夏(pinellia ternate)、黄芩(scutellaria baicalensis)、黄连(coptis chinensis)、炙甘草(glycyrrhiza uralensis)、干姜(zingiber officinale)、党参(codonopsis pilosula)和大枣(ziziphus jujuba)均购自北京华邈中药工程技术开发中心;CPT-11注射液(CAMPTO,美国辉瑞公司,进口药品注册证号H20080574,批号为EJ23M);盐酸洛哌丁胺胶囊(西安杨森制药公司,批号为130219290)。
1.3 半夏泻心汤及其不同配伍组分的制备
1.3.1 全方提取物
按处方比例称取清半夏、黄芩、黄连、炙甘草、干姜、党参和大枣,加8倍量水,冷浸30 min,微沸回流40 min,倾出药液,再加6倍量水,微沸回流30 min,倾出药液,合并2次的药液,滤纸过滤,减压浓缩,冷冻干燥,备用。
1.3.2 各配伍组提取物
按各单味药在复方中的配比,分别称取各单味药,加8倍量水,冷浸30 min,微沸回流40 min,倾出药液,再加6倍量水,微沸回流30 min,倾出药液,合并2次的药液,滤纸过滤,减压浓缩,冷冻干燥,制成辛温组(半夏+干姜)、苦寒组(黄芩 +黄连)、辛温 +苦寒组(半夏+干姜+黄芩+黄连)、辛温+补益组(半夏+干姜+党参+大枣+甘草)和苦寒+补益组(黄芩+黄连+党参+大枣+甘草),备用。
2 方法与结果
2.1 动物分组及给药
将90只小鼠随机分为正常组、模型组、阳性药组、半夏泻心汤全方组(简称全方组)及辛温组、苦寒组、辛温+苦寒组、辛温+补益组、苦寒+补益组,各10只。正常组:蒸馏水等量灌胃,1次/天,第4天起腹腔注射等体积生理盐水,连续用药 4 d;模型组:以 CPT-11 (40 mg/kg)代替生理盐水,其余与正常组同步处理;阳性药组:以洛哌丁胺悬浊液代替蒸馏水[按正常人(体质量70 kg)每日最大药量18 mg计算小鼠所需口服药量],其余与模型组同步处理;全方组:以半夏泻心汤全方代替蒸馏水(按小鼠等效剂量的4倍计算半夏泻心汤提取物的每天用量),其余与模型组同步处理;辛温组、苦寒组、辛温+苦寒组、辛温+补益组、苦寒+补益组:以各配伍组提取物代替半夏泻心汤全方(按小鼠等效剂量的4倍及在原方中的比例计算半夏泻心汤热药组提取物的每天用量),其余与全方组同步处理。
2.2 腹泻情况观察
末次腹腔注射CPT-11后出现的腹泻为迟发性腹泻,每天观察各组小鼠迟发性腹泻状况6 h。腹泻评定按照《药理实验方法学》[6],以腹泻指数作为评定腹泻的主要指标。1)腹泻率:一组动物中排稀便的动物占该组动物总数的百分率;2)稀便率:每只动物所排的稀便数与总便数之比;3)稀便级:表示稀便程度,以稀便污染滤纸形成污染面积的大小定级;4)腹泻指数:稀便率与稀便级的乘积。数据分析采用 t检验。末次CPT-11注射后24 h内,模型组大部分小鼠解淡黄色稀便,阳性药组、全方组及苦寒+补益组稀便不明显,其余各组部分小鼠解淡黄色稀便,计算各组小鼠的腹泻指数,结果见表1。
24 h后,模型组小鼠腹泻率达到100.00%,并持续到实验结束。与模型组比较,全方组、苦寒组、辛温+苦寒组、苦寒+补益组和阳性药组腹泻指数明显降低(P<0.01),辛温组和辛温+补益组腹泻指数无显著性差异;与阳性药组比较,全方组、苦寒组、辛温+苦寒组和苦寒+补益组腹泻指数无统计学差异,辛温组和辛温+补益组腹泻指数显著升高(P<0.05)。
腹泻指数的变化与小鼠体质量的变化基本一致,小鼠体质量变化见表2。
2.3 肠组织学观察
于第8天处死小鼠,剥离小肠,盲肠连同结肠上段约 2 cm处切断取下,用生理盐水冲洗干净,快速置10%福尔马林溶液中固定,组织经修块,梯度酒精脱水,石蜡包埋,切片厚度5 μm,常规苏木素-伊红(HE)染色,光学显微镜下观察小鼠肠黏膜组织结构的变化。结果发现,正常组肠壁各层结构清晰,黏膜内腺体形态规则,腺体间质未见明显异常。模型组的盲肠和结肠均出现肠黏膜上皮细胞变性坏死,杯状细胞增多,黏膜下层水肿,少量炎性细胞浸润等病变。阳性药组肠壁各层结构清晰,黏膜内腺体形态规则,腺体间质未见明显异常。全方组有1例结肠黏膜上皮细胞发生肿胀变性,1例结肠杯状细胞增多,其余各受检脏器未见明显病理改变。其他组盲肠和结肠出现不同程度的组织病理变化,其中苦寒组、辛温+苦寒组、苦寒+补益组动物病变缓解较明显,表现为上皮肿胀变性,杯状细胞增多,水肿等轻微病变;辛温组及辛温+补益组小鼠肠形态病变缓解作用轻微,表现为肠黏膜上皮细胞变性坏死,杯状细胞增多,黏膜下层水肿,少量炎性细胞浸润等病变。
表1 各组小鼠腹泻指数比较(±s,n=10)
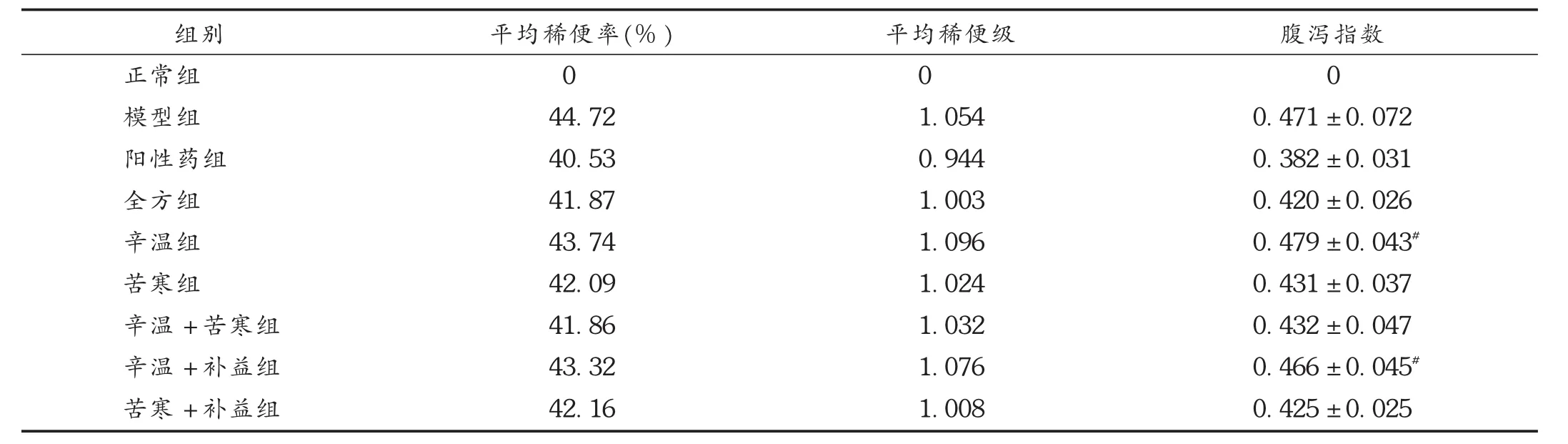
表1 各组小鼠腹泻指数比较(±s,n=10)
注:与模型组比较, P<0.01;与阳性药组比较,#P<0.05。
组别正常组模型组阳性药组全方组辛温组苦寒组辛温+苦寒组辛温+补益组苦寒+补益组平均稀便率(%)0 44.72 40.53 41.87 43.74 42.09 41.86 43.32 42.16平均稀便级0 1.054 0.944 1.003 1.096 1.024 1.032 1.076 1.008腹泻指数0 0.471±0.072 0.382±0.031 0.420±0.026 0.479±0.043#0.431±0.037 0.432±0.047 0.466±0.045#0.425±0.025
表2 各组小鼠体质量变化比较(±s,g,n=10)

表2 各组小鼠体质量变化比较(±s,g,n=10)
组别正常组模型组阳性药组全方组辛温组苦寒组辛温+苦寒组辛温+补益组苦寒+补益组第1天32.63±1.12 32.63±1.57 32.80±1.85 32.30±1.01 32.08±1.17 31.48±1.97 32.00±1.10 31.73±1.77 32.30±1.54第5天33.10±2.10 31.66±1.06 31.05±2.09 31.84±1.01 31.58±1.66 29.82±1.91 30.93±1.46 31.49±1.81 31.62±2.07第8天33.13±2.10 26.99±2.11 31.84±1.38 31.90±1.49 27.01±2.03 27.80±2.49 28.81±1.87 28.96±3.25 31.72±2.50体质量变化0.50±0.12-5.64±2.42-0.86±1.30-0.65±1.82-0.16±0.05-0.12±0.07-3.43±1.98-2.77±2.87-0.58±1.25
2.4 肠道 -葡萄糖醛酸酶测定
取盲肠、结肠内容物,称定质量,用9倍生理盐水匀浆,以4 000 r/min的速率离心10 min,得到肠内容物匀浆上清,分离上清液,置无菌EP管中,进行酶联免疫吸附检测法(ELISA)检测,检测方法和步骤严格按照试剂盒附件说明书进行。光密度(OD)值测定:应用酶标仪(MQx200型微孔板酶标仪)在405 nm波长处测定β-葡萄糖醛酸酶的 OD值,绘制β-葡萄糖醛酸酶标准曲线(r=0.999 7),根据标准曲线计算待测肠道中β-葡萄糖醛酸酶的活性。数据分析采用 t检验,结果见表3。结果显示,与模型组相比,全方组、苦寒组、辛温+苦寒组、苦寒+补益组酶活性显著降低(P<0.01),其中苦寒+补益组与全方组作用相当。
表3 各组小鼠 -葡萄糖醛酸酶活性比较(±s,U/mL,n=10)

表3 各组小鼠 -葡萄糖醛酸酶活性比较(±s,U/mL,n=10)
注:与模型组比较, P<0.01;与苦寒组比较, P<0.01。
组别正常组模型组阳性药组全方组辛温组苦寒组辛温+苦寒组辛温+补益组苦寒+补益组-葡萄糖醛酸酶638.21±14.40 632.28±29.52 238.33±15.68 322.18±12.28 645.92±39.66 399.32±45.07 403.45±47.66 647.96±36.78 327.14±22.19
2.5 血清白细胞介素15(IL-15)测定
小鼠于第8天脱臼处死前,摘眼球取血0.5 mL,室温静置1 h,4℃下以3 000 r/min的速率离心15 min,分离血清,进行ELISA检测。检测方法和步骤严格按照试剂盒附件说明书进行。OD值测定:应用酶标仪(MQx200型微孔板酶标仪)在 450 nm波长处测定IL-15的 OD值,绘制IL-15标准曲线(r=0.999 2),根据标准曲线计算待测血清中IL-15水平。数据分析采用 t检验,结果见表4。结果显示,与正常组比较,模型组、辛温组、辛温+补益组IL-15水平明显降低(P<0.01);与模型组相比,全方组、苦寒组、辛温+苦寒组、苦寒+补益组的IL-15水平明显升高(P<0.01)。
表4 各组小鼠血清IL-15水平比较(±s,pg/mL,n=10)

表4 各组小鼠血清IL-15水平比较(±s,pg/mL,n=10)
注:与正常组比较, P<0.01;与模型组比较, P<0.01。
组别正常组模型组阳性药组全方组辛温组苦寒组辛温+苦寒组辛温+补益组苦寒+补益组IL-15 89.66±6.07 49.40±9.74 80.91±8.68 190.93±15.83 54.42±5.92 140.96±10.32 157.87±22.99 50.11±7.76 186.87±16.19
3 讨论
迟发性腹泻是化疗药CPT-11的常见不良反应,影响化疗进程和生存质量。目前认为,其发生机制主要是CPT-11在肝羧基酯酶作用下转化为活性代谢产物SN-38,后者随胆汁排泄至肠腔,重吸收时产生肠毒性,发生迟发性腹泻,同时造成肠黏膜免疫屏障功能的损伤[7]。
本研究中按 Melo方法[8],对 ICR小鼠腹腔注射CPT-11造模进行了考察,结果表明,剂量调整至40 mg/kg进行腹腔注射时,连续用药4 d,小鼠一般在用药后第4天开始腹泻,第5天腹泻率达100.00%,平均腹泻次数约为16次/天,建立的模型结果与大鼠迟发性腹泻模型一致[9]。采用腹泻指数评价腹泻等级,既能兼顾稀便量的变化,又能考虑到质的因素,使观察指标较全面、客观。选择ICR小鼠,腹腔给药,用腹泻指数评定,可提供一种成本可以接受、观察指标全面客观的CPT-11迟发性腹泻模型。
有研究认为,CPT-11肠毒性的发生机制是由其活性代谢物SN-38对肠黏膜的直接组织损伤引起。SN-38通过干扰DNA的拓扑异构酶Ⅰ(TopoⅠ)而对肠黏膜产生毒性作用[10]。肠道内的细菌和羧酸酯酶在肠黏膜损伤机制中起重要作用,研究揭示了细菌β-葡萄糖醛酸酶在迟发性腹泻发生中的作用,肠道微生物菌群能在肠道中将SN-38G转化为SN-38,从而导致肠黏膜损害[11]。实验大鼠预防性应用抗生素,能降低肠腔内SN-38的浓度,并减少腹泻的发生,缓解体质量的减轻[12]。
IL-15是与IL-2功能相似的免疫抗炎性因子,可促进B细胞的分化增殖,诱导自然杀伤(NK)细胞增殖、细胞因子产生,与IL-12协同作用对增强NK细胞的功能和机体免疫力有重要作用。有研究发现,IL-15可降低CPT-11所致腹泻的发生率,并防止十二指肠微绒毛的缩短和破坏,减轻结肠隐窝杯状细胞的损伤[13]。
研究显示,中医药在治疗CPT-11所致迟发性腹泻中显现出独特的疗效,以整体观为指导,运用脏腑辨证、气血津液辨证的理论,可明显改善化疗所致肠毒性出现的腹泻、腹痛,改善患者的生存质量[14-15]。中医中药的成分及其配伍规律相对复杂,而相关的现代药理实验研究较少,仍然处在探索阶段。半夏泻心汤组方寒热并用,辛开苦降,具有和胃降逆、开结除痞、补气和中等功效,对于肠的运动功能有双相调节作用,可使异常运动的肠道功能趋于正常。
本研究中,在成功建立小鼠迟发性腹泻模型的基础上,从腹泻指数、肠组织学病理变化、肠道β-葡萄糖醛酸酶活性、血清IL-15水平多个角度,考察了半夏泻心汤及不同配伍组分的相互作用。结果显示,半夏泻心汤全方组、苦寒组、辛温+苦寒组、苦寒+补益组的小鼠体质量减轻较小,腹泻指数降低;盲肠和结肠HE染色肠黏膜情况发生的病变较轻,提示半夏泻心汤及其不同配伍组分灌胃给药后,对肠黏膜结构损伤的病理变化有不同程度的治疗作用,治疗效果由强到弱依次为:全方组>苦寒+补益组>辛温+苦寒组>苦寒组>辛温+补益组>辛温组,可见,半夏泻心汤全方的作用不可替代,苦寒组与补益组或辛温组配伍,具有增效作用;肠道β-葡萄糖醛酸酶活性降低;血清IL-15水平升高。提示半夏泻心汤具有防治CPT-11所致迟发性腹泻的作用,全方使用效果最好,苦寒组(黄芩+黄连)在预防迟发性腹泻方面起主导作用,而在保护肠黏膜结构、降低肠道β-葡萄糖醛酸酶活性、增高血清IL-15水平方面,苦寒组与补益组或辛温组配伍,则具有增效作用,体现出半夏泻心汤“寒热同调”(黄芩 +黄连,半夏+干姜)、“相须相使”(黄芩+黄连)的配伍特点。
目前的多数研究认为,CPT-11化疗后腹泻可能与UGT1A1基因的多态性及肠道菌群的改变有关。有研究表明,UGT1A1基因多态性可降低UGT1A1活性,从而对SN-38的灭活能力下降,肠道内大量聚集的具有肠黏膜毒性的 SN-38,可直接作用于肠上皮细胞内TopoⅠ,引起DNA双链断裂,肠上皮细胞坏死、凋亡,进而破坏小肠黏膜结构,引起小肠吸收功能和分泌功能紊乱,导致腹泻发生[16]。病理学主要表现为肠壁变薄,伴空腔形成、血管扩张、炎细胞浸润及回肠细胞凋亡,小肠绒毛萎缩,肠黏膜损害,通常以结肠和盲肠段的损伤更严重[17]。国外的研究表明,CPT-11化疗所致腹泻还与肠道细菌产生的β-葡萄糖醛酸酶有关[18],SN-38G易被β-葡萄糖醛酸酶水解,重新转变成SN-38,损伤肠道黏膜,引起腹泻[19]。因此,产β-葡萄糖醛酸酶的细菌及β-葡萄糖醛酸酶均参与了CPT-11化疗所致迟发性腹泻的发生。之前对生姜泻心汤的相关研究结果显示,降低肠道β-葡萄糖醛酸苷酶的活性,促进小鼠血清中IL-15的表达,提升UGT1A1蛋白的表达,从而降低肠道SN-38的浓度和接触时间,维持肠道正常结构和功能,可能是生姜泻心汤治疗CPT-11导致结直肠癌小鼠迟发性腹泻多作用靶点的体现[20]。半夏泻心汤与生姜泻心汤为类同方,药味组方基本相同,从而推测,半夏泻心汤在治疗CPT-11所致迟发性腹泻中也应具有类似的作用机制。
[1]Limonti A,Gelibtter A,Pavese I,et al.New approaches to prevent intestinal toxicity of irinotecan-based regimens[J].Cancer Treat Rev,2004,30(6):555-562.
[2]关忠霞,孙晓非,冯奉仪,等.伊立替康治疗晚期大肠癌临床研究[J].癌症,1999,18(6):686-690.
[3]Mori K,Kondo T,Kamiyama Y,et al.Preventive effect of Kampo medicine(Hangeshashinto)against irinotecan-induced diarrhea in advanced non-small-cell lung cancer[J].Cancer Chemother Pharmacol,2003,51(5):403-406.
[4]卢红阳,马胜林.半夏泻心汤对依立替康致小细胞肺癌荷瘤鼠腹泻的改善作用及机理研究[J].中华中医药学刊,2009,27(5):1082-1084.
[5]史家文,闫利利,关焕玉,等.LC-ESI-MS/MS法研究半夏泻心汤对大鼠体内伊立替康药代动力学影响[J].中华中医药学刊,2015,33(9):2118-2123.
[6]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:1342-1343.
[7]张 梅,李 平.加味半夏泻心汤预防伊立替康所致延迟性腹泻的临床研究[J].安徽医药,2008,12(11):1073-1074.
[8]Melo ML,Brito GA,Soares RC,et al.Role of cytokines(TNF-alpha,IL-l beta and KC)in the pathogenesis of CPT-11-induced intestinal mucositis in mice:effect of pentoxifylline and thalidomide[J].Cancer Chemother Pharmacol,2008,61(5):775-784.
[9]邓海燕,贾立群,潘 琳,等.生姜泻心汤预防伊立替康所致迟发性腹泻的实验研究[J].中日友好医院学报,2006,20(6):344-347.
[10]Dranitsaris G,Shah A,Spirovski B,et al.Severe diarrhea in patients with advanced-stage colorectal cancer receiving FOLFOX or FOLFIRI chemotherapy:the development of a risk Prediction tool[J].Clin Colorectal Cancer,2007,6(5):367-373.
[11]Ikuno N,Soda H,Watanabe M,et al.Irinotecan(CPT-11)and character isticmucosal changes in thrmouseileum and cecum[J].J Natl Cancer Inst,1995,87(24):1876-1883.
[12]Takasuna K,Hagiwara T,Hirohashi M,et al.Inhibition of intestinal microflora beta-glucuronidase modifies the distribution of the active metabolite of the antitumor agent,irinotecan hydrochloride(CPT-11)in rats[J].Cancer Chemother Pharmacol,1998,42(4):280-286.
[13]Cao S,Black JD,Troutt AB,et al.Interleukin-15 offers selective protection from irinotecan-induced intestinal toxicity in a preclinicalanimalmodel[J].CancerRes,1998,58(15):3270-3274.
[14]闫利利,石 钺.中医药防治伊立替康肠毒性的研究进展[J].中华中医药学刊,2013,31(3):501-503.
[15]王海艳,霍介格,王小宁.中医药防治伊立替康所致迟发性腹泻研究述评[J].中医学报,2016,31(10):1455-1460.
[16]方青芳.化疗相关性腹泻的发生机制和治疗策略[J].中国临床药理学与治疗学,2009,14(3):351-355.
[17]张秀萍.益生菌防治化疗相关性腹泻的临床现状及其作用机制[J].中华医学杂志,2013,93(32):2600-2601.
[18]Wallace BD,Roberts AB,Pollet RM,et al.Structure and inhibition of microbiome -glucuronidases essential to the alleviation of cancer drug toxicity[J].Chem Biol,2015,22(9):1238-1249.
[19]Lin XB,Dieleman LA,Ketabi A,et al.Irinotecan(CPT-11)chemotherapy alters intestinal microbiota in tumor bearing rats[J].PLoS One,2012,7(7):e39764.
[20]彭 罡,关焕玉,王小明,等.生姜泻心汤治疗伊立替康导致的结直肠癌小鼠迟发性腹泻[J].中成药,2017,39(3):475-479.
Clinical Evaluation of Different Combinations of Banxia Xiexin Decoction for Treating Delayed Diarrhea Caused by Irinotecan in Mice
Shi Jiawen1,2,Guan Huanyu1,He Yang1,Wang Xiaoming1,Tan Wenting1,3,Luo Xiaomei1,Su Meifeng1,3,Yue Jiajing1,Shi Yue1
(1.Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing,China 100193;2.Tai′an City Central Hospital,Tai′an,Shandong,China 271000; 3.College of Traditional Chinese Pharmacy,Beijing University of Traditional Chinese Medicine,Beijing,China 100102)
Objective To observedifferent combinations of Banxia Xiexin Decoction(BXD) for treating delayed diarrhea caused by irinotecan(CPT-11)in mice,and to investigate the mechanism of compatibility.Methods ICR mice were intraperitoneal injected with CPT-11 40 mg/kg for 4 consecutive to establish models of delayed diarrhea.Totally 90 ICR female mice were randomly assigned to normal group,model group,positive drug group,BXD group,and 5 different compatibility groups,10 cases in each group.The diarrhea models were established as the same above.The normal group was injected with the same amount of normal saline instead of CPT-11,and the positive drug group,BXD group,and different compatibility groups were treated with loperamide hydrochloride every day respectively for 8 days starting 4 days before CPT-11 was injected.The diarrhea index of each group was calculated and their body weight was recorded.Mice were killed on the 8th day after experiments and intestinal tissues were removed for histological studies.Contents of serum IL-15 and β-glucuronidase of intestine were investigated.Results Delayed diarrhea after injected CPT-11 was observed on mice.Compared to model group,the diarrhea index of mice for BXD group,Kuhan group,Xinwen + Kuhan group,and Kuhan + Buyi group were obviously decreased(P<0.01),the weight loss also had obvious improvements,and the damage degree of intestinal mucosa under light microscope was milder than that in the model group,the content of β-glucuronidase of intestine were significantly decreased(P<0.01),the levels of serum IL-15 were increased.Conclusion BXD group,Kuhan group,Xinwen + Kuhan group and Kuhan + Buyi group can prevent the delayed diarrhea caused by CPT-11.The results reflected the characteristics of″symptoms caused by cold factors and symptoms caused by heat factors were recuperated at the same time″in Banxia Xiexin Decoction.
irinotecan;delayed diarrhea;Banxia Xiexin Decoction;mechanism of compatibility
R285.5
A
1006-4931(2017)16-0001-05
2017-01-24;
2017-05-24)
10.3969/j.issn.1006-4931.2017.16.001
国家自然科学基金项目[81274054];“重大新药创制”科技重大专项[2012ZX09301002-001-027]。
史家文(1988-),男,山东泰安人,博士研究生,研究方向为中药药效物质基础,(电子信箱)jiawen86712@163.com。
石钺(1963-),男,河北张家口人,研究员,博士研究生导师,研究方向为中药药效物质基础及其质量控制,(电子信箱)yshi@implad.ac.cn。

