霜霉菌诱导葡萄叶中白藜芦醇积累的氧化还原调控规律研究
董锦蕾,张闪闪,王晓琴,张波*
(石河子大学药学院/省部共建新疆特种资源植物药重点实验室,新疆 石河子,832002)
霜霉菌诱导葡萄叶中白藜芦醇积累的氧化还原调控规律研究
董锦蕾,张闪闪,王晓琴,张波*
(石河子大学药学院/省部共建新疆特种资源植物药重点实验室,新疆 石河子,832002)
本文针对霜霉菌侵染葡萄叶过程中植保素积累与活性氧调控规律开展研究。选取7月龄的红地球葡萄叶片,鉴定并分离霜霉病菌对离体的葡萄叶片在20℃黑暗条件下进行侵染处理。HPLC法分析侵染时间与白藜芦醇的含量的时效关系,检测侵染后细胞活性氧积累时效关系,分析茋类物质合成途径限速酶基因的表达时效关系,最后通过助氧化剂及抗氧化剂的正反验证来确定霜霉菌对葡萄白藜芦醇的诱导规律。结果表明,霜霉菌侵染离体葡萄叶片活性氧与白藜芦醇积累呈现时效关系的顺序性,活性氧水平24 h时达到最高,白藜芦醇叶鲜重含量72 h达到最高(59.46 μg/g);侵染过程中白藜芦醇合成途径下相关酶STS基因表达明显上调,而PAL、C4H和4CL的酶基因表达量在24 h或48 h最高;助氧化剂H2O2和FeCl3前处理组叶片白藜芦醇含量增加,抗氧化剂NAC和GSH-EE前处理组白藜芦醇含量减少,提示霜霉菌诱导白藜芦醇积累与活性氧调控密切相关。
白藜芦醇;霜霉菌;茋类合成途径;ROS积累;美国红地球葡萄
在植物与病原菌互作过程中,病原菌通过分泌酶或毒素类物质实现侵染,植物则通过表达抗病基因,进而产生抗菌物质,从而来抵抗病原菌的侵染。正常生理条件下,植物机体内ROS的产生与清除处于动态平衡状态,其内环境氧化还原状态是相对稳定的,来维持机体的相对平衡。
但植物受外界刺激(如生物因素和非生物因素)时,这个平衡就会被打破,植物会应激产生大量的ROS从而导致ROS水平迅速上升,这种 ROS的大量增加称为氧化爆发。氧爆发是植物防卫系统开启的标志之一,在逆境胁迫时其中以H2O2的含量为氧爆发最普遍特征[1]。如李欣龙等人[2]发现当用霜霉菌侵染葡萄叶片时,白藜芦醇的含量明显增加且内源性H2O2的含量也显著升高。
白藜芦醇(Resveratrol,简称 Res),主要存在于虎杖、花生、葡萄等植物中。白藜芦醇与植物抗病性具有密切的关系,在动物体上又具有良好的抗炎、抗氧化等作用。
课题组前期研究白藜芦醇运用的诱导因子有UV[3]、AlCl3[4]、H2O2[5]和 FeCl3[6]等,在葡萄叶片及其愈伤组织中诱导白藜芦醇的积累具有显著效果,但各自都具有一些局限性,不能很好的被广泛应用。即使是作为植物中的基本元素且低毒所出现的FeCl3溶液,也不能够将白藜芦醇完全从提取液中分离出来,主要原因是由于植物体内本身含有大量的糖分。针对这一点,本文利用微生物发酵过程中需要大量的糖来维持发酵,从而诱导葡萄叶片中的茋类物质。
在植物的生长发育过程中,茋类物质不仅受到一些自然环境因素(气候和环境)的影响,也会因为一些生物因子而受影响,如病原菌的侵染等。当植物受到病原菌侵染时,植物往往会表达其体内的抗病基因使抗菌物质积累从而抵御病原菌的侵染。
马勉娣等[7]研究发现从不同品种不同地区分离大量的内生真菌,外施内生真菌也证明可以有效改变葡萄叶片的内生菌群结构和提高葡萄果实中一些次生代谢产物含量。Kretschmer等[8]通过研究葡萄果皮感染葡萄灰霉病后PAL和STS基因表达变化再次证实了葡萄果实Res合成能力与感染葡萄灰霉病的相关关系。Pezet R等[9]比较研究了不同葡萄品种对霜霉菌(Plasmopara viticola)的抗性,发现敏感品种感染病菌后产生的大量Res迅速糖基化为较小毒性的白藜芦醇苷(piceid,PD),而抗性品种感染病菌后产生的大量Res则迅速氧化为更高毒性的白藜芦醇聚合体(viniferins)。
作为葡萄的第一产区,找到一种合理有效的方法诱导葡萄中白藜芦醇的积累,并提取出来在实际应用中具有重要意义。
1 材料与方法
1.1 材料
1.1.1 同龄孢子囊的获取
实验前1 d的20:00-21:00在石河子大学试验站葡萄园感病品种红地球葡萄(Vitis vinifera L.cv.Red Globe)上采集典型新鲜的霜霉病(Plasmopara viticola(Berk.et Curtis)Berl.et de Toni)叶片,用流水冲洗10 min,直至霉层完全冲净,室温下放置10 min,使叶片表面无明显水分,然后在保湿缸中20℃黑暗条件下保湿培养12 h,待病部生长出新的孢子囊,即视为同龄孢子囊[10]。
1.1.2 供试品种
供试品种为感病品种红地球葡萄。3年生红地球葡萄苗(Vitis vinifera L.cv.Red Globe)购自新疆石河子葡萄研究所,于石河子大学北区农学实验站培育(25℃);实验选取7月龄葡萄茎上距顶尖第4或第5叶(大小相近)摘取后(含叶柄)避光保存[11]。
1.2 试剂
白藜芦醇标准品(色谱纯,美国Sigma-Aldrich公司);甲醇(AR,天津市富宇精细化工有限公司)、乙腈(色谱纯,美国 Fisher公司);FeCl3(AR,天津盛奥化学试剂有限公司);谷胱甘肽乙酯(GSH-EE,美国Sigma公司)、N-乙酰-L-半胱氨酸(美国Sigma公司);其余试剂均为分析纯,稀释及空白处理中的水为实验室制备双蒸水。
1.3 方法
1.3.1 霜霉菌对葡萄叶片的侵染
将制备的新鲜同龄孢子囊用小排笔刷到灭菌的平皿中加无菌水混匀制成悬液,将悬液倒入喷壶中备用。将灭菌的培养皿底部放置同底大小滤纸,并用无菌水润湿。将孢子囊悬液喷于葡萄叶片背面,置于培养皿中封口培养。培养条件:温度20℃,湿度90%,于气候箱中避光培养3~5 d,侵染过程如图1所示。

图1 感染霜霉菌的叶片(400×)Fig.1 Leaves infected with downy mildew(400×)
1.3.2 霜霉菌发酵液的制备
将培养好的新鲜同龄孢子囊用小排笔刷到灭菌的平皿中加无菌水混匀制成悬液,用血球计数的方法计算菌液中霜霉菌孢子数,调节菌液孢子数至107个/mL待用。
将孢子囊悬液喷洒于葡萄叶片背面,置于装有50 mL灭菌水的三角锥形瓶中封口培养。培养条件:温度20℃恒温摇床中避光震荡培养0、24、48和72 h的相同时间点进行取样,液氮速冻后保存于-80℃冰箱备用。前处理实验分组与流程参考表1,其中 NAC的浓度为 1 mmol/L[12],GSH-EE的浓度为 2 mmol/L(表 1)。
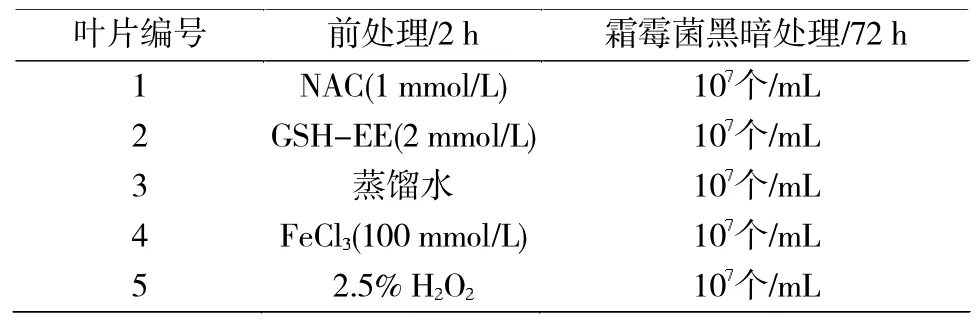
表1 抗氧化剂和助氧化剂的处理方式Tab.1 Antioxidants and Auxiliary oxidant treatment
1.3.3 叶片组织中ROS积累测定
定量检测叶片组织中H2O2:提取叶片细胞间隙液,提取方法参考 Sutherland等人[13],测定 560 nm(或595 nm)处吸光度值。具体方法参照上海生工生物工程股份有限公司的过氧化氢定量分析试剂盒推荐方法。
1.3.4 白藜芦醇的提取和检测
分别于0、24、48、72和96 h采集发酵后的葡萄叶片,将称重后的葡萄叶片加适量甲醇,研磨,超声提取20 min,振荡离心,提取3次,再将3次提取的上清液收集蒸干,干样品用甲醇溶解,并用甲醇定容至10 mL容量瓶中。通过HPLC法对葡萄叶片发酵液中的白藜芦醇进行定量分析,参照田春芳等[14]的方法。上述操作均在避光条件下进行。用HPLC检测:将制备的样品(10000×g)离心10 min,取上清液过有机膜 (0.45 μm),0.2%磷酸水过水膜(0.45 μm)。色谱条件:采用二元梯度洗脱,流动相B为双蒸水(0.2%磷酸),A为乙腈,柱温25℃,进样量20 μL,流速 1 mL/min,检测波长 306 nm。色谱柱Atlantis C18 (250 mm×4.6 mm,5 μm,Waters公司)。洗脱程序:0-4 min,80%~76%B;4-20 min,76%~69%B;20-25 min,69%~60%B。每个样品重复3次。白藜芦醇含量采用(μg/g鲜重)表示。
1.3.5 白藜芦醇茋合酶基因的RT-PCR检测
选取 0、24、48、72和 96 h发酵后的葡萄叶片,用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取RNA(天根生化科技有限公司,北京),参考方法[15];cDNA第一条链合成根据(PrimeScript R RT reagent Kit Perfect Real Time,TaKaRa)推荐方法进行;根据参考文献设计葡萄白藜芦醇合成途径关键酶的引物:苯丙氨酸解氨酶(PAL)、肉桂酸 -4-羟化酶(C4H)和4-肉桂酸辅酶A连接酶(4CL)及白藜芦醇合成酶 (STS)[16];内参 18S rRNA[17]。RT-PCR反应及电泳相关步骤参考文献[17],引物序列见表2。

表2 引物序列Tab.2 Primer sequences table
1.3.6 数据分析
所有实验测定均重复3次。结果统计和方差分析采用SPSS软件进行,结果以平均值±标准偏差(Mean values±S)表示。
实验组之间统计学差异利用t检验,P<0.05表示差异具有统计学意义,P<0.01表示差异具有显著统计学意义。
2 结果与分析
2.1 霜霉菌处理时间与白藜芦醇积累水平呈现正相关
结果表明,随着处理时间的增加葡萄叶片中白藜芦醇的含量呈现先升高再降低的趋势(图3),并且在处理72 h时白藜芦醇积累量最高,其含量达到59.46 μg/g,是空白组的2.12倍;并呈时效依赖关系。

图2 霜霉菌处理葡萄叶片后HPLC分析Fig.2 The HPLC analysis of grape leaves treated with downy mildew

图3 霜霉菌对葡萄叶片中白藜芦醇诱导的时效关系Fig.3 The time-effect of resveratrol induced by downy mildew in grape leaves
2.2 霜霉菌上调了葡萄茋类物质合成途径相关基因表达
图4为茋类物质合成途径RT-PCR凝胶电泳图。由图4可知RT-PCR凝胶电泳图表明随着处理时间的增加,苯丙氨酸代谢公共途径相关分子表达有明显的变化。公共途径中茋合酶(STS)基因随着处理时间的增加而增加,在72 h时表达量最高,这与白藜芦醇的积累时间一致,具有明显的时效关系;而苯丙氨酸解氨酶(PAL)、肉桂酸 -4-羟化酶(C4H)和 4-肉桂酸辅酶 A连接酶(4CL)基因表达则随着处理的增加在24 h或48 h时表达量最高。

图4 霜霉菌对红地球葡萄叶片中茋类物质合成限速酶基因表达的影响Fig.4 The effect of downy mildew treatment on stilbene material synthesis rate-limiting enzymes gene expression in grape leaf
2.3 霜霉菌发酵后引起细胞ROS水平的升高
过氧化氢(最主要的ROS种类)被认为是生物和非生物胁迫的过程中重要的信号分子,它从协调生理过程到应激反应起着多方面的作用。细胞内源性H2O2在较低的浓度,它可以启动细胞内信号传导活动,而在较高的浓度可能导致植物细胞的代谢功能障碍,同时诱导核酸,蛋白质和脂质损伤[18]。检测叶片中H2O2含量可以看出霜霉菌侵染叶片24 h时葡萄叶片产生的内源性的H2O2含量最高,达到2.77 μmol/g Fw,是空白处理组的2.7倍。随着处理时间的增加,H2O2含量也逐渐减少,但整体水平高于空白处理组。
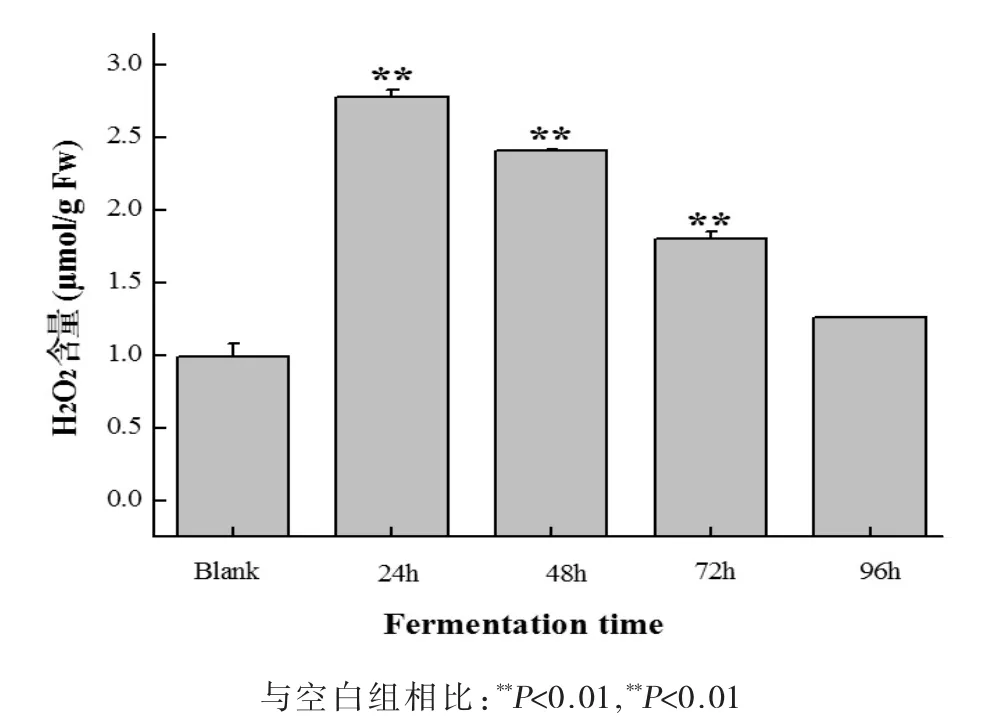
图5 霜霉菌发酵葡萄叶片后细胞间隙液H2O2的含量Fig.5 Changes of H2O2contents in intercellular fluid of grape leaves after fermentation with downy mildew
2.4 氧化还原调控正反验证
由图我们可以看出在霜霉菌处理时间72 h时,加预处理助氧化剂H2O2和FeCl3处理组的白藜芦醇含量有所增加,而加了预处理抗氧化剂NAC和GSH-EE的处理组白藜芦醇的含量则有所减少(图6)。

图6 霜霉菌在不同前处理条件下对葡萄叶片白藜芦醇诱导的量效关系(72 h)Fig.6 The dose-effect of downy mildew on resveratrol content in grape leaves under different pretreatment conditions for 72 hours treatment
3 讨论
本文采用红地球葡萄叶片为研究材料进行研究,通过定量霜霉菌检测白藜芦醇的含量来探究葡萄叶片中茋类物质的积累与霜霉菌之间的关系。
在植物与病原真菌互作中,无论是抗病反应还是感病反应,双方都会发生一系列形态上的变化。植物与病原真菌的互作分为亲和互作(特异性侵染)与非亲和互作(非特异性侵染)。在亲和互作中,一些真菌利用植物表面的气孔或创伤入侵,许多毒性较强的真菌还具有主动入侵的机制,如以附着孢形式入侵植物,造成植物感染[19]。在非亲和互作中,在侵染处形成与周围健康组织差异明显的局部细胞坏死-过敏反应(hypersensitive reaction,HR),并伴随有高水平的H2O2[20]。在葡萄中,Liswidowati等人认为:在真菌诱导前,植物细胞内基本上没有茋类化合物这种物质,就算有含量也很少。这一观点与Pezet R等人[9]的研究结果类似,用Plasmopara viticola(霜霉病)处理葡萄叶片后分离并检测相关的芪类物质,结果发现经处理后的葡萄叶片可以产生更多的芪类物质,正常的对照组葡萄叶片检测出的芪类物质相对较少。
实验研究发现霜霉菌对葡萄叶片中的茋类物质具有显著的诱导作用,且白藜芦醇的积累呈现一定的时效依赖关系。在72 h时白藜芦醇的积累量达到最高,鲜重为59.46 μg/g,是空白组的2.12倍。随着时间的增加,ROS水平呈现先升高后降低的趋势,在24 h时达到最大值。检测苯丙氨酸代谢途径(白藜芦醇合成途径)相关酶基因[14]苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-肉桂酸辅酶A连接酶(4CL)以及茋合酶(STS)的表达,发现STS基因随着处理时间的增加而增加,在72 h时表达量最高,这与白藜芦醇的积累时间一致,具有明显的时效关系;而PAL、C4H和4CL基因表达量则随着处理时间的增加在24 h或48 h时表达量最高,这与叶片内源性H2O2含量检测结果一致。已有报道表明:茋类化合物通过合成植保素来参与植物的防御反应,而ROS在植物防御过程中可能起着信号传递作用和直接刺激植物体发挥植保素的功能[21]。在霜霉菌侵染葡萄叶片的前期ROS大量积累,当超过植物体内ROS动态平衡后,刺激机体开启茋类物质合成途径,并在72 h时达到最高。另一方面,造成白藜芦醇积累的原因可能是由于霜霉菌侵染正常葡萄叶片时,在侵染处形成与周围健康组织差异明显的局部细胞坏死区域,它能阻断病原菌的营养来源,限制其进一步扩散。然而,一些研究表明,细胞过敏性坏死并不足以阻止所有的病原真菌的扩散,某些植物的抗病反应过程也并不一定伴随有HR产生[22]。Konate等在烟草花叶病毒感染的烟草叶片的紧邻坏死斑周围区域里发现一些病毒颗粒的存在[23]。因此,当病原真菌突破坏死斑的界限后,周围细胞中被强烈诱导的防御反应就成为限制病原菌扩散的主要屏障。然而,这种具有防御作用的物质通常被称之为植保素,白藜芦醇是葡萄中最主要的植保素。
最后,根据课题组前期研究成果在实验中加入了抗氧化剂NAC、GSH-EE和助氧化剂H2O2来验证霜霉菌与白藜芦醇的积累在氧化损伤角度的关系。结果表明,加了助氧化剂H2O2和FeCl3处理组的白藜芦醇含量增加,而加了抗氧化剂NAC和GSH-EE的处理组白藜芦醇的含量则减少。说明霜霉菌同样能够造成植物氧化损伤,进而刺激机体产生能够保护机体的芪类物质。
4 结论
白藜芦醇被认为是茋类物质单体中最重要的生物活性物质,对于植物抗病具有重要意义。霜霉菌处理葡萄叶片时会诱导白藜芦醇的积累,在72 h时其含量达到59.46 μg/g,是空白组的2.12倍,且植物体内ROS水平在24 h达到最高;加助氧化剂H2O2和FeCl3共处理组的白藜芦醇含量有所提高;而加了抗氧化剂NAC和GSH-EE的共处理组白藜芦醇的含量则有所减少。霜霉菌诱导白藜芦醇积累与植物氧化胁迫有密切关系。
[1]Zelko I N,Mariani T J,Folz R J.Superoxide dismutase multigene family:a comparison of the CuZn-SOD(SOD1),Mn-SOD(SOD2),and EC-SOD(SOD3)gene structures,evolution,and expression[J].Free Radic Biol Med,2002,33(3):337-349.
[2]李欣龙.山葡萄‘双红’与葡萄霜霉菌互作的分子机制研究[D].中国农业大学,2016.
[3]颜欢,张波,赵文彬,等.孵育时间对UV-C辐射处理离体葡萄叶片茋类物质含量和种类的影响 [J].新疆农业科学,2013,21(10):1908-1916.Yan H,Zhang B,Zhao W B,et al.The stilbenes contents and kinds of detached grapevine leaves during incubation time after UV-C irradiation treatment[J].Xinjiang Agricultural Science,2013,21(10):1908-1916.
[4]黄方爱,张波,杨晓燕,等.3种非生物诱导剂对红地球葡萄离体叶片中主要茋类物质的诱导作用[J].农垦医学,2012(5):393-396.Huang F A,Zhang B,Yang X Y,et al.The effects of three nonbiotic inducers on major stilbenes contents in detached grape leaves[J].JournalofNongken Medicine,2012(5):393-396.
[5]李月荣,颜欢,张波,等.过氧化氢诱导不同色素水平葡萄愈伤组织白藜芦醇及白藜芦醇苷含量差异 [J].北方园艺,2015,283(8):114-116.Li Y R,Yan H,Zhang B,et al.The differences between resveratrol and piceid in grapevine callus responsed to the hydrogen peroxide treatment[J].Northren Horticulture,2015,283(8):114-116.
[6]李月荣,李荣飞,张波,等.FeCl3溶液诱导葡萄愈伤组织白藜芦醇积累及其与氧化应激的关系 [J].新疆农业科学,2016,23(1):149-155.Li Y R,Li R F,Zhang B,et al.The relationship between FeCl3-induced resveratrol accumulation and oxidative stress in grapevine callus[J].Xinjiang Agricultural Science,2016,23(1):149-155.
[7]马勉娣,张秀英,程玉,等.再接种内生真菌对葡萄叶内生真菌群落结构的影响[J].微生物学通报,2014,30(12):2458-2465.Ma M D,Zhang X Y,Cheng Y,et al.Effects on folia endogenous flora structure of grape after reinoculation with different endophytic fungi[J].Microbiology China,2014,30(12):2458-2465.
[8]Kretschmer M,Kassemeyer H H,Hahn M.Age-dependent grey mould susceptibility and tissue-specific defence gene activation of grapevine berry skins after infection by Botrytis cinerea[J].Journal of Phytopathology,2007,155(3):258-263.
[9]Pezet R,Gindro K,Viret O,et al.Effect of resveratrol,viniferins and pterostilbene on plasmopara viticola zoospore mobility and disease development[J].Vitis,2004,43(7):145-148.
[10]李卓,金恭玺,郎宁,等.温湿度与光照对葡萄霜霉病菌孢子囊萌发及存活的影响 [J].新疆农业科学,2016,23(11):2090-2097.Li Z,Jin G X,Lang N,et al.Effects of temperature humidity and illumination on the germination and survival of sporangia of downy mildew of grapes[J].Xinjiang Agricultural Science,2016,23(11):2090-2097.
[11]Adrian M,Jeandet P,Bessis R,et al.Induction of phytoalexin resveratrol synthesis in grapevine leaves treated with aluminum chloride AlCl3[J].Agric Food Chem,1996,44(10):1979-1981.
[12]Jie L,Xiaomin Wang,Yanfeng Hu.Glucose-6-phosphate dehydrogenase plays a pivotal role in tolerance to drought stress in soybean roots[J].Plant Cell Rep,2013,32(4):415-429.
[13]Sutherland M W,Deverall B J.The ubiquity of non-specific eliciting activity in intercellular washing fluids from rustinfect wheat leaves[J].Plant Pathol,1990,39(1):50
[14]田春芳,张波,刘景磊,等.HPLC法测定离体葡萄叶中茋化物的含量[J].湖北农业科学,2013,10(1):2411-2419.Tian C F,Zhang B,Liu J L,et al.Determination of the main stilbenes composition in detached grape leaves by HPLC[J].Hubei Province Agricultural Science,2013,10(1):2411-2419.
[15]杨晓燕,张波,黄方爱,等.葡萄叶片中提取总RNA的三种方法比较[J].北方园艺,2013,281(2):87-90.Yang X Y,Zhang B,Huang F A,et al.Comparative study on three methods for the extraction of total RNA from grape leaves[J].Northren Horticulture,2013,281(2):87-90.
[16]Lijavetzky D,Almagro L,BelchiNavarro S,et al.Synergistic effect of methyliasmonate and cyclodextrin on stilbene biosynthesis pathway gene expression and resveratrol production in Monastrell grapevine cell cultures[J].BMC Research.Notes,2008(1):132-135.
[17]赵晓,马会勤,陈尚武,等.葡萄果实发育后期半定量RT-PCR内参基因的优选[J].中国农业大学学报,2010,15(3):7-14.Zhao X,Ma H Q,Chen S W,et al.Internal reference gene selection for semi quantitative RT-PCR of genes in the second half of grape berry development[J].Journal of China Agricultural University,2010,15(3):7-14.
[18]Gupta K,Sengupta A,Chakraborty M,et al.Hydrogen peroxide and polyamines act as double edged swords in plant abiotic stress responses[J].Front Plant Sci,2016,12(7):1343.
[19]Correa A,Hoch H C.Identification of thigmoresponsive loci forcell differentiation in Uromyces germlings[J].Protoplasma,1995(186):34-40.
[20]Wang H,Lin J,Chang Y,et al.Comparative transcriptomic analysis reveals that Ethylene/H2O2-Mediatedhypersensitive response and programmed cell death determine the compatible interaction of sand pear and alternaria alternata[J].Front Plant Sci,2017(8):195.
[21]Pool R M,Creasy L L,Frackelton A S.Resveratrol and the viniferins,their application to screening for disease resistance in grape bredding programs[J].Vitis,1981(20):136-145.
[22]Hammond Kosack K E,Silverman P,Raskin I,et al.Racespecific elicitors of cladosporium fulvum induce changes in cell morphology and the synthesis of ethylene and salicylic acid in tomatoplants carrying the corresponding cf disease resistance genes[J].Plant Physiol,1996,10(1):1381-1394.
[23]Konate G,Kopp M,Fritig B,et al.Rates of tobacco mosaic virusmultiplication in systemic and necrotic responding tobacco varieties:Biochemical approach to the study of hypersensitive resistance toviruses[J].Phytopathol Z,1982(105):214-225.
Accumulation of resveratrol and redox regulation in grape induced by downy mildew
Dong Jinlei,Zhang Shanshan,Wang Xiaoqin,Zhang Bo*
(School of Pharmacy,Shihezi University/Key Laboratory of Xinjiang Endemic Phytomedicine Resources,Shihezi,Xinjiang 832002,China)
Downy mildew is the most common grape disease.This study carried out a research on the patterns of phytoalexin accumulation and reactive oxygen regulation during the infection of downy mildew on grape leaves.7-month-old grapevine(Red globe)leaves and fresh downy mildew were selected for innoculation in 20℃under dark conditions.The time-effect relationships between infection and resveratrol content were analyzed by HPLC method.Similarly,the accumulation of reactive oxygen species(ROS)after infection was determined by spectrophotometric method.The gene-expression level of key enzymes in stilbene pathway was semi-quantified by RT-PCR assay.The relationship between the resveratrol-elicitied potency by downy mildew and ROS accumulation was identified by positive and negative validation via additional both pro-oxidative or anti-oxidative approaches.The results showed that downy mildew induced the accumulation of ROS in grape leaves which reached the highest level at 24 h.Resveratrol accumulated with time and at 72 h it reached 59.46 μg/g.The expression of STS gene was significantly up-regulated,while the expression of PAL,C4H and 4CL reached the highest at 24 h or 48 h in the resveratrol synthesis pathway.The content of resveratrol in grape leaves increased in H2O2and FeCl3treated groups,while the content of resveratrol decreased in the treatment group treated with antioxidant NAC and GSH-EE.It suggests that the accumulation of resveratrol induced by downy mildew is related to redox mechanism.
resveratrol;downy mildew;stilbene biosynthesis;ROS accumulation;Vitis viniferaL.cv.Red Globe
R363
A
10.13880/j.cnki.65-1174/n.2017.04.016
1007-7383(2017)04-0486-07
2017-01-25
国家自然科学基金项目(31160058),新疆兵团重点领域科技攻关项目(2014BA029)
董锦蕾(1990-),女,硕士研究生,专业方向为生物技术制药。
*通信作者:张波(1978-),男,教授,从事肿瘤药理及生物技术制药研究,e-mail:Bozhang_lzu@126.com。

