两种油葵自交系再生体系的建立
周茜萍,王梦瑶,吕新华,祝建波,孙黎
(石河子大学生命科学学院,新疆石河子 832003)
两种油葵自交系再生体系的建立
周茜萍,王梦瑶,吕新华,祝建波,孙黎
(石河子大学生命科学学院,新疆石河子 832003)
【目的】取两种自交系油葵(1538-3和1573-2)的不同外植体,建立组织再生培养体系,选出最适品系,为遗传转化奠定基础。【方法】分别取两种自交系油葵的不同组织,采用不同激素配比,从器官间接和直接发生两个方面分别诱导油葵不定芽再生。【结果】以油葵自交系1538-3的不同外植体为材料,在含有1-萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、激动素(KT)的培养基中都易形成愈伤组织,但均表现为白色、水渍化程度高,无分化能力;6-BA浓度在0~1.0 mg/L时,子叶节可诱导出不定芽,其他激素配比中未见此现象;以胚轴为外植体时,油葵1573-2自交系不定芽诱导的最佳培养基为MS + 0.6 mg/L 6-BA + 0.1 mg/L GA3;1538-3自交系不定芽诱导的最佳培养基为MS + 0.5 mg/L 6-BA + 0.05 mg/L GA3;两种自交系诱导不定芽生根时NAA的最佳浓度为0~0.2 mg/L。【结论】两种基因型油葵诱导不定芽的能力差别较大,其中自交系1538-3再生能力较强,遗传转化时选用1538-3的胚轴作为转化受体时较好。
油葵;胚轴;组织培养;再生体系
0 引 言
【研究意义】油葵为油用向日葵(HelianthusannuusL.)的简称,是菊科向日葵属植物。油葵是世界四大油料作物之一,也是我国北方主要食用油的植物来源。利用现代生物技术培育优质、高产的油葵新品种已成为越来越多育种者的目标,而离体培养技术是现代生物技术中改造并培育优良油葵品种的重要途径。【前人研究进展】20世纪80年代,对向日葵离体培养进行了研究,主要以器官发生[1-4]和胚胎发生[5-7]为主,利用茎尖[8]、子叶[9]、真叶[10]、下胚轴[11]、未成熟胚[12]等不同程度地得到胚状体或植株。向日葵是公认的难再生植物,加上基因型[13]、内外源激素、外植体类型的差异,使得油葵组织培养再生研究仅在有限的基因型上获得成功[14]。徐培洲[9]和Paterson[15]等研究结果表明,不含2,4-D是获得胚性愈伤组织的必要条件。【本研究切入点】向日葵难转化的原因是从转化的细胞或组织再生植株困难,研究以两种油葵自交系为材料,以子叶、子叶节和胚轴为外植体,探讨不同激素水平对油葵愈伤组织分化的影响,从器官发生途径进行了不定芽诱导再生实验。【拟解决的关键问题】研究从愈伤组织建立油葵再生体系的可能性,以提高油葵的转化与再生效率,为油葵的遗传转化奠定基础。
1 材料与方法
1.1 材 料
两个油葵自交系1538-3和1573-2由新疆农垦科学院提供。
1.2 方 法
1.2.1 油葵无菌苗的获得
挑选颗粒饱满,无病虫害的种子50粒,去壳后用75%酒精震荡消毒3 min,无菌水冲洗1次,再用2%次氯酸钠震荡消毒5~6 min后,用无菌水冲洗4次,然后接种于MS培养基上。
1.2.2 胚轴外植体的准备
胚轴外植体的准备参考刘宇新[16]的方法。

表1 不同KT、NAA和6-BA激素浓度配比
1.2.3 KT、NAA和6-BA激素浓度的配比
以MS为基本培养基,参考杨长友[17]的方法,以不同浓度的KT、NAA和6-BA进行试验,以获得最佳的愈伤诱导激素配比。表1
1.2.4 6-BA与GA3激素浓度的配比
根据刘宇新等[16]的方法,以MS为基本培养基,分别以0.05、0.1、0.15、0.2 mg/L GA3与0.2、0.4、0.5、0.6 mg/L 6-BA进行正交组合。
1.2.5 不同NAA激素浓度对油葵胚轴再生苗生根的影响
待培养基中分化出的小苗长至3 cm左右时切下,接种于附加不同浓度NAA(0、0.2、0.4、0.6、0.8、1.0 mg/L)的生根培养基中。每瓶选1~3个芽接种,实验重复五次,培养20 d后统计生根数和生根率。实验中所用的MS固体培养基含琼脂7.0 g/L,蔗糖浓度为30 g/L,培养基pH为5.8~6.0,培养温度为(25±1)℃,12 h光照/12 h黑暗。愈伤组织与分化试验每组处理3个培养皿,每个培养皿放8~10个材料,每组重复3次,接种后第20与第40 d后分别统计子叶、子叶节的愈伤生长情况;接种后24 d统计不定芽分化情况。表2
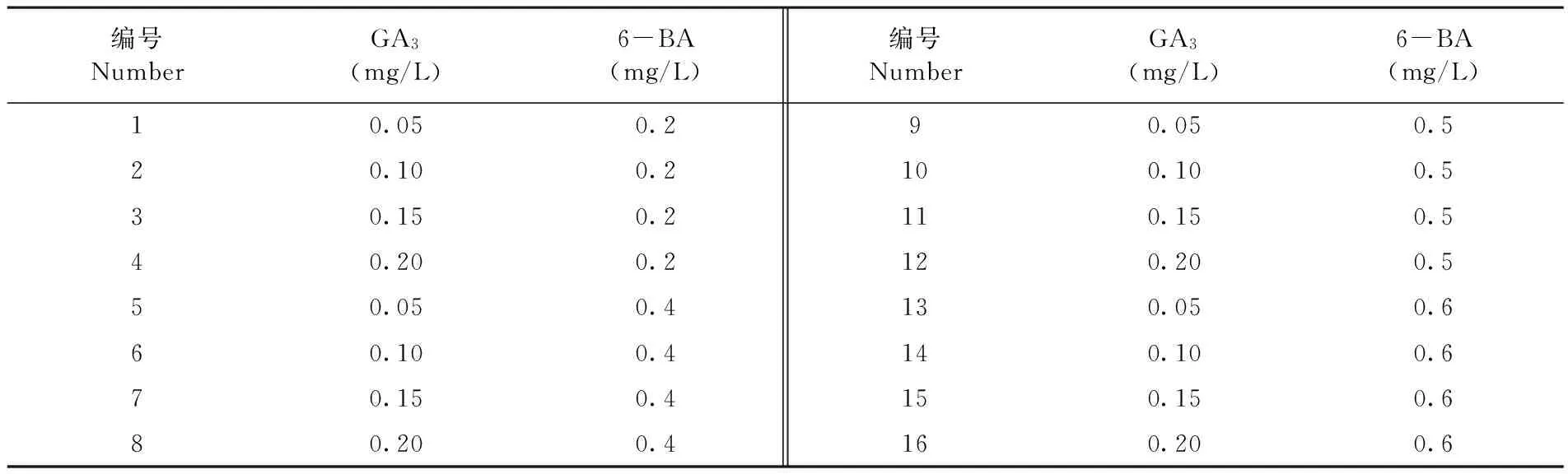
表2 不同GA3和6-BA激素浓度配比
1.3 数据处理
统计结果、绘图用Excel分析完成,试验数据用SPSS19.0软件进行统计分析。参数的计算方法如下:
子叶节芽诱导率=长芽的子叶节数/接种的子叶节数×100%。
胚轴分化率=分化的胚轴数/接种的胚轴数×100%。
生根率=长根苗数/接种苗数×100%。
2 结果与分析
2.1 不同浓度KT、NAA和6-BA对油葵子叶和子叶节愈伤诱导的影响
油葵1538-3自交系在不同培养基上培养20和40 d后不同组织的愈伤生长情况表明,当以子叶为外植体时,以上21种添加不同激素的培养基上都可以诱导出愈伤,但无胚性愈伤组织。在愈伤诱导初期,大多数表现为外植体稍膨大,愈伤呈现黄绿色或浅黄绿色,水渍化程度高,质地蓬松。经过多次继代培养之后愈伤已呈现无分化能力的菌丝状物。以子叶节为外植体在21种愈伤诱导培养基的愈伤生长状况与子叶的大致相同,呈浅黄色或白色,手感蓬松;经过几次继代培养后,个别愈伤呈稀泥状组织,水渍化程度加深,失去了继续分化为胚性愈伤的能力。
在试验过程中发现6-BA浓度在0、0.5和1.0 mg/L时,子叶节可以分化出不定芽,分化率分别为66.67%、30%和15%,且6-BA浓度越低,分化率越高。NAA浓度在0或0.1~1.0 mg/L时,子叶节可诱导出芽点或者生长点处有叶分化。通过诱导不定芽的最佳激素配比为1.0 mg/L KT + 0.1 mg/L NAA + 0 mg/L 6-BA或 0.5 mg/L 6-BA。表3

表3 不同激素配比对不同外植体愈伤生长情况
2.2 不同浓度GA3和6-BA对油葵胚轴不定芽诱导的影响
为进一步了解6-BA对油葵胚轴不定芽诱导的影响,根据刘宇新等[16]的方法,以两种油葵自交系的胚轴为外植体,进一步研究了不同激素配比对油葵不定芽诱导的影响。研究表明,两种油葵自交系1538-3和1573-2在16种培养基中不定芽分化率最高为100%,最低为33.33%,平均不定芽诱导率分别为81.47%和60.68%。图1
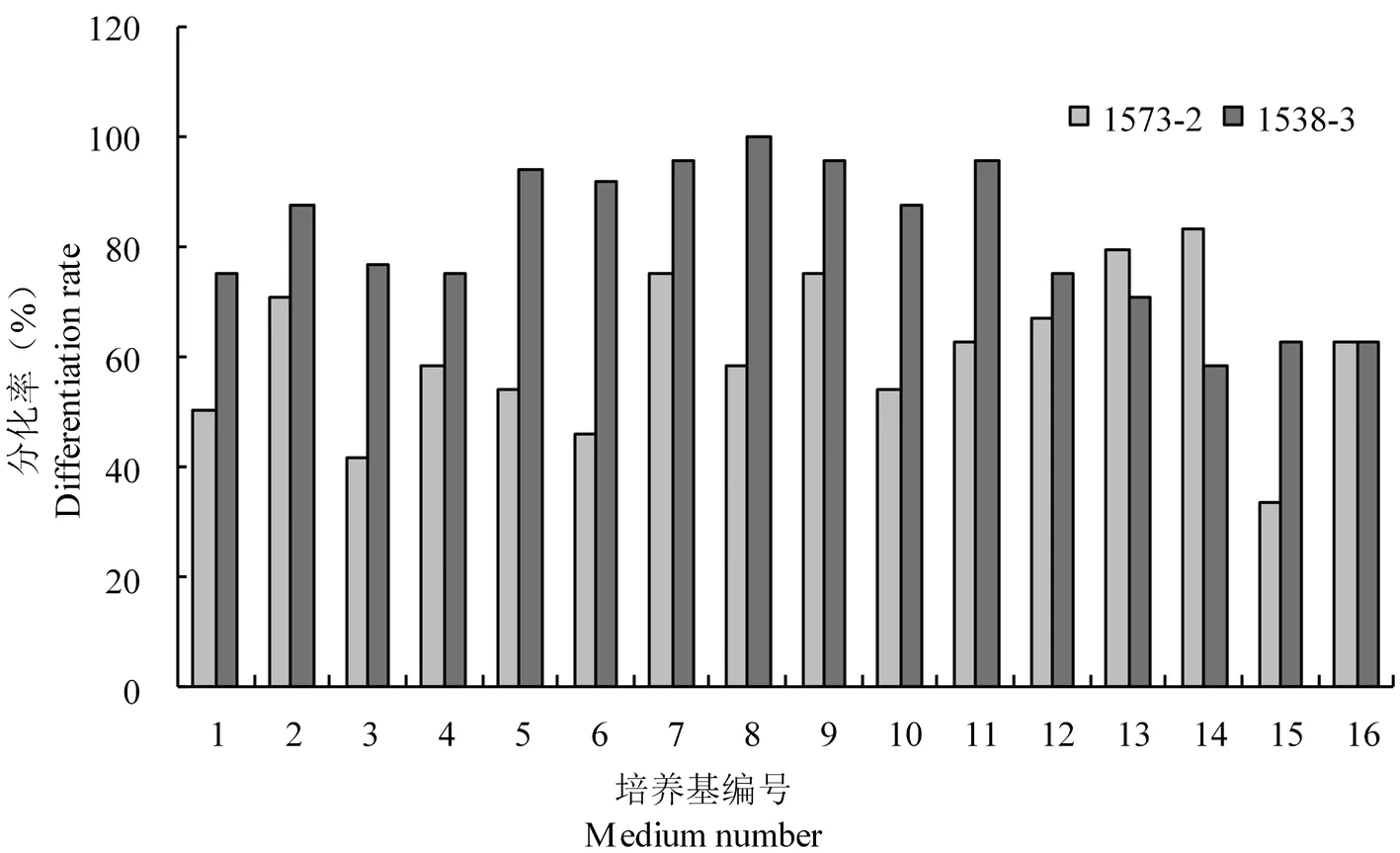
图1 不同激素配比下两种油葵不定芽分化变化
对于1573-2来说,当6-BA浓度大于0.5 mg/L时,胚轴分化呈增加趋势,在0.6 mg/L时达到最大,分化率达到83.33%,随着附加物GA3浓度的增加,分化率降低。因此1573-2的胚轴分化最佳培养基配比为MS + 0.6 mg/L 6-BA + 0.1 mg/L GA3。对于1538-3来说,随着6-BA浓度的升高,不定芽分化率也随之增加,在0.4 mg/L时达到最大;而后随着6-BA浓度的升高,不定芽分化数反而降低;同时在实验中发现有些培养基组合虽然能强烈诱导不定芽的生长,但生长状态不理想(图2A),表现为丛生芽数过多,幼芽高度下降,茎秆畸形,不易在生根培养基上成苗。因此1538-3的胚轴分化最佳培养基配比为MS + 0.5 mg/L 6-BA + 0.05 mg/L GA3。图2

A:1538-3;B:1573-2
图2 GA3和6-BA对自交系诱导不定芽的影响(诱导培养20 d)
Fig.2 Effect of the concentration of GA3and 6-BA on shoot regeneration of inbred lines(Induced culture for 20 days)
2.3 不同基因型不同外植体对向日葵子叶节不定芽诱导率的影响
以1573-2和1538-3油葵自交系成熟种子的胚轴为材料,在上述不同浓度6-BA与GA3培养基上诱导分化。研究表明,2种基因型不定芽诱导率依次为1538-3>1573-2。方差分析结果表明:不同基因型之间不定芽诱导率存在极显著差异(P<0.01)。图2,表4

表4 两个基因型对不定芽诱导率的差异显著性测验
2.4 不同浓度NAA对油葵胚轴再生苗生根影响
研究表明,两种自交系在不添加NAA或NAA浓度较低的1/2 MS培养基中均能不同程度地诱导油葵不定芽生根。对于自交系1573-2来说,在不含NAA的1/2 MS培养基上,一般从第10 d就可见根的分化,随着培养天数的增加,根表现为根系细弱,根系不发达,移栽后不易成活;NAA浓度在0.2和0.4 mg/L时,不定芽生根有延迟现象,但一般从第15 d开始,激素诱导不定根分化明显,表现为根系量大,根系粗壮(图3B)。对于1538-3来说,在不同生根培养基中根的生长状况与1573-2相似,但是NAA浓度为0 mg/L时,它的生长状况最好(图3A),随着激素浓度的升高,NAA浓度在0.2 mg/L时,其生根率快速下降,无生根植株表现为在根部分生区有愈伤组织的大量生长,这可能与油葵本身的内源激素高有关[18]。确定1573-2油葵生根最佳培养基为1/2 MS + 0.2 mg/L NAA ,1538-3油葵生根最佳培养基为1/2 MS + 0 mg/L NAA。图3,表5
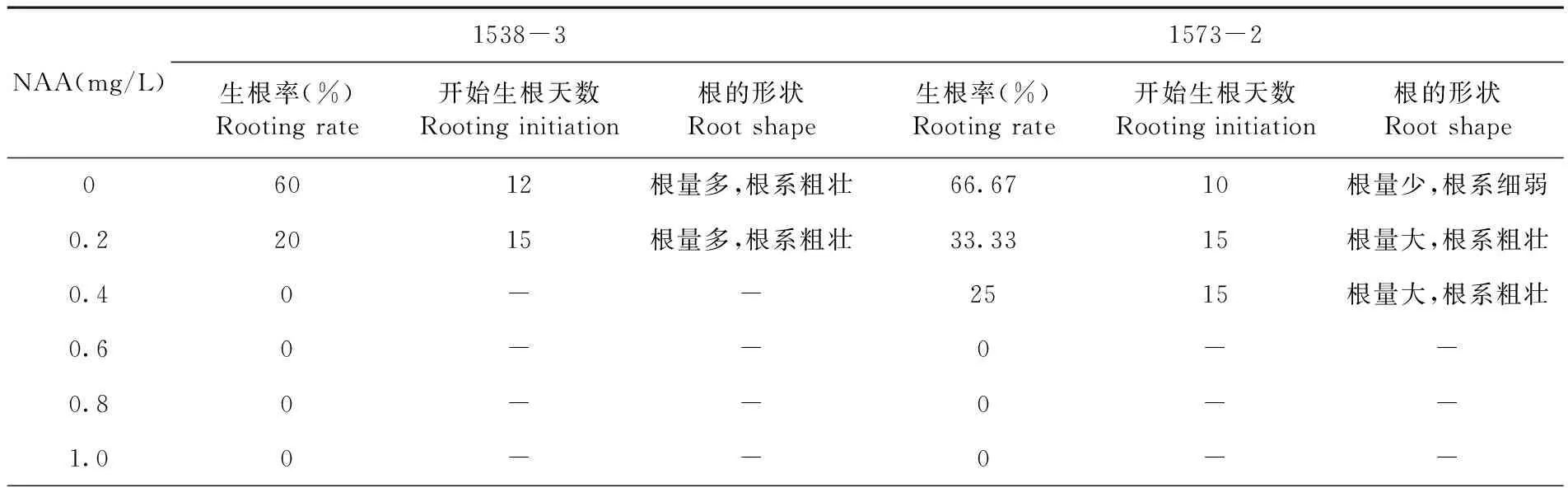
表5 不同浓度NAA下生根情况
A、D:1538-3;B、C:1573-2;
图3 油葵再生苗生根与移栽
Fig.3 Rooting and transplanting of the sunflower’s regeneration plantlets
3 讨 论
3.1 不同激素对油葵外植体再生的影响
在植物组织培养中,植物激素的类型及其在培养基中添加的比例是影响外植体是否再生的重要因素。梁国婷[19]对模式植物拟南芥离体器官的再生研究表明,培养基中生长素(2,4-D、IAA和NAA)与细胞分裂素(6-BA、Zeatin)的浓度比例高时易于诱导根的形成,低时促进芽的分化。勾畅等[20]用菊花花瓣作为外植体,不形成愈伤组织,直接诱导产生丛生芽,缩短了培养周期。在实验中,培养基中添加NAA、KT、6-BA和GA3均能不同程度地诱导出不定芽,在NAA、KT和6-BA组合中,6-BA不添加或者浓度很低时才能诱导出不定芽,这与Paterson等[15]的研究结果相似。Pugliesi等[1]的研究结果表明,KT和IAA对植株再生是必须的,当其比值(KT/IAA)达到4∶1时,再生频率最高。在其选用的5个材料中,不论遗传组成如何,在补加KT(4 mg/L)和IAA(0.1 mg/L)的MS培养基中均能再生。在6-BA和GA3激素组合中,较低浓度的6-BA和GA3均能诱导不定芽产生。在愈伤诱导过程中,虽然子叶节周缘产生不定芽,但未观察到胚性愈伤组织形成,这可能与激素配比、外植体选择和植物自身激素水平等因素有关,具体原因有待进一步研究。
3.2 不同基因型向日葵对外植体再生的影响
研究表明,植物基因型的差异对其再生频率有显著的影响。Vanegas等[21]以万寿菊叶片为材料,在MS附加IAA和6-BA的培养基上不定芽的诱导率最高可达69.4%。齐迎春等[22]则建立了五种不同基因型孔雀草的再生体系,并且发现五种孔雀草在同种培养基上的再生率均不同。这些结果说明了基因型差别越大,对外源激素的种类和含量的需求差异越明显。刘宝等[13]对51份向日葵自交系材料进行了离体培养,其中16份自交系获得了再生芽。在研究过程中发现,离体培养植株再生能力存在显著的基因型间的差异。Paterson等[15]对100个向日葵自交系的茎尖组织在加有细胞分裂素的培养基上进行了培养,其中54%的基因型发生不同程度的再生现象。研究也发现,不同基因型自交系油葵在芽诱导方面存在差异,自交系1538-3不定芽诱导率显著高于自交系1573-2。但Pugliesi等[1]则持不同的观点,认为基因型与植物再生能力之间无明显关系,而与生长素与细胞分裂素的配比有关。
4 结 论
向日葵作为难再生植物,许多内源或外源因素影响其离体植株再生过程。研究探讨了激素类型、外植体类型及基因型对油葵离体组织再生的影响。油葵子叶和子叶节在不同激素诱导愈伤组织过程中的差异不大。通过几次继代培养,愈伤组织均表现为质地蓬松、水渍化程度高,失去分化能力。在激素配比为1.0 mg/L KT + 0.1 mg/L NAA + 0 mg/L 6-BA或0.5 mg/L 6-BA时,子叶节可诱导出不定芽。不同浓度配比的6-BA和GA3对油葵1573-2和1538-3不定芽诱导的分化率也不同,后者高于前者。在遗传转化时可以选用不定芽再生率较高的1538-3作为转化受体。
References)
[1] Pugliesi, C., Cecconi, F., Mandolfo, A., & Baroncelli, S. (1991). Plant regeneration and genetic variability from tissue cultures of sunflower (helianthusannuusl.).PlantBreeding, 106(2): 114-121.
[2] Jeannin, G., Bronner, R., & Hahne, G. (1995). Somatic embryogenesis and organogenesis induced on the immature zygotic embryo of sunflower (helianthusannuml.) cultivated in vitro: role of the sugar.PlantCellReports, 15(3-4): 200-204.
[3] Sarrafi, A., Roustan, J. P., Fallot, J., & Alibert, G. (1996). Genetic analysis of organogenesis in the cotyledons of zygotic embryos of sunflower (helianthusannuusl.).TheoreticalandAppliedGenetics, 92(2): 225-229.
[4] Fiore, M. C., Trabace, T., & Sunseri, F. (1997). High frequency of plant regeneration in sunflower from cotyledons via somatic embryogenesis.PlantCellReports, 16(5): 295-298.
[5] Zezul', T. G., Gorbatenko, E. V., & Raldugina, G. N. (1995). Regeneration of sunflower (helianthusannuusl.) plants via somatic embryogenesis in vitro.Genetika. (3):197-202.
[6] Fambrini, M., Cionini, G., & Pugliesi, C. (1997). Acquisition of high embryogenic potential in regenerated plants of helianthus annuus x h. tuberosus.PlantCell,TissueandOrganCulture(PCTOC) , 51(2):103-110.
[7] Laparra, H., Bronner, R., & Hahne, G. (1997). Histological analysis of somatic embryogenesis induced in leaf explants ofhelianthus smithii heiser.Protoplasma, 196(1): 1-11.
[8] 贺宾,高燕,向理军,等. 油葵茎尖周缘分生区培养及高频率芽再生[J]. 新疆农业科学, 2004,41(2): 86-88.
HE Bin, GAO Yan, XIANG Li-jun, et al. (2004) The culture of apical shoot of oil sunflower and its high frequent regeneration [J].XinjiangAgriculturalSciences, 41(2): 86-88. (in Chinese)
[9] 徐培洲, 吴先军, 胡保民, 等. 油葵子叶外植体不定芽再生体系的建立[J]. 中国油料作物学报, 2004, 26(4): 16-19.
XU Pei-zhou, WU Xian-jun, HU Bao-min, et al. (2004) A shoot regeneration system from cotyledon ofHelianthusannuusL.[J].ChineseJournalofOilCropSciences, 26(4): 16-19. (in Chinese)
[10] 胡文冉, 黄乐平, 孟庆玉, 等. 油葵叶片离体再生体系的建立[J]. 新疆农业科学, 2006,43(1): 82-85.
HU Wen-ran, HUANG Le-ping, MENG Qing-yu, et al. (2006) A regeneration system from cotyledon of sunflower (HelianthusannuusL.) [J].XinjiangAgriculturalSciences, 43(1): 82-85. (in Chinese)
[11] 刘海臣. 向日葵下胚轴组织培养及其遗传转化的研究[D]. 长春:长春理工大学硕士学位论文, 2007.
LIU Hai-chen. (2007).Studyonthetissuecultureandgenetictransformationwithhypocotylofsunflower[D]. Master Dissertation. Changchun University of Science and Technology, Changchun. (in Chinese)
[12] 刘海学, 王罡, 季静, 等. 向日葵(HelianthusannuusL.)不同外植体组织培养及其再生的研究[J]. 中国农业科学, 2006, 39(11):2 208-2 213.
LIU Hai-xue, WANG Gang, JI Jing, et al. (2006). The research of tissue culture and regenerated of the different explants of sunflower (HelianthusannuusL.) [J].ScientiaAgriculturaSinica, 39(11):2,208-2,213. (in Chinese)
[13] 刘宝, 顾德锋, 邬信康, 等. 向日葵(Helianthusannus)自交系的组织培养和芽的分化[J]. 吉林农业大学学报, 1991, 13(1): 6-10.
LIU Bao, GU De-feng, WU Xin-kang, et al. (1991) Tissue culture and plantlet regeneration of sunflower (HelianthusannuusL.) inbred lines [J].JournalofJilinAgricultureUniversity, 13(1): 6-10. (in Chinese)
[14] 王园园, 李彩凤, 张翼飞, 等. 向日葵离体再生体系的建立[J]. 生物工程学报, 2011,27(9): 379-389.
WANG Yuan-yuan, LI Cai-feng, ZHANG Yi-fei, et al. (2011). Establishing the regeneration system of sunflower [J].ChineseJournalofBiotechnology, 27(9): 379-389. (in Chinese)
[15] Paterson, K. E., & Everett, N. P. (1985). Regeneration of helianthus annuus, inbred plants from callus.PlantScience, 42(2): 125-132.
[16] 刘宇新. 抗氧化蛋白SsPrxQ在向日葵中的表达研究[D]. 天津: 天津大学硕士学位论文, 2009.
LIU Yu-xin. (2009).StudiesofexpressionofantioxidantproteinSsprxQinsunflower[D]. Master Dissertation. Tianjin University, Tianjin. (in Chinese)
[17] 杨长友. 向日葵离体再生及农杆菌介导的遗传转化研究[D]. 重庆:重庆师范大学硕士学位论文, 2014.
YANG Chang-you. (2014).Regenerationinvitroandagrobacterium-mediatedtransformationofsunflower(HelianthusannuusL.) [D]. Master Dissertation. Chongqing Normal University, Chongqing. (in Chinese)
[18] 卫志明, 许智宏. 向日葵的组织培养和植株再生[J]. 植物生理学通讯, 1983, (5):42.
WEI Zhi-ming, XU Zhi-hong. (1983). Tissue culture and plantlet regeneration of sunflower [J].PlantPhysiologyJournal, (5): 42. (in Chinese)
[19] 梁国婷. 生长素和细胞分裂素调节拟南芥离体器官的再生[D]. 泰安:山东农业大学硕士学位论文, 2009.
LIANG Guo-ting. (2009)AuxinandcytokininregulateorganregenerationofArabidopsisinvitro[D]. Master Dissertation. Shandong Agricultural University,Taian. (in Chinese)
[20] 勾畅, 武慧, 将达, 等. 激素配比对不同基因型菊花再生体系的调控[J]. 北方园艺, 2013, (13): 135-137.
GOU Chang, WU Hui, JIANG Da, et al. (2011) Effects of different hormone combinations on the regeneration of four different chrysanthemum genotypes [J].NorthernHourticulture, (13): 135-137. (in Chinese)
[21] Vanegas, P. E., Cruz-Hernández, A., Valverde, M. E., & Paredes-López, O. (2002). Plant regeneration via organogenesis in marigold. Plant Cell,TissueandOrganCulture(PCTOC) , 69(3): 279-283.
[22] 齐迎春, 叶要妹, 刘国锋, 等. 不同基因型孔雀草高效植株再生体系的建立[J]. 中国农业科学, 2005, 38(7): 1 414-1 417.
QI Ying-chun, YE Yao-mei, LIU Guo-feng, et al. (2005) The establishment of efficient regeneration system for different genotypes of Tagetes patula L. [J].ScientiaAgriculturaSinica, 38(7): 1,414-1,417. (in Chinese)
Establishment of Regeneration System of Two Types Inbred Lines from Oil Sunflower (HelianthusannuusL.)
ZHOU Xi-ping, WANG Meng-yao, LÜ Xin-hua, ZHU Jian-bo, SUN Li
(College of Life Science, Shihezi University, Shihezi Xinjiang 832003, China)
【Objective】 The explants of two inbred oil sunflower (1538-3 and 1573-2) were used to establish the tissue regeneration culture system, and the optimum strain was selected to lay the foundation for genetic transformation.【Method】Two different inbred lines of oil sunflower were taken respectively, and the regeneration of adventitious bud of oil sunflower was induced from two aspects of indirect and direct organs by different hormone ratio.【Result】The results showed that inbred lines 1538-3 was easy to form callus in the mediums containing NAA, 6-Benzylaminopurine (6-BA) and kinetin (KT), but all the callus were white with high water damage level. The sunflower cotyledonary node could induce adventitious buds when the concentration of 6-BA was 0 to 1.0 mg/L, which couldn't be observed in other hormone combinations. The combination of MS + 0.6 mg/L 6-BA + 0.1 mg/L GA3was most suitable for the induction of adventitious bud from inbred lines 1573-2 hypocotyls explants. While for inbred line 1538-3, the most suitable medium was MS + 0.5 mg/L 6-BA + 0.05 mg/L GA3. The best concentration of NAA for inducing the root of adventitious buds ranged from 0 to 0.2 mg/L in both inbred lines.【Conclusion】The ability of the two genotypes of oil sunflower to induce adventitious bud is different. Among them, the inbred line 1538-3 has stronger regeneration ability, and it is better to choose the 1538-3 axis as the transformation receptor in the genetic transformation.
HelianthusannuusL.; hypocotyl; tissue culture; regeneration system
SUN Li (1971- ), female, Native place: Shanxian, Shandong. Associate Professor, Research field: Plant physiology and molecular biology. (E-mail) sunlishz@126.com
10.6048/j.issn.1001-4330.2017.07.005
2017-03-24
国家自然科学基金项目“油葵DGAT1和DGAT2基因调控含油量和脂肪酸组分的分子机制”(31360052)
周茜萍(1990-),女,甘肃武威人,硕士研究生,研究方向为基因资源的研究与评价,(E-mail)zxpshzu@163.com
孙黎(1971-),女,山东单县人,副教授,研究方向为植物生理与分子生物学,(E-mial)sunlishz@126.com
S565.4
A
1001-4330(2017)07-1208-08
Supported by: the National Natural Science Foundation of China "Molecular Mechanism of DGAT1 and DGAT2 from Sunflower in Regulating Oil Content and Fatty Acid Composition" (31360052)

