利拉鲁肽调控PI3K-Akt-mTOR通路改善糖尿病肾病患者病情
沈艳萍, 乔 青, 李 明, 卢国元
苏州大学附属第一医院肾内科,苏州 215006
利拉鲁肽调控PI3K-Akt-mTOR通路改善糖尿病肾病患者病情
沈艳萍, 乔 青, 李 明, 卢国元
苏州大学附属第一医院肾内科,苏州 215006
目的 针对糖尿病肾病患者应用利拉鲁肽进行干预,从而探讨药物的治疗效果和作用机制。方法 选取糖尿病肾病患者,实验组给予利拉鲁肽干预,对照组给予常规治疗,采集各组患者血液及尿液进行血糖、血脂、肾功能、炎性因子、全段成纤维细胞生长因子-23(iFGF-23)以及α-Klotho蛋白含量的检测,提取外周血单个核细胞进行信号通路的检测。结果 在血糖方面,与治疗前比较,实验组空腹血糖(FBG)及糖化血红蛋白(HbAlc)含量显著降低(均P<0.05)。在血脂方面,治疗后,相对于对照组,实验组患者总胆固醇(TC),三酰甘油(TG)及低密度脂蛋白胆固醇(LDL-C)含量显著降低,高密度脂蛋白胆固醇(HDL-C)含量显著升高(均P<0.05)。在肾功能方面,相对于对照组,实验组患者血肌酐(Scr),尿微量白蛋白(Umalb)、尿白蛋白/尿肌酐比值(ACR)含量显著降低,肾小球滤过率(GFR)显著升高(均P<0.05)。在炎性因子方面,相对于对照组,实验组TNF-α、IL-1及IL-6含量显著降低(均P<0.05)。在iFGF-23及α-Klotho蛋白含量方面,相对于对照组,实验组患者iFGF-23含量显著降低,α-Klotho含量显著升高(均P<0.05)。信号通路方面,与对照组比较,治疗后实验组患者磷脂酰肌醇(-3)激酶(PI3K),蛋白激酶B(Akt),雷帕霉素靶蛋白(mTOR)含量显著降低(均P<0.05)。结论 利拉鲁肽可通过调控PI3K-Akt-mTOR通路改善糖尿病肾病患者病情,为临床用药提供了理论基础。
利拉鲁肽; 糖尿病肾病; 炎性因子; iFGF-23; α-Klotho; PI3K-Akt-mTOR通路
随着居民生活水平的提高,糖尿病肾病(DKD)发病率逐年升高,作为糖尿病最常见的微血管并发症,它严重危害着患者的身心健康。DKD患者初期虽然病情不显著,进展缓慢,但随病情进展,患者会逐渐出现蛋白尿、肾功能损伤,进而发展为终末期肾病[1]。DKD的发生发展机制至今不明,但多数研究认为由血糖和血脂的紊乱,及伴随的炎性状态,导致疾病的发展。已有研究表明,全段成纤维细胞生长因子-23(iFGF-23),α-Klotho蛋白与DKD疾病进展密切相关[2-3]。目前临床上治疗2型糖尿病的药物有多种,胰高糖素样肽-1(GLP-1)因较好的疗效及较少的副作用被临床广为应用。利拉鲁肽是GLP-1的同源类似物,已有研究表明,利拉鲁肽可通过调控PI3K-Akt-mTOR通路保护肾功能[4],然而有关该药物改善DKD的机制至今不明。因此,本研究针对DKD患者给予利拉鲁肽干预,观察干预后患者血糖、血常规、肾功能、体内炎性因子分泌及FGF-23、α-Klotho蛋白变化,探讨药物对疾病的干预途径。
1 资料与方法
1.1 研究对象
选取2015年1月至2016年12月在苏州大学附属第一医院首次就诊的60例DKD患者,其中患者须符合以下诊断标准[5]:(1)须符合WHO的糖尿病诊断标准;(2)根据Mogensen标准应符合DKD诊断,且为Ⅲ期患者。患者入院前6月未服用免疫相关药物及激素,患者无高血压,无其他免疫系统疾病及肿瘤疾病,无其他心肺功能异常,近期无感染及外伤,患者及家属均知情同意。将60例患者随机分为2组(n=30),即实验组和对照组。其中实验组男性17例,女性13例,年龄为51~75岁,体重指数(body mass index,BMI)为(27.9±9.3)kg/m2。对照组男性16例,女性14例,年龄为52~74岁,BMI为(28.1±10.1)kg/m2。2组患者在年龄、性别和BMI方面的差异无统计学意义(均P>0.05)。
1.2 治疗方法
所有受试者均接受低盐低蛋白优质饮食。其中实验组给予奥美沙坦口服20 mg/d,利拉鲁肽皮下注射,第1周0.6 mg/d,以后维持1.2 mg/d。对照组给予奥美沙坦口服20 mg/d,皮下注射胰岛素。受试者均连续治疗6个月,观察不良反应的发生,并于治疗前及治疗结束后采集血液及尿液进行后续检查。
1.3 基本指标检测
取患者静脉血及尿液,送检验科进行血糖、血脂和肾功能的检测。其中,检测血糖的指标为空腹血糖(FBG)及糖化血红蛋白(HbA1c)。检测血脂的指标为总胆固醇(TC),三酰甘油(TG),低密度脂蛋白胆固醇(LDL-C),高密度脂蛋白胆固醇(HDL-C)。肾功能的检测是以下指标:血肌酐(Scr),尿微量白蛋白(UmAlb)、尿白蛋白/尿肌酐比值(ACR)。并根据公式计算出肾小球滤过率(GFR),为175×(Scr)-1.234×年龄-0.179,女性计算值×0.79。
1.4 酶联免疫吸附测定实验
患者血液常温静置2 h后,12 000 r/min离心15 min,取上清置于新的离心管深冻冰箱保存备用。该实验方法用来检测肿瘤坏死因子-α(TNF-α)、IL-1、IL-6及血清iFGF-23、α-Klotho蛋白的含量,操作方法严格按照说明书进行,并置于酶标仪上进行吸光度值测定。
1.5 血液单个核细胞提取
最初的RRLs技术把群体中全部个体混合在一起,仅可完成对整个群体遗传参数的估测.为了获取群体中个体之间的遗传参数,需为个体赋予标签,完成区分.针对得到的测序片段,按照是否存在质量很高的参考基因组完成相应处理:如果有高质量的参考基因组,则可把得到的测序片段和基因组进行对比找到SNP标记,与基因组重测序技术类似[19];如果无高质量的参考基因组,需完成对测序片段的从头拼接,将拼接后的片段当成参考序列完成比较,以获取SNPs.现阶段RRLs技术被广泛应用于SNP标记开发、遗传多样性分析和性状关联分析等领域[20-22].
将血液标本与等量PBS缓冲液混合,然后将混合液小心加入淋巴分离液上面,2 000 r/min离心30 min。离心后,小心取出离心管,不要晃动,用吸管轻轻吸出中间的白膜层,置于另一离心管中,加入7 mL PBS缓冲液清洗2次,即可得到单个核细胞。
1.6 蛋白印迹实验
取单个核细胞,加入含1%PMSF的RIPA裂解液,12 000 g,4℃,离心30 min取上清,应用蛋白定量检测蛋白浓度后,将各样品浓度配齐,并加入上样缓冲液煮沸变性。上样跑胶,转膜,封闭,加入磷脂酰肌醇(-3)激酶(PI3K)、蛋白激酶B(Akt)、雷帕霉素靶蛋白(mTOR)及内参β-actin的一抗4℃过夜,第2天辣根过氧化物酶二抗常温孵育2 h,在暗室内进行显影定影,结果应用Image-plus软件测量灰度值。
1.7 统计学方法
2 结果
2.1 各组患者血糖指标比较

表1 各组患者血糖指标比较Table 1 Comparison of indexes related to plasma glucose in each group(±s)
与治疗前比较,*P<0.05
2.2 各组患者血脂指标比较
治疗前,2组患者TC、TG、LDL-C及HDL-C含量无明显区别(均P>0.05)。治疗后,相对于对照组,实验组患者TC、TG及LDL-C含量显著降低(均P<0.05);HDL-C含量显著升高(P<0.05)。实验组和对照组患者各自与治疗前比较,患者治疗后TC、TG及LDL-C含量显著降低(均P<0.05);HDL-C含量显著升高(均P<0.05)。具体见表2。

表2 各组患者血脂指标比较Table 2 Comparison of indexes related to blood lipids in each group(±s)
与同组治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 各组患者肾功能比较
治疗前,2组患者Scr、UmAlb、ACR含量及GFR无明显区别(均P>0.05)。治疗后,相对于对照组,实验组患者Scr,UmAlb、ACR含量显著降低(均P<0.05);GFR显著升高(P<0.05)。实验组和对照组患者各自与治疗前比较,患者治疗后Scr,UmAlb及ACR含量显著降低(均P<0.05);GFR显著升高(均P<0.05)。具体见表3。

表3 各组患者肾功能指标比较Table 3 Comparison of indexes related to renal function in each group(±s)
与同组治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 各组患者炎性因子含量比较
治疗前,两组患者TNF-α、IL-1、IL-6含量无明显区别(均P>0.05)。治疗后,相对于对照组,实验组患者TNF-α、IL-1、IL-6含量显著降低(均P<0.05)。实验组和对照组患者各自与治疗前比较,患者治疗后TNF-α、IL-1、IL-6含量显著降低(均P<0.05)。具体见表4。

表4 各组患者炎性因子含量比较Table 4 Comparison of expression of inflammatory factors in each group(±s)
与同组治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.5 各组患者血清iFGF-23、α-Klotho蛋白含量比较
治疗前,2组患者iFGF-23、α-Klotho蛋白含量无明显区别(均P>0.05)。治疗后,相对于对照组,实验组患者iFGF-23含量显著降低(P<0.05);α-Klotho含量显著升高(P<0.05)。实验组和对照组患者各自与治疗前比较,治疗后患者iFGF-23含量显著降低(均P<0.05);α-Klotho含量显著升高(均P<0.05)。具体见表5。

表5 各组患者iFGF-23及α-Klotho含量比较Table 5 Comparison of expression of iFGF-23 and α-Klotho in each group(±s)
与同组治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.6 各组患者单核细胞PI3K、Akt、mTOR蛋白含量比较
治疗前,2组患者PI3K、Akt、mTOR蛋白含量无明显区别(均P>0.05)。治疗后,相对于对照组,实验组患者PI3K、Akt、mTOR含量显著降低(均P<0.05)。实验组和对照组患者各自与治疗前比较,治疗后患者PI3K、Akt、mTOR含量显著降低(均P<0.05)。具体见图1。
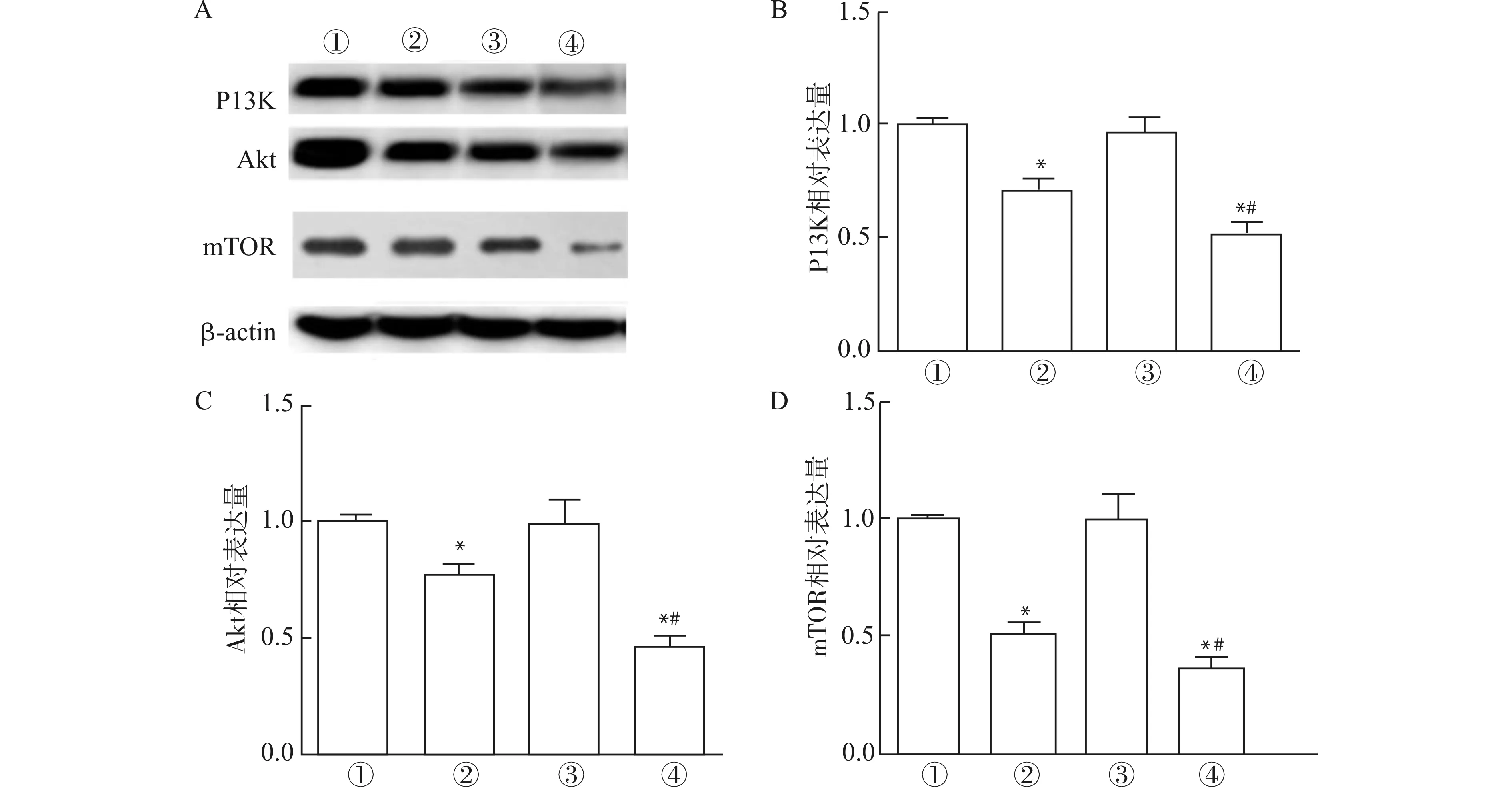
①对照组治疗前;②对照组治疗后;③实验组治疗前;④实验组治疗后;A:各组患者PI3K、Akt、mTOR蛋白表达;B:各组患者PI3K蛋白表达灰度值比较;C:各组患者Akt蛋白表达灰度值比较;D:各组患者mTOR蛋白表达灰度值比较;与同组治疗前比较,*P<0.05;与对照组治疗后比较,#P<0.05图1 各组患者PI3K、Akt、mTOR蛋白表达Fig.1 Expression of PI3K,Akt and mTOR protein in each group
3 讨论
DKD作为糖尿病较为常见的并发症,主要病理表现为肾小球纤维化及硬化,肾功能受损等,多种因素均可诱发[6-7],然而其发病机制至今未明。越来越多的研究认为DKD是一种炎性疾病,多种炎性因子如单核细胞趋化蛋白-1、C反应蛋白及结缔组织生长因子等均参与疾病过程中[8]。TNF-α可通过改变内皮细胞功能调控肾脏功能,还可通过促进前列腺素的合成,诱导更多的炎性因子分泌,加重DKD的病情[9]。IL-1可诱导肾细胞分泌细胞间黏附因子-1以及血管细胞黏附分子-1表达,从而加重肾脏的损伤。并且,体内IL-6可增加毛细血管通透性,分泌更多黏附因子,加重蛋白尿的生成[10]。
利拉鲁肽是GLP-1的同源类似物,是新型的降糖药物,然而国内对其应用于DKD患者身上的研究较少。本研究可以看出,在血糖方面,实验组患者与治疗前比较,FBG及HbA1c含量显著降低,提示利拉鲁肽降糖效果可达到常规药物作用。在血脂方面,相对于对照组,实验组患者治疗后TC、TG及LDL-C含量显著降低,HDL-C含量显著升高,说明了利拉鲁肽调控血脂的能力大大增强。在肾功能方面,相对于对照组,实验组患者治疗后Scr、UmAlb、ACR含量显著降低,GFR显著升高,也说明了利拉鲁肽改善肾功能的能力。在炎性因子分泌方面,相对于对照组,实验组患者治疗后TNF-α、IL-1、IL-6含量显著降低,提示了利拉鲁肽降低体内炎性因子的能力。研究发现,DKD患者体内TNF-α含量显著升高,与疾病严重程度呈正相关[9]。并且,在糖尿病大鼠体内,IL-1及IL-6含量均显著增加,分泌量与疾病呈正相关,均提示炎性因子的致病作用,与本研究吻合[11]。
相对于对照组,实验组患者iFGF-23含量显著降低,α-Klotho含量显著升高,提示相比于常规药物,利拉鲁肽调控iFGF-23、α-Klotho含量的能力大大增强。作为成纤维细胞因子,iFGF-23与维生素D的代谢和磷的重吸收有密切关系,其可负性调节维生素D含量,并抑制钠磷协同转运蛋白家族分子,从而增加尿磷的排出,并影响肾脏对磷的重吸收[12-13]。α-Klotho蛋白可显著保护肾功能,动物体内转入α-Klotho基因后,可显著改善肾功能,表现为肾小管细胞凋亡降低及肾损伤的改善[14]。在DKD患者体内,α-Klotho蛋白可抑制血管钙化,改善心肌功能[15]。本研究与之前研究均吻合,均佐证了iFGF-23、α-Klotho在DKD发病机制中的重要性,也提示了本研究的意义。
我们发现,利拉鲁肽可以降低PI3K-Akt-mTOR通路活性,发挥疾病调节作用。这一结果与国内外多项研究吻合[16-18],均提示利拉鲁肽可以显著改善DKD患者的病情。研究发现,针对糖尿病肾病大鼠模型,利拉鲁肽可通过调控PI3K-Akt-mTOR通路显著减轻大鼠血糖含量[4],改善肾功能,从而改善大鼠疾病情况。然而针对患者体内的研究仍然缺如,本研究从患者层面探讨了利拉鲁肽的药物治疗机制,更加直接地论证了药物的治疗作用。
综上所述,本研究应用利拉鲁肽治疗DKD患者,从多方面验证利拉鲁肽的药物治疗作用,并且还发现了利拉鲁肽可通过PI3K-Akt-mTOR通路参与疾病的发生发展,为临床用药提供了理论基础。
[1] 朱锐,陈建武,刘与进,等.积雪排毒汤1号对糖尿病肾病小鼠肾损伤的保护作用及机制[J].华中科技大学学报:医学版,2015,44(6):622-628.
[2] Humalda J K,Seiler-Muler S,Kwakernaak A J,et al.Response of fibroblast growth factor 23 to volume interventions in arterial hypertension and diabetic nephropathy[J].Medicine(Baltimore),2016,95(46):e5003.
[3] Asai O,Nakatani K,Tanaka T,et al.Decreased renal α-Klotho expression in early diabetic nephropathy in humans and mice and its possible role in urinary calcium excretion[J].Kidney Int,2012,81(6):539-547.
[4] 陈瑾.利拉鲁肽抑制mTOR表达延缓糖尿病肾损伤的机制研究[D].上海:第二军医大学,2015.
[5] 李慧,高方,薛耀明,等.2型糖尿病肾病患者生长分化因子-15的表达及临床意义[J].南方医科大学学报,2014,34(3):387-390,395..
[6] 林子桐,张超,沈雪梅,等.糖尿病肾病发病机制研究进展[J].中国药理学与毒理学杂志,2014,28(5):765-773.
[7] 闫寒,马博清,付彩雯,等.糖尿病肾病发病机制研究进展[J].中国老年学杂志,2015,35(20):5973-5975.
[8] 李玮,苏文弟.糖尿病肾病分子发病机制及临床应用研究进展[J].国际泌尿系统杂志,2015,35(6):953-955.
[9] 王勾琴,周小春,王俭勤,等.TGF-β1相关microRNA在糖尿病肾病发病机制中的研究进展[J].医学综述,2015,21(19):3548-3550.
[10] Navarro-González J F,Mora-Fernández C.The role of inflammatory cytokines in diabetic nephropathy[J].J Am Soc Nephrol,2008,19(3):433-442.
[11] Karadag S,Sakci E,Uzun S,et al.The correlation of inflammatory markers and plasma vaspin levels in patients with diabetic nephropathy[J].Ren Fail,2016,38(7):1044-1049.
[12] Dogan B,Arikan I H,Guler D,et al.Fibroblast growth factor-23 but not sKlotho levels are related to diastolic dysfunction in type 1 diabetic patients with early diabetic nephropathy[J].Int Urol Nephrol,2016,48(3):399-407.
[13] Yilmaz M I,Sonmez A,Saglam M,et al.Ramipril lowers plasma FGF-23 in patients with diabetic nephropathy[J].Am J Nephrol,2014,40(3):208-214.
[14] 张宝玉.2型糖尿病肾病患者血清iFGF-23、α-Klotho蛋白、NLR、PLR水平变化的研究[D].北京:北京协和医学院中国医学科学院,2015.
[15] Hu M C,Shi M,Zhang J,et al.Klotho deficiency causes vascular calcification in chronic kidney disease[J].J Am Soc Nephrol,2011,22(1):124-136.
[16] 郑焱,於松达.利拉鲁肽联合甘精胰岛素治疗2型糖尿病肾病的疗效观察[J].现代实用医学,2015,27(2):251-253.
[17] 杨冉,王韫芳,张维,等.利拉鲁肽联合替米沙坦对早期糖尿病肾病患者血中TNF-α、IL-6及TGF-β1水平的影响[J].西部医学,2016,28(2):191-194.
[18] 江思瑜,梁婵,吴晓光,等.利拉鲁肽对糖尿病肾病患者炎症因子影响的研究进展[J].中国药房,2017,28(2):280-283.
(2017-02-27 收稿)
Effect of Liraglutide on PI3K-Akt-mTOR Pathway in Patients with Diabetic Nephropathy
Shen Yanping,Qiao Qing,Li Mingetal
Department of Nephrology,The First Affiliated Hospital of Soochow University,Suzhou 215006,China
Objective To investigate the therapeutic effect of liraglutide in patients with diabetic nephropath and related mechanism.Methods The patients in diabetic nephropathy were treated with liraglutide and the control group
routine treatment.The blood and urine of each group were taken to test blood glucose,blood lipid,kidney function,inflammatory factor,total fibroblast growth factor-23(IFGF-23)and α-Klotho protein content.Peripheral blood mononuclear cells were harvested for detection of the signal pathway.Results The contents of FBG and HbAlc in the experimental group were significantly lower than those in before the treatment(bothP<0.05).The levels of total cholesterol(TC),triglyceride(TG)and low density lipoprotein cholesterol(LDL-C)in the experimental group were significantly lower than those in the control group,while the level of HDL-C was significantly increased (allP<0.05).Renal function,serum creatinine(Scr),urinary microalbuminuria(Umalb),urinary albumin/creatinine ratio(ACR)were significantly decreased in the experimental group compared with the control group,and the glomerular filtration rate(GFR)was significantly increased(allP<0.05).As for inflammatory cytokines,the levels of TNF-α,IL-1 and IL-6 in the experimental group were significantly lower than those in the control group(allP<0.05).The content of iFGF-23 in the experimental group was significantly lower than that in the control group(P<0.05),and the level of α-Klotho was significantly increased(P<0.05).Kinase-3(PI3K),protein kinase B(Akt)and rapamycin target protein(mTOR)were significantly decreased in the experimental group as compared with those after the treatment in the control group(allP<0.05).Conclusion Liraglutide can improve the condition of diabetic nephropathy by regulating PI3K-Akt-mTOR pathway,which provides a theoretical basis for clinical drug use.
liraglutide; diabetic nephropathy; inflammatory factor; iFGF-23; α-Klotho; PI3K-Akt-mTOR pathway
R578.1
10.3870/j.issn.1672-0741.2017.04.019
沈艳萍,女,1982年生,医学硕士,主治医师,E-mail:ava1105@163.com

