外周血捕获循环肿瘤细胞的有效方法研究*
周洲,李良平,高采平,钟应佳,翟祎星,赖兵
[1.四川省医学科学院(四川省人民医院)消化内科,四川 成都 610072;2.地奥九泓制药厂前沿生物技术研究室,四川 成都 610041]
外周血捕获循环肿瘤细胞的有效方法研究*
周洲1,李良平1,高采平1,钟应佳2,翟祎星2,赖兵2
[1.四川省医学科学院(四川省人民医院)消化内科,四川 成都 610072;2.地奥九泓制药厂前沿生物技术研究室,四川 成都 610041]
目的 建立有效获取肿瘤患者外周血中单个循环肿瘤细胞(CTC)的方法。方法 预先将经DiI染色的SW480细胞混入健康成人的抗凝全血中,分别单独采用密度梯度离心(OncoQuick)、淋巴细胞分离术(Ficoll)、“玫瑰花富集”(RosetteSep)、免疫磁珠(CELLection)及淋巴细胞分离术联合免疫磁珠联用(Ficoll+CELLection)富集这些肿瘤细胞,统计回收率并观察纯度以进行比较。再使用显微操作仪捕获单个NCI-H460、HCT-116、DLD-1、SW480、TF-1等探测细胞及从肝癌患者外周血中富集获得的CTC,采用实时荧光定量聚合酶链反应(qRT-PCR)技术分析单细胞的CD45 mRNA表达水平。结果 5组方法的肿瘤细胞回收率分别为(52.5±3.5)%、(46.6±1.9)%、(36.9±5.5)%、(14.1±3.1)%和(8.8±1.4)%;单因素方差分析表明,5组方法回收率比较差异有统计学意义(P<0.05);SNK-q检验表明,除OncoQuick组和Ficoll组(P>0.05)、CELLection组和Ficoll+CELLection组(P>0.05)外,其他各组之间的差异均有统计学意义(P<0.05)。在荧光显微镜下观察富集的肿瘤细胞,发现CELLection组及Ficoll+CELLection组的纯度更高。qRT-PCR结果显示,总循环数60,GAPDH Ct均值为(29.94±0.59),除了单个TF-1细胞的CD45 Ct均值为(34.21±0.22),其他单个探测细胞及CTC的CD45均无表达。结论 CELLection即免疫磁珠法配合显微操作能有效获取肝癌患者外周血中的单个CTC并保留其原始的分子特性,适用于后续单细胞分析与研究。该方法为CTC运用于剖析肿瘤分子的特征、评价靶向治疗药物的药效以及监控肿瘤的复发与转移等临床问题奠定了基础。
循环肿瘤细胞;免疫磁珠法;显微操作
肿瘤转移是导致患者死亡的主要原因之一。它是一个多步骤、多因素相互作用的复杂过程。循环肿瘤细胞(circulating tumor cell,CTC)是由肿瘤原发灶或转移灶脱落并释放到外周血中的肿瘤细胞。其中部分CTC随着血液循环分散、黏附并逐渐发展成新的转移灶[1],可见其在肿瘤转移中发挥了重大作用。诸多实验结果表明,CTC与肿瘤的发生发展、早期转移密切相关[2-3]。由于它来源于肿瘤实体,检测血液中的CTC能获得更多个体化的肿瘤信息,以监控肿瘤的复发与转移、评价抗肿瘤药物的药效、分析患者的预后水平等。然而,患者外周血中的CTC数量极少[4],目前主要依据细胞密度及形态[5-6]或细胞表面免疫原性[7]分离并富集这些CTC,而后者的发展时间更长、技术相对更成熟、应用更多。
随着分子生物学的迅速发展,单细胞分析已成为研究疾病生物标志物、克隆多样性、致病分子机制等的重要技术手段,比如通过微芯片技术检测其临床标志物[8];通过微流控获得其相关物理特征[8];通过检测特定基因表达分析其转录特征或肿瘤突变情况[9];通过扫描离子电导显微镜搭建的纳米级研究平台在不影响细胞状态的的条件下取出其胞内物质如线粒体[10]。由于血液中CTC的数量极少且难以分离,上述手段并不适用。然而,目前针对CTC的研究亟需分析其分子如DNA、RNA、蛋白质等的特征[11],以研究其与肿瘤发生发展及转移的关联。因此,本次实验试图建立一种能维持分子特性、快速准确的CTC单细胞化方法。
通过传统的富集方法获得的CTC往往存在正常血液细胞如红细胞、白细胞、血小板的污染,为后续单细胞化及分析带来干扰。本文比较了5种商品化的富集CTC的方法,即密度梯度离心(Onco-Quick)、淋巴细胞分离术(Ficoll)、“玫瑰花富集”(RosetteSep)、免疫磁珠(CELLection)及淋巴细胞分离术联合免疫磁珠联用(Ficoll+CELLection)等,发现CELLection不仅能富集高纯度的CTC,还具有可接受的回收率。随后,利用显微操作平台挑选出的单个探测细胞和CTC,采用实时荧光定量聚合酶链反应(qRT-PCR)技术检测其生物标志物(白细胞分化抗原CD45)的mRNA表达水平。结果表明,通过CELLection即免疫磁珠法配合显微操作获得的单个CTC较完整地维持了其分子特性,适用于后续单细胞分析。
1 材料与方法
1.1 材料
四川省医学科学院、四川省人民医院初治肝癌患者1例,对其穿刺检测、收集癌组织并由病理学确诊,同时抽取外周血4 ml;健康成人的外周血取自输血全套检测合格的成人志愿者。实验所用细胞株(NCI-H460、HCT-116、DLD-1、SW480、TF-1)均购于美国模式培养物集存库(ATCC)。实验所用试剂:DiIC18(3)染料(DiI)(碧云天生物技术研究所);Ficoll-Paque PLUS(GE);OncoQuick(Greiner Bio-One);RosetteSep CTC Enrichment Cocktail Containing Anti-CD36(Stemcell);CELLection Epithelial Enrich(Invitrogen);Single Cell-to-CT qRT-PCR Kit(Ambion);SsoAdvanced SYBR Green Supermix(Bio-Rad)。实验所用仪器:PCR仪型号:S1000,购自Bio-Rad(美国);qRT-PCR仪型号:CFX96,购自Bio-Rad(美国);倒置荧光显微镜型号:DM IL LED,购自Leica(德国);显微操作仪型号:TransferManNK2,购自Eppendorf(德国)。
1.2 方法
1.2.1 血液样本 严格消毒之后,用真空采血针分别采集健康成人或肝癌患者肘正中静脉血4 ml入EDTA抗凝管,并于4 h内开展实验。
1.2.2 外周血中肿瘤细胞的富集 以SW480细胞作为阳性肿瘤细胞,预先用DiI将其染色,以100个/ 50μl的浓度加入4 ml健康成人的抗凝全血中。再分别用 OncoQuick、Ficoll、RosetteSep、CELLection、Ficoll+CELLection等方法富集这些肿瘤细胞,随后将肿瘤细胞悬液在光学显微镜下计数并观察,取直径≥10μm的细胞数比血液样本体积作为患者外周血中的CTC浓度。
1.2.3 肿瘤细胞的单细胞化 以 NCI-H460、HCT-116、DLD-1、SW480、TF-1等作为探测细胞,收集其经正常培养、胰酶消化后的细胞悬液及肝癌患者外周血中富集的CTC悬液,在光学显微镜下依据肿瘤细胞形态学特征(细胞呈圆形、椭圆形或梭形,直径≥10μm,细胞核完整而不规则,核浆比高等)利用显微操作平台(荧光显微镜搭配显微操作仪)挑取单个肿瘤细胞。
1.2.4 单细胞qRT-PCR检测生物标志物的mRNA表达水平 利用单细胞逆转录试剂盒提取上述单个肿瘤细胞的总RNA并逆转录为cDNA。先对其进行PCR预扩增:95℃预变性10 min,95℃15 s,60℃4 min,扩增14个循环。再将产物稀释后使用qRT-PCR检测:94℃预变性3 min,95℃10 s,60℃30 s,扩增60个循环。所用引物见附表,其中GAPDH的引物序列源于文献[12],CD45的引物序列为自行设计。

附表 qRT-PCR所用引物序列表
1.3 统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料用均数±标准差(±s)表示,用单因素方差分析,组间用SNK-q检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 免疫磁珠法是富集CTC的较优方法
先用OncoQuick、Ficoll、RosetteSep、CELLection等4种方法提取正常人的抗凝全血中预先加入的100个/50μl经DiI染色的SW480细胞,并将其移至荧光显微镜下的96孔板中计数。结果显示,4种方法的肿瘤细胞回收率分别为:OncoQuick(52.5± 3.5)%,Ficoll(46.6±1.9)%,RosetteSep(36.9±5.5)%,CELLection(14.1±3.1)%。在光镜下观察发现,虽然OncoQuick有最高的回收率,但富集的CTC纯度偏低(见图1H),严重影响后续单细胞化操作;CELLection则反之。于是,本实验试图将Ficoll+CELLection联用以期在CTC的回收率和纯度上均维持较高水平。该方案先用Ficoll大量分离并去除血液样本中的白细胞,再用CELLection富集EpCAM表达阳性的CTC。结果显示,Ficoll+CELLection组富集的CTC虽然纯度较Ficoll组或CELLection组更高(见图1J),但其回收率降至(8.8±1.4)%,且繁琐的步骤不利于成功富集血液样本中原本数量就极少的CTC。单因素方差分析表明,上述5组方法回收率的差异有统计学意义(F=97.95,P<0.05);SNK-q检验表明,除OncoQuick组和Ficoll组(P=0.075)、CELLection组和Ficoll+CELLection组(P=0.080)外,其他各组之间的差异均有统计学意义(P<0.05)。综上所述,本实验最终选择单独采用CELLection富集用于后续单细胞化的CTC。
2.2 CTC的单细胞化
采集肝癌伴腹膜转移病人血液样本4 ml,采用CELLection富集其中的CTC,肿瘤细胞悬液计数为58个/ml(见图2A)。富集后的CTC存在正常血液细胞的污染,这直接影响CTC分子水平的检测与分析。因此,利用光学显微镜观察细胞形态,辅以显微操作平台挑取选定的单个CTC用于后续实验。为维持CTC原有的分子特性,本实验依据CTC体积大(直径大于≥10μm)、细胞核完整而不规则、核浆比高等特征进行挑选,而未经EpCAM荧光抗体染色(见图2B)。
2.3 单细胞化CTC的鉴定
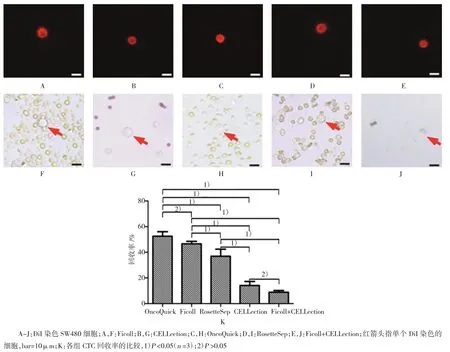
图1 CELLection富集CTC有高纯度及可接受的回收率
收集经正常培养、胰酶消化后的NCI-H460、HCT-116、DLD-1、SW480、TF-1等探测细胞悬液,利用显微操作平台从中挑取单个肿瘤细胞作为对照,利用qRT-PCR技术检测其CD45的mRNA表达水平,其中Ct值(循环阈值)与模板中的目的基因cDNA分子数成正比。由于单个细胞中总RNA量本就偏少,还需均分cDNA作为模板检测内参及目的基因的mRNA表达水平,在qRT-PCR后加入了预扩增步骤,并将循环数设为60次。结果显示,探测细胞除红系白血病细胞TF-1外,其余4种上皮来源的细胞株单个细胞均未检测到CD45 mRNA的表达(Ct值>60);单个TF-1的CD45 Ct均值为(34.21± 0.22)(n=3);5种单个细胞的GAPDH Ct值都<35且差异较小(见图3A)。上述结果说明,5种探测细胞仅TF-1高表达CD45,而其余上皮来源的贴壁细胞无表达,与预期相符;制备的单细胞cDNA具有较好的浓度和质量;该实验方案稳定可靠,能进一步甄别CTC和白细胞。值得注意的是,单个TF-1 CD45的扩增曲线和熔解曲线良好(见图3C、3D),说明这次自行设计的引物能特异性扩增CD45。随后,采用上述的方法富集并单细胞化肝癌患者血液样本中的CTC,检测其CD45的mRNA表达水平。结果显示,挑取的CTC①、②、③CD45均无表达(图3B),与上述4种单个上皮样探测细胞的结果一致。该结果说明CELLection配合显微操作单细胞化CTC的方案消除了正常血细胞的污染,降低了假阳性率,为后续检测与分析提供了高质控标准的实验对象。
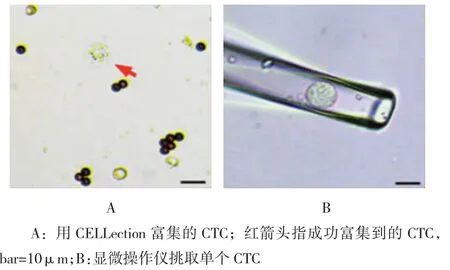
图2 CTC的单细?胞化
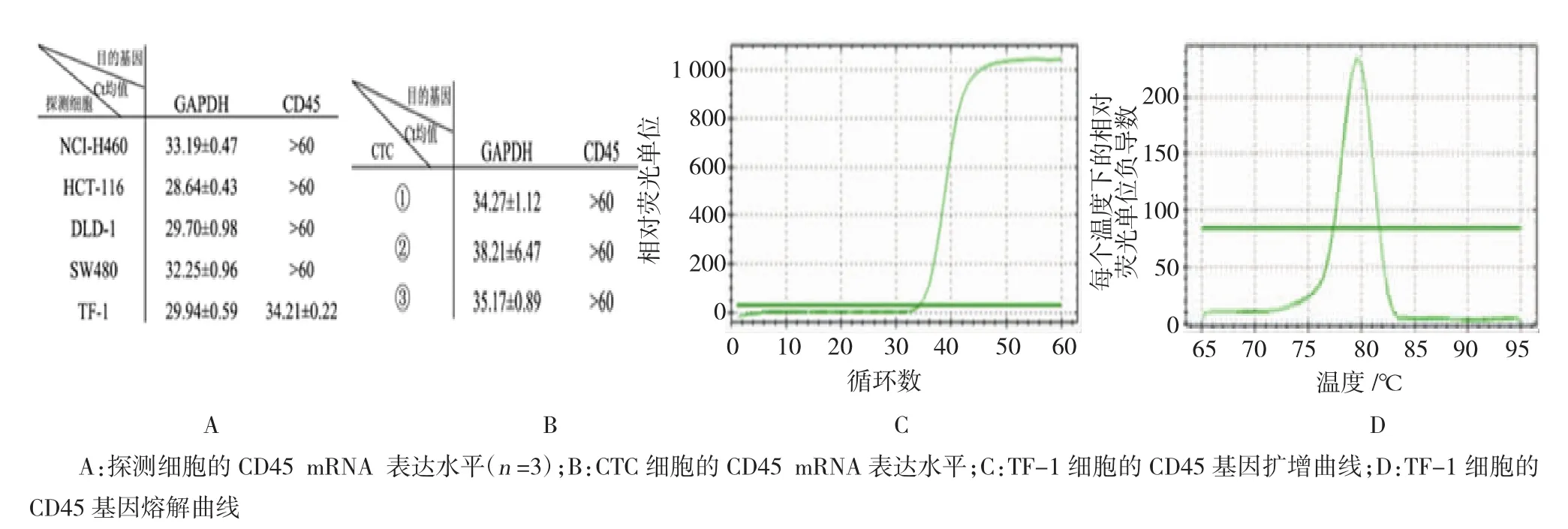
图3 单细胞化CTC的鉴定
3 讨论
侵袭和转移是恶性肿瘤重要的生物学特性。CTC在肿瘤转移中发挥重要的作用,并对评价疗效、推测预后等具有重要意义[13-15]。对于已确诊的肿瘤患者,分析其外周血中的CTC能提供更多的病理信息,进而准确获得维持原有分子特性的CTC是体现其应用价值的前提条件。迄今为止,CTC的富集方法主要基于细胞大小及形态、细胞特性如细胞密度、细胞表面免疫原性等[16]。本文首先比较了多种CTC富集方法的回收率及纯度,体现出免疫磁珠法的优势,随后利用显微操作仪实现了富集后CTC的单细胞化,并通过检测生物标志物的表达水平鉴定了单个CTC的分子特性。
本文中所用的多种CTC富集方法均存在一定的局限:①OncoQuick依据细胞密度及直径大小分离并富集CTC[17],其步骤中初步分离的肿瘤细胞用50 ml洗液混匀再经离心后最终CTC悬液体积约300μl。该方法虽然回收率高,但血小板、红细胞、白细胞等污染明显。②CELLection是以带EpCAM抗体的磁珠去捕获并富集血液样本中的上皮样CTC。该方法富集的CTC纯度高,最终细胞液体积仅100~200μl,但步骤繁多,如反复多次的清洗磁珠,易导致较低的回收率。③Ficoll依据细胞密度有效分离血液中的CTC和红细胞,但无法除去白细胞和血小板。因此,尽管它的回收率高,一般仍需与其他方法联用来富集高纯度的CTC。本研究尝试Ficoll+ CELLection联用富集最高纯度的CTC,但繁琐的步骤不利于成功富集血液样本中原本数量就极少的CTC。④RosetteSep先用抗体集结红细胞成团,再以密度梯度离心分离CTC和血细胞团。通过该方法富集的CTC中常含有凝集的红细胞团,且红细胞团常与CTC聚集到一起。综上所述,本实验最终选择了相对较优的CELLection富集EpCAM阳性的CTC。
显微操作能准确挑取单个细胞用于检测与分析,对细胞损伤小,可有效维持其原有的分子特性。本研究选择该方法将富集后的CTC单细胞化,挑取形态、体积与正常血细胞显著不同的细胞。随后,本文还鉴定出单个探测细胞及挑取的CTC CD45均无表达,进一步验证了上述联合方法的可行性和准确度。
相较于穿刺活检,检测分析单个CTC对患者的伤害小,实时性和可操作性高。单细胞化的CTC还可用于体外培养建系,建立人源肿瘤模型[18],分析CTC之间以及病例之间的差异性[19]等后续实验,进一步在化疗药物筛选的基础上找到更适合患者的个体化治疗方案。综上所述,本研究为CTC的单细胞分析提供了切实可行的前置方案,为实现CTC在肿瘤患者临床问题中的应用奠定了基础。
本文通过比较 OncoQuick、Ficoll、RosetteSep、CELLection、Ficoll+CELLectio 5种方法富集外周血中肿瘤细胞的回收率及纯度,建立起CELLection即免疫磁珠法配合显微操作成功分离并鉴定肝癌患者外周血中的单个CTC的方法,为其运用于剖析肿瘤分子的特征、评价靶向治疗药物的药效、监控肿瘤的复发与转移等临床问题奠定了基础。
[1]PACHMANN K,CLEMENT J H,SCHNEIDER C P,et al.Standardized quantification of circulating peripheral tumor cells from lung and breast cancer[J].Clin Chem Lab Med,2005,43(6): 617-627.
[2]HUSEMANN Y,GEIGL J B,SCHUBERT F,et al.Systemic spread is an early step in breast cancer[J].Cancer Cell,2008, 13(1):58-68.
[3]MULLER V,STAHMANN N,RIETHDORF S,et al.Circulating tumor cells in breast cancer:correlation to bone marrow micrometastases,heterogeneous response to systemic therapy and low proliferative activity[J].Clin Cancer Res,2005,11(10):3678-3685.
[4]MILLER M C,DOYLE G V,TERSTAPPEN L W.Significance of circulating tumor cells detected by the cellsearch system in patients with metastatic breast colorectal and prostate cancer[J].J Oncol,2010,2010:617421-617429.
[5]FRIEDERICHS J,GERTLER R,ROSENBERG R,et al.Correlation of CK-20-positive cells in peripheral venous blood with serum CEA levels in patients with colorectal carcinoma[J].World J Surg,2007,31(12):2329-2334.
[6]BALIC M,DANDACHI N,HOFMANN G,et al.Comparison of two methods for enumerating circulating tumor cells in carcinoma patients[J].Cytometry B Clin Cytom,2005,68(1):25-30.
[7]GLEGHORN J P,PRATT E D,DENNING D,et al.Capture of circulating tumor cells from whole blood of prostate cancer patientsusing geometrically enhanced differentialimmunocapture (GEDI)and a prostate-specific antibody[J].Lab Chip,2010,10 (1):27-29.
[8]PAGADUAN J V,SAHORE V,WOOLLEY A T.Applications of microfluidics and microchip electrophoresis for potential clinical biomarker analysis[J].Anal Bioanal Chem,2015,407(23):6911-6922.
[9]MOIGNARD V,GOTTGENS B.Transcriptional mechanisms of cell fate decisions revealed by single cell expression profiling[J]. Bioessays,2014,36(4):419-426.
[10]ACTIS P,MAALOUF M M,KIM H J,et al.Compartmental genomics in living cells revealed by single-cell nanobiopsy[J]. ACS Nano,2014,8(1):546-553.
[11]STAHLBERG A,THOMSEN C,RUFF D,et al.Quantitative PCR analysis of DNA,RNAs,and proteins in the same single cell[J].Clin Chem,2012,58(12):1682-1691.
[12]ZHANG Y,BA Y,LIU C,et al.PGC-1alpha induces apoptosis in human epithelial ovarian cancer cells through a PPARgamma-dependent pathway[J].Cell Res,2007,17(4):363-373.
[13]O'FlAHERTY J D,GRAY S,RICHARD D,et al.Circulating tumour cells,their role in metastasis and their clinical utility in lung cancer[J].Lung Cancer,2012,76(1):19-25.
[14]REUBEN J M,KRISHNAMURTHY S,WOODWARD W,et al. The role of circulating tumor cells in breast cancer diagnosis and prediction of therapy response[J].Expert Opin Med Diagn, 2008,2(4):339-348.
[15]JURATLI M A,SIEGEL E R,NEDOSEKIN D A,et al.In vivo long-term monitoring of circulating tumor cells fluctuation during medical interventions[J].PLoS One,2015,10(9):e0137613.
[16]WU L J,PAN Y D,PEI X Y,et al.Capturing circulating tumor cells of hepatocellular carcinoma[J].Cancer Lett,2012,326 (1):17-22.
[17]HUANG L,CHENG H C,LSOM R,et al.Protein kinase cepsilon mediates polymeric fibronectin assembly on the surface of blood-borne ratbreastcancer cells to promote pulmonary metastasis[J].J Biol Chem,2008,283(12):7616-7627.
[18]YU M,BARDIA A,ACETO N,et al.Cancer therapy.Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility[J].Science,2014,345(6193):216-220.
[19]DENG G,KRISHNAKUMAR S,POWELL A A,et al.Single cell mutational analysis of PIK3CA in circulating tumor cells and metastases in breast cancer reveals heterogeneity,discordance,and mutation persistence in cultured disseminated tumor cells from bone marrow[J].BMC Cancer,2014,14(1):456-468.
(张西倩 编辑)
Isolation of single circulating tumor cell from peripheral blood of liver cancer patients by immunomagnetic beads and micromanipulation*
Zhou Zhou1,Liang-ping Li1,Cai-ping Gao1,Ying-jia Zhong2,Yi-xing Zhai2,Bing Lai2
[1.Department of Gastroenterology,Sichuan Academy of Medical Sciences(Sichuan Provincial People's Hospital),Chengdu,Sichuan 610072,China;2.Laboratory of Advanced Biotechnology,
Di'ao Jiuhong Pharmaceutical Company,Chengdu,Sichuan 610041,China]
Objective To isolate single circulating tumor cell(CTC)from peripheral blood of liver cancer patients. Methods Four commercial kits including OncoQuick,Ficoll-Paque PLUS (Ficoll),RosetteSep and CELLection,as well as Ficoll-CELLection-combination were used to enrich DiI-stained SW480 cells added to peripheral blood of healthy adults.In order to compare the above five methods,recovery and purity of enriched tumor cells were counted or observed.Then,detection cells including NCI-H460,HCT-116,DLD-1,SW480 and TF-1,and CTCs from the peripheral blood of liver cancer patients were isolated by micromanipulation individually.Subsequently,mRNAexpression level of CD45 antigen,the leukocyte common antigen,was detected by qRT-PCR.Results Compared in pairs,the recovery of the five methods[OncoQuick(52.5±3.5)%,Ficoll(46.6±1.9)%,RosetteSep(36.9±5.5)%, CELLection(14.1±3.1)%and Ficoll-CELLection-combination(8.8±1.4)%]revealed significant differences(P<0.05)except for OncoQuick and Ficoll(P>0.05),CELLection and Ficoll-CELLection-combination(P>0.05)by one-way ANOVA test and SNK-q method.Moreover,CELLection and Ficoll-CELLection-combination enriched tumor cells with higher purity when they were observed under fluorescent microscope.In addition,CD45 mRNA expression of all single detection cells and CTC were negative except TF-1(mean Ct within 60 cycles:TF-1(34.21 ±0.22),GAPDH (29.94±0.59),others none;n=3).Conclusions The combination of immunomagnetic beads and micromanipulation is an effective method to isolate single CTC from peripheral blood of liver cancer patients.The captured single CTC keeps its original molecular characteristics for subsequent single-cell analysis.Furthermore,our method lays a foundation for clinical application of CTC,for tumor molecular characteristic analysis,therapeutic effect evaluation and treatment monitoring.
circulating tumor cell;immunomagnetic beads;micromanipulation
R730.4
A
2016-11-13
四川省科技厅资助项目(No:2014TD0028)
赖兵,E-mail:laib76@139.com;Tel:028-82855467· 34·
10.3969/j.issn.1005-8982.2017.19.007
1005-8982(2017)19-0034-06

