体外消化/Caco-2细胞模型分析发酵对面粉铁生物利用率的影响
雷 激,黄承钰
体外消化/Caco-2细胞模型分析发酵对面粉铁生物利用率的影响
雷 激1,黄承钰2
(1.西华大学食品与生物工程学院,四川 成都 610039;2.四川大学华西公共卫生学院,四川 成都 610041)
中国居民膳食以谷物为主食,谷物中铁吸收率低是造成营养性贫血的主要原因,适当的加工方式可缓解谷物中植酸、多酚等物质对铁生物利用率(Fe bioavailability,Fe BV)的影响。为考察酵母发酵对面粉Fe BV的影响,采用体外消化/Caco-2细胞模型。结果表明,面团在发酵后pH值呈下降趋势,酸度呈上升趋势;多酚、植酸含量降低,植酸酶活性升高,以上各指标在发酵前后差异均具有统计学意义(P<0.05)。发酵后面粉样品的Fe BV增加约5%~38%,大多数面粉Fe BV发酵前后比较,差异具有统计学意义(P<0.05)。结论:发酵可降低面粉的pH值,增加酸度,有利于面粉多酚和植酸的降解以及植酸酶活力的升高,可有效提高面粉Fe BV。
小麦面粉;铁生物利用率;发酵;体外消化/Caco-2细胞模型
据世界卫生组织统计,缺铁性贫血是全球普遍存在的营养性缺乏症,其发生率为儿童43%,非孕期妇女29%,孕妇38%[1];中国居民膳食以小麦等谷物为主食,缺铁现象在国内尤其是贫困地区普遍存在。谷物类主食中含有大量的植酸、多酚类等抑制铁吸收的因子,严重影响了铁的生物利用率(Fe bioavailability,Fe BV),导致人体铁的普遍缺乏,谷物的铁吸收率低是造成营养性贫血的主要原因[2]。
植酸、多酚等因素对小麦等谷物中铁吸收利用的影响已被广泛认同[3-4],如果能找到一种经济适用、操作简便、符合人们饮食习惯的加工方法对小麦面粉进行合理加工,降低面粉中植酸、多酚等抑制因子的含量,可望提高小麦的Fe BV,这对指导人们正确加工面粉、合理食用面粉、充分发挥小麦的功能、改善缺铁人群的健康现状将会产生积极的影响。资料显示,适当的食品加工方式如浸泡、发芽、发酵等可缓解植酸对非血红素铁吸收的抑制作用[5-7],国外有对小麦麸皮添加酵母[8]以及对面团进行乳酸发酵研究发现植酸含量可降低[9],也有报道浸泡发芽处理蚕豆可降解其植酸和多酚[10],还有研究发现发酵可降低高粱和小米中多酚含量[11],而有关面粉进行酵母发酵对Fe BV的影响还鲜见报道。对面粉进行酵母发酵是面粉加工常用的方法,人们食用的面包、馒头、花卷、包子等食物都是面粉经酵母发酵的产物,据统计,中国北方约70%的小麦面粉用来做馒头。
体外消化/Caco-2细胞模型法(in vitro/Caco-2 cell culture model)可经济、快速、简便地评估食物中Fe BV,目前该模型已成为食物实验应用最广泛的模型,用于婴儿食品的开发、农业中富铁植物品种的批量快速准确筛选、药物生产方面改良铁补充剂的开发等,已有实验证明此法所测得的结果与人体实验铁吸收率显著相关[12-14]。
本研究通过对面粉添加酵母进行发酵,采用体外消化/Caco-2细胞模型法考察发酵对其Fe BV的影响,从而为通过食品加工途径改善植物性谷物中Fe BV提供理论依据,为人们合理加工和食用面粉提供参考。
1 材料与方法
1.1 材料与试剂
小麦面粉:选取不同品种的小麦籽粒,采用蒸馏水冲洗并严格控制灰尘等的污染,晾干,Buhler实验磨制粉,共10 种样品,分别是出粉率78%的京冬8号、安阳中优9507、北京中优9507、新疆中优9507、中麦9号、豫麦18、中麦175、豫麦2号和出粉率40%的豫麦18、中麦175。制粉后严密包装-20 ℃保存。
人结肠腺癌细胞株(Caco-2) 四川大学华西药学院保藏;低糖高活性干酵母 安琪酵母股份有限公司。
MWCO15000透析膜 美国Spectrum Medical公司;6 孔板插入环 美国Corning公司;细胞培养液、MEM营养液等组成参照文献[2];VC、Chelex-100离子交换树脂 美国Bio-Rad公司;鼠尾Ⅰ型胶原蛋白 美国BD生物公司;猪胆汁提取物、猪胰酶、猪胃酶、植酸钠、植酸酶 美国Sigma公司。
1.2 仪器与设备
CO2孵箱 日本Sanyo公司;纯水仪 美国Millipore公司;JY92-Ⅱ细胞超声破碎仪 宁波新芝生物科技股份有限公司;酶标仪 美国Bio-Rad公司;SOLAAR M6原子吸收仪 美国Thermal Element公司;Lyolab 3000型真空冷冻干燥机、Ultra Freeze 3410型超低温冰箱 丹麦Heto公司;5810R冷冻离心机 德国Eppendorf公司;pHs-3C+型酸度计 成都世纪方舟科技有限公司。
1.3 方法
1.3.1 细胞处理与指标测定
细胞培养、样品体外消化与吸收、细胞收集、细胞中蛋白质和铁蛋白测定、面粉植酸磷含量测定等操作参考文献[2]。
1.3.2 小麦面粉发酵
按照活性干酵母说明书,每份面粉称取100 g,加入面粉质量0.5%的活性干酵母搅拌混匀,缓慢加入30~35 ℃超纯水44~50 mL进行搅拌和面,搅拌好的面团放入30 ℃恒温培养箱中发酵50 min。将发酵好的面团迅速放入-70 ℃超低温冰箱中冷冻3 h,取出放入冻干机中进行干燥,36 h后取出粉碎,装袋密封,于-20 ℃储存备用[2],供发酵后面粉多酚、植酸(磷)、植酸酶、Fe BV的测定。
1.3.3 指标测定
发酵前后及发酵过程中面粉pH值和酸度测定参考GB/T 5517—2010《粮油检验 粮食及其制品酸度测定》方法[15]。各称取面粉15 g,采用1.3.2节方法进行面粉发酵,分别发酵0、10、20、30、40、50 min,于120 ℃加热迅速终止酵母的作用,然后立即按GB/T 5517—2010方法制备样液并测定面粉酸度,同时用酸度计测定面粉样液的pH值,酸度以中和10 g粮食试样所需0.1 mol/L碱液的体积来表示。
面粉总多酚含量采用Folin-Ciocalteu比色法,以没食子酸为标准品[16]。
面粉植酸酶活力测定参考GB/T 18634—2009《饲用植酸酶活性的测定 分光光度法》[17]并稍作修改,反应条件改为1.5 mmol/L植酸钠、55 ℃、pH 5.15。酶活力单位定义为样品(植酸酶)在55 ℃、pH 5.15条件下每分钟使1.5 mmol/L植酸钠溶液释放1.0 μmol无机磷,即为一个植酸酶活力单位(U),其余同国标。
1.3.4 面粉Fe BV计算
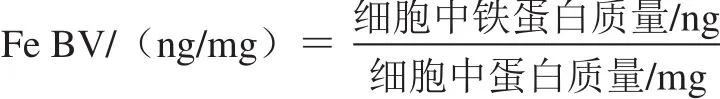
1.4 统计分析
2 结果与分析
2.1 发酵过程中面团pH值和酸度的变化如表1所示,面团在发酵后pH值总体上呈下降趋势,降幅绝对值为1.28~1.52,酸度则呈上升趋势,升幅绝对值为0.11~2.28 mL/10 g。

表1 发酵过程中面粉pH值和酸度的变化Table 1 Changes in pH and acidity in wheat flour dough during yeast fermentation
2.2 发酵后面粉植酸酶活性和植酸磷含量的变化
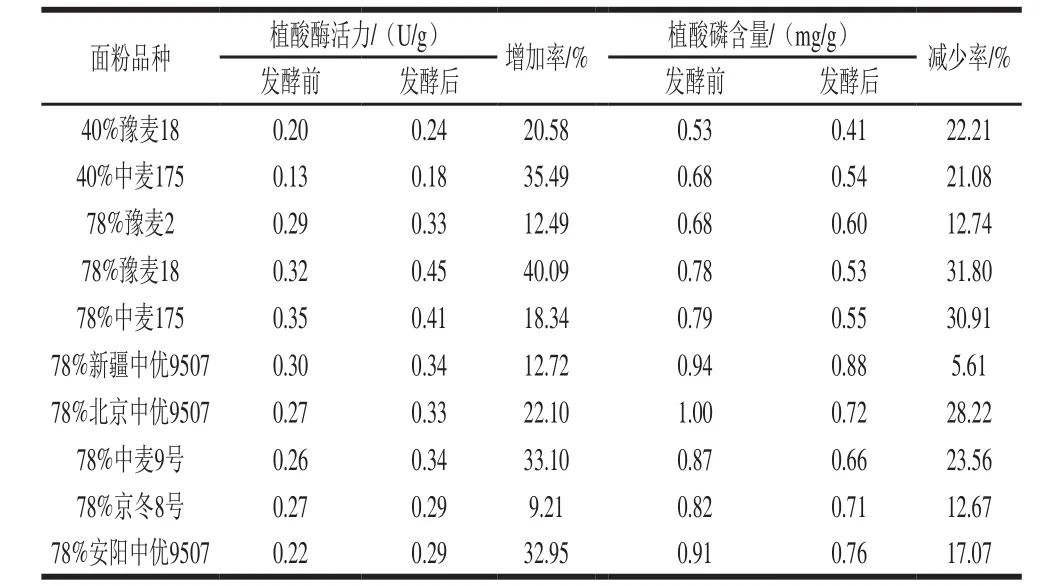
表2 面粉发酵前后植酸磷含量和植酸酶活力变化Table 2 Changes in phytate phosphorus content and phytase activity before and after yeast fermentation
由表2可知,发酵后面粉中植酸酶活力上升约9%~40%,植酸磷(植酸)降低约6%~31%。经t检验,发酵前后植酸磷、植酸酶活力差异均有统计学意义(P<0.05),说明发酵有利于面粉植酸的降解和植酸酶活力的升高。
2.3 发酵后面粉多酚含量的变化
10 种面粉发酵后多酚含量均呈下降趋势,降幅约15%~42%,结果见表3。经t检验,发酵前后面粉多酚含量差异有统计学意义(P<0.05),说明发酵有利于面粉多酚的降解。
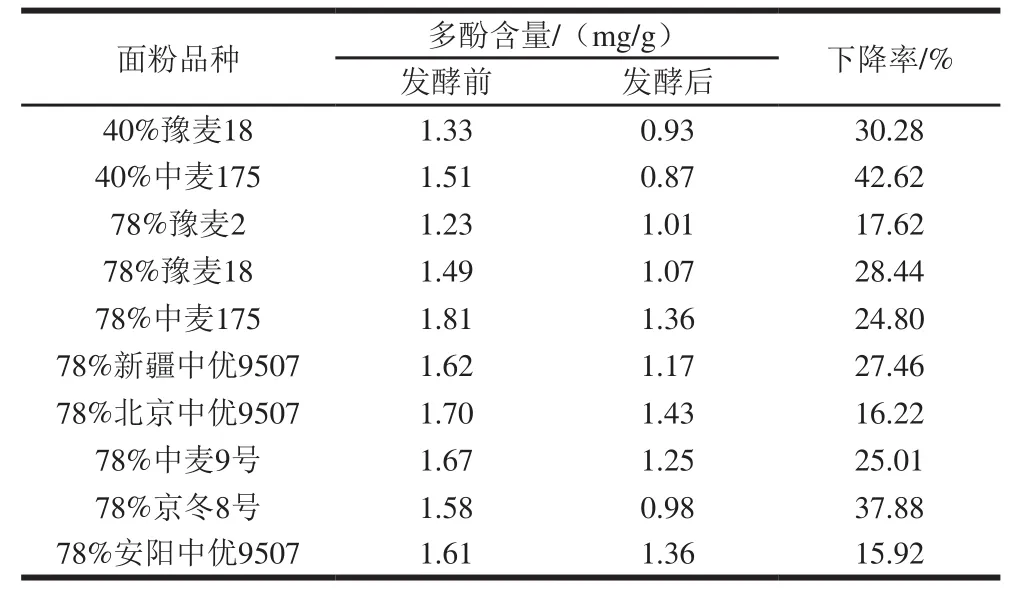
表3 发酵前后面粉多酚含量的变化Table 3 Changes in polyphenol content before and after yeast fermentation
2.4 发酵后面粉Fe BV的变化
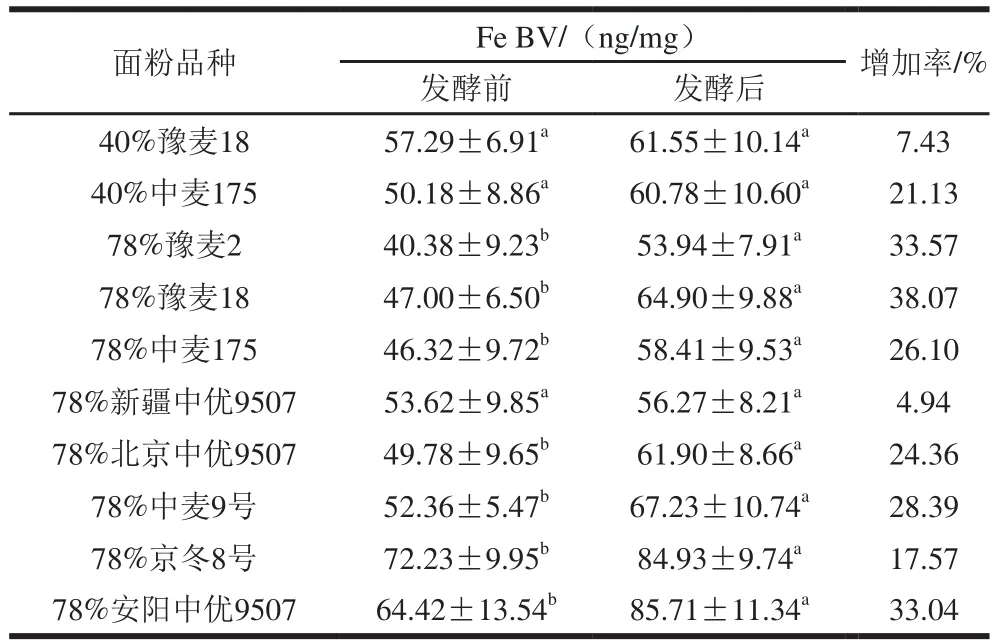
表4 发酵前后面粉Fe BV比较Table 4 Fe bioavailability in 10 wheat flours before and after fermentation
由表4可知,发酵后10 个样品的Fe BV比发酵前增加约5%~38%,对每一种面粉发酵前后的Fe BV进行t检验,发现除了40%出粉率的豫麦18和中麦175以及78%出粉率的新疆中优9507之外,其余面粉的Fe BV在发酵后都显著高于发酵前(P<0.05),这说明发酵可显著改善和提高大多数面粉Fe BV。
3 讨 论
3.1 发酵过程中pH值变化的原因及其对其他因素的影响
发酵初期,由于刚搅拌的面团中充有大量的空气,酵母进行旺盛的有氧呼吸,随着发酵的进行,CO2气体的不断增多,面团中的CO2是发酵过程中pH值下降的原因之一,同时氧气被消耗,酵母又进行无氧发酵。无氧发酵中在乙醛向酒精的转化过程中酵母体内也可能生成乙酸,会扩散到面团中,虽然它不是主要产物,但对pH值是有影响的。同时来自面粉的乳酸菌利用面粉的营养物开始发酵,生成乳酸等产物,由于乙酸、乳酸等酸的生成,使面团的pH值下降[18-19]。
发酵过程中pH值的降低会使面粉中植酸和多酚含量产生不同程度的降低,从而改善面粉中铁等微量元素的吸收率,原因如下陈述。
3.2 面粉发酵前后植酸、植酸酶变化的原因及其对Fe BV的影响
要提高食物中营养素的吸收率,食品加工方法非常重要,应该是简单易懂易接受、易制作的食物,在经济和劳动力方面可行。发酵是众所周知的降解植酸的方法之一,从实验结果可以看到发酵后面粉植酸酶活性都有所升高,增幅约为9%~40%,而植酸含量则降低约6%~31%,同时面粉Fe BV则增加约5%~38%,各指标变化在发酵前、后均具有统计学意义。发酵使植酸酶活性升高和植酸含量降低的原因与面粉内源性植酸酶和外源性植酸酶(来自干酵母)有关,发酵过程中pH值降低会激发植酸酶活性[20-21]。植酸酶是一类水解植酸的磷酸酶类,大多数微生物植酸酶适宜pH值在酸性范围内,植物植酸酶适宜pH值在4.8~6.0之间。天然植物食品中含有内源性植酸酶,一定条件下可以催化其中的植酸水解。酵母菌也会分泌产生植酸酶,Towo等[22]在对高梁粉进行发酵时发现,发酵后高梁粉的植酸含量降低,原因是来自谷物和微生物的植酸酶使植酸含量下降,发酵时pH值在5.0左右与植酸酶最适pH值接近;植酸酶存在于多种谷物中,在发酵过程中会被激活,白色高粱发酵后植酸下降可溶性铁大大增加;Frontela等[23]对出粉率分别为95%和80%的全麦面粉和普通面粉进行发酵、焙烤制作面包,发现发酵后两种面粉的植酸含量均显著降低;Caputo等[24]发现一种酿酒酵母能显著降低全麦面包中植酸的含量(约下降79%);上述报道都与本实验结果吻合,面粉发酵过程中可达到植酸酶的最适pH值,因此推测发酵后面粉植酸含量降低是因为发酵过程中pH值下降到了植酸酶的最适pH值范围,来自面粉和酵母菌的植酸酶活性都得到提高,从而降解植酸,由此减少了由植酸导致的对铁等微量元素吸收的抑制作用,使Fe BV提高。
3.3 面粉发酵前后多酚变化的原因及其对Fe BV的影响
Prom-u-thai等[25]发现在糙米中Fe BV与多酚含量负相关,说明除植酸外多酚也可能是低生物利用率的原因之一,由于多酚往往与谷物颜色有关,其将水稻谷皮的颜色作为高Fe BV水稻筛选的指标之一。本研究发现面粉发酵后多酚含量减少约16%~43%,面粉Fe BV增加约5%~38%,这2 个指标在发酵前后的变化均具有统计学意义。面粉发酵所致多酚含量降低的原因可能是两方面:发酵后多酚氧化酶(polyphenol oxidase,PPO)活性升高及有机酸的生成。PPO可氧化多酚生成醌类化合物,导致食品褐变,表现出面粉颜色加深[26],这方面的研究很多[27];同时PPO也可用于含多酚类的植物中以提高铁等微量元素的利用率。多酚成分中有邻位-二羟基基团,可螯合铁离子,使其在胃肠不被吸收。酚类物质氧化后可减少螯合的铁离子,从而提高铁利用率[28-29]。Elyas等[30]发现珍珠米发酵后PPO活性被激活,多酚含量降低,Matuschek等[28]对去除了植酸的高单宁高粱粉用多种水果汁孵育,发现高梁粉经果汁处理后多酚含量降低,体外可利用铁增加,究其原因,主要还是水果中丰富的PPO使多酚氧化,其次是水果中有机酸的作用,提高了铁利用率。这与本实验有相似之处,面粉发酵后有机酸生成,酸性条件下铁溶解性增加,同时pH值降低后接近小麦PPO的最适pH 6.0[31],使PPO活性上升,铁吸收率增加。
4 结 论
对面粉进行酵母发酵处理,发酵后面团pH值降低,酸度增加,植酸酶活性显著上升,植酸和多酚含量显著下降,各方面的因素促进了面粉发酵后Fe BV增加,可以认为发酵可有效提高面粉Fe BV。
[1] GARCÍA-CASAL M N. Planning and implementing food fortification programs to combat micronutrient malnutrition: iron[J]. Food & Nutrition Sciences, 2014, 5(10): 880-888. DOI:10.4236/ fns.2014.510097.
[2] LEI J, ZHANG Y, CHEN X G, et al. Assessment of iron bioavailability in ten kinds of Chinese wheat flours using an in vitro digestion/Caco-2 cell model[J]. Biomedical and Environmental Sciences, 2012, 25(5): 502-508. DOI:10.3967/0895-3988.2012.05.002.
[3] KRUGER J, TAYLOR J R N, OELOFSE A. Effects of reducing phytate content in sorghum through genetic modification and fermentation on in vitro iron availability in whole grain porridges[J]. Food Chemistry, 2012, 131(1): 220-224. DOI:10.1016/ j.foodchem.2011.08.063.
[4] LUO Y W, XIE W H. Effect of phytase treatment on iron bioavailability in faba bean (Vicia faba L.) flour[J]. Food Chemistry, 2012, 134(3): 1251-1255. DOI:10.1016/j.foodchem.2012.03.082.
[5] FRONTELA C, GARCÍA-ALONSO F J, ROS G, et al. Phytic acid and inositol phosphates in raw flours and infant cereals: the effect of processing[J]. Journal of Food Composition and Analysis, 2008, 21(4): 343-350. DOI:10.1016/j.jfca.2008.02.003.
[6] LIANG J F, HAN B Z, NOUT M J R, et al. Effects of soaking, germination and fermentation on phytic acid, total and in vitro soluble zinc in brown rice[J]. Food Chemistry, 2008, 110(4): 821-828. DOI:10.1016/j.foodchem.2008.02.064.
[7] SOKRAB A M, AHMED I A M, BABIKER E E. Effect of germination on antinutritional factors, total, and extractable minerals of high and low phytate corn (Zea mays L.) genotypes[J]. Journal of the Saudi Society of Agricultural Sciences, 2012, 11(2): 123-128. DOI:10.1016/j.jssas.2012.02.002.
[8] SERVI S, ÖZKAYA H, COLAKOGLU A S. Dephytinization of wheat bran by fermentation with bakers’ yeast, incubation with barley malt flour and autoclaving at different pH levels[J]. Journal of Cereal Science, 2008, 48(2): 471-476. DOI:10.1016/j.jcs.2007.10.011.
[9] CORSETTI A, SETTANNI L. Lactobacilli in sourdough fermentation[J]. Food Research International, 2007, 40(5): 539-558. DOI:10.1016/j.foodres.2006.11.001.
[10] LUO Y W, XIE W H, JIN X X, et al. Impact of sprouting pretreatment on phytic acid and polyphenol level of faba bean (Vicia faba L.) flour[J]. International Food Research Journal, 2013, 20(3): 1133-1138.
[11] TAYLOR J R, DUODU K G. Effects of processing sorghum and millets on their phenolic phytochemicals and the implications of this to the health-enhancing properties of sorghum and millet food and beverage products[J]. Journal of the Science of Food & Agriculture, 2014, 95(2): 225-237. DOI:10.1002/jsfa.6713.
[12] TAKO E, BLAIR M W, GLAHN R P. Biofortified red mottled beans (Phaseolus vulgaris L.) in a maize and bean diet provide more bioavailable iron than standard red mottled beans: studies in poultry (Gallus gallus) and an in vitro digestion/Caco-2 model[J]. Nutrition Journal, 2011, 10: 113. DOI:10.1186/1475-2891-10-113.
[13] DELLAVALLE D M, VANDENBERG A, GLAHN R P. Seed coat removal improves iron bioavailability in cooked lentils: studies using an in vitro digestion/Caco-2 cell culture model[J]. Journal of Agricultural & Food Chemistry, 2013, 61(34): 8084-8089. DOI:10.1021/jf4022916.
[14] YUN S M, HABICHT J P, MILLER D D, et al. An in vitro digestion/ Caco-2 cell culture system accurately predicts the effects of ascorbic acid and polyphenolic compounds on iron bioavailability in humans[J]. Journal of Nutrition, 2004, 134(10): 2717-2721.
[15] 国家质量监督检疫检疫总局. 粮油检验 粮食及制品酸度测定: GB/T 5517—2010[S]. 北京: 中国标准出版社, 2010.
[16] 梅进, 丁文平, 熊金娟, 等. Folin-Ciocalteu比色法测定大麦糟中总酚条件的优化[J]. 食品与机械, 2016, 32(2): 51-54.
[17] 国家质量监督检疫检疫总局. 饲用植酸酶活性的测定 分光光度法: GB/T 18634—2009[S]. 北京: 中国标准出版社, 2009.
[18] 韩丹丹. 面食用酵母发酵特性对比研究[D]. 郑州: 河南工业大学, 2014: 16-33.
[19] 张一. 面团发酵过程控制对馒头品质的影响研究[D]. 长春: 吉林大学, 2011:18-38.
[20] HUMER E, SCHEDLE K. Fermentation of food and feed: a technology for efficient utilization of macro and trace elements in monogastrics[J]. Journal of Trace Elements in Medicine and Biology, 2016, 37: 69-77. DOI:10.1016/j.jtemb.2016.03.007.
[21] ZHAO H M, GUO X N, ZHU K X. Impact of solid state fermentation on nutritional, physical and flavor properties of wheat bran[J]. Food Chemistry, 2017, 217: 28-36. DOI:10.1016/j.foodchem.2016.08.062.
[22] TOWO E, MATUSCHEK E, SVANBERG U. Fermentation and enzyme treatment of tannin sorghum gruels: effects on phenolic compounds, phytate and in vitro accessible iron[J]. Food Chemistry, 2006, 94(3): 369-376. DOI:10.1016/j.foodchem.2004.11.027.
[23] FRONTELA C, ROS G, MARTÍNEZ C. Phytic acid content and“in vitro” iron, calcium and zinc bioavailability in bakery products: The effect of processing[J]. Journal of Cereal Science, 2011, 54(1): 173-179. DOI:10.1016/j.jcs.2011.02.015.
[24] CAPUTO L, VISCONTI A, DE ANGELIS M. Selection and use of a Saccharomyces cerevisae strain to reduce phytate content of wholemeal flour during bread-making or under simulated gastrointestinal conditions[J]. LWT-Food Science and Technology, 2015, 63(1): 400-407. DOI:10.1016/j.lwt.2015.03.058.
[25] PROM-U-THAI C, HUANG L, GLAHN R P, et al. Iron (Fe) bioavailability and the distribution of anti‐Fe nutrition biochemicals in the unpolished, polished grain and bran fraction of five rice genotypes[J]. Journal of the Science of Food and Agriculture, 2006, 86(8): 1209-1215. DOI:10.1002/jsfa.2471.
[26] MARTIN J M, BERG J E, HOFER P, et al. Allelic variation of polyphenol oxidase genes impacts on Chinese raw noodle color[J]. Journal of Cereal Science, 2011, 54(3): 387-394. DOI:10.1016/ j.jcs.2011.08.003.
[27] ALTUNKAYA A, GÖKMEN V. Partial purification and characterization of polyphenoloxidase from durum wheat (Triticum durum L.)[J]. Journal of Cereal Science, 2012, 55(3): 300-304. DOI:10.1016/j.jcs.2011.12.013.
[28] MATUSCHEK E, SVANBERG U. The effect of fruit extracts with polyphenol oxidase (PPO) activity on the in vitro accessibility of iron in high-tannin sorghum[J]. Food Chemistry, 2005, 90(4): 765-771. DOI:10.1016/j.foodchem.2004.06.002.
[29] SHARMA P, GUJRAL H S. Antioxidant and polyphenol oxidase activity of germinated barley and its milling fractions[J]. Food Chemistry, 2010, 120(3): 673-678. DOI:10.1016/ j.foodchem.2009.10.059.
[30] ELYAS S H A, TINAY A H E, YOUSIF N E, et al. Effect of natural fermentation on nutritive value and in vitro protein digestibility of pearl millet[J]. Food Chemistry, 2002, 78(1): 75-79. DOI:10.1016/ S0308-8146(01)00386-7.
[31] 黄海霞, 张真, 吴金芝. 小麦多酚氧化酶特性及褐变控制研究[J].安徽农业科学, 2008, 36(31): 13574-13575.
Effects of Fermentation on Iron Bioavailability in Wheat Flour Assessed with an in Vitro Digestion/Caco-2 Cell Model
LEI Ji1, HUANG Chengyu2
(1. School of Food and Biotechnology, Xihua University, Chengdu 610039, China; 2. West China School of Public Health, Sichuan University, Chengdu 610041, China)
Cereals are the most important staple crops in China. However, cereals are low in iron (Fe) absorption, which is attributed as the major reason of nutritional anemia. Proper processing can relieve the inhibition of substances like phytic acid and polyphenol in grains on iron bioavailability (Fe BV). In this experiment, an in vitro digestion/Caco-2 cell model was used to assess the impact of yeast fermentation on Fe BV in wheat flour. Results demonstrated that after fermentation, the pH of wheat flour dough declined and consequently the acidity showed a rising trend. In addition, the contents of polyphenol and phytic acid declined and the phytase activity increased. All the above changes were statistically significant (P < 0.05). Fe BV of flour samples increased by 5%–38% after fermentation, with significant differences (P < 0.05) being observed for most wheat flours compared with that measured before fermentation. Fermentation can reduce the pH of wheat flour and increase the acidity, thereby promoting the degradation of polyphenol and phytic acid, increasing phytase activity, and effectively improving Fe BV in wheat flour.
wheat flour; Fe bioavailability; fermentation; in vitro digestion/Caco-2 cell model
10.7506/spkx1002-6630-201716015
R282.75
A
1002-6630(2017)16-0099-05
雷激, 黄承钰. 用体外消化/Caco-2细胞模型观察发酵对面粉铁生物利用率的影响[J]. 食品科学, 2017, 38(16): 99-103. DOI:10.7506/spkx1002-6630-201716015. http://www.spkx.net.cn
LEI Ji, HUANG Chengyu. Effects of fermentation on iron bioavailability in wheat flour assessed with an in vitro digestion/ Caco-2 cell model[J]. Food Science, 2017, 38(16): 99-103. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716015. http://www.spkx.net.cn
2016-09-04
西华大学人才基金项目(R0910507);四川省科技厅项目(2014NZ0078;2016NZYZF0028)
雷激(1966—),女,教授,博士,研究方向为食品科学。E-mail:jil765@163.com

