高浓度CO2对热胁迫条件下高羊茅生长和抗氧化系统的影响
于景金,范宁丽,李冉,杨志民
(南京农业大学草业学院,江苏 南京210095)
高浓度CO2对热胁迫条件下高羊茅生长和抗氧化系统的影响
于景金,范宁丽,李冉,杨志民*
(南京农业大学草业学院,江苏 南京210095)
大气CO2浓度及温度逐年上升是当前全球范围内主要的两大气候特征,但不断升高的大气CO2浓度可以缓解高温对植物生长发育带来的负面影响。为了探究高浓度CO2在多年生禾草生长和抗氧化系统方面对热胁迫的响应,本试验以高羊茅(Festucaarundinaceacv. ‘Barlexas’)为材料,进行CO2[当前浓度(400 μmol/mol)和高浓度(800 μmol/mol)]和温度[(最适生长温度(25/20 ℃)和热胁迫温度(35/30 ℃)]处理。结果表明,高温导致高羊茅的生长速率(Gr)、净光合速率(Pn)、光化学效率(Fv/Fm)、绿叶数、活性氧清除物质[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)]活性等显著下降,叶片黄绿比、电解质渗漏率(EL)、丙二醛(MDA)、活性氧[过氧化氢(H2O2)、超氧阴离子(O2-·)]显著上升;热胁迫处理28 d时,高浓度CO2较正常CO2浓度使细胞膜稳定性增强(EL、MDA分别降低72%和39%),光合能力提高(Pn、Fv/Fm、绿叶数分别升高174%、17%和165%),活性氧积累减少(H2O2、O2-·含量分别下降46%和31%)。以上结果说明:高浓度CO2通过提高高羊茅在热胁迫下的光合能力,维持细胞膜的稳定以及减少体内活性氧的积累减弱了热胁迫对植株的伤害,从而提高了高羊茅的抗热性。
高羊茅;高温胁迫;高浓度CO2;抗氧化系统
工业革命以来,大气CO2浓度逐年上升已经成为当前全球气候变化的重要特征,大气CO2浓度上升带来的全球生态环境的改变成为科学家们最为关注的问题。有报道称[1],大气CO2浓度已经由工业革命之前的280 μmol/mol增长到目前的接近400 μmol/mol,增幅达到41%。据预测,到21世纪末大气中CO2浓度可能上升到700 μmol/mol左右。CO2是植物光合作用的碳源,陆生植物光合所需CO2绝大部分来自大气,CO2主要通过扩散的方式从大气到达叶绿体内的羧化部位,扩散动力即为CO2浓度差,所以大气CO2供应在一定程度上成为植物光合作用的重要限制因素之一。大气CO2浓度的升高,从理论上讲,可以提高植物的光合能力,促进生物量的积累及品质的改善[2]。目前,关于高浓度CO2对植物生长发育影响的研究较多,但是由于物种间的差异,不同物种对CO2浓度的升高表现出差异应答响应。在CO2浓度对大豆(Glycinemax)光合作用影响的研究中发现,倍增CO2浓度可以提高大豆的净光合速率及水分利用效率[3];还有研究[4]表明,短期高浓度CO2对植物的光合作用有积极作用,但是长期高浓度CO2会使这种积极效应逐渐丧失。
高羊茅(Festucaarundinacea)具有较强的抗干旱、耐贫瘠、适应性广等特性,是一种重要的禾本科草坪草及牧草。当前,在全球气候变化大背景下,各地极端高温天气频繁出现;加之愈发加剧的温室效应,全球范围内温度逐年上升[5],因此,高温成为严重影响高羊茅生长的因素之一。高温通过破坏植物的生物膜、光合器官、渗透调节物质、抗氧化系统和激素调节物质等途径,影响植物正常的生长发育。热胁迫直接导致细胞膜透性增大甚至丧失,细胞内电解质外渗。另外,丙二醛(MDA)是植物生物膜过氧化的产物之一,也是植物细胞膜破坏程度的参考指标之一,高温胁迫下细胞内MDA的含量显著升高[6]。光合作用是植物最重要的生命活动,对温度的变化非常敏感,其最敏感的部位为光系统Ⅱ(PSⅡ),高温下植物的净光合速率(Pn)和光化学效率(Fv/Fm)都有所下降,这在水稻(Oryzasativa)等多种植物中都有报道[7-8]。在热胁迫条件下,植物体内的渗透调节物质也会发生变化,暖季型草坪草狗牙根(Cynodondactylon)叶片中可溶性糖及脯氨酸含量显著升高[9]。正常情况下,植物体内不断产生活性氧(reactive oxygen species, ROS),ROS氧化能力极强,对植物体内许多生物大分子都具有破坏作用,但由于植物体内同时具有相应的ROS清除系统,使得ROS的产生和消除处于动态平衡状态[10]。然而,植物的抗氧化系统在热胁迫下受到破坏,ROS出现过剩,导致植物代谢失活、光合降低,进而产量下降等。植物的ROS清除系统由酶促抗氧化和非酶促抗氧化反应组成,酶促抗氧化剂为植物提供了一个高效而又专一的ROS清除体系,主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)及过氧化物酶(POD)等,每种酶发挥的作用各不相同,却又相互保护,协同作用[10]。
关于CO2浓度和温度交互作用对植物影响的研究很多,但大多集中在农作物及木本植物上,而对于多年生草类植物的研究较少。苏营等[2]在大豆对CO2浓度及高温响应的研究中发现,高温胁迫下CO2浓度升高有利于维持其生长势;徐辉等[11]在关于大气CO2浓度升高及高温对茶树(Camelliasinensis)光合机制及茶叶品质的研究中发现,高浓度CO2能够通过改善叶片的光系统结构来促进光合作用,进而提高茶叶的产量和品质。梁建平等[12]的研究表明,CO2浓度倍增可以通过提高体内的抗氧化酶活性,有效提高落叶松(Larixgmelinii)幼苗对高温胁迫的抵御性。前期研究发现,在热胁迫条件下,高浓度CO2使高羊茅叶片中大量有机酸(莽草酸、丙二酸、甘油酸、柠檬酸)、氨基酸(丝氨酸、缬氨酸)和碳水化合物(蔗糖、麦芽糖)增加[13];同时,参与光合作用光反应的叶绿素a-b结合蛋白、电子传递载体分子铁氧化还原蛋白等发生了上调表达[14]。但是,从生长及抗氧化系统探讨高浓度CO2对多年生草类植物热胁迫的缓解作用,目前还没有报道。因此,本研究不仅可以完善高浓度CO2提高多年生禾草耐热性的理论基础,还可以为气候变化大背景下草类植物的抗性育种提供依据。
1 材料与方法
1.1 试验材料及生长环境
本试验选用2年龄长势良好的高羊茅(F.arundinaceacv. ‘Barlexas’)草皮块作为试验材料,草皮块利用高尔夫果岭打洞器获取,地上部约8 cm,地下部带有约8 cm原土,全部取自南京农业大学草业学院草坪实验基地。于2016年2月选取长势均匀一致的草皮块,移植到PVC管(直径11 cm,高50 cm),管中基质为河沙与营养土的混合物(1∶1,v/v)。在材料培养阶段,每3 d浇透水1次,每周浇1次霍格兰营养液并修剪1次,使高度保持在大约10 cm,培养2个月。培养期结束后,将材料转入人工气候室中预培养1周,光周期设置为14 h,相对湿度为60%,光照强度大约600 μmol/(m2·s),处理28 d。
1.2 试验设计
采取双因素随机区组试验设计,主因子为CO2浓度,即当前平均大气CO2浓度(400 μmol/mol)和倍增大气CO2浓度(800 μmol/mol),副因子为温度,即适宜温度25/20 ℃(日/夜)和高温胁迫35/30 ℃(日/夜),共计4个处理,每个处理5个重复。
本试验在能够控制环境因素的人工气候室进行,共计4间人工气候室,其中2间设置为400 μmol/mol的当前CO2浓度,分别将温度控制为25/20 ℃(日/夜)和35/30 ℃(日/夜);另外2间设置为800 μmol/mol的倍增CO2浓度,温度控制同上。每间气候室材料随机摆放,每隔一天重新调整位置,防止因环境差异造成结果误差。保证水分充足,每周浇1次营养液,利用土壤含水量测定仪(Mini Trase Kit 6050X3,美国)测定相对水分含量,以保证不同处理下的高羊茅具有相同的土壤水分条件。
1.3 测定指标及方法
分别在处理的7、14、21、28 d时,采用混合取样方法采样,分别测定高羊茅叶片各项生理指标,包括生长速率(growth rate,Gr)和电解质渗漏率(electrolyte leakage, EL)、光化学效率(photochemical efficiency,Fv/Fm)、净光合速率(net photosynthetic rate,Pn),分别采用Yu等[13,15]的方法进行测定。
相对生长速率:以7 d为时间间隔所测定的每盆高羊茅平均冠层高度的差值与时间的比值。
电解质渗漏率:剪取约0.2 g高羊茅叶片,去离子水润洗干净,浸入装有30 mL去离子水的50 mL离心管中。在室温下摇床上振荡24 h测定初始电导率(C0),然后140 ℃高压灭菌20 min,重新放在摇床上24 h后测定最终电导率(C1),EL(%)=(C0/C1)×100。
光化学效率:利用叶夹对所测叶片暗适应30 min,用叶绿素荧光效能分析仪,将测量探头置于叶夹上,打开叶夹的遮光片,测量叶片光化学效率值。
叶片净光合速率:采用Li-6400光合仪进行测定。叶片被夹在内置红蓝光源的6 cm2叶室中,光强设置为600 μmol/(m2·s)。
黄绿比:通过记录每个重复标记叶的绿叶、黄叶数,计算黄绿比。
在处理28 d时,测定高羊茅叶片的ROS指标,包括超氧阴离子(O2-·)、过氧化氢(H2O2)、丙二醛(MDA)含量以及抗氧化酶活性,参照Zhang等[16]的方法进行测定。
超氧阴离子(O2-·):称取0.1 g叶片,在液氮中充分研磨,加入3 mL 65 mmol/L的磷酸钾缓冲液(pH 7.8),混合均匀后于4 ℃下10000 r/min离心15 min,收集上清。将0.5 mL 65 mmol/L 磷酸钾缓冲液和0.1 mL 10 mmol/L 盐酸羟胺在离心管中混合均匀,25 ℃水浴10 min,然后加入0.5 mL收集的上清液摇匀,25 ℃水浴20 min;依次加入1 mL 58 mmol/L磺胺和1 mL 7 mmol/L的萘胺混合均匀,25 ℃水浴20 min;加入3 mL 氯仿充分涡旋,并于10000 r/min离心3 min。测定上层水相在530 nm波长处的吸光度。
过氧化氢(H2O2):采用KI法测定,称取样品约0.3 g,在5 mL 0.1%(w/v)三氯乙酸中冰浴研磨,匀浆在4 ℃下12000 r/min离心15 min。取上清液0.5 mL,与0.5 mL 0.1 mol/L pH 7.0磷酸缓冲液和1 mL 1 mol/L KI溶液混合,于室温黑暗下静置1 h后,测定390 nm处吸光度。H2O2含量通过标准曲线计算。
MDA、SOD、CAT、APX:取0.3 g叶片在液氮中充分研磨,加入3 mL 预冷的50 mmol/L磷酸钾缓冲液(1% PVP和2 mmol/L EDTA)混合均匀,4 ℃下15000 r/min离心20 min,收集上清用于酶活的测定。SOD:在波长560 nm处测定上清液吸光度,以引起氮蓝四唑(NBT)50%的光还原抑制所需酶量作为一个SOD酶活单位。CAT:通过测定240 nm处酶液的吸光度随着H2O2浓度的降低而下降的速率表示。APX:通过测定在290 nm处1 min后酶液吸光度的降低速率确定。
1.4 数据处理
分别利用SPSS 18.0和Sigmaplot 20.0进行数据处理和作图,采用Duncan进行方差分析的显著性检验,采用最小显著差异法(LSD)进行不同处理间的多重比较,置信度为P=0.05。
2 结果与分析
从表1的双因素方差分析结果可以看出,单独温度对除APX外的所有指标均具有极显著影响;单独CO2浓度对高羊茅叶片的EL、Pn、Fv/Fm、叶片黄绿比、H2O2、O2-·、Pn均具有极显著影响,对MDA和SOD具有显著影响,但对Gr、CAT、POD没有影响;温度与CO2浓度交互作用对MDA、Pn、O2-·、APX和POD没有显著影响,对其余生理生化指标具有显著或极显著影响。

表1 双因素方差分析
注:值代表均方和;*、**分别代表显著相关(P<0.05)和极显著相关(P<0.01);ns代表不相关。EL:电解质渗漏率;MDA:丙二醛;Gr:相对生长速率;Pn:净光合速率;Fv/Fm:光化学效率;H2O2:过氧化氢;O2-·:超氧阴离子;SOD:超氧化物歧化酶;APX:抗坏血酸过氧化物酶:CAT:过氧化氢酶;POD:过氧化物酶。
Note: Value indicates mean square; *, ** indicates the significant (P<0.05) and highly significant (P<0.01) correlation, respectively. ns means not different. EL: Electrolyte leakage; MDA: Malondialdehyde;Gr: Relative growth rate;Pn: Net photosynthetic rate;Fv/Fm: Photochemical efficiency; H2O2: Hydrogen peroxide; O2-·: Superoxide anion; SOD: Superoxide dismutase; APX: Ascorbate peroxidase; CAT: Catalase; POD: Peroxidase.
2.1 CO2浓度对细胞膜的影响
在400和800 μmol/mol CO2条件下,热胁迫都导致EL显著提高,和对照相比,分别平均上升了78%和31%;在热胁迫条件下,随着处理天数的增加,400和800 μmol/mol CO2条件下的EL均持续上升,但处理28 d时800 μmol/mol CO2条件下的EL比400 μmol/mol条件下降低了72%,差异显著(图1A)。
热胁迫显著提高了高羊茅在当前和高CO2浓度下的MDA含量,处理28 d时,和对照相比分别上升了75%和26%;在热胁迫处理下,400和800 μmol/mol CO2条件下生长的高羊茅叶片MDA含量均表现为持续上升,但高浓度CO2较正常CO2显著抑制了MDA含量的增加(图1B)。
2.2 CO2浓度对生长速率(Gr)和净光合速率(Pn)的影响
处理28 d时,在400 μmol/mol CO2下,热胁迫导致Gr比对照降低了83%,而800 μmol/mol CO2下,热胁迫使Gr比对照降低了64%;适宜温度条件下,CO2浓度对Gr没有影响,但是在热胁迫处理的7~21 d内,800 μmol/mol CO2下的Gr都显著高于对照(图2A)。
在正常浓度和高CO2浓度条件下,热胁迫导致Pn均显著下降,处理28 d时,和对照相比分别下降了32%和31%;适宜温度下的整个处理期间内,800 μmol/mol CO2下生长的高羊茅叶片的Pn都显著高于400 μmol/mol CO2;热胁迫处理下,800 μmol/mol CO2下的Pn从热处理开始就剧烈下降,但到处理28 d时仍比正常CO2浓度下高出78%,差异显著(图2B)。
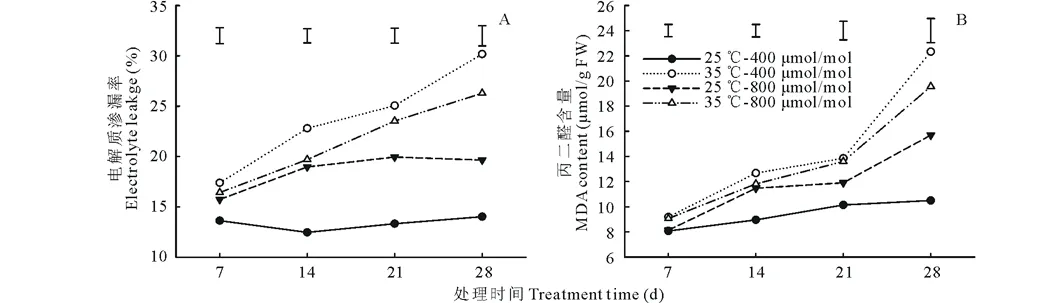
图1 CO2浓度和温度对高羊茅电解质渗漏率和丙二醛含量的影响Fig.1 Effects of CO2 and temperatures on electrolyte leakage and MDA content in tall fescue竖线代表LSD值(P<0.05),表示同一时间点不同处理间的差异显著性。下同。Bar represents difference among different treatments by least significant difference (LSD) test at the level of P<0.05. The same below.
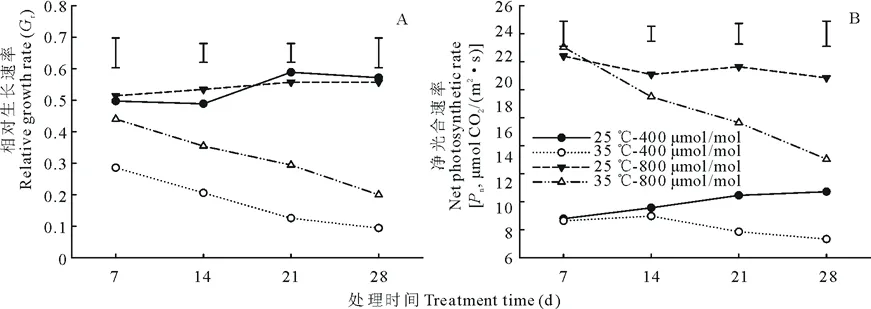
图2 CO2浓度和温度对高羊茅生长的影响Fig.2 Effects of CO2 and temperatures on growth in tall fescue
2.3 CO2浓度对光化学效率(Fv/Fm)的影响
热胁迫显著降低了高羊茅的Fv/Fm,在400和800 μmol/mol浓度下处理28 d时分别比对照下降了21%和9%;在适宜温度下不同CO2浓度对Fv/Fm无显著影响,但在热胁迫条件下,高浓度CO2显著抑制了Fv/Fm的下降,处理结束时比400 μmol/mol CO2下升高了17%(图3)。
2.4 CO2浓度对叶片衰老的影响

图3 CO2浓度和温度对高羊茅光化学效率的影响Fig.3 Effects of CO2 and temperatures on photochemical efficiency in tall fescue
在400 μmol/mol CO2条件下,热胁迫导致绿叶数在整个实验处理期比对照平均减少了40%,而在800 μmol/mol CO2条件下, 热胁迫对绿叶数没有影响;适宜温度处理的整个期间内,不同CO2浓度对绿叶数均无影响;但是,在热胁迫下,高浓度CO2显著提高了绿叶数,处理28 d时,比正常浓度CO2下的绿叶数增加1.65倍(图4A)。
高温导致400 μmol/mol CO2条件下的叶片黄绿比急剧上升,处理28 d时比对照增加8.75倍,但是对800 μmol/mol CO2条件下的黄绿比却无显著影响;在适宜温度下,不同CO2浓度对黄绿比无显著影响;在热胁迫下,高浓度CO2显著抑制了黄绿比的持续升高,到处理结束时比400 μmol/mol CO2条件下减少了89%(图4B)。
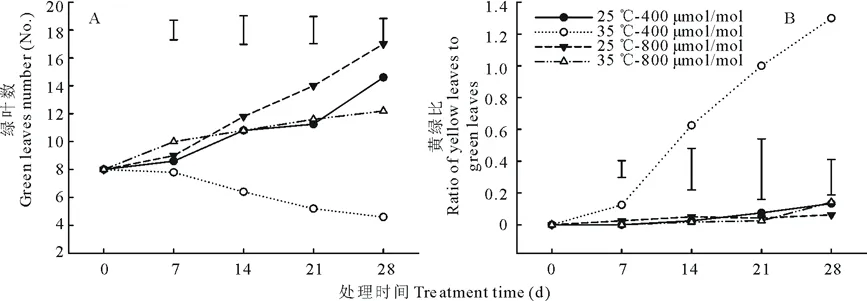
图4 CO2浓度和温度对高羊茅叶片衰老的影响Fig.4 Effects of CO2 and temperatures on leaf senescence in tall fescue
2.5 CO2浓度对活性氧的影响
在400和800 μmol/mol CO2条件下,热处理第7天时,叶片过氧化氢(H2O2)含量均未发生显著改变;但是处理到第28天时,含量均显著上升,分别比适宜温度下的含量提高了182%和52%;在适宜温度下,不同CO2浓度对H2O2含量没有显著影响;热胁迫第28天时,高浓度CO2显著减少了H2O2含量,比正常CO2浓度下降低了46%(图5A)。
在400 μmol/mol CO2条件下,热胁迫导致处理第7和28天时的高羊茅叶片超氧阴离子(O2-·)含量均显著升高;但是,在800 μmol/mol CO2条件下O2-·含量却没有发生显著变化;与正常CO2浓度相比,高浓度CO2显著降低了热胁迫第7和28天时的O2-·含量,分别下降了43%和31%(图5B)。
2.6 CO2浓度对抗氧化酶活性的影响
在400 μmol/mol CO2条件下,处理第7和28天时,热胁迫下的叶片SOD活性都显著下降,分别较正常温度降低了39%和32%(图6A);在800 μmol/mol CO2下,热胁迫对7 d处理下的高羊茅叶片SOD活性无影响,但使处理28 d下的SOD活性比适宜温度下降低了14%;在适宜温度下,不同CO2浓度对SOD活性无影响;但在热胁迫下,高浓度CO2显著提高了处理28 d时的SOD活性,比对照升高了26%。
在400 μmol/mol CO2条件下,处理第7天时,热胁迫对叶片APX活性无显著影响,处理第28天时,导致叶片APX活性显著降低(图6B);但是对800 μmol/mol CO2条件下的叶片APX活性无显著影响;热胁迫条件下,处理28 d时,高浓度CO2下的叶片APX的活性较正常CO2升高了30%。

图5 CO2浓度和温度对高羊茅活性氧的影响Fig.5 Effects of CO2 and temperatures on reactive oxygen species in tall fescue 竖线代表SE,不同小写字母代表同一时间点不同处理间的差异显著(P<0.05)。下同。Bar represents standard error (SE). Different small letters mean significant differences among different treatments at the same time (P<0.05). The same below.

图6 CO2浓度和温度对高羊茅抗氧化酶活性的影响Fig.6 Effects of CO2 and temperatures on antioxidant enzyme activities in tall fescue
在400 μmol/mol CO2条件下,热胁迫导致处理第7和28天的叶片CAT活性均发生显著下降,分别比对照降低了34%和57%(图6C);但是热胁迫对800 μmol/mol CO2条件下第7天时的叶片CAT活性无显著影响,28 d时叶片CAT活性比对照降低了14%;适宜温度下,不同CO2浓度对叶片CAT活性均无影响;热胁迫处理第28天时,800 μmol/mol CO2下的叶片CAT活性比400 μmol/mol升高了50%。
在正常CO2浓度下,处理第7和28天时,热胁迫导致叶片POD活性分别比对照降低了33%和45%(图6D);在高浓度CO2条件下,处理第7天,热胁迫导致叶片POD活性下降,28 d时无显著影响;在适宜温度和热胁迫温度下,不同CO2浓度对整个实验处理期高羊茅叶片的POD活性均无影响。
3 讨论
3.1 细胞膜对CO2浓度和高温互作的响应
植物细胞膜是细胞的重要组成部分,为细胞的生命活动提供了稳定的内环境,是感知温度变化及其他胁迫最为敏感的部位。在高温胁迫对细胞膜伤害的研究中,电解质渗漏率(EL)是一个用来衡量细胞膜完整性的最为普遍且测定方法简单准确的指标[17]。另外,膜质过氧化也是植物细胞膜受到高温伤害的重要表现,丙二醛(MDA)作为膜质过氧化的主要产物,可以直接表示膜质过氧化水平和细胞膜受损伤的程度。本试验中MDA含量的测定结果与EL一致,高温导致MDA含量显著上升,但高浓度CO2可以明显抑制其上升幅度。
植物细胞膜对高温的耐受性主要体现在类囊体成分的改变,且有研究表明,高温胁迫导致类囊体膜的流动性增强,甚至破坏膜结构,但是玉米黄素的积累可以通过降低类囊体膜流动性而间接保护膜系统[18]。叶黄素是类胡萝卜素的一种,而叶黄素包括紫黄素、玉米黄素和环氧玉米黄素。因此,高浓度CO2对细胞膜在热胁迫下的保护作用可能与CO2影响植物光合色素的含量有关,这在高浓度CO2对油桐(Verniciafordii)和烟草(Nicotianatabacum)的研究中均有发现[4]。本试验中关于绿叶数及黄绿比的实验结果也可以看出,叶绿素和叶黄素含量在高浓度CO2下发生变化,但高浓度CO2通过影响光合色素来缓解胁迫的机制尚需进一步研究。
3.2 光合能力对CO2浓度和高温互作的响应
植物生长速率(Gr)是度量植物生长快慢的单位,高温胁迫对植物正常的生长发育造成影响,最直接的影响就是生长受阻。因此,Gr在一定程度可以作为衡量植物受胁迫损害程度的指标。本试验结果表明,高温胁迫严重降低了高羊茅的Gr,并且Gr随处理时间的延长而持续下降,但是高浓度CO2对Gr的下降有一定的抑制作用。由于CO2浓度的增大,光合作用同化的CO2增多,为叶肉组织提供的原料相应增多,因此高浓度CO2对高羊茅高温胁迫下的生长有促进作用。
高温胁迫可以通过各个途径影响植物的光合能力,包括促进叶绿素的降解,本试验体现为高温下绿叶数减少,黄绿比升高。但是,在加以高浓度CO2处理时,绿叶数显著增加。有研究发现[19],植物光合作用的最适温度随着CO2浓度的升高会增加2~7 ℃。所以,虽然35 ℃比高羊茅生长的最适温度高出10 ℃左右,但是由于高浓度CO2的作用,最适温度可能提高,故高温的不利影响减弱。光合作用中的能量转换是由植物光系统Ⅱ(PSⅡ)和光系统Ⅰ(PSⅠ)协同完成的。PSⅡ是结合在类囊体膜上的一个色素蛋白复合体,能够利用光能将水氧化释放氧气,把光能转化为化学能[20],被认为是光合机构中对高温胁迫最为敏感的部位[7]。因此,PSⅡ吸收光子释放氧气的效率即光化学效率(Fv/Fm)是衡量PSⅡ光抑制的重要指标。本试验也表明,在高温处理下,Fv/Fm显著下降,但是高浓度CO2条件下的Fv/Fm显著高于对照,说明高浓度CO2对PSⅡ在高温胁迫下有一定的保护作用。
此外有研究[19]发现,PSⅡ和PSⅠ在高温下所受损伤程度及对高温的敏感程度存在差异,PSⅡ对高温更敏感。当植物处于高温胁迫下,PSⅡ反应中心受到抑制,只吸收捕光色素传递的光能而不能将其传递并转化为化学能[22],因此光合作用失去能量来源,加之叶绿素降解,导致净光合速率(Pn)下降。而对Pn的测定结果也验证了这点。
3.3 抗氧化系统对CO2浓度和高温互作的响应
高温胁迫下,植物体内ROS过剩,造成细胞膜脂过氧化,从MDA和EL的结果也可以看出高温对细胞膜的伤害。但是,高浓度CO2条件可以部分抵消掉高温造成的ROS积累。有研究表明,植物产生ROS的主要方式是在叶绿体中发生的光还原反应,而光还原反应包括类囊体、叶绿体基质和黄素脱氢酶3条途径,其中叶绿体基质途径产生ROS会受到低浓度氧及高浓度CO2的抑制[23],因此高浓度CO2在一定程度可以减少植物体内ROS的积累。PSⅡ是产生ROS的重要部位之一,尤其是在CO2固定受阻的时候。因此,高浓度CO2可以通过抑制高温下ROS的积累而间接保护PSⅡ,这与对Fv/Fm的测定结果也相吻合。植物的抗氧化系统包括多种酶,SOD是清除ROS的第一道防线,把多余的超氧阴离子(O2-·)转化为过氧化氢(H2O2);CAT、APX和POD催化H2O2生成水[10],降低ROS对植物的毒害作用。在胁迫程度较轻时,抗氧化酶可以将过剩的ROS清除,随着胁迫时间的延长,胁迫程度不断加剧,抗氧化酶自身受到毒害,活性下降,ROS开始积累。但是,高浓度CO2显著抑制了抗氧化酶活性的下降,提高了ROS的清除能力。因此,抗氧化酶之间具有协同互补的作用,在高温及高浓度CO2下表现出一致的活性变化趋势。
4 结论
综上可知,高浓度CO2可以提高高羊茅的抗热性,具体表现为热胁迫抑制了高羊茅的正常生长(较低的Gr、Pn、Fv/Fm),破坏了细胞膜的稳定性(较高的EL),使膜脂发生过氧化(较高的MDA),抗氧化酶活性下降(SOD、APX、CAT、POD);但是,高浓度CO2使热胁迫条件下生长的高羊茅具有较高的Gr、Pn、Fv/Fm、绿叶数及细胞膜完整性,并且ROS得到有效清除。因此,高浓度CO2对高羊茅热胁迫的缓解作用主要体现在3个方面:1)对光合器官的保护和生长的促进;2)对细胞膜稳定性的维持;3)对ROS的有效清除。
References:
[1] Zhang C S, Liu G B, Xue S. Photosynthetic characteristics ofBothriochloaishaemumunder drought stress and elevated CO2concentration. Chinese Journal of Applied Ecology, 2012, 23(11): 3009-3015. 张昌盛, 刘国斌, 薛萐, 等. 干旱胁迫和CO2浓度升高条件下白羊草的光合特征. 应用生态学报, 2012, 23(11): 3009-3015.
[2] Su Y, Zhao Y F, Mou W Y,etal. Morphological traits and yield of soybean under elevated atmospheric CO2concentration and temperature. Acta Ecologica Sinica, 2016, 36(9): 2597-2606. 苏营, 赵逸飞, 牟文雅, 等. 大豆主要株型和产量指标对大气CO2浓度和温度升高的响应. 生态学报, 2016, 36(9): 2597-2606.
[3] Zhang Q Y, Zong Y Z, Dong Q,etal. Effects of elevated atmospheric CO2concentration on soybean photosynthesis. Journal of Shanxi Agricultural Science, 2016, 44(11): 1675-1679. 张仟雨, 宗毓铮, 董琦, 等. 大气CO2浓度升高对大豆光合生理的影响. 山西农业科学, 2016, 44(11): 1675-1679.
[4] Zhao T H, Wang M Y, Zhang W W,etal. Effects of elevated atmospheric CO2concentration on plant photosynthesis. Ecology and Environment, 2006, 15(5): 1096-1100. 赵天宏, 王美玉, 张巍巍, 等. 大气CO2浓度升高对植物光合作用的影响. 生态环境, 2006, 15(5): 1096-1100.
[5] Jing L Q, Lai S K, Wang Y X,etal. Combined effect of rising atmospheric CO2concentration and temperature on growth and development of rice. Acta Ecological Sinica, 2016, 36(14): 4254-4265. 景立权, 赖上坤, 王云霞, 等. 大气CO2浓度和温度互作对水稻生长发育的影响. 生态学报, 2016, 36(14): 4254-4265.
[6] Li L X, Li J L, Zhang Q,etal. Effects of high temperature stress on cell membrane and nuclear DNA of tall fescue turfgrass. Guizhou Agricultural Sciences, 2008, 36(1): 37-39. 李良霞, 李建龙, 张强, 等. 高温胁迫对高羊茅细胞膜及其核DNA伤害的影响. 贵州农业科学, 2008, 36(1): 37-39.
[7] Yang W L, Huang F Q, Cao Z Z,etal. Effects of high temperature stress on PSⅡ function and its relation to D1 protein in chloroplast thylakoid in rice flag leaves. Acta Agronomica Sinica, 2013, 39(6): 1060-1068. 杨卫丽, 黄福气, 曹珍珍, 等. 高温胁迫对水稻光合 PSⅡ 系统伤害及其与叶绿体D1蛋白间关系. 作物学报, 2013, 39(6): 1060-1068.
[8] Qin L Q, Zhang Y L, Guo F,etal. Damaging mechanisms of peanut (ArachishypogaeaL.) photosystems caused by high-temperature and drought under high irradiance. Acta Ecologica Sinica, 2011, 31(7): 1843-1845. 秦立琴, 张悦丽, 郭峰, 等. 强光下高温与干旱胁迫对花生光系统的伤害机制. 生态学报, 2011, 31(7): 1845-1843.
[9] Du H M, Wang Z L, Yu W J,etal. Differential metabolic responses of perennial grassCynodontransvaalensis×Cynodondactylon(C4) andPoapratensis(C3) to heat stress. Physiologia Plantarum, 2011, 141: 251-264.
[10] Noctor G, Foyer C H. Ascorbate and glutathione: keeping active oxygen under control. Annual Review of Plant Physiology & Plant Molecular Biology, 1998, 49: 249-279.
[11] Xu H, Li L, Li Q H,etal. Effects of elevated atmospheric CO2concentration and temperature on photosynthesis system and quality components in tea plant. Journal of Nanjing Agricultural University, 2016, 39(4): 550-556. 徐辉, 李磊, 李庆会, 等. 大气CO2浓度与温度升高对茶树光合系统及品质成分的影响. 南京农业大学学报, 2016, 39(4): 550-556.
[12] Liang J P, Liu Y M, Niu Y,etal. Effects of high temperature and double CO2on antioxidant enzymes lipid peroxidation inLarixprincipis-rupprechtiiMayr. seedings. Chinese Journal of Eco-Agriculture, 2007, 25(3): 100-103. 梁建平, 刘咏梅, 牛远, 等. 高温和CO2浓度倍增对华北落叶松幼苗抗氧化酶及膜质过氧化的影响. 中国农业生态学报, 2007, 25(3): 100-103.
[13] Yu J J, Du H M, Xu M,etal. Metabolic responses to heat stress under elevated atmospheric CO2concentration in a cool-season grass species. Journal of the American Society for Horticultural Science, 2012, 137: 221-228.
[14] Yu J J, Yang Z M, Jespersen D,etal. Photosynthesis and protein metabolism associated with elevated CO2mitigation of heat stress damages in tall fescue. Environmental and Experimental Botany, 2014, 99: 75-85.
[15] Yu J J, Chen L H, Xu M,etal. Effects of elevated CO2on physiological responses of tall fescue to elevated temperature, drought stress, and the combined stresses. Crop Science, 2012, 52(4): 1848-1858.
[16] Zhang J, Li H B, Xu B,etal. Exogenous melatonin suppresses dark-induced leaf senescence by activating the superoxide dismutase-catalase antioxidant pathway and down-regulating chlorophyll degradation in excised leaves of perennial ryegrass (LoliumperenneL.). Frotiers in Plant Science, 2016, 7: 1500(e93724). doi: 10.3389/fpls.2016.01500
[17] Blum A, Ebercon A. Cell membrane stability as a measure of drought and heat tolerance in wheat. Crop Science, 1981, 21(1): 43-47.
[18] Gruszecki W I, Strzalka K. Does the xanthophyll cycle take part in the regulation of the thylakoid membrane. Biochimica et Biophysica Acta, 1991, 1060(3): 310-314.
[19] Ghannoum O, Phillips N G, Sears M A,etal. Photosynthetic responses of two eucalypts to industrial-age changes in atmospheric [CO2] and temperature. Plant Cell and Environment, 2010, 33(10): 1671-1681.
[20] Debus R J, Debus R J. The manganese and calcium ions of photosynthetic oxygen evolution. Biochimica et Biophysica Acta, 1992, 1102(3): 269-352.
[21] Li Z X, Li X, Fan L C,etal. Effects of heat stress on the photosynthesis system of tea leaves. Journal of Tea Science, 2015, 35(5): 415-422. 李治鑫, 李鑫, 范利超, 等. 高温胁迫对茶树光合系统的影响. 茶叶科学, 2015, 35(5): 415-422.
[22] Tang T, Zheng G W, Li W Q. Defense mechanisms of plant photosystem to heat stress. Chinese Journal of Biochemistry and Molecular Biology, 2012, 28(2): 127-132. 唐婷, 郑国伟, 李唯奇. 植物光合系统对高温胁迫的响应机制. 中国生物化学与分子生物学报, 2012, 28(2): 127-132.
[23] Guo Y S, Li X Y, Ren X L. Metabolism and function of reactive oxygen species in plant. Heilongjiang Agricultural Sciences, 2011, (8): 146-148. 郭玉双, 李祥羽, 任学良. 植物体内活性氧(ROS)的产生极其作用研究进展. 黑龙江农业科学, 2011, (8): 146-148.
Effects of elevated carbon dioxide concentration on the growth and antioxidant system in tall fescue under heat stress
YU Jing-Jin, FAN Ning-Li, LI Ran, YANG Zhi-Min*
CollegeofAgro-grasslandScience,NanjingAgriculturalUniversity,Nanjing210095,China
The gradual increases in the atmospheric CO2concentration and temperature are the two primary characteristics of global climate change. However, the rising atmospheric CO2concentration could alleviate the negative effects of heat stress. Therefore, the aim of this study was to explore the mitigating effects of elevated CO2on the growth and antioxidant system a perennial grass under heat stress. Tall fescue (Festucaarundinaceacv. ‘Barlexas’) was exposed to either ambient CO2concentration (400 μmol/mol) or elevated CO2concentration (800 μmol/mol) under optimal growth temperature (25/15 ℃ day/night) or elevated temperature (35/25 ℃ day/night) conditions. After 28 days of the experimental treatment, heat stress caused a significant reduction in relative growth rate (RGR), leaf net photosynthetic rate (Pn), number of green leaves, antioxidant enzyme activities [(superoxide dismutase, (SOD), catalase (CAT), peroxidase (POD), and ascorbate peroxidase (APX)], as well as an increase in electrolyte leakage (EL), and the contents of malondialdehyde (MDA) and reactive oxygen species (ROS) (H2O2and O2-·). Elevated CO2mitigated these negative effects of heat stress in tall fescue. Compared with plants grown under heat stress and ambient CO2, those grown under heat stress and elevated CO2had lower leaf EL and MDA contents (72% and 39% lower, respectively); thePn,Fv/Fm, and number of green leaves were increased by 1.74-fold, 17%, and 1.65-fold, respectively; and the ROS contents were significantly lower (H2O2and O2-·contents decreased by 46% and 31%, respectively). These results demonstrated that elevated CO2can improve the heat tolerance of tall fescue through increased photosynthetic capacity, cellular membrane stability, and decreased ROS accumulation.
tall fescue; heat stress; elevated CO2; antioxidant system
10.11686/cyxb2017093
http://cyxb.lzu.edu.cn
2017-03-07;改回日期:2017-04-20
国家自然科学基金项目(31301799)和中央高校基本科研业务费专项资金(KYZ201673)资助。
于景金(1983-),女,内蒙古赤峰人,副教授,博士。E-mail: jingjin_yu@126.com*通信作者Corresponding author. E-mail: nauyzm@njau.edu.cn
于景金, 范宁丽, 李冉, 杨志民. 高浓度CO2对热胁迫条件下高羊茅生长和抗氧化系统的影响. 草业学报, 2017, 26(8): 113-122.
YU Jing-Jin, FAN Ning-Li, LI Ran, YANG Zhi-Min. Effects of elevated carbon dioxide concentration on the growth and antioxidant system in tall fescue under heat stress. Acta Prataculturae Sinica, 2017, 26(8): 113-122.

